ریحانه مقتدری، دکتر لیلا حقشناس، دکتر علی عجمی
آزمایشگاه پاتوبیولوژی نوبل اصفهان
مقدمه
سندرم پیش از قاعدگی (PMS) به طور کلی به عنوان مجموعهای از علائم فیزیکی و رفتاری تعریف میشود که در انتهای فاز لوتئال (نیمه دوم چرخه قاعدگی) ایجاد میشود. علائم با شروع قاعدگی یا مدت کوتاهی پس از آن از بین میرود. حداقل 40 درصد از زنان چند روز یا چند هفته قبل از شروع دوره قاعدگی، علائم دردناکی دارند. این علائم میتواند شامل حساسیت سینه، نفخ، ولع غذا، افسردگی، اضطراب، تحریکپذیری و نوسانات خلقی باشد. این علائم میتوانند در درجات و شدت مختلف بروز کنند. علائم سندرم پیش از قاعدگی معمولاً در عرض دو هفته از دوره قاعدگی بعدی شروع میشود. در نیمه اول چرخه (14-10 روز اول بلافاصله پس از قاعدگی) هیچ علامتی وجود ندارد. حدود 40-20٪ از زنان PMS را تجربه میکنند و 8-2٪ از اختلال نارسایی پیش از قاعدگی (PMDD) رنج میبرند. در عین حال، به نظر میرسد که شیوع این سندرم در بین فرهنگها و گروههای قومی متفاوت است.
(1) از نظر بالینی، افسردگی، اضطراب و تحریکپذیری به عنوان سه علامت مورد مطالعه PMDD دیده میشود و نفخ، گرفتگی یا درد شکم، تحریکپذیری، ماستالژی و درد مفاصل، عضله و کمر شایعترین علائم در بیماران است.
(2) PMS میتواند زندگی روزمره زنان را به شدت مختل کند و حتی برخی از زنان به دنبال درمان پزشکی هستند.
(3) مطالعات نشان داده است که علائم PMS با هورمونهای چرخه قاعدگی مرتبط است. تعدادی مطالعات نشان میدهد که تولید هورمون، سطح و زمان افزایش هورمونها توسط تخمدانها طبیعی است، چیزی که طبیعی نیست تأثیر این هورمونها بر سیستم عصبی مرکزی است. عوامل ژنتیکی و عوامل محیطی در بروز علائم پیش از قاعدگی نقش دارند. شواهد اولیه نشان میدهد که خطر PMDD با تنوع ژنتیکی در ESR1، ژن آلفا گیرنده استروژن مرتبط است و سایر عوامل محیطی برای ایجاد PMS شامل سطح تحصیلات، استعمال دخانیات، تغذیه، سابقه حوادث آسیبزا یا اختلال اضطراب و… است. (4)
شکل 1: چرخه قاعدگی
پاتوژنز PMS
شواهد موجود نشان میدهد که سندرم پیش قاعدگی (PMS) اختلالی است که توسط تغییرات در استروئیدهای گنادی در طول فاز لوتئال در زنان مستعد ایجاد میشود. تصور میشود که PMS نتیجه تعامل بین تغییرات چرخهای در استروئیدهای تخمدان و عملکرد انتقال دهندههای عصبی مرکزی است. سروتونین، انتقال دهنده عصبی است که بیشترین نقش را در تظاهرات PMS دارد. اگرچه شواهدی دال بر دخیل بودن بتا اندورفین، گاما آمینوبوتیریک اسید (GABA) و سیستم عصبی خودمختار وجود دارد. علاوه بر این، برخی از علائم سیستمیک مانند احساس نفخ ممکن است توسط مکانیسمهای محیطی ایجاد شود. همچنین ممکن است اختلال تنظیم کلسیم، در پاتوژنز PMS نقش داشته باشد. (5) زنان مبتلا به PMS/PMDD دارای غلظت طبیعی استروژن و پروژسترون سرم هستند، اما به نظر میرسد که پاسخ غیرطبیعی ناقل عصبی (به ویژه سروتونین) به تغییرات هورمونی فاز لوتئال دارند. احتمالاً در میان انتقال دهندههای عصبی، سروتونین مهمترین نقش را در علت PMS/PMDD ایفا میکند. (4)
نقش ژنتیک در سندرم PMS
نقش عوامل ژنتیکی در ابتلا به سندرم پیش قاعدگی (PMS) و اختلال نارسایی پیش از قاعدگی (PMDD) همچنان مورد بحث است. اگرچه یافتههای قطعی هنوز در دسترس نیست اما به نظر میرسد که زنان با و بدون PMDD آللهای مختلف ناقل سروتونین را به ارث نمیبرند. برخی از مطالعات ارتباط احتمالی با ژن گیرنده استروژن آلفا (ESR1) را نشان میدهد.
در یک گزارش، سلولهای زنان با و بدون PMDD الگوهای پاسخی متفاوتی به اجزای کمپلکس ESC/E(Z) (Extra Sex Combs/Enhancer of Zeste) نشان دادند که شامل ژن ESR1 است. (6) برخی از تغییرات ژنتیکی ممکن است مستعد ایجاد PMDD باشد. اولین یافته ژنتیکی مثبت به سال 2007 برمیگردد که ارتباط بین PMDD و انواع گیرنده استروژن 1 (ESR1) نشان داده شد. اخیراًDubey و همکاران دریافتند که ژنهای کمپلکس اپیژنتیک حساس به استروژن ESC/E(Z) در ردههای سلولی لنفوبلاستوئید جدا شده از زنان مبتلا به PMDD در مقایسه با افراد سالم به طور متفاوت بیان میشوند. در نهایت، یافتههای اخیر بر تغییرات ژنتیکی مربوط به سیستم GABAergic متمرکز شدهاند و برای اولین بار ارتباطی بین PMDD و تغییرات تعداد کپی در ژن GABRB2 که برای زیرواحد گیرنده GABA-A کدگذاری میکند، ایجاد کردهاند؛ بنابراین، مطالعات ژنتیکی و اپیژنتیکی ممکن است حساسیت رفتاری احتمالی به استروئیدهای جنسی تخمدان را روشن کند و ممکن است راه را برای اهداف جدید جهت درمان هموار کند. (7)
ژن پروژسترون در کروموزوم 11q22-23 قرار دارد. یکی از انواع چند شکلی ژن پروژسترون، ژن PROGINS است. تا به امروز، نقش عوامل ژنتیکی در توسعه پاتولوژی زنان به خوبی مورد مطالعه قرار نگرفته است. با بررسی پلیمورفیسم ژن S/L PROGINS گیرنده پروژسترون، نقش آن در بروز این بیماری مشخص نشده است. دانشمندان بر این باورند که در توسعه PMS نوع خاصی از ترکیب “افزایش فعالیت عملکرد جسم زرد در مرحله دوم چرخه قاعدگی و وجود آلل L ژن گیرنده پروژسترون PROGINS” رخ میدهد. (8)
نقش داروها در درمان سندرم PMS
محققان در The Cochrane Collaboration شواهد مربوط به اثربخشی و ایمنی مهارکنندههای انتخابی بازجذب سروتونین (Selective serotonin reuptake inhibitors) ؛ دستهای از داروهای ضد افسردگی که به اختصار به آنSSRI میگویند را برای درمان PMS بررسی کردند. SSRIدر مطالعه شامل فلوکستین، سرترالین، پاروکستین، سیتالوپرام و اس سیتالوپرام است. در این بررسی مشخص شد کهSSRI ها برای کاهش علائم کلی PMS و همچنین برای کاهش انواع خاصی از علائم (علائم روانی، فیزیکی و عملکردی و تحریکپذیری) مؤثر هستند.SSRI ها معمولاً حدود دو هفته قبل از شروع دوره قاعدگی (مرحله لوتئال) یا هر روز (به طور مداوم) مصرف میشدند. بیشتر دادهها مربوط به دوز متوسط از SSRI است که فقط در فاز لوتئال یا به طور مداوم مصرف میشدند. یافتهها صرف نظر از دوز و زمانSSRI ها نسبتاً سازگار بود. اندازه اثر برای اکثر نتایج کوچک یا متوسط بود. همهSSRI های آزمایش شده مؤثر ظاهر شدند. شواهد ثابتی مبنی بر اینکه حتی دوزهای پایین SSRIها مؤثر بودند، وجود دارد، اگرچه دوزهای متوسط عموماً با اندازه اثر بزرگتر و پاسخ بالاتر همراه بود. (9)
تحقیقات گسترده نشان میدهد که اثرات مرکزی پروژسترون بر خلقوخوی عمدتاً ناشی از متابولیت آلوپرگنانولون است؛ یک استروئید عصبی فعال که به عنوان تعدیلکننده مثبت قوی گیرنده گاما آمینوبوتیریک اسید (GABA)51-53 عمل میکند. GABAانتقال دهنده عصبی مهاری اصلی در CNS و تنظیمکننده اصلی استرس، اضطراب، هوشیاری و تشنج است. دخالت سیستم GABAergic در پاتوفیزیولوژی PMS/PMDD اخیراً علاقه فزایندهای را برای یافتن درمانهای جدید علائم پیش از قاعدگی برانگیخته است. افراد مبتلا به PMS/PMDD شدید دارای سطوح طبیعی آلوپرگنانولون پلاسما هستند، اما برخی شواهد نشان میدهند که غلظت آلوپرگنانولون و پروژسترون پیشساز آن کاهش یافته و پاسخ ضعیفی بهGnRH در طول فاز لوتئال چرخه قاعدگی وجود دارد. نوسانات آلوپرگنانولون باعث ایجاد تغییراتی در ساختــار گیرنده GABA-A میشود که برای تعیین رفتارهای شبه اضطرابی در زنان مستعد کافی است. در پرتو این یافتهها، توسعه درمانهای جدید برای PMDD سعی در تثبیت سیگنالدهی آلوپرگنانولون دارد. دوتاستراید، یک مهارکننده آنزیم 5 آلفا ردوکتاز که پروژسترون را به آلوپرگنانولون تبدیل میکند، اخیراً با هدف تعدیل تعادل پروژسترون/آلوپرگنانولون در زنان مبتلا به PMDD آزمایش شده است. دوتاستراید از افزایش آلوپرگنانولون در فاز لوتئال جلوگیری کرده و اکثر علائم PMDD (مانند تحریکپذیری، اضطراب، افسردگی، هوس غذایی و نفخ) را بدون اعمال هیچ تأثیری بر افراد سالم بهبود بخشید. (10)
اگرچه زنان مبتلا به سندرم پیش از قاعدگی دارای غلظت طبیعی استروژن و پروژسترون سرم هستند، اما ممکن است پاسخ غیرطبیعی به تغییرات هورمونی طبیعی داشته باشند. به عنوان مثال، در یک کارآزمایی متقاطع دوسوکور بر روی زنان مبتلا به PMS،10 زن دریافتکننده لوپرولید) یک هورمون مصنوعی که با تحریک تولید استروژن، تولید استروژن را به شدت کاهش میدهد و میتواند باعث عدم تخمکگذاری شود) در مقایسه با زنانی که دارونما دریافت کرده بودند، کاهش قابلتوجهی در علائم داشتند. با این حال، تجویز بعدی استروژن یا پروژسترون علاوه بر لوپرولید منجر به عود قابل توجه علائم شد. در مقابل، هیچ تغییری در خلقوخوی 15 زن کنترل بدون PMS که همان رژیم را دریافت کردند، یا در پنج زن مبتلا به PMS که هورمون درمانی پس از یائسگی لوپرولید به همراه دارونما را دریافت کردند، رخ نداد).(11)
زمانی تصور میشد که مجموعه علائم سندرم پیش از قاعدگی ناشی از تغییرات استروئید در سیستم اپیوئیدی است. تفاوت در سطوح بتا اندورفین محیطی در زنان مبتلا به سندرم پیش از قاعدگی در مقایسه با گروه شاهد در مراحل تخمکگذاری و قبل از قاعدگی مشاهده میشود. با این حال، دادههای آزمایشگاهی نشان میدهد که این سیستم توسط پروژسترون تعدیل میشود. بهطور غیرمستقیم، مؤثر بودن بنزودیازپین آلپرازولام در درمان علائم PMS تأیید میشود. علاوه بر این، تصور میشود که سطوح پایین متابولیت پروژسترون آلوپرگنانولون، عملکرد گیرنده GABA-A را تقویت میکند، دارای اثرات ضد اضطراب است و در درمان علائم PMS تأثیر دارد. بیماران مبتلا به سندرم پیش از قاعدگی، در مقایسه با گروه شاهد، میزان سروتونین و جذب سروتونین پلاکتی خون و اتصال ایمی پرامین در طول فاز لوتئال چرخه قاعدگی کمتری دارند و سطوح بالاتری از متابولیت سروتونین 5-هیدروکسی اندولاستیک اسید در مایع مغزی نخاعی در مقایسه با متابولیت دوپامین هومووانیلیک اسید دارند. علائم PMS توسط آگونیست سروتونین فن فلورامین بهبود مییابد و با کاهش حاد پیشساز سروتونین تریپتوفان تشدید میشود. (12)
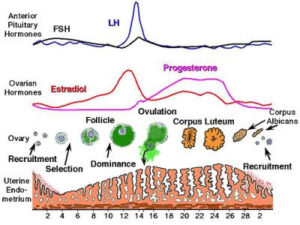
شکل 2: سطح هورمونها در دوره پیش از قاعدگی و دوره قاعدگی
نقش آنتی اکسیدانها در ایجاد سندرم PMS
استدلالهای مختلفی در مورد تأثیر آنتی اکسیدانها بر PMS وجود دارد. بالات و همکاران و کالیا و همکاران سطوح آنتی اکسیدانی مانند گلوتاتیون، سرولوپلاسمین، سوپراکسید دسموتاز(SOD) و محصول پراکسیداسیون لیپیدی مالوندآلدهید (MDA) را در PMS ارزیابی کردند. آنها هیچ تفاوت معنیداری بین زنان کنترل و PMS از نظر سطح آنتی اکسیدان پیدا نکردند. از سوی دیگر، برخی مطالعات گزارش کردند که (total antioxidant capacity) ظرفیت آنتی اکسیدانی تام در فاز لوتئال در زنان PMS کاهش یافته است. به نظر میرسد نتایج متفاوت به دلیل انتخاب نشانگرهای مختلف در ارزیابیاثر آنتی اکسیدانها بر PMS و TAC باشد که شامل مجموعهای از چندین شاخص آنتی اکسیدانی است. اگرچه استروژن یک آنتی اکسیدان قوی است، فعالیت بیش از حد آن در فاز لوتئال زنان PMS ممکن است خاصیت پرواکسیدانی آن را تحریک کند که منجر به کاهش سطح TAC در این زنان میشود؛ بنابراین، اختلال عملکرد غشای عصبی میتواند با آسیبشناسی رادیکالهای آزاد از طریق اثرات سمی رادیکالهای آزاد بر نسبت بالای اسید چرب غیر اشباع در غشای عصبی باشد و ممکن است سیستم GABAergic را در PMS زنان تحت تأثیر قرار دهد. (13)
چاقی: یک عامل خطر برای سندرم پیش از قاعدگی
دادهها شواهدی را نشان میدهد که چاقی به شدت با PMS مرتبط است. از آنجایی که چاقی یک عامل خطر قابل اصلاح است، استراتژیهای مدیریت PMS نه تنها باید عواملی مانند استرس زیاد و سیگار کشیدن را در نظر بگیرند، بلکه باید چاقی را نیز مد نظر داشته باشند. یافتهها نشان میدهد که حفظ توده بدنی سالم ممکن است برای جلوگیری از پیشرفت PMS مهم باشد. (14)
نتایج یک مطالعه را میتوان با چندین مکانیسم شناخته شده بر روی تأثیر بافت چربی بر تخمکگذاری و چرخه قاعدگی توضیح داد؛ همانطور که فریش (1994) بیان کرد بافت چربی آندروژنها را به استروژن تبدیل میکند. وزن بدن بر متابولیسم استروژن تأثیر میگذارد، زنان با وزن کم تأثیر کمتری بر متابولیسم استروژن و زنان چاقتر بیشتر بر متابولیسم استروژن تأثیر میگذارند. در زنان چاق توانایی کمتری برای اتصال استروژن به گلوبولین منتقل شده وجود دارد که باعث غیرفعال شدن استروژن میشود، در نتیجه سطح استرادیول آزاد سرم افزایش مییابد و طبق یافتههای سیلوا و همکاران، زنان چاق معمولاً در معرض خطر استرس، افسردگی و کمبود خواب هستند و معمولاً کمتر ورزش میکنند، احتمالاً یکی از دلایلی که PMS در افراد با BMI بالا بیشتر از BMI طبیعی و پایین است این است که افراد مبتلا به PMS معمولاً علائم استرس، اضطراب، افسردگی و بیحوصلگی بیشتری دارند؛ به عبارت دیگر PMS یکی از دلایل سبک زندگی کمتحرک و انزوا است که منجر به افزایش چاقی میشود. افزایش چربی ممکن است به علائم احتباس آب در سندرم پیش از قاعدگی (PMS) کمک کند. استروژن (RAAS) سیستم رنین-آنژیوتانسین-آلدوسترون را تحریک میکند و احتباس مایعات را افزایش میدهد، در حالی که به نظر میرسد پروژسترون اواخر فاز لوتئال این اثرات را خنثی میکند. چاقی ممکن است عملکرد انتقالدهندههای عصبی را از طریق اثر آن بر استروژن و پروژسترون تغییر دهد. برخی مطالعات، موارد PMS و اختلال نارسایی پیش از قاعدگی(PMDD) ، ناهنجاریهای سروتونین، گاما آمینوبوتیریک اسید (GABA) و سایر سیستمها را در مقایسه با گروههای کنترل بدون علامت نشان دادهاند. استروژن با افزایش سنتز، انتقال، بازجذب و بیان گیرنده و پاسخدهی پس سیناپسی، عملکرد سروتونین را افزایش میدهد. سطوح استرادیول مرتبط با چاقی ممکن است منجر به اختلال در عملکرد سروتونین شود و در بروز PMS نقش داشته باشد. مهارکنندههای بازجذب (SSRls) در درمان علائم خلقی قبل از قاعدگی، هوسهای غذایی، تغییرات اشتها و نفخ شکم مؤثر هستند، این فرضیه توسط مطالعات بالینی پشتیبانی میشود. (25) همانطور که توسط Lee و همکارانش بیان شد، چاقی ممکن است با تأثیرگذاری بر وضعیت ویتامین D با PMS مرتبط باشد. افراد چاق بیشتر در معرض خطر کمبود ویتامین D، به عنوان اصلیترین ویتامین در گردش هستند؛ زیرا متابولیت اصلی ویتامین دی در گردش، 25-هیدروکسی ویتامین D، در بافت چربی ذخیره میشود. ویتامین D همچنین در تنظیم سیستم رنین-آنژیوتانسین-آلدوسترون نقش دارد. (15)
نقش فاکتور التهابی در سندرم PMS
استرادیول و پروژسترون دارای خواص ضدالتهابی و ضد اکسیداتیو هستند و کاهش آنها در اواخر فاز لوتئال منجر به افزایش استرس اکسیداتیو آندومتر و سنتز پروستاگلاندینهای پیش التهابی، سیتوکینها، کموکاینها و ماتریکس متالوپروتئینازها میشود. در گذشته تحقیقات گسترده التهاب مزمن را با اختلالات روانپزشکی و جسمی مرتبط با علائم مشترک با PMS/PMDD از جمله افسردگی، اضطراب، میگرن و سندرم خستگی مزمن مرتبط دانسته است. در سالهای اخیر، مطالعات متعددی ارتباط احتمالی بین التهاب محیطی و PMS/PMDD را بررسی کردهاند. سطوح محیطی اینترلوکینهای پیش التهابی و فاکتور نکروز تومور آلفا (TNF-α) در زنان مبتلا به PMS افزایش یافته است. سطوح پروتئین واکنشی (CRP) C، یکی دیگر از نشانگرهای زیستی التهاب، ارتباط مثبتی با شدت علائم PMS، به ویژه خلقوخو، رفتار و علائم درد دارد. جالب توجه است که میکروبیوتای روده در طول چرخه قاعدگی و با توجه به شدت علائم قبل از قاعدگی متفاوت است. (25)
یافتههای زیادی وجود دارد که از نقش التهاب در PMS حمایت میکند. عزیزیه و همکاران به نقش احتمالی سیتوکینهای پیش التهابی IL-8 و TNF-α به عنوان یک عامل کمککننده در علائم PMS اشاره کردند. در انسان و حیوان، انتشار سیتوکینهای پیش التهابی منجر به بیماری و علائم افسردگی، بیاشتهایی، فلج اندام، اختلال عملکرد شناختی و کاهش تعامل اجتماعی میشود که همگی از علائم رایج PMS هستند. بیان سیتوکین در آندومتر، بافت تخمدان و سلولهای گرانولوزا (نوعی از سلولهای فولیکول) نشان داده شده است. نقش التهاب در سندرم پیش از قاعدگی توسط مطالعات تشدید آسم قبل از قاعدگی حمایت شد که در آن افزایش سطح التهاب راه هوایی در اواخر فاز لوتئال با بدتر شدن علائم همراه بود CRP،TNF-α و IL-6 همراه با سردرد میگرنی، از علائم معمول PMS، ارتباط مثبتی دارند. (13) اما بر اساس یافتهها، به نظر میرسد که اثر ویتامین D بر اینترلوکین از طریق اثر 1α،25-دی هیدروکسی ویتامین D3 تولید IL-12 را مهار میکند. در ماکروفاژهای فعالشده علاوه بر این، اثر مهاری α1،25(OH)2D3 بر بیانIL-12 ارائه شده است، در حالی که پاسخ ویتامین D عملکردی (VDREs) در ژنهای IL-12A یا IL-12B یافت نشد. در شروع التهاب، اثر اولیه α1،25(OH)2D3 کاهش چرخهای بیان IL-12B است تا زمانی که پاسخ ایمنی در سطح قابل قبول حفظ شود و بعداً اثر ثانویه IL-10 رخ میدهد که خاموش میشود. توجه به این نکته ضروری است که IL-10 علاوه بر عملکرد ایمنی ضد التهابی خود، تأثیراتی بر مغز و رفتار دارد و در تعدیل علائم خلقوخو، اضطراب و افسردگی نقش دارد. (13)
نقش ویتامینها و مواد معدنی
در یک مطالعه کوهورت، زنانی که ویتامینهای B1 تیامین و ریبوفلاوین B2را از منابع غذایی دریافت میکردند، نسبت به کسانی که مصرف کم داشتند، کمتر در معرض ابتلا به PMS بودند. چندین گزارش نشان میدهد که بیماران مبتلا به PMS ممکن است سطوح پایینتری از منیزیم داخل سلولی در طول چرخه قاعدگی داشته باشند، اگرچه مطالعات در مورد سطوح سرمی تغییریافته نتایج متناقضی را بیان کرده است. در یک مطالعه با تجویز منیزیم پیرولیدون کربوکسیلیک اسید (360 میلیگرم سه بار در روز در نیمه دوم چرخه قاعدگی) نمرات کل علائم PMS و علائم عاطفی بهبود یافته است. با این حال، در مطالعات دیگر، منیزیم بیاثر بود. (16)
یک بررسی در سال 2000 این فرضیه را مطرح کرد که تنظیم هورمون کلسیوتروپیک عامل تحریککننده اصلی در PMS است. کلسیم به عنوان یک ریزمغذی مستقیماً با شدت علائم PMS مرتبط است. ویتامین D و هورمون پاراتیروئید از عوامل کلیدی در هموستاز کلسیم هستند. با این حال، مصرف کم ویتامین D در رژیم غذایی با بروز علائم قبل از قاعدگی همراه است. مطالعات مربوط به ویتامین D عمدتاً تأثیر مکملها یا دریافت رژیم غذایی را بر علائم قبل از قاعدگی آزمایش کردند که در آن میزان بروز علائم کمتر با مصرف زیاد ویتامین D گزارش شده است. تغییر گزارش شده توسط تایس جاکوب در سال 2007 در مصرف ویتامین D در زنان و افرادی که علائم قبل از قاعدگی دارند نشان میدهد که تغییرات در سطوح هورمونهای تنظیمکننده کلسیم در طول چرخه در بیماران قابل توجه است. پنلند و جاکوب دریافتند که مصرف زیاد کلسیم شدت علائم قبل از قاعدگی را کاهش میدهد. همانطور که برای هر یک از علائم، تنها سردرد و انزوای اجتماعی در افرادی که مصرف روزانه لبنیات بالایی داشتند به طور قابلتوجهی کمتر بود. ارتباط قوی بین دیسمنوره و PMS ممکن است با اختلال در تولید استروئیدهای جنسی مرتبط باشد. (17)
تعداد زیادی از نشریات در مورد استفاده سودمند از ویتامینها و ریزعناصر در PMS صحبت میکنند. پیریدوکسین ویتامین B6 یک کوفاکتور ضروری برای سنتز کاتکولآمینها و دوپامین است. ویتامین E ماستالژی را تسکین میدهد و میتوان آن را در تمام دوره قاعدگی تجویز کرد، اما مصرف آن در فاز لوتئال بهتر است. کمبود منیزیم میتواند منجر به علائم PMS شود و زنانی که مکملهای حاوی منیزیم دریافت کردهاند اثر بهبودی را گزارش کردند. کمبود کلسیم ممکن است در شکلگیری علائم PMS نقش داشته باشد. به عنوان مثال، هنگام مصرف کلسیم 500 میلیگرم 2 بار در روز به مدت سه ماه در زنان مبتلا به PMS، سطح خستگی و شدت افسردگی به طور قابلتوجهی کاهش یافت و نتیجه در یک مطالعه کنترل شده با دارونما تأیید شد. (18)
برای اصلاح اختلالات روانی در PMS شامل سردرد، تهوع، بیخوابی، خستگی، اسهال، سرگیجه، کاهش میل جنسی، کاهش تمرکز، استفاده از مهارکنندههای انتخابی بازجذب سروتونین فلوکستین، سرترالین، پاروکستین، سیتالوپرام به عنوان خط اول پیشنهاد شده است؛ اما در اختلالات روانی شدید، از جمله افسردگی، زنان باید با روانشناس یا روانپزشک مشورت کنند. داروهای ضد بارداری خوراکی یک درمان مؤثر برای PMS هستند. آنها تخمکگذاری را سرکوب کرده و ضخامت آندومتر را کاهش میدهند که به نوبه خود منجر به کاهش حجم از دست دادن خون قاعدگی میشود، همچنین باعث کاهش سطح پروستاگلاندین شده و بر این اساس، درد مرتبط با انقباض رحم را کاهش میدهد. (18)
دادههای محدودی نشان میدهد که مصرف زیاد ویتامین B6 (از رژیم غذایی، اما نه از مکملها) با خطر کمتر PMS/PMDD مرتبط است. تعدادی از ویتامینها و مکملهای غذایی، از جمله ویتامین B6، ویتامین E، ویتکس آگنوس کاستوس، کلسیم و منیزیم، به عنوان عوامل درمانی برای PMS مورد مطالعه قرار گرفتهاند. با این حال، مطالعات بیشتری جهت بررسی نیاز است. (4)
چگونه ورزش به زنان مبتلا به PMS کمک میکند؟
در اواخر فاز لوتئال چرخه قاعدگی، سطح هورمون استروژن و پروژسترون برای آماده شدن جهت قاعدگی در سطح پایینی قرار دارد. به نظر میرسد این سطوح پایین عاملی در بروز علائم PMS باشد. مطالعات اولیه نشان میدهد که فعالیت بدنی متوسط ممکن است ناراحتی قبل از قاعدگی و هورمونهای استروئیدی تخمدان، پروژسترون و استرادیول را که در ایجاد PMS نقش دارند، کاهش دهد. یک برنامه ورزشی ممکن است برای زنان مبتلا به اختلال پیش از قاعدگی مرتبط با پروژسترون مفید باشد. (19) ورزش هوازی باعث افزایش هموگلوبین، هماتوکریت، تعداد گلبولهای قرمز و تعداد پلاکتها و کاهش سطح پرولاکتین، استرادیول میشود و در نتیجه باعث بهبود خستگی، اختلال در تمرکز، گیجی و بیشتر علائم قبل از قاعدگی میگردد. (20) ورزشهای هوازی به طور گذرا غلظت استروژن و پروژسترون را افزایش میدهد که ممکن است فواید مثبتی برای خلقوخو و کاهش سطح استرس داشته باشد. افزایش این هورمونهای تخمدانی بر کاهش غلظت رنین و آلدوسترون تأثیر میگذارد که به تنظیم تعادل مایعات و به علائمی مانند نفخ و ادم در چرخه قاعدگی کمک میکند. کاهش این هورمونها و انقباضات مداوم عضلانی که در طول ورزش هوازی اتفاق میافتد به فرآیند بازجذب سدیم و آب کمک میکند و منجر به بهبود علائم فیزیکی PMS میشود و سبب افزایش پروستاگلاندینها در بدن شده که به پیشگیری و کاهش درد و ناراحتی در لگن و شکم کمک میکند. ترشح اندورفینهایی که در حین ورزش اتفاق میافتد باعث کاهش درد، کاهش استرس و بهبود خلقوخو میشود. اندورفینها به القای افکار و احساسات مثبت در افراد کمک میکند و سطوح استرس را کاهش میدهد. (21) چندین مطالعه ارتباط ورزش هوازی با شدت متوسط، افزایش در بتا اندورفین در گردش را نشان داده است. گزارش شده است که کاهش بتا اندورفین پلاسما با علائم PMS مرتبط است. (22)
انجام تمرینات هوازی با شدت 60 درصد حداکثر ظرفیت جذب اکسیژن، منجر به افزایش سطح کورتیزول حداقل 2 ساعت پس از ورزش میشود؛ بنابراین کورتیزول غدد هیپوتالاموس و هیپوفیز را مهار میکند و هموستاز را برای پاسخ سالم به استرس بازیابی میکند. تمرینات هوازی با شدت متوسط در همه مطالعات انجام شده به اثرات قابل توجه ورزش هوازی در کاهش علائم مرتبط با استرس مانند عصبانیت، نوسانات خلقی، اضطراب، افسردگی، ولع مصرف غذا، خستگی و غیره نسبت داده شده است. انجام 30 دقیقه ورزش هوازی، 3 تا 5 جلسه در هفته به مدت حدود 10 هفته، مزایای بالقوهای در بهبود علائم پیش از قاعدگی زنان در سنین باروری دارد. همچنین پیشنهاد میشود که زنان مبتلا به PMS میتوانند از نوع فعالیت بدنی هوازی در مدیریت علائم جسمی و روانی خود بهرهمند شوند. (22)
نقش رژیم غذایی در سندرم PMS
پیشنهاد شده است که مالتوز ممکن است با PMS مرتبط باشد و مصرف زیاد اسید استئاریک ممکن است با خطر کمتر ابتلا به PMS مربوط باشد. طبق مطالعات انجام شده تفاوت معنیداری در علائم قاعدگی گزارش شده توسط افراد دو گروهی که مصرف اسیدهای چرب غیراشباع و اسید چرب اشباع داشتند، وجود نداشت، اما کاهش قابلتوجهی در علائم مرتبط با احتباس آب گزارش شد. همچنین مصرف کل چربی (اشباع و تک غیراشباع) با علائم درد ارتباط معنیداری داشت. تأثیر ریزمغذیها و مکملهای گیاهی روی، دارای اثرات مفید متعددی از جمله اثرات ضد التهابی، آنتی اکسیدانی و ضد افسردگی است. به طور کلی، مکمل روی به مدت 12 هفته در میان زنان مبتلا به PMS تأثیر مفیدی بر علائم جسمی و روانی، ظرفیت آنتی اکسیدانی کل و فاکتور نوروتروفیک مشتق از مغز داشت. چندین مطالعه نشان داده است که افراد مبتلا به PMS سطح کلسیم سرمی پایینتری دارند و مکمل کلسیم میتواند به طور قابلتوجهی بروز PMS و علائم مرتبط با آن را بهبود بخشد. (23)
تحقیقات دیگر رویکرد مصرف زیاد کلسیم مرتبط با ویتامین D را در کاهش علائم PMS، از جمله کاهش خطر پوکی استخوان و برخی سرطانها، توجیه کرده است. مکمل کلسیم و ویتامین D به عنوان یک رویکرد ارزان، کمخطر، قابل قبول و در دسترس برای از بین بردن یا کاهش علائم توصیه میشود. مطالعات مختلف اهمیت ویتامین D را در تولیدمثل زنان احتمالاً به دلیل تأثیرات آن بر هموستاز کلسیم، نوسانات چرخهای هورمون استروئید جنسی، یا عملکرد انتقال دهندههای عصبی نشان میدهد. درمان با ویتامین D با بهبود کیفیت زندگی مرتبط با PMS و اختلالات خلقی در نوجوانان، همراه است. مکمل منیزیم در پیشگیری از دیسمنوره، PMS و میگرن قاعدگی، مؤثر در نظر گرفته میشود. ترکیبی از منیزیم با ویتامین B6 میتواند به طور مؤثر استرس قبل از قاعدگی را کاهش دهد و ویتامین B6 میتواند به طور مؤثری اضطراب را در زنان مسن کاهش دهد. تیامین (B1)، ریبوفلاوین (B2)، نیاسین (B3)، پیریدوکسین (B6)، اسید فولیک (B9) و کوبالامین (B12) ویتامینهای ضروری در سنتز انتقال دهندههای عصبی هستند که به طور بالقوه در پاتوفیزیولوژی PMS نقش دارند. (23)
ویتامین D یک هورمون استروئیدی است که اعمال بیولوژیکی آن از طریق گیرنده ویتامین D (VDR) انجام میشود. VDR نه تنها در بافتهای تنظیمکننده کلسیم، بلکه در بسیاری از اندامهای تناسلی دیگر نیز شناسایی شده است که نقش بالقوه ویتامین D را در فیزیولوژی تولیدمثل زنان نشان میدهد. علاوه بر این، شواهد علمی نشان میدهد که حفظ سطح کافی 25D(OH) در پیشگیری از طیف گستردهای از اختلالات سلامت ضروری است. برخی مطالعات، عملکردهای دیگری از ویتامین D مانند اثرات ضد التهابی و تعدیلکننده ایمنی آن را پیشنهاد کردهاند. زنان مبتلا به PMS در فاز لوتئال در مقایسه با گروه کنترل طبیعی، سطح سرمی ویتامین D کمتری دارند. علاوه بر این، بالاترین سطوح دریافتی ویتامین D با کاهش 41 درصدی PMSبه دلیل تأثیر بر سطوح کلسیم، نوسانات دورهای در هورمونهای جنسی و/یا انتقالدهندههای عصبی تعدیلکننده مرتبط بود؛ بنابراین، به نظر میرسد کمبود ویتامین D با PMS مرتبط باشد. مطالعات سلولی نشان داده است که مکمل ویتامین D باعث کاهش تولید سایتوکینهای التهابی و افزایش نشانگرهای ضد التهابی میشود. (13)
با نگاهی به مکانیسمهای اثر ویتامین D بر PMS و اثرات مشاهدهشده تجویز آن بر بیومارکرهای التهاب و استرس اکسیداتیو که از طریق بیان ژن آپولیپوپروتئین، سرکوب هورمون پاراتیروئید، ســرکوب فعالسازی NF-kB و تنظیم دگرگونی سیستمهای آنتیاکسیدانی انجام میشود، فرض بر این است که بهبود وضعیت ویتامین D ممکن است عوامل التهابی و ظرفیت آنتی اکسیدانی را بهبود بخشد و از این رو، بروز و شدت علائم PMS را کاهش دهد. (22)
افسردگی و PMS
موارد دیگری وجود دارد که میتواند علائمی مشابه PMS داشته باشد، شایعترین آن افسردگی است که در زنان میتواند درست قبل از هر دوره قاعدگی شدیدتر به نظر برسد. با این حال، برخلاف PMS، افسردگی اغلب در طول ماه، از جمله در نیمه اول چرخه، علائمی را ایجاد میکند. طبق یک مطالعه در زنان افسرده، علائم قبل از قاعدگی و حتی در زنان با سنین بالاتر اغلب علائم شدیدتر میشوند. علائم در طول فاز فولیکولار برای افراد افسرده بالینی شدیدترین، برای افراد افسرده تحت بالینی، متوسط و برای شرکتکنندگان غیرافسرده کمترین شدت را داشت. علائم پیش از قاعدگی، از جمله تغییرات ناخوشایند و تحریکپذیری میتواند علیرغم درمان مؤثر افسردگی شدید ادامه یابد. در یک مطالعه، تشدید اختلالات افسردگی پیش از قاعدگی با بدتر شدن عملکرد بیش از آنچه قبلاً در زنان افسرده تجربه شده بود، همراه است. بیماران ممکن است بدون توجه به شدت افسردگی، تعداد دورهها یا وضعیت بهبودی مستعد ابتلا به PMS باشند. (23)
مدیریت درمان PMS
مدیریت PMS شامل تمرینات ورزشی، اصلاح رژیم غذایی، مدیریت استرس، درمان شناختی رفتاری و داروها (بر اساس علائم) است. با توجه به بولتن تمرینی کالج آمریکایی متخصصین زنان و زایمان (ACOG)، درمان غیردارویی به عنوان درمان اصلی برای همه زنان مبتلا به PMS توصیه میشود. فعالیتهای بدنی به عنوان جایگزین مفیدی برای داروها در مدیریت علائم قبل از قاعدگی در نظر گرفته میشود و با بهبود سلامتی در طول دورههای PMS همراه است. فعالیتهای بدنی به طور بالقوه میتواند پروفایل هورمونی، عملکرد تولیدمثل، چرخه قاعدگی، تخمکگذاری و باروری را در بین زنان در تمام سنین بهبود بخشد. با توجه به شواهد موجود، بهبود پارامترهای خونی و کاهش سطح پرولاکتین، استرادیول و پروژسترون را با تمرینات در حین PMS گزارش کردهاند و تعداد کمی از مطالعات دیگر از تمرینات برای بهبود عزت نفس، افسردگی و اضطراب حمایت میکنند. (22) پیشنهاد شده است که دریافت کالری و همچنین انتخاب ترجیحی کربوهیدرات در طول دوره قبل از قاعدگی در زنان مبتلا به PMS که حساستر به نوسانات دورهای هورمونی یا انتقالدهندههای عصبی هستند، مهمتر است. (24) علاوه بر این، مهارکنندههای بازجذب سروتونین، مانند فلوکستین، یکی از مؤثرترین داروها برای درمان PMS هستند. همچنین تجویز مترگولین، یک آنتاگونیست سروتونین، به زنان تحت درمان با فلوکستین مبتلا به PMDD باعث بازگشت علائم خلقی میشود. (12)
Refrences:
- Chumpalova P, Lakimova R, Stoimenova-Popova M, Aptalidis D, Pandova M, Stoyanova M, Fountoulakis K. Prevalence and clinical picture of premenstrual syndrome in females from Bulgaria. Annals of General Psychiatry. 2020. Volume19. :10.1186/s12991-019-0255-1.
- Dennerstein L, Lehert Ph, Heinemann K, Epidemiology of premenstrual symptoms and disorders, Menopause Int, 2012, doi: 10.1258/mi.2012.012013.
- Marjoribanks J, Brown J, O’Brien P, Wyatt K. Selective serotonin reuptake inhibitors for premenstrual syndrome. Volume 07, 2013. doi:10.1002/14651858.CD001396.pub3
- Yonkers K, Casper R, Epidemiology and pathogenesis of premenstrual syndrome and premenstrual dysphoric disorder, 2022.
- Thys-Jacobs S, McMahon D, Bilezikian J, Cyclical changes in calcium metabolism across the menstrual cycle in women with premenstrual dysphoric disorder, J Clin Endocrinol Metab 2007, doi: 10.1210/jc.2006-2726.
- Dubey N, J Hoffman J, Schuebel K,Yuan Q, Martinez P, Nieman L,Rubinow D, Schmidt J, Goldman D The ESC/E(Z) complex, an effector of response to ovarian steroids, manifests an intrinsic difference in cells from women with premenstrual dysphoric disorder. Mol Psychiatry.2017. doi: 10.1038/mp.2016.229.
- Hartlage S, Freels S, Gotman N,Yonkers K. Criteria for premenstrual dysphoric disorder: secondary analyses of relevant data sets. Arch Gen Psychiatry, 2012. doi:10.1001/archgenpsychiatry.2011.1368.
- Pakharenko L, Evaluation of progesterone and progesterone receptor gene PROGINS polymorphism in the development of some forms of premenstrual syndrome, 2015, doi: https://doi.org/10.30841/2708-8731.1.2020.471241
- Gao M,Gao D, Sun H, Cheng X, An L,Qiao M. Trends in Research Related to Premenstrual Syndrome and Premenstrual Dysphoric Disorder From 1945 to 2018: A Bibliometric Analysis,2021, https://doi.org/10.3389/fpubh.2021.596128.
- Deuster P,Adera T,South-paul J, Biological, social, and behavioral factors associated with premenstrual syndrome, 1999, doi: 10.1001/archfami.8.2.122.
- Schmidt P,Nieman L, Danaceau M, Adams L,Rubinow D, Differential behavioral effects of gonadal steroids in women with and in those without premenstrual syndrome,1998, DOI: 1056/NEJM199801223380401.
- Eriksson E, Alling C,Andersch B, Andersson K, Berggren U. Cerebrospinal fluid levels of monoamine metabolites. A preliminary study of their relation to menstrual cyclephase, sex steroids, and pituitary hormones in healthy women and in women with premenstrual syndrome.1994, doi: 10.1038/sj.npp.1380107.
- Heidari H, Amani R, Feizi A, Askari Gh, Kohan Sh, Tavasoli P, Vitamin D Supplementation for Premenstrual Syndrome-Related inflammation and antioxidant markers in students with vitamin D deficient: a randomized clinical trial, nature,2019, https://doi.org/10.1038/s41598-019-51498-x.
- Johnson E, Hankinson S, Willett W, Manson. Adiposity and the Development of Premenstrual Syndrome, 2010, https://doi.org/10.1089/jwh.2010.2128.
- ELBanna M, ELBbandrawy A, Elhosary E, Gabr A. Relation between body mass index and premenstrual syndrome,2019, Current Science International. https://doi.org/10.5603/gp.2019.0048.
- Facchinetti F, Borella P, Sances G, Fioroni L, Nappi RE, Genazzani AR. Oral magnesium successfully relieves premenstrual mood changes. Obstet Gynecol. 1991 Aug;78(2):177-81. PMID: 2067759.
- Obeidat B,Alchalabi H, Ruzzak Kh, Farras M, Premenstrual Symptoms in Dysmenorrheic College Students: Prevalence and Relation to Vitamin D and Parathyroid Hormone Levels, 2012, https://doi.org/10.3390/ijerph9114210.
- Abduhamidonva Kh, Premenstrual syndrome in the modern science, Eurasian journal of academic research,2021, doi:10.5281/zenodo.5584563.
- Stoddard, J.L., Dent, C.W., Shames, L. et al. Exercise training effects on premenstrual distress and ovarian steroid hormones. Eur J Appl Physiol 99, 27–37 (2007). https://doi.org/10.1007/s00421-006-0313-7
- El-lithy A, Mazany A, Sabbour A, Deeb A, Effect of aerobic exercise on premenstrual symptoms, haematological and hormonal parameters in young women , 2014, https://doi.org/10.3109/01443615.2014.960823
- Sanchez, B.N. Kraemer, W.J. Maresh, C.M. Premenstrual Syndrome and Exercise: A Narrative Review. Women 2023, 3, 348-364. https://doi.org/10.3390/women3020026
- Noviyanti N,Gusriani, Ruqaiyah, Mappaware N, The effect of estrogen hormone on premenstrual syndrome (PMS) occurrences in teenage girls at Pesantren Darul Arqam Makassar,2021, https://doi.org/10.1016/j.gaceta.2021.10.103
- Hartlage SA, Brandenburg DL, Kravitz HM. Premenstrual exacerbation of depressive disorders in a community-based sample in the United States. Psychosomatic Medicine. 2004 Sep-Oct;66(5):698-706. DOI: 10.1097/01.psy.0000138131.92408.b9. PMID: 15385694.
- Siminiuc R, Dinu Ţurcanu D, Impact of nutritional diet therapy on premenstrual syndrome, 2023, Nutrition and Sustainable Diets, Volume 10 – 2023, https://doi.org/10.3389/fnut.2023.1079417
- Tiranini L, Nappi RE. Recent advances in understanding/management of premenstrual dysphoric disorder/premenstrual syndrome. Fac Rev. 2022 Apr 28;11:11. doi: 10.12703/r/11-11. PMID: 35574174; PMCID: PMC9066446.