روشهای کنترل کیفیت در قارچشناسی کلینیکی
بخش سوم
دکتر محمد قهری
www.ghahri.ir
انواع نمونهها
خون و مغز استخوان
خون: آمادهسازی محل جمعآوری خون بهمنظور جلوگیری از آلودگی میکروبی و مقدار خون جمعآوری شده از فاکتورهای مهم در تهیهی این نمونه برای کشت هستند. برای این منظور محیطهای کشت اختصاصی قارچها و یا لولههای لیز- سانتریفیوژ توصیه میشوند.
دستورات شرکت سازندهی محیط کشت همیشه باید مدنظر قرار گیرد. هیچگاه نمونههای کشت خون را بعد از جمعآوری در یخچال قرار ندهید. برای اطلاعات بیشتر به بخش 4-2-10 CLSI-M47 مراجعه کنید.
مغز استخوان: نمونههای مغز استخوان باید بطریق آسپتیک آسپیره شود و بداخل لولهی لیز- سانتریفیوژ، یا لولهی هپارین یا در شیشههای کشت خون ویژهی قارچشناسی منتقل گردد.
دستگاه تنفسی
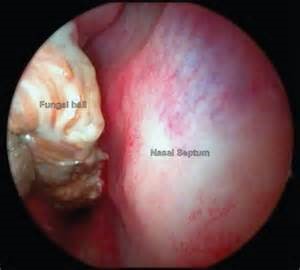
مجاری فوقانی تنفسی: نمونههای سینوس باید بهوسیلهی آسپیراسیون اندوسکوپیک و یا بافت سینوس از طریق جراحی جمعآوری شود. کشتهای بینی برای تشخیص عفونت سینوس مناسب نیستند.
منظرهی سینوسکوپی از یک توپ قارچی
نمونههای بینی، نازوفارنکس و رینوسربرال: لزیونها یا زخمهای مجاری بینی نیاز به نمونهبرداری از حاشیهی در حال پیشرفت ضایعات دارد. برای نگهداشتن بافت به حالت مرطوب، نمونهی بافت را در ظرف استریل حاوی مقدار کمی سالین استریل فاقد مواد محافظ قرار دهید.
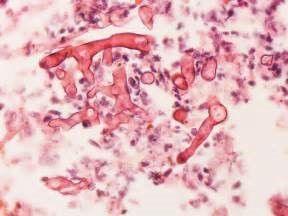
اگر به یکی از قارچهای موکوراسئوس مشکوک هستید، بافت را نباید (با کمک تیشو گریندر) هموژنیزه کنید، بلکه بهوسیلهی اسکالپل خرد نمایید. این بدان علت است که کپکهای موکوراسئوس دارای دیوارهی عرضی کمی هستند و بنابراین نمیتوانند سیتوپلاسم خود را بهصورت کوپه کوپهای نگهداری کنند و در نتیجه اغلب در اثر شکستن هایفی زنده نمیمانند.
هایفیهای فاقد دیواره عرضی مربوط به یک زیگومیست در بافت
نمونههای دهانی
لزیونها یا اسکارهای دهانی باید بیوپسی شوند و همانند یک بافت با آنها برخورد شود. در صورت مطرح شدن کاندیدیازیس یک سواب یا شستشوی سالین مورد استفاده قرار میگیرد. سالین برای شستشوی دهان بکار رفته و سپس به داخل یک ظرف استریل برگردانده میشود.
مجاری تحتانی تنفسی
مایع بدستآمده حاصل از شستشوی برونشیال از طریق برونکوسکوپی در یک ظرف استریل ریخته میشود. برای تمیز کردن یا سایش برونشها، بروس را در یک ظرف محتوی یک میلیلیتر سالین استریل بدون مواد محافظ قرار دهید. 5 تا 10 میلیلیتر از مایع لاواژ برونکوآلوئلار در یک ظرف استریل تهیه شود. بیوپسی ترانس برونشیال ریه باید در یک ظرف محتوی یک میلیلیتر سالین استریل بدون مواد محافظ قرار گیرد.
نمونههای خلط به شرطی قابل قبول هستند که بیمار بعد از آنکه دهانش را خوب شستشو داد با یک سرفهی عمیق در ابتدای صبح، نمونهی خلط را جمعآوری کرده باشد. اگر یک نمونهی خلط قابل تهیه نباشد یک نمونهی خلط القاء شده مناسب است.
اگر نمونه برای کشتهای قارچی و مایکوباکتریال جمعآوری شده باشد، کشت قارچی قبل از آلودگیزدایی و هضم برای مایکوباکتریها باید انجام شود. قرار دادن نمونههای مجاری تحتانی تنفسی در یخچال میتواند در موارد خاصی به جهت کاهش تکثیر باکتریهای کومنسال مطلوب باشد.
مایعات استریل بدن غیر از خون
مایع آسیت یا مایع پاراسنتز: از حفرهی شکمی مایع آسپیره شده و نمونهای در حد 5 تا 10 میلیلیتر در یک ظرف استریل دربدار یا درپیچدار منتقل و به آزمایشگاه ارسال شود.
مایع مغزی نخاعی: مقدار 3 تا 5 میلیلیتر مایع مغزی نخاعی در لولههای درپیچدار استریل جمعآوری کنید. بلافاصله تمام مایع را در شرایط دمای اتاق به آزمایشگاه منتقل نمایید. نمونه در یخچال قرار نگیرد. اگر فقط یک لوله دریافت شده باشد باید ابتدا برای میکروبشناسی مورد بررسی قرار گیرد. اگر بیش از یک لوله دریافت شود لولههای دوم و سوم (هرکدام که کمتر خونی باشد) برای میکروبشناسی مورد بررسی قرار میگیرند. هرگونه لخته در مایع باید قبل از انجام کشت کاملاً خرد شود.
مایع پلورال، مایع سینوویال، یا توراسنتز (thoracentesis)
نمونهای از مایع جمعآوری شده را در چند لولهی استریل دربدار یا درپیچدار قرار دهید.
نمونهی ادرار
بیش از یک میلیلیتر از ادرار اول صبح را در شرایط تمیز در یک ظرف استریل جمعآوری کنید. نمونهی ادرار را میتوان از طریق کاتتر مستقیم یا بطریقهی سوپراپوبیک بدست آورد. استفاده از لولههای انتقال بوریک اسید برای موارد مشکوک به عفونت کاندیدائی مناسب است.
نمونهی ادراری که از کیسهی کاتتر فولی تهیه شده باشد برای کشت مناسب نیست.
نمونهی ادرار متعاقب ماساژ پروستات برای نشان دادن میکوزهای اندمیک میتواند مورد استفاده قرار گیرد.
گونههای کاندیدا میتوانند بهصورت گذرا مجاری ادراری را کلونیزه یا آلوده نمایند.
مشاهدهی سیستوسکوپیک یا حین عمل جراحی، توپهای قارچی، پیلونفریت یا شواهد هیستولوزیکی تهاجم مخاطی برای اثبات پروسهی عفونی لازم است.
قارچهای مهاجم (مانند کریپتوکوکوس نئوفرمنس، کریپتوکوکوس گتی آی، گونههای آسپرجیلوس، گونههای موکوراسه، هیستوپلاسما کپسولاتوم، گونههای بلاستومایسس، کوکسیدیوئیدس ایمیتیس و کوکسیدیوئیدس پوساداسی آی) بهعنوان بخشی از عفونت قارچی سیستمیک یا منتشره میتوانند روی کلیهها تأثیر بگذارند و بنابراین حضور آنها نشاندهندهی عفونت است.
نمونههای درماتولوژیکال
نمونههای موردنظر برای کشت درماتوفیتها نباید در یخچال قرار گیرند، علاوه بر این موفقیت کشت درماتوفیت مستقیماً با مقدار نمونهی دریافتشده ارتباط دارد.
مو
موهایی که در زیر نور وود فلئورسانس دارند را انتخاب کنید. در غیاب فلئورسانس موهایی را انتخاب کنید که بهآسانی کنده میشوند، یا شکسته میشوند و یا حاوی ندولهائی هستند. با کمک فورسپس 10 الی 12 موی مشکوک را بردارید و آنها را در یک ظرف استریل یا یک پاکت تمیز کوچک قرار دهید.
توجه: برخی از اسپریهای مو ممکن است در زیر نور ماوراءبنفش فلئورسانس نشان دهند.
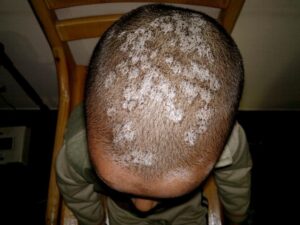
فرم اکتوتریکسی کچلی سر
فرم اندوتریکسی کچلی سر (نقاط سیاه black dots)
پوست و پوست سر
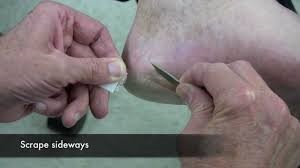
برای تمیز کردن پوست یا سطح پوست سر از الکل 70 درجه استفاده کنید. حاشیهی فعال لزیون را با کمک یک اسکالپل بتراشید و مواد سطحی را برداشته و دور بریزید. تراشههای زیرین را در یک پاکت کوچک تمیز و یا یک لوله یا ظرف استریل مناسب قرار دهید.
روش تراشیدن از ضایعهی پوستی
در صورت تهیهی بیوپسی (punch or share) همانند بافت عمل کنید.
یک روش جایگزین برای جمعآوری نمونههای پوست سر استفاده از برس استریل و یا یک مسواک کوچک یا یک سواب مرطوبشده است.
نمونهی چرک از شانکرها و کریونهای مشکوک به اسپوروتریکوزیس درصورتیکه به روش آسپیراسیون بدست آمده باشد دارای ارجحیت است. قبل از جمعآوری نمونه، سطح پوست باید با الکل 70 درجه تمیز و ضدعفونی شود. در درجات بعد، استفاده از سواب روش جمعآوری قابل قبولی است و 2 یا چند سواب باید تهیه شود و تمام آنها بهصورت سفت و محکم بر روی قسمت داخلی حاشیهی در حال پیشرفت ضایعه چرخانده شوند.
شانکر بهصورت یک ندول زخمیشده، زگیلی، یا اریتماتوس با امکان انتشار موضعی لنفاتیکی ظاهر میشود. چنین مواردی در جراحتهای کوچک که توسط مواد گیاهی ایجاد شدهاند میتواند مورد تردید قرار گیرند.
ناخنها
ناخنهای فاقد لاک را با کمک گاز آغشته به الکل 70 درجه تمیز کرده، سپس سطح ناخن را تراشیده و دور بریزید. تراشههای نواحی عمقی و دبریهای زیر ناخن را جمعآوری کرده و در یک پاکت کوچک تمیز یا لوله یا ظرف استریل قرار دهید.
نمونهگیری از ناخن
نمونههای متفرقه
محتویات معده و شستشوی معده: نمونههای محتویات معده و مایعات حاصل از شستشوی معده نمونههای غیرقابل قبول برای کشتهای قارچی هستند.
نمونههای تناسلی
ترشحات واژینال برای جستجوی عفونتهای سرسخت مخمری بهوسیلهی سواب جمعآوری میشوند. نمونهی بافت از لزیونهای واژینال برای کشت قارچی جهت تشخیص هیستوپلاسموز و یا پاراکوکسیدیوئیدومایکوز مناسب هستند.
ترشحات پروستاتیک برای تشخیص بلاستومایسس درماتیتیدیس، گونههای کریپتوکوکوس و سایر قارچها باید بهوسیلهی ماساژ پروستات بعد از تخلیهی مثانه جمعآوری شده باشد.
نمونههای چشمی
مواد چرکی ملتحمهای توسط سواب جمعآوری میشوند.
قرنیه (با حلقهای از صلبیه) دهنده باید در 1 تا 5 میلیلیتر سالین استریل عاری از مواد محافظ قرار داده شود.
برای تراشههای قرنیه یک پلیت آگار فاقد مواد مهارکننده فراهم گردد و یک لام میکروسکپی در اختیار افتالمولوژیست قرار گیرد. از او بخواهید که تراشههای قرنیه را بداخل محیط آگار به شکل X و یا C دو تا سه بار در نواحی مرکزی پلیت تلقیح کند و کمی از نمونه را نیز در مرکز لام قرار داده، پلیتهای آگار را در دمای اتاق نگهداری و بلافاصله به آزمایشگاه منتقل نماید.
مایع ویتره بهوسیلهی آسپیراسیون توسط پزشک جمعآوری میشود.
نمونههای گوش خارجی
استفاده از سواب برای جمعآوری نمونههای مربوط به کانال خارجی گوش قابل قبول است.
دستگاههای پزشکی/ پروستتیک
دستگاه را در یک ظرف استریل محتوی 1 تا 5 میلیلیتر سالین استریل فاقد مواد محافظ قرار دهید تا مرطوب بماند.
برای لنزهای تماسی، کشت مستقیمِ لنز، انتخاب ارجحی میباشد.
نمونههای بافت
بافت را در یک ظرف استریل با مقدار کمی سالین استریل فاقد مواد محافظ قرار دهید تا آن را مرطوب نگاهدارد.
آسپیرههای پوسچولار یا بیوپسیهای پوست باید در یک ظرف استریل و تمیز با مقدار کمی سالین استریل فاقد مواد محافظ قرار گیرند.
آبسهها و زخمها
برای جمعآوری مواد آبسهای اکسودای سطحی را با سالین استریل یا اتیل الکل 70 درجه برداشته و آسپیراسیون آسپتیک با استفاده از سوزن و سرنگ از آبسهی تخلیهنشده فراهم کنید. این نکته شامل بافت از عمقیترین قسمت لزیون بهاضافهی حاشیهی در حال پیشرفت نیز میشود.
نمونهی آسپیره شده را در یک لولهی استریل قرار دهید.
زخمها میتوانند به همان حالت شبیه آبسهها بهوسیلهی آسپیراسیون آسپتیک با کمک سرنگ و سوزن جمعآوری شوند.
نمونهی آسپیره شده را در یک لولهی استریل قرار دهید.
اصول و روشهای نشان دادن قارچها در نمونههای کلینیکی آزمایش مستقیم و کشت (3)
اصول و روشهای نشان دادن قارچها در نمونههای کلینیکی (9)
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب (2)
روشهای کنترل کیفیت در قارچشناسی کلینیکی (1)
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام