اساس کار و کاربرد روش الکتروکمیلومینسانس
شیوا گنجعلی (دانشجوی دکتری تخصصی بیوتکنولوژی پزشکی، دانشگاه علوم پزشکی مشهد)
مقدمه
روشهای سنجش مولکولها در علوم زیستی یکی از مهمترین شاخههای تحقيقاتی به شمار میآید (1). در سالهای گذشته پیشرفتهای زیادی در بسیاری از روشها و سیستمهای ایمونواسی مشاهده شده است و عمده گرایشها به سمت سنجشهای فاز جامد بر پایه آنتیبادیهای منوکلونال بوده است (2). یکی از تکنولوژیهایی که در سالهای اخیر طراحی شده است به نام لومینسانس (Luminescent) معروف است که محصول نهایی قابل سنجش آن نور میباشد (1). در واقع در یک واکنش لومینسانس یک الکترون از سطح تهییج شده یا بالاتر به سطح پایینتر انرژی میرسد و انرژی خود را به صورت نور متصاعد میکند که با توجه به منبع تحریک واکنش لومینسانس را میتوان به انواع:
- فتولومینسانس (فلورسنس و فسفرسنس) که منبع تحریک انرژی جذب شده از نور است،
- بیولومینسانس که منبع تحریک انرژی جذب شده از واکنشهای کاتالیز شده بیولوژیکی میباشد.
- کمیلومینسانس
طبقهبندی کرد که البته واکنش کمیلومینسانس از سایر پدیدههای لومينسانس متفاوت بوده و در حقیقت به تابش نور از محصول تهییج شده یک واکنش شیمیایی زمانی که به سطح پایه برمیگردد، اطلاق میشود (3).
1-کمی لومینسانس (CL)
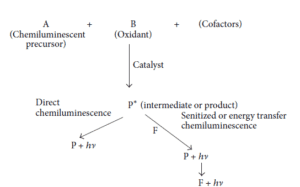
به طور کلی یک واکنش کمیلومینسانس (CL) میتواند از طریق دو مکانیسم اساسی ایجاد گردد (شکل 1). در واکنش CL دو ماده (به طور معمول سوبسترا و اکسیدانت) در حضور یک کوفاکتور واکنش داده و یک محصول یا ماده حدواسط را ایجاد میکنند. در روش مستقیم CL بخشی از محصول به حالت برانگیخته تبدیل شده و سپس با انتشار فوتون به حالت پایه برمیگردد و همین امر مسئول انتشار نور میباشد (3). اما روش غیرمستقیم CL برای مولکولهایی است که به طور مستقیم نمیتوانند وارد واکنش شوند، بنابراین بر مبنای پروسه، انتقال انرژی از یک گونه برانگیخته شده به یک فلوروفور میباشد که نور ساطع شده مربوط به ماده فلوروفور وقتی که به سطح پایین انرژی برمیگردد، میباشد (4).
شکل 1) انواع واکنش کمیلومینسانس (P=Product, F=Fluorescing substance) (3)
در روشهای کمیلومینسانس به دلیل اینکه محدوده زمانی و محل تابش نور تولید شده قابل کنترل نیست، نمیتوان غلظتهای بسیار کم یا محدوده گستردهای از غلظت مواد را با آنها اندازهگیری کرد. همچنین در بسیاری از تکنیکهای کمیلومینسانس به دلیل نزدیکی محل واکنش نمونههای مختلف، نور تولید شده از یک نمونه بر روی اندازهگیری نور نمونه مجاور تأثیر گذاشته و باعث بدست آمدن نتایج نه چندان دقیق میشود (3)، بنابراین برای حل مشکلات روشهای کمیلومینسانس و در جهت بهبود آن طی چند سال گذشته روش الکتروکمیلومینسانس ابداع شده است.
2- الکتروکمیلومینسانس (ECL)
ECL در واقع یک روش کمیلومینسانس است که با روشها و واکنشهای الکتروشیمیایی انجام میشود. در ECL واکنشی که به تولید نور میانجامد با جریان الکتریکی آغاز و با قطع آن خاتمه مییابد. این روش فرآیندی است که سبب تولید پیشسازهای پایدار در سطح الکترود میشود و محصول نهایی این واکنش نور است (5).
2-1-اصول روش الکتروکمیلومینسانس
ECL میتواند از طریق 4 مسیر انجام شود:
1) مسیر annihilation
2) مسیر Co-reactant
3) مسیر Hot electron-induced
4) مسیر Electrostatic chemiluminescence
که دو مسیر اول مسیرهای غالب در انجام ECL هستند و در ادامه به توضیح مختصر راجع به 2 مسیر اول میپردازیم.
2-1-1- Annihilation pathway
در این روش هر دو گونه اکسید شده و احیا شده توسط یک پتانسیل مرحلهای در سطح الکترود تولید میشوند، سپس این گونهها به منظور تولید یک حالت برانگیخته الکتریکی با یکدیگر میانکنش انجام میدهند و در نهایت با تابش نور به حالت پایه برمیگردند. بیشتر سیستمهای ECL بر پایه ترکیبات آروماتیک که مطابق با این نوع مکانیسم هستند، میباشند (6).
2-1-2- Co-reactant pathway
در این روش ECL به طور معمول توسط یک پتانسیل مستقیم در سطح الکترود در حضور هر دوی لومینوفور و کمک واکنشگر ایجاد میگردد؛ به عنوان مثال یک سیستم اکسیداسیون-احیایی که بسیار محبوب است و اخیراً پایهECL ایمونواسیهای تجاری میباشد، سیستم Ru(bpy)32+/tripropylamine است. همانطور که در شکل 2 مشاهده میکنید هر دو Ru(bpy)32+ و TPrA در سطح الکترود اکسیده شده و Ru(bpy)32+ توسط رادیکال آزاد TPrA احیا میشود و ایجاد حالت برانگیخته میکند (6).
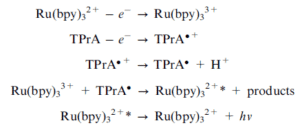
3- اجزای دخیل در یک واکنش ECL
ECL با واسطه مولکولهای متعددی از جمله ترکیبات روتنیوم، اسمیوم و رنیوم انجام میگیرد. در واقع پایه و اساس ECL در استفاده از کمپلکس روتنیوم و تریپروپیلامین میباشد که محصول نهایی به صورت نور قابل ملاحظه میباشد (2).
به عنوان مثال: اگر آنالایت مورد نظر یک آنتیژن مجهول باشد، دو آنتیبادی در این واکنش استفاده میشود که یکی از آنتیبادیها با بیوتین و دیگری با روتنیوم کونژوگه شدهاند که هر دوی آنها دارای اپیتوپ کاملاً اختصاصی برای اتصال به آنتیژن موردنظر هستند. هر دو آنتیبادیها با آنتیژن موردنظر کمپلکسی را تشکیل میدهند. سپس میکروپارتیکلهای پوشیده شده با استرپتوآویدین به محلول اضافه میشوند. استرپتوآویدین پیوندهای قویی را با بیوتین برقرار میکند. در مدت زمان انکوباسیون که این مواد در کنار یکدیگر قرار میگیرند به هم متصل شده و کمپلکسی را تشکیل میدهند که از یک انتهای آن میکروپارتیکلهای پوشیده شده با استرپتوآویدین و در انتهای دیگر روتنیوم قرار دارد.
سپس این کمپلکس کامل ایمونواسی به سلول اندازهگیری منتقل میگردد. بعد از انتقال محلول به سلول اندازهگیری یک میدان مغناطیسی جهت تثبیت کمپلکسها استفاده میشود که باعث اتصال میکروپارتیکلها به سطح الکترود خواهد شد. سپس بافری مملو از تریپروپیلامین، که نقش مرکزی در واکنش ECL دارد، را وارد واکنش میکنیم. این بافر هم تریپروپیلامین موردنیاز را تأمین میکند و هم مواد اضافی و باند نشده را حذف میکند (1). اعمال ولتاژ بر سطح الکترود، که معمولاً از جنس طلا یا پلاتین میباشد، باعث شروع واکنش خواهد شد.
تریپروپیلامین اکسید شده و سپس با از دست دادن یک اتم هیدروژن به شکل رادیکال آزاد تریپروپیلامین تبدیل میشود. کمپلکس روتنیوم نیز در اثر اعمال ولتاژ یک الکترون از دست داده و به صورت کاتیون روتنیوم تبدیل میشود. در نهایت یون روتنیوم یک الکترون از رادیکال آزاد تریپروپیلامین (که به عنوان یک کاهنده عمل میکند) گرفته و برانگیخته شده و سپس جهت رسیدن به حالت پایه، نور از خود ساطع میکند. حالت احیاء شدن تریپروپیلامین نیز طی پروسهای انجام خواهد شد که تأثیری روی فرآیند الکتروکمیلومینسانس نخواهد داشت. همچنین این واکنش به وسیله میزان حضور تریپروپیلامین و مقدار کمپلکس روتنیوم کنترل میشود. چرخه ECL تا زمانی که ولتاژ برقرار باشد تکرار خواهد شد که نتیجه آن تقویت نور خواهد بود. انتشار نور توسط فتومولتیپلایر شناسایی میشود و غلظت آنالایت موردنظر از طریق اندازهگیری میزان سیگنال نور ساطع شده اندازهگیری خواهد شد (2).
4-کاربردهای روش ECL
در طول دو دهه گذشته ECL به سرعت پیشرفت کرده و به یک تکنولوژی قدرتمند تبدیل شده است. ECL دارای گستره وسیعی از کاربردها در زمینه تشخیصهای کلینیکالی، پزشکی قانونی، تحقیقات محیط زیست، مطالعات دارویی و تشخیص عامل خطر بیولوژیکی میباشد (6). همچنین ECL استفادههای زیادی در بسیاری از زمینههای مختلف علوم از جمله میکروبیولوژی، ایمونولوژی، ویروسشناسی و بیولوژی مولکولی دارد. انواع مختلفی از سنجشها برای تشخیص و اندازهگیری میکروارگانیسمها مثل باکتریها و پروتوزا در طبیعت و نمونههای بیولوژیکی استفاده شده است. لازم است که این میکرواورگانیسمها به طور دقیق برای ردیابی و کنترل بیماریهای انسانی اندازهگیری شوند. ECL با بهبود حساسیت سنجش، به آنالیز این میکرواورگانیسمها کمک میکند و محدوده تشخیص را افزایش میدهد.
سنجشهای ایمنی بر پایه ECL برای تشخیص توکسینهای باکتریایی مثل بوتولینوس A، زیرواحد بتای کلرا و اسپورهای باکتریایی توسعه پیدا کردهاند. علاوه بر این در مورد سایتوکاینها که پروتئینهای ترشحی از انواع مختلف سلولها هستند و پاسخهای ایمنی مثل التهاب، ترمیم بافت و خونسازی را تنظیم میکنند نیز مطالعاتی از سنجش بر پایه ECL برای آنالیز آنها استفاده شده است که تکرارپذیری و حساسیت بالاتری نسبت به الایزا داشته است. توانایی اندازهگیری شبکه سایتوکاینی با استفاده از ECL محققان را قادر میسازد تا مسیرهای سیگنالینگ این سایتوکاینها را به طور کاراتر مطالعه کنند. همچنین تکنیک ECL در بررسی ویروسها و عفونتهای ویروسی نیز کاربرد دارد. علاوه بر اینها نتایجECL برای سنجش محصولات PCR نیز استفاده میشوند.
به علاوه یکی از زمینههای مطالعات دارویی اندازهگیری سطح دارو در افراد تحت درمان میباشد که این کار با تکنیک ECL کمهزینهتر و موفقتر بوده است (8). همچنین با استفاده از این تکنیک میتوان پروتئینهای سطح سلولهای زنده و بیومارکرهای پروتئینی سرطانها را نیز اندازهگیری کرد و تشخیص داد، بنابراین ECL ایمونواسی به یک ابزار قدرتمند برای تشخیص فوقالعاده حساس بیومارکرها تبدیل شده است. در 5 سال گذشته تحقیقات زیادی به منظور افزایش حساسیت و کاربردهای ECL انجام گرفته است (7).
5- مزایا و محدودیتهای روش ECL
تکنیک ECL در مقایسه با دیگر تکنیکها ویژگیهای ممتاز بسیاری دارد. اول اینکه، ECL حساسیت بالایی جهت اندازهگیری آنالایتهای با مقدار کم (حجم کم نمونه) و همچنین مدت زمان کوتاه دارد. همچنین تعدادی از واکنشگرها میتوانند به صورت الکتروشیمیایی در سطح الکترود بازسازی شوند، مثل تریپروپیلامین، که اجازه میدهد تا زمانی که سوبسترا وجود داشته باشد واکنش ECL و تولید نور انجام شود، بنابراین تعداد زیادی فوتون در هر سیکل اندازهگیری تولید میشود که همین موضوع حساسیت تکنیک را بالا برده و سبب میشود تا غلظتهای حتی زیر پیکومولار را هم اندازهگیری کند.
علاوه بر این بازسازی واکنشگر سبب سادگی کار دستگاه و نیز صرفهجویی در واکنشگرها میشود. دوم اینکه ECL محدوده گستردهای از مواد را تشخیص میدهد زیرا بسیاری از معرفها و ترکیباتی که در روش کمیلومینسانس غیرفعال بودند از طریق ECL به ترکیباتی تبدیل میشوند که قادرند در واکنش شرکت کنند، بنابراین این تکنیک میتواند محدوده گستردهای از آنالایتها را شناسایی کند. سوم اینکه سرعت اندازهگیری آن زیاد است به طوریکه تنها چند ثانیه برای انجام تکنیک کافی است.
چهارم اینکه هیچ رادیوایزوتوپی در آن استفاده نمیشود و دارای معرفهای غیرایزوتوپی بسیار پایدار و با کاربرد آسان است. پنجم اینکه به دلیل نزدیکی تابش نور به سطح الکترود در ECL امکان کنترل بیشتر تابش نور میباشد، بنابراین در حساسیت اندازهگیری و تشخیص چندین آنالایت به طور همزمان مفید میباشد و بالاخره اینکه در این تکنیک قابلیت اتوماسیون کامل دستگاه وجود دارد که خطای تکنیکی را کامل حذف میکند و تنها یک دستگاه ساده برای انجام این روش موردنیاز میباشد و توان بالایی در تجزیه و تحلیل نتایج دارد.
اما در این تکنیک از دستگاهها و کیتهای گرانقیمت و اختصاصی که منحصر به یک شرکت خاص هستند استفاده میشود که از جمله مهمترین محدودیتهای این روش میتوان به هزینه زیاد آن اشاره کرد (7).
6- نتیجهگیری
ECL نه تنها یک تکنیک موفق تجاری است، بلکه یک ابزار چندگانه برای فهم سؤالات اساسی در زمینه شیمی، بیولوژی و فیزیک میباشد. همانطور که اشاره شد ECL دارای مزایای زیادی برای تشخیص گستره وسیعی از آنالایتها مثل بیومارکرها، توکسینها و میکروبها میباشد، بنابراین ویژگیهای برجسته این تکنیک نشان میدهد که استفاده از آن به صورت فعال برای کاربردهای عملی و تحقیقات علمی همچنان ادامه دارد.
7- منابع:
- http://hnlab.ir/HosseiniNasabLab/BaseServices/Articles/eclia.aspx
- Biju C.M, Biju RS, Thapalia N. An overview of electrochemiluminescent (ECL) technology in laboratory investigations. Kathmandu University Medical Journal (2005) Vol. 3, No. 1, Issue 9, 91-93.
- Fereja T.H, Hymete A, Gunasekaran1 T. A Recent Review on Chemiluminescence Reaction, Principle and Application on Pharmaceutical Analysis. Spectroscopy. 2013. Article ID 230858, 12 pages.
- Han, J. Jose, E. Mei, and K. Burgess, “Chemiluminescent energy-transfer cassettes based on fluorescein and nile red,” Angewandte Chemie International Edition (2007), vol. 46, no. 10, pp. 1684–1687.
- Stefanie E. K. Kirschbaum & Antje J. Baeumner. A review of electrochemiluminescence (ECL) in and for microfluidic analytical devices. Anal Bioanal Chem (2015) DOI 10.1007/s00216-015-8557-x.
- Hu L, Xu G. Applications and trends in electrochemiluminescenceChem. Soc. Rev., 2010, 39, 3275–3304.
- Liu Z, Qi.W, Xu G. Recent advances in electrochemiluminescence. 2015. Chem. Soc. Rev.DOI: 10.1039/c5cs00086f.
- Rhyne P.W. Wong O.T, Zhang Y.J, Weiner R.S. Electrochemiluminescence in bioanalusis. Bioanalysis (2009) 1(5), 919-935
https://en.wikipedia.org/wiki/Electrochemiluminescence
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام


بسیار مفید بود ممنون.