تازههایی از باسیل گرم منفی غیرتخمیرکننده
(اسینتوباکترها و سایر باکتریهای این گروه)
دكتر رضا ميرنژاد (استاد تمام دانشگاه)
اسینتوباکترها:
تاریخچهی جنس اسینتوباکتر به اوایل قرن بیستم برمیگردد، هنگامی که در سال 1911، بیولوژیست آلمانی بیجرنیک، ارگانیسمی به نام Micrococcus calcoaceticus را با غنیسازی در محیط حاوی استات از خاک جدا کرد. در طول دهههای بعدی، ارگانیسمهای مشابه توصیف شدند و حداقل در 15 جنس و سویهی مختلف زیر طبقهبندی گردیدند.
Diplococcus mucosus, Micrococcus calcoaceticus, Alcaligenes haemolysans, Mima polymorpha, Moraxella lwoffi, Herellea vaginicol, Bacterium anitratum, Niesseria winogradskyi, Moraxella lwoffi var. glucidolytica, Acromobacter anitratus, Achromobacter mucosus.
اسم طبقهبندی جدید، Acinetobacter (برگرفته از واژهی یونانی akinetos به معنی غیر متحرک)، ابتدا توسط Brisou و Prevot در سال 1954 برای تمایز ارگانیسمهای غیرمتحرک از متحرک جنس Achromobacter بهکار برده شد، اما این نام جدید تا سال 1968 بهطور گسترده مورد پذیرش واقع نشد تا اینکه Baumann و همکارانش مقالهای جامع منتشر کردند و نتیجه گرفتند که گونههای مختلفی که در بالا ذکر شدهاند متعلق به یک جنس هستند، به همین دلیل نام اسینتوباکتر انتخاب شد، اگرچه طبقهبندی به زیرگونههای مختلف بر اساس خصوصیات فنوتیپی امکانپذیر نبود. این یافتهها باعث انتخاب جنس اسینتوباکتر توسط کمیتهی مسئول تاکسونومی Moraxella و باکتریهای همراه آن شد تا اینکه در ویرایش سال 1974 کتاب باکتریولوژی سیستماتیک برجی، جنس اسینتوباکتر با توصیف گونهی جدای Acinetobacter calcoaceticus (نوع سویه برای هر دوی جنس و گونه ATCC 23055 A.calcoaceticus است) طبقهبندی گردید. لیست نهایی نام باکتریها، شامل دو گونهی مختلف A.lwoffii و A.calcoaceticus بود؛ چرا که این گونهها برخلاف سایر گونههای اسینتوباکتر غیرساکارولیتیک هستند. لازم به ذکر است که A.calcoaceticus برخلاف A.lwoffii همولیتیک میباشند. بر اساس همین اطلاعات A.calcoaceticus به دو زیرگونه یا بیووار تقسیم شده است؛ A.calcoaceticus بیووار anitratus (که در گذشته Herellea vaginicola نامیده میشد) و A.calcoaceticus بیووار lwoffii (که در گذشته Mima polymorpha نامیده میشد)، هرچند که این تقسیمبندی تاکنون توسط تاکسونومیستها اثبات نشده است.
جنس اسینتوباکتر شامل باکتریهای گرم منفی، بهشدت هوازی، غیرتخمیرکننده، غیر اسیددوست، غیرمتحرک، کاتالاز مثبت و اکسیداز منفی با محتوای DNA G+C 47 – 39% است. بر اساس یافتههای جدید تاکسونومی، اسینتوباکتر باید در خانوادهی جدید Moraxellaceae در راستهی Gammaproteobacteria که شامل جنسهای Moraxella، Acinetobacter، Psychrobacterو سایر ارگانیسمهای وابسته است، طبقهبندی شود. این باکتریها در هنگام رنگآمیزی نمونههای حاصل از مایعات بدن و از محیط کشت جامد اغلب مشابه نایسریا هستند.
اعضای جنس اسینتوباکتر در همهجا حضور دارند، چرا که این ارگانیسمها بعد از غنیسازی در محیط کشت از انواع نمونههای حاصل از خاک یا آبهای سطحی احیا میشوند؛ در حقیقت اکثر گونههای جنس اسینتوباکتر در محیط زیست دارای زیستگاه طبیعی هستند، اگرچه بیشتر گونههای اسینتوباکترها بخشی از فلور پوست انسان هستند در یک مطالعهی اپیدمیولوژی که برای بررسی کلونیزاسیون اسینتوباکتر روی پوست و موکوس انجام گرفت، مشخص شد که 43% افرادی که در بیمارستان بستری نشدهاند، با این ارگانیسم کلونیزه شدهاند. بیشترین گونههای ایزوله شده شامل (58%) A.lwoffii، (20%) A.johnsonii، (10%) A.junii و اسینتوباکتر بیوتیپ 3 (61%)، است. در یک مطالعهی مشابه، مشخص شد که 44% داوطلبان سالم حامل A.lwoffii (61%)، اسینتوباکتر بیوتیپ 15BJ (12%)، radioresistent.A (8%) و اسینتوباکتر بیوتیپ 3 (5%) هستند. در بیماران بستری در بخش، میزان حامل بودن حتی از این میزان نیز بیشتر بوده و به 75% میرسد.
در هنگکنگ Chu و همکارانش دریافتند که حدود 53% از دانشجویان پزشکی و پرستاران جدید در تابستان و 32% آنها در زمستان با اسینتوباکتر کلونیزه میشوند. چنین تغییرات فصلی در کلونیزاسیون پوستی ممکن است به دلیل تغییر در شیوع A.baumannii در نمونههای کلینیکی باشد. اسینتوباکتر بیوتیپ 3 (36%)، اسینتوباکتر بیوتیپ 13TU (15%)، اسینتوباکتر بیوتیپ 15TU(6%) و اسینتوباکتر بومانی (4%) شایعترین گونههای ایزولهشده بودند، درحالیکه A.lwoffii، johnsonii.A و A.Junii بهندرت یافت شدند. اگرچه گونههای مختلفی از اسینتوباکتر از جانوران جدا شده است و اسینتوباکتر بومانی بهعنوان عامل بیماریزایی شناخته شده است، برای بررسی حضور اسینتوباکترها، تاکنون فلور نرمال حیوانات بهصورت سیستماتیک بررسی نشده است. لازم به ذکر است که اسینتوباکتر بومانی از 22% نمونههای شپش جمعآوریشده از افراد بیخانمان احیا شده است، این نتایج ممکن است حاکی از باکتریمی مخفی در این افراد باشد، اگرچه اهمیت کلینیکی این نتایج هنوز مشخص نیست. حضور اسینتوباکتر در محیطهای غیرزنده نیز بررسی شده است. Berlau و همکارانش در انگلستان سبزیجات را برای وجود اسینتوباکتر بررسی کردند و دریافتند که 30 کشت از 177 نمونه سبزیجات برای این باکتری مثبت هستند، جالب توجه است که اسینتوباکتر بومانی و اسینتوباکتر بیوتیپ 8 (هرکدام27%) شایعترین گونه بودند و بعد از آنها calcoaceticus.A و اسینتوباکتر بیوتیپ 3 تنها در یک نمونهیافت شد. Houang و همکارانش اسینتوباکترها را در 23 مورد از 60 نمونهی گرفتهشده در هنگکنگ یافتند. فراوانترین نمونهی اسینتوباکتر بیوتیپ 3 (27%) و اسینتوباکتر بومانی (23%) بود و تنها یک نمونه حاوی calcoaceticus.A بود. در یک تحقیق منتشرنشده در آلمان 92 مورد از 163 نمونههایی (56%) که از خاک و آبهای سطحی جمعآوری شده بودند، دارای اسینتوباکتر بهخصوص calcoaceticus.A، johnsonii.A، haemolyticus.A و اسینتوباکتر بیوتیپ 3 بودند و اسینتوباکتر بیوتیپ 13TU به هیچ عنوان در نمونههای آب و خاک یافت نشد. گونههای جدید اسینتوباکتر که از لجن فعال جدا شدهاند شامل baylyi.A، bouvetii.A، tjernbergiae.A، grimontii.A، towneri.A و tandoii.A هستند. این گونهها محیطیاند و تاکنون در انسان مشاهده نشدهاند، در مقابل دو سویهی دیگر که بهتازگی توصیف شدهاند، یعنی schindleri.A و ursingii.A از نمونههای انسانی جدا شده است، درحالیکه parvus.A هم از نمونههای انسانی و هم از سگسانان جدا شده است. بعضی از گونههای اسینتوباکتر بهطور گستردهای در طبیعت منتشرند، برای مثال calcoaceticus.A در آب، خاک و سبزیجات یافت میشود. اسینتوباکتر بیوتیپ 3 در آب، خاک سبزیجات و سطح پوست انسان یافت شده است و johnsonii.A در آب، خاک، پوست و مدفوع انسان وجود دارد و A.lwoffii و radioresistens.A در پوست انسان، اسینتوباکتر بیوتیپ 11 در آب، خاک، سبزیجات و دستگاه گوارش انسان دیده نمیشوند. حداقل در اروپا، نرخ ناقلین اسینتوباکتر در جامعه تقریباً پایین است.
شناسایی گونهها:
اسینتوباکترها تا مرحلهی جنس بهواسطهی خصوصیاتی مانند کوکوباسیلهای گرم منفی، کاتالاز مثبت، اکسیداز منفی، غیرتخمیرکننده و غیرمتحرک شناسایی میشوند. اسینتوباکترها باسیلهای کوتاه و پهن هستند که رنگ خود را بهآسانی از دست نمیدهند و به همین دلیل ممکن است با کوکسیهای گرم مثبت اشتباه گرفته شوند. اسینتوباکترهای با منشأ انسانی بهخوبی در محیطهای جامد که بهطور معمول در آزمایشگاههای میکروبیولوژی استفاده میشوند، مانند بلاد آگار گوسفندی یا تریپتیکاز سوی آگار در دمای ◦37 رشد میکنند. این ارگانیسمها کلنیهای صاف، گاهی موکوئیدی و خاکستری تشکیل میدهند. کلنیهای مجموعهی A.calcoaceticus –A.baumannii بعد از یک شب گرماگذاری، با قطری در حدود 3-1/5 میلیمترشبیه کلنیهای انتروباکتریاسهها است، درحالیکه اغلب گونههای دیگر اسینتوباکتر، کلنیهای کوچکتر و کدرتری تشکیل میدهند. برخلاف انتروباکتریاسهها، بعضی از گونههای اسینتوباکتر خارج از مجموعهی A.baumannii– A.calcoaceticus ممکن است بر روی محیط مککانکی آگار رشد نکنند. ایزولههای A.haemolyticus و چندین گونهی دیگر که بهخوبی توصیف نشدهاند، مانند اسینتوباکتر بیوتیپ 6، 13BJ، 14BJ، 15BJ، 16، 17ممکن است همولیز را در محیط خون گوسفندی نشان دهند که این ویژگی در اسینتوباکترهای ایزولهشـدهی متعلق به مجموعهی A.baumannii– A.calcoaceticusدیده نشده است. متأسفانه هیچ تست بیوشیمیایی که بهتنهایی قادر باشد بین اسینتوباکترها و سایر باکتریهای گرم منفی غیرتخمیرکننده تمایز ایجاد کند، وجود ندارد. یک روش قابل اعتماد برای تشخیص قطعی اسینتوباکترها تا مرحلهی جنس استفاده از روش تغییریافتهی Juni است. در این روش از سویهی جهشیافتهی BD413L استفاده میشود که برای اسیدآمینهی تریپتوفان اگزوتروف است. این سویه بهطور طبیعی قابل تغییر بوده و اخیراً بهعنوان A.baylyi شناخته میشود. این سویه میتواند در حضور DNA ناخالص هرگونهای از اسینتوباکتر به فنوتیپ نوع وحشی تغییر یابد. برای بهدست آوردن اسینتوباکتر از نمونههای محیطی و کلینیکی (برای مثال پوست)، بهترین شیوه استفاده از روشهای غنیسازی در pH پایین در محیط مایع همراه با مکملهای معدنی و استات یا منبع مناسب کربن است. ثابت شده است که وجود نیترات بهعنوان منبع نیتروژن برای افزایش رشد مفید است. برای جداسازی اسینتوباکترها از مخلوطی از جمعیت باکتریایی، استفاده از محیط کشت اختصاصی Leeds پیشنهاد میشود.
از چندین روش موجود برای شناسایی گونههای اسینتوباکتر، هیبریداسیون DNA- DNA بهعنوان روش مرجع استاندارد است. روش شناسایی فنوتیپی که در سال 1986 توسطBouvet و Grimont پیشنهاد شد، بر اساس 28 تست فنوتیپی است. این روش در سال 1987 بهبود یافت، به این روش جدید پارامترهایی مانند رشد در دمای 37، 41 و 44 درجه سانتیگراد تولید اسید از گلوکز، هیدرولیز ژلاتین و استفاده از 14 منبع کربن مختلف اضافه شد. اگرچه این روش قادر به تمایز بین 11 تا 12 بیوتیپ اسینتوباکتر که در ابتدا توصیف شدند، هست و همچنین 95/6% از ایزولههای اسینتوباکتر جداشده از نمونههای پوستی انسان را تا مرحلهی گونهای بهدرستی شناسایی میکند، اما توانایی شناسایی گونههایی که اخیراً شناسایی شده بودند را ندارد، همچنین این روش توانایی شناسایی گونههای بسیار نزدیک به یکدیگر، گونههای شایع کلینیکی، اسینتوباکتر بومانی و اسینتوباکتر بیوتیپ 13TU را ندارد. درحالیکه A.calcoaceticus و اسینتوباکتر بیوتیپ 3 تنها بهواسطهی تفاوت رشد در دماهای مختلف قابل تمایز هستند، متأسفانه، تستهای فنوتیپی ساده که بهطور معمول در آزمایشگاههای تشخیص طبی به کار میرود، حتی برای شناسایی قطعی شایعترین گونههای اسینتوباکتر غیرمناسب است.
هر دو روش هیبریداسیون DNA-DNA و Bouvet و Grimont بسیار پرزحمت بوده و برای آزمایشگاههای میکروبیولوژی مناسب نیستند. در حقیقت این روشها در تعداد کمی از آزمایشگاههای مرجع دنیا در دسترس هستند. امروزه روشهای مولکولی همانند تحلیل قطعات محدودشدهی ژن16S rRNA (ARDRA[1])، انگشتنگاری DNA با قدرت تفکیک بالا با روش پلیمورفیسم طول قطعات تکثیرشده (AFLP[2])، ریبوتایپینگ، انگشتنگاری فاصلهگذارهای tRNA، آنالیز توالیهای فاصلهگذار بینژنی 16S-23S rRNA و آنالیز توالیهای ژن rpoB (زیرواحدβ RNA pol) و فاصلهگذارهای آن، برای شناسایی اسینتوباکترها در دسترس است. آنالیزهای ARDRA و AFLP امروزه از جمله پذیرفتهشدهترین روشهای شناسایی گونههای اسینتوباکتر هستند. انگشتنگاری tRNA، اگرچه برای شناسایی گونهها مناسب است، اما بین اسینتوباکتر بومانی و اسینتوباکتر بیوتیپ 13TU تمایز ایجاد نمیکند. مشخص شده است هر دو روش ریبوتایپینگ و آنالیز توالی نواحی فاصلهگذار بین ژنهای 16S-23SrRNA توانایی تشخیص بین گونههای مجموعهی A.baumanniii -A calcouceticus. را دارند، اما تاکنون برای سایر گونههای اسینتوباکتر بهکار نرفتهاند، توالییابی ژن rpoB اگرچه نویدبخش است، اما باید تغییراتی برای بهبود عملکرد در آن صورت گیرد. همهی این روشها منجر به شناخت بهتری از اپیدمیولوژی و اهمیت کلینیکی گونههای اسینتوباکتر در سالهای اخیر شده است، اما این روشها برای استفاده روزانه در آزمایشگاههای تشخیص میکروبیولوژی بسیار پرزحمت هستند و تنها در آزمایشگاههای مرجع کاربرد دارند. پیشرفتهای جدید در زمینهی شناسایی اسینتوباکتر بومانی بهواسطهی شناسایی ژنهای شبه کارباپانماز blaOXA-51 و الکتروسکوپی PCR (PCR–ESI-MS) که باعث نمایان شدن سریع تفاوتهای میان ژنهای وابسته به gyrB A.baumannii و اسینتوباکتر بیوتیپ 13TU میشود، حاصل شده است.
طیفسنجی جرمی جذب یونش لیزری با ماتریکس در کمتر از یک ساعت توانایی شناسایی گونهها را دارد، اما نیازمند تجهیزات گرانقیمت و تغییرات بیشتر است. شناسایی گونهها با سیستمهای دستی یا نیمهخودکار در آزمایشگاههای تشخیص میکروبیولوژی ماننـد Microscon. walk way systems،Phoenix، Vitek2 و API ZONE مشکلاتی دارد. این اشکالات نهتنها به دلیل محتوای محدود دادهها است، بلکه همچنین سوبستراهای مورد استفاده برای شناسایی گونهها برای اسینتوباکترها اختصاصی نیست.
سه عضو کلینیکی مشهور مجموعهی A.baumannii -A.calcouceticus از طریق سیستمهای شناسایی تجاری قابل شناسایی نیستند. در حقیقت A.baumannii، اسینتوباکتر بیوتیپ 3 و اسینتوباکتر بیوتیپ 13TU مجموعاً بهعنوان A.baumannii شناخته میشوند، بنابراین بهنظر میرسد استفاده از اصطلاح گروه A.baumannii بهجای مجموعهی A.baumannii–A.calcouceticus مناسبتر است. این مطلب به این حقیقت اشاره دارد که A.baumannii، اسینتوباکتر بیوتیپ 3 و اسینتوباکتر بیوتیپ 13TU دارای خصوصیات اپیدمیولوژیکی و کلینیکی مشترک هستند.
همانطورکه در بالا اشاره شد اسینتوباکتر بومانی (A. baumannii) شایعترین گونه جداشده است. گونههای دیگر نظیر اسینتوباکتر لوفی (A. lwoffii)، اسینتوباکتر جانسونی (A.johnsonii)، اسینتوباکتر همولیتیکوس (A. heamolyticus) و سایر گونهها بندرت جدا میشوند. قبلاً اسینتوباکترها با نامهای مختلفی نظیر میما پلیمورفا (Mima polymorpha) و هرلا واژینیکولا (Herellea vaginicolla) که بیانگر خصوصیات ارگانیسمها بود، نامیده میشدند. اسینتوباکتر بومانی که برخلاف سایر گونههای شایع در دمای 44 درجه سلسیوس نیز رشد دارد از خون، خلط، پوست، مایع جنب و ادرار (معمولاً در عفونتهای همراه با تجهیزات پزشکی) جدا میشود. اسینتوباکتر جانسونی پاتوژن بیمارستانی با بیماریزایی محدود بوده و در کشت خون بیماران دارای کاتترهای پلاستیکی داخل وریدی دیده میشود. اسینتوباکترهایی که از پنومونیهای بیمارستانی جدا میشوند، اغلب از مرطوبکنندهها یا خنککنندهها منشأ گرفتهاند. این باکتریها در بین باسیلهای غیرتخمیرکننده بعد از سودوموناس بیشترین وفور را در نمونههای کلینیکی دارند.
امروزه اسینتوباکتر بومانی بهعنوان یکی از مشکلسازترین پاتوژنهای انسانی در مراکز پزشکی دنیا شناخته میشود. به دلیل بهدست آوردن شاخصهای مقاومت بهخصوص در 15 سال اخیر، اسینتوباکتر بومانی تبدیل به یکی از ارگانیسمهای تهدیدکنندهی آنتیبیوتیکهای عصر حاضر شده است. سویههای اسینتوباکتر بومانی به تمامی آنتیبیوتیکهای شناختهشده مقاوم هستند که این موضوع تلاشهای گسترده در سطح جهانی را برای کنترل این ارگانیسم میطلبد.
با توجه به توانایی زیاد اسینتوباکتر بومانی به کلونیزه شدن و آلوده کردن بیماران بدحال که صرفنظر از عوارض ثانویهی عفونت، امید به بهبودی بسیار اندکی دارند، تعیین اثرات واقعی این پاتوژن بسیار مشکل است و بحثهای فراوانی پیرامون آن وجود دارد.
هنگامی که نتایج حاصل از باکتریمی اسینتوباکتر بومانی با باکتریمی حاصل از سایر باکتریهای گرم منفی مثل کلبسیلا پنومونیه مقایسه شد، افزایش قابلتوجهی در کشندگی اسینتوباکتر بومانی دیده شد. مطالعات دیگر، کشندگی بیشتری را هنگام کلونیزاسیون اسینتوباکتر بومانی مقاوم به چند دارو نشان دادند. عفونتهای حاصل از این باکتری قابل مقایسه با عفونت حاصل از سودوموناس آئروژینوزای مقاوم به چندین دارو است. اخیراً اهمیت کلینیکی درمان تجربی عفونتهای اسینتوباکتر بومانی مورد تجزیه و تحلیل گرفته است. در مقایسه با سایر ارگانیسمهای گرم منفی مانند سودوموناس آئروژینوزا، اطلاعات اندکی دربارهی واکنشهای متقابل بین اسینتوباکتر بومانی و میزبانش وجود دارد. مطالعات اخیر که بر روی توالیهای ژنومی اسینتوباکتر بومانی انجام گرفته است، طیف گستردهای از عوامل مقاومت آنتیبیوتیکی و جزایر بیماریزایی را آشکار کرده است. مشخص شده است که تعداد زیادی از ژنهای شناساییشده که مقاومت به آنتیبیوتیکها، فلزات سنگین و آنتیسپتیکها را کد میکنند، احتمالاً از ارگانیسمهایی با قدرت بیماریزایی بالا شامل E.coli، spp. Salmonella و Pseudomonas spp منشأ گرفتهاند. این یافته نشان میدهد که انتقال عناصر بیماریزایی در بین این ارگانیسمها امری محتمل است.
چرا اسینتوباکتر بومانی پاتوژن بیمارستانی مقاوم است؟
3 فاکتور اصلی احتمالاً در بقای اسینتوباکتر بومانی در شرایط بیمارستانی نقش دارند. این عوامل عبارتند از مقاومت به اکثر داروهای ضد میکروبی، مقاومت به خشکی و مقاومت به دزانفکتانتها.
مقاومت به آنتیبیوتیکها و فشار مضاعف ناشی از آنها ممکن است باعث ایجاد سویههایی خاص با خاصیت انتخابی شود. مطالعات مختلف نشان داده است که میزان مقاومت در سویههای اپیدمیک اسینتوباکتر بومانی به میزان قابلتوجهی بیشتر از سویههای عامل مولد تکگیر است. مقاومت به فلوروکینولونها در ارتباط با رفتارهای اپیدمیک است. Villers و همکارانش دریافتند که درمانهای قبلی با فلوروکینولونها بهعنوان یک فاکتور خطر مستقل برای عفونت با اسینتوباکتر بومانی اپیدمیک است و بهنظر میرسد که فشار انتخابی ناشی از استفادهی مداوم فلوروکینولونها در حداقل 5 سال، مسئول مقاومت و گسترش اپیدمیک کلونهای اسینتوباکتر بومانی مقاوم به چند دارو است. افزایش مقاومت سویههای اسینتوباکتر بومانی به کارباپنمها در ارتباط با همهگیریهای بیمارستانی است. پیشنهاد شده است که هر ایزولهی کلینیکی اسینتوباکتر بومانی با مقاومت به چندین آنتیبیوتیک میتواند سویهای با توانایی ایجاد همهگیریهای بیمارستانی ایجاد کند.
برای یافتن میزان تحمل اسینتوباکتر بومانی به خشکی، جواد و همکارانش مدت زنده ماندن 22 سویهی ایزولهشده از 8 همهگیری بیمارستانی را با مدت زنده ماندن 17 سویهی عامل موارد تکگیر مقایسه کردند. مدتزمان زنده ماندن رویهمرفته 27 روز بود که بهطور کامل طیف 21 تا 33 روزه را شامل میشد. قابلتوجه است که بین مدت زنده ماندن سویههای عامل همهگیریها و موارد تکگیر، اختلافی وجود نداشت، رویهمرفته، مطالعه نشان داد که اسینتوباکتر بومانی توانایی زنده ماندن طولانی مدتی را بر روی سطوح خشک دارد و بنابراین توانایی بالقوهای برای گسترش اپیدمیک دارد. مشاهده شده است که سویههای اسینتوباکتر بومانی در خشکی بسیار بهتر از سایر گونههای اسینتوباکتر مانند A.lwoffii، A.junii و A.johnsonii. زنده میمانند. اغلب سویههای اسینتوباکتر بومانی نسبت بهE.coli و سایرEnterobacteriaceae مدتزمان بسیار بیشتری زنده میمانند، اما مدت بقایی همانند استافیلوکوکوس اورئوس دارند.
این مشاهدات به همراه مطالعات قبلی که به گسترش.Acinetobacter spp از راه هوا در بیمارستان اشاره دارد، میتواند دلیلی بر وقوع همهگیریهای پشت سر هم بعد از ضدعفونی ناقص سطوح خشک باشد. مشخص شده است بقای طولانی مدت اسینتوباکتر بومانی در مراکز بیمارستانی، برای مثال نردههای تخت بیماران، با وقوع همهگیریها در ICU ارتباط دارد و توضیح میدهد که ناقلان خشک میتوانند دومین مخزنی باشند که اسینتوباکتر بومانی قادر به زنده ماندن در آن است. نگرانیها به دلیل توانایی همزمان باکتریهای مهم کلینیکی به آنتیبیوتیکها و دزانفکتانتها در حال افزایش است. حساسیت کاهشیافتهی استافیکوکوکوس اورئوس مقاوم به متیسیلین (MRSA[3]) در مقابل S.aureus حساس به متیسیلین به کلرهگزیدین و ترکیبات چهارتایی آمونیوم گزارش شده است و سویههای MRSA با مقاومت پایین به تریکلوسان پدیدار شدهاند. مطالعات مشابهی در باکتریهای گرم منفی مانند سودوموناس آئروژینوزا انجام گرفته است و مشخص شده است که مقاومت به دزانفکتانتها ممکن است با گسترش اپیدمیک ارگانیسمها در تجهیزات بیمارستانی در ارتباط باشد، اما ارتباط مقاومت به بیوسایدها و تمایل برای گسترش اپیدمیکی تاکنون بهطور سیستماتیک مطالعه نشده است.
تشخیص آزمایشگاهی:
از نمونههای خون، مایع پلور، ادرار، ضایعات پوستی میتوان این باکتریها را جدا کرد.
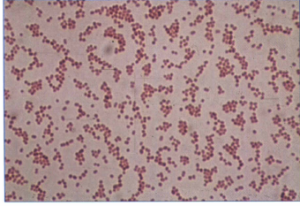
رنگآمیزی گرم: کوکوباسیل یا باسیلهای کوتاه که در روی محیطهای جامد و نمونههای کلینیکی اغلب به شکل دیپلوکوک هستند و با نایسریاها اشتباه میشوند (شکل 1). این باکتریها گرم منفی هستند که گاهی اوقات گرم مثبت مشاهده میشوند (گرم متغیر).
شکل (1): رنگآمیزی گرم گونههای اسینتوباکتر
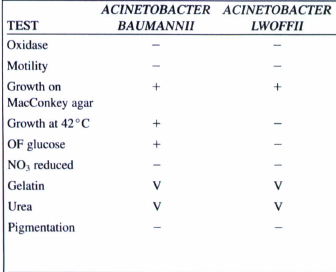
کشت: بر روی بیشتر محیطهای معمولی رشد میکند. روی بلادآگار کلنیهای محدب، خاکستری تا سفید به قطر 3-2 میلیمتر با همولیز متغیر ایجاد میکند. کلنی آن در روی مکانکی شبیه سایر لاکتوز منفیها است. در عمق TSI نمیتواند رشد نماید و الگوی TSI آن مانند سودوموناس ALK/ALK است. در جدول زیر مشخصات مهم اسینتوباکتر بومانی و لوفی نشان داده شده است.
عدم تخمیر گلوکز وجه افتراق آن با انتروباکتریاسه و تست اکسیداز وجه تمایز آن با نایسریا است (اسینتوباکتر برخلاف نایسریاها اکسیداز منفی است).
کلید تشخیصی اسینتوباکتر: در TSI واکنش ALK/ALK، رنگآمیزی گرم با مشخصات ذکرشده، اکسیداز منفی، مقاومت به پنیسیلین، H2s منفی، بدون حرکت، کاتالاز مثبت، حساس به پلیمیکسین B
جدول (1): مشخصات کلیدی اسینتوباکترها
درمان
سویههای اسینتوباکتر اغلب نسبت به عوامل ضدمیکروبی مقاوم بوده و درمان عفونتهای حاصل از اینها مشکل است. برای انتخاب بهترین درمان ضدمیکروبی، انجام تست تعیین حساسیت ضروری است. این باکتریها به سولفونامیدها، سفالوسپورینهای قدیمی، اریترومایسین، تتراسایکلین و کلرامفنیکل مقاوم بوده و در اکثر موارد سویههای اسینتوباکتر نسبت به جنتامایسین، آمیکاسین، توبرامایسین و پنیسیلینها یا سفالوسپورینهای جدید و آمینوگلیکوزیدها پاسخ میدهند.
تعریف اسینتوباکتر بومانی مقاوم به چندین دارو:
اکثر مطالعات انجامگرفته درصد ایزولههای حساس (یا مقاوم) به طیف آنتیبیوتیکها را نشان میدهند. اگرچه برخی از مطالعات نیز مقاومت چندگانه به آنتیبیوتیکها را نشان میدهند. بهترین تعریف برای اسینتوباکتر بومانی مقاوم به چند دارو این است؛ مقاومت چندگانهی دارویی، مقاومت همزمان به بیش از 2 آنتیبیوتیک از 5 دسته کلاس آنتیبیوتیکی است،Antipeudomonal carbapenems (ایمیپنم یا مروپنم)، آمپیسیلین– سولباکتام، فلوروکینولونها و سیپروفلوکساسین یا لووفلوکساسین و آمینو گلیکوزیدها (جنتامیسین، توبرامایسین یا آمیکاسین). لازم به ذکر است که تستهای حساسیتسنجی بتالاکتامها و بازدارندههای آن یعنی بتالاکتامازها بسیار پرزحمت هستند و آزمایشگاهها ممکن است از پیپراسیلین– تازوباکتام یا تیکارسیلین– کلاولانات در اسینتوباکتر بومانی استفاده کنند. علاوه بر این مقاومت به همهی داروها به معنای مقاومت به تمام مواد ضد میکروبی است که برای درمان اسینتوباکتر بومانی مورد استفاده قرار میگیرند که شامل بتالاکتامها (شامل کارباپنمها و سولباکتام MIC بیش از mg/mL4)، فلوروکینولونها و آمینوگلیکوزیدها است. اگرچه با افزایش استفادهی پلیمیکسینها و tigecycline، این تعریف احتمالاً، این عوامل ضد میکروبی را نیز دربر میگیرد.
استنوترفوموناس
این باکتریها در بین NFB بعد از سودوموناس و اسینتوباکتر بیشترین وفور را در نمونههای کلینیکی دارند. استنوتروفوموناس مالتوفيليا (گزانتوموناس) مهمترین گونه این جنس است. در مواد ضدعفونیکننده و آب وجود دارد و عامل عفونت بيمارستاني (بهخصوص در بیماران بستری در ICU)، پنوموني، باكتريمي اوليه، سپسيس و عفونت ادراري است. فاکتورهای خطر برای کلونیزاسیون یا عفونت با این ارگانیسم شامل تهویه مکانیکی، استفاده از آنتیبیوتیکهای وسیعالطیف، کاتترگذاری و کاهش نوترفیلها هستند. این باکتری بهخوبی روی محیطهای بلاد آگار و مکانکی آگار رشد میکند. کلنیها بر روی بلاد آگار بنفش کمرنگ است. اکسیداز منفی و تست OF گلوکز آن منفی ولی تست OF مالتوز آن مثبت است. لیزین دکربوکسیلاز، اسکولین، DNase مثبت است و بعضی از گونههای آن پیگمانت تولید میکنند. آنها به پلیمیکسین حساس هستند. جدول زیر تفاوتهای این باکتریها با بورخولدريا که هر دو آنها لیزین دکربوکسیلاز مثبت هستند را نشان میدهد. استنوتروفوموناس مالتوفيليا بهطور ذاتی به بسیاری از آنتیبیوتیکها بهویژه کارباپنمها مقاوم هستند. تریمتوپریم– سولفومتوکسازول آنتیبیوتیک انتخابی است، اگرچه برخی از سویهها به این دارو مقاوم شدهاند. CLSI تنها لووفلوکساسین، تریمتوپریم– سولفومتوکسازول و مینوسایکلین را پیشنهاد مینماید. اخیراً Break pointهایی جهت تفسیر این عوامل برای MIC و دیسک دیفیوژن ارائه داده است.
جدول (2): تمایز و شناسایی بورخولدريا سپاشیا و استنوترفوموناس مالتوفیلا
(هردو باسیل غیرتخمیری و لیزین دکربوکسیلاز مثبت)
آلکالیژنز:
گروه آلکالیژنها که شامل چهار گونه باسیل گرم منفی هستند، ممکن است قسمتی از فلور طبیعی انسان باشند و از دستگاههای تنفس مصنوعی، اسپریها و دستگاه دیالیز جدا شوند. آنها گاهی از ادرار، خون، مایع نخاعی، زخمها و آبسهها بدست میآیند. اکسیداز و کاتالاز مثبت بوده و دارای تاژکهای پریتریش (وجه تمایز از سودوموناسها) هستند. این باکتریها محیط نیترات و محیط OF را که دارای گلوکز است، قلیایی مینمایند و اورهآز و نیترات منفی هستند. بر روی بلادآگار کلنیهای سفید، صاف، بزرگ و خشن با حاشیه نامنظم ایجاد میکنند و همچنین قادر به رشد در روی مکانکی هستند (شکل 2). شکل و اندازه کلنی آن روی مکانکی متغیر است، اغلب به باکتریم حساس هستند.
شکل (2): کلنی آلکالیژنز فکالیس روی محیط بلاد آگار
موراکسلا:
موراکسلا کاتارالیس و سایر موراکسلاها جزء فلور طبیعی دستگاه تنفسی فوقانی هستند و گاهی باکتریمی، اندوکاردیت، کونژنکتیویت، مننژیت برونشیت، پنومونی، سینوزیت و عفونت گوش میانی بوجود میآورند.
کوکوباسیلهای گرم منفی، اکسیداز و کاتالاز مثبت، غیرمتحرک و بدون پیگمان که کربوهیدراتها را مصرف و تخمیر نمیکنند، بیشتر گونههای آن به آهستگی بر روی مکانکی رشد میکنند، ولی M.lacunata و M. catarrhalis که از چشم جدا میشود، رشد نمیکنند، اما روی بلادآگار بدون تولید همولیز ایجاد حفره مینمایند. از سایر NFB بر اساس واکنش در محیط OF، تست اکسیداز و تحرک قابل افتراق است. نسبت به پنیسیلین حساس است که میتواند وجه افتراق آن از اسینتوباکتر باشد (جدول 3).
موراکسلا کاتارالیس که قبلاً به آن برانهاملا کاتارالیس میگفتند از نظر شکلی مشابه نایسریاها است و قدرت رشد روی تایر مارتین و بلاد آگار را دارد. در تست CTA هيچ قندي را مصرف نميكند و حتي ممكن است باعث قلياييتر شدن محيط گردد. بر اساس قدرت احیاء نیترات، عدم قدرت تخمیر و دارا بودن قدرت تولید DNase و تولید بوتیرات استراز از سایر نایسریاها افتراق داده میشود. اغلب آنها نسبت به پنیسیلین و سایر داروهای ضدمیکروبی حساسند. موراکسلا کاتارالیس اغلب بتالاکتاماز تولید میکند.
ایکنلا:
قبلاً بهعنوان باکتروئیدس کورودنس (Bacteroides corrodens) طبقهبندی میشد، باسیلهای خورندهای (Corroding bacilli) هستند که بیهوازی اختیاریاند. ایکنلا کورودنس (Eikenella corrodens) یک باسیل گرم منفی، کاپنوفیلیک سختگیر و کوچک است که قسمتی از فلور لثه و روده را در 40 تا 70% انسانها تشکیل میدهد. این باکتری در زخمهای ناشی از گاز گرفتن توسط انسان به همراه استرپتوکوکها مشاهده میشود و از سلولیتها، مننژیت، اندوکاردیت، پنومونی ناشی از آسپیراسیون و غیره جدا میگردد. عفونتهای آن معمولاً با سایر ارگانیسمها مخلوط است. ایکنلا کورودنس باسیل غیرتخمیرکننده است که کلنیهای آن ممکن است سبب خوردگی آگار شود. رشد این باکتری توسط 5 تا 10 درصد دیاکسید کربن و یا حضور همین (فاکتورX) در محیط افزایش مییابد.
وجود خون در محیط کشت جهت رشد لازم است و روی محیطهای مکانکی و EMB رشد نمیکند و وجود CO2 رشد آن را سریع میسازد. بعضی از سوشهای آن ابتدا فقط بهطور بیهوازی قابل جداسازی است. کلنیهای آن بسیار ریز بوده و برای مشاهده نیاز به ذرهبین دارد. در حدود 50% نمونههای جداشده در طول چندین روز که برای رشدشان لازم است، با تولید آنزیم آگاراز در آگار ایجاد حفرههایی مینمایند. کلنیهای آن بوی آب ژاول (هیپوکلریت سدیم) یا مایع سفیدکننده (Bleach) میدهند. رطوبت جهت رشد آن لازم است. به دلیل اینکه مقاوم به کلیندامایسین است میتوان برای ساختن یک محیط انتخابی از آن استفاده کرد. روی بلاد آگار یا شکلات آگار رشد دارد ولی روی مکانکی رشد نمیکند.
این باکتری اکسیداز، اورنیتین دکربوکسیلاز و نیترات مثبت، کاتالاز، اورهآز، اندول هیدرولیز اسکولین، ONPG و تخمیر کربوهیدراتها منفی است. هیدرولیز اسکولین و ONPG منفی است. در محیط آبگوشت حاوی گلوکز بهصورت گرانولهای مجزا رشد کرده و اغلب به دیواره لوله میچسبد (جدول 3).
ایکنلا کورودنس به پنیسیلینها، کینولونها و تتراسایکلین حساس است و به آمینوگلیکوزیدها به شکل متغیری حساس است. به کلیندامایسین و مترونیدازول مقاوم است. در سویههای بالینی بتالاکتاماز توصیف شده است، اما میتوان از ترکیب مهارکنندههای بتالاکتاماز با آنتیبیوتیکهای بتالاکتام جهت غلبه بر این مقاومت استفاده کرد.
جدول (3): تمایز باکتریهای غیرتخمیری مهم از نظر کلینیکی
| باکتری | اکسیداز | رنگآمیزی گرم | رشد روی مکانکی | حرکت |
| سودوموناس آئرژینوزا | + | باسیل | + | + |
| سایر گونههای سودوموناس | + | باسیل | + | + |
| اسینتوباکتر | _ | کوکوباسیل | + | _ |
| موراکسلا | + | کوکوباسیل | (+) | _ |
| آلکالیژنز | + | باسیل | + | + |
| ایکنلا | + | باسیل | _ | ? |
سایر باسیلهای گرم منفی تخمیری شامل اعضای آکروموباکتر، فلاووباکتریوم، فلاویموناس، کریزموناس، اسیدوراکس، بروندیموناس، کوموناس و رالستونیا هستند. این ارگانیسمها بهندرت از نمونههای بالینی جدا میشوند که میتواند نشاندهنده آلودگی و یا کلونیزاسیون باشند. این عوامل بهویژه هنگامی که از مکانهای استریل بدن، ایزولاسیون متعدد از بیماران دارای سرکوب سیستم ایمنی و یا بیماران دارای اجزای خارجی جدا گردند، میتوانند مهم باشند.
[1] Amplified Ribosomal DNA Restriction Analysis
[2] Amplified Fragment Length Polymorphism
[3]Methicillin Resistant Staphylococcus aureus
مقاومتهای آنتیبیوتیکی در آسینتوباکتر بومانی و مروری بر مطالعات انجامشده در ایران
نکات مهم کاربردی در میکروبشناسی بالینی (1)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام