تکنیکهای تعیین توالی اسید نوکلئیک
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیها… (عج))
زهرا کریمی ( مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتررضا میرنژاد ( دانشیار دانشگاه)
امروزه سه روش مختلف برای تعیین توالی[1] بازهای DNA شامل ماکسام-گیلبرت، سانجر و روش اتومات وجود دارد. در ادامه این روشها به تفضیل بیان میشوند.
روش ماکسام- گیلبرت
در روش ماکسام- گیلبرت به تعداد زیادی نسخههای یکسان از یک قطعه DNA نیاز است. این کار امروزه با استفاده از تکنیک PCR صورت میگیرد، ولی با استخراج مقدار زیادی DNA مورد نظر از خود موجود نیز میتوان قطعات یکسان با تعداد زیاد بهدست آورد. این روش پس از تهیه قطعات یکسان DNA به میزان زیاد به ترتیب مراحل زیر انجام میشود:
الف- نشاندار کردن فسفر انتهای ‘5: اصول انجام این کار بهطور خلاصه به این صورت است که ابتدا فسفات ‘5 را با یک فسفاتاز برداشته و با استفاده از ATP نشاندار و آنزیم ATP کیناز خاص، فسفات نشاندار را به انتهای ‘5 میچسبانند. پس از این کار رشته در دو انتهای ‘5 نشاندار خواهد بود.
ب- برش با یک آنزیم محدودالاثر: ازآنجایی که وجود دو انتهای نشاندار در کار اختلال ایجاد خواهد کرد، این دو انتها را باید از هم جدا کرد. برای این کار از یک آنزیم محدودالاثر که قطعه DNA را بهطور نامساوی میشکند، استفاده میشود. با استفاده از این آنزیم دو قطعه متفاوت DNA ایجاد میشود که بهوسیله الکتروفورز میتوان آنها را از هم جدا کرد. سپس عملیات بعدی تعیین توالی بر روی هر قطعه بهطور جداگانه انجام میشود و در آخر توالیهای بهدستآمده در کنار هم قرار گرفته و توالی کل قطعه DNA تعیین میگردد.
ج- جداسازی دو رشته DNA: در مرحله بعد با استفاده از حرارت دو رشته قطعه DNA از هم جدا و واسرشت میشود.
د- ایجاد شکاف با استفاده از مواد شیمیایی: در این مرحله قطعات DNA در چهار لوله مختلف تقسیم شده و به هر لوله مواد شیمیایی خاص اضافه میشود. خاصیت این مواد این است که در محل بازهای خاص در رشته DNA، شکاف ایجاد میکنند؛ برای مثال یک ماده شیمیایی رشته DNA را فقط در محل سیتوزین میشکند. ماده دیگر فقط در محل تیمین و دیگری در محل آدنین و آخری در محل گوانین رشته DNA را خواهد شکست.
مواد شیمیایی که در هر واکنش به کار میرود باعث اختصاصی شدن واکنشها برای باز خاص میشوند. برای مثال در pH=2 در مجاورت اسید فرمیک و پپریدین، زنجیره DNA در محل بازهای پورین (آدنین و گوانین) میشکند. حال اگر بهجای اسید فرمیک از دیمتیل سولفات (DMS) استفاده گردد، واکنش بهطور اختصاصی باعث شکسته شدن در محل باز گوانین میشود.
در مورد بازهای پیریمیدین از هیدرازین و پپریدین استفاده میشود که این مخلوط باعث شکسته شدن اختصاصی در محل بازهای پیریمیدین (سیتوزین و تیمین) میگردد. اگر به محیط این واکنش مقادیر مناسب نمک طعام (NaCl) افزوده شود، واکنش برای سیتوزین اختصاصی خواهد شد. به دلیل واکنشهای شیمیایی فوق روش ماکسام- گیلبرت به روش شیمیایی موسوم است.
از این مرحله به بعد توالی زیر بهطور فرضی در نظر گرفته میشود تا تفهیم مطلب بهتر باشد:
:نتیجه حاصل از هر واکنش در هر لوله بهصورت زیر خواهد بود *P-GCTAGTCGAC
لوله شماره 1، شکست در سیتوزین: در اثر شکست در محل سیتوزین قطعات نشاندار زیر حاصل میشود:
P-G, *P-GCTAGT, *P-GCTAGTCGA*
توجه به دو نکته ضروری است: اول اینکه هیدرولیز قطعات DNA باید بهصورت ناقص صورت بگیرد؛ یعنی شرایط و مدت زمان واکنشهای هیدرولیز باید به صورتی تنظیم شود که هر رشته فقط در یک مکان شکسته شود، زیرا اگر شکستن بهصورت کامل و در تمامی بازهای یکسان صورت بگیرد، در انتها فقط قطعات یکسان ایجاد میشود. برای روشن شدن مطلب به شکل زیر توجه کنید:
*P-GC، TAG، TCGAC : T شکست کامل در
*P-GC، *P-GCTAG، TAGTCGAC، TCGAC : T هیدرولیز نسبی در
نکته دوم اینکه شکست در محل قبل از باز صورت میگیرد؛ یعنی خود باز در قطعه مورد شناسایی وجود ندارد. در واقع هر نقطه نشاندهنده باز بعد از خود است.
لوله شماره 2، شکست در تیمین: در اثر شکست در تیمین از قطعه DNA فوق دو قطعه بهصورت زیر به دست میآید:
P-GC, *P-GCTAG*
لوله شماره 3، شکست در آدنین: در اثر شکست در محل آدنین دو قطعه بهصورت زیر حاصل میشود:
P-GCT, *P-GCTAGTCG*
لوله شماره 4، شکست در گوانین: در اثر شکست در گوانین سه قطعه به شرح زیر به وجود میآید:
P, *P-GCTA, *P-GCTAGTC*
نکته قابل توجه به وجود آمدن فسفر رادیواکتیو آزاد است که بهصورت یون فسفات آزاد میشود. این فسفر در مراحل بعدی قابل دیدن نخواهد بود و ناپدید میشود، به همین دلیل باز اول انتهای ‘5 رشته DNA در روش ماکسام گیلبرت قابل شناسایی نخواهد بود.
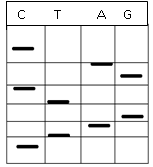
ه- الکتروفورز قطعات حاصل از شکستهای شیمیایی: در این مرحله محتویات هر لوله بهطور جداگانه به چاهکهای ژل الکتروفورز (در این مورد از ژل پلیاکریلامید استفاده میشود) انتقال داده میشود و طبق استاندارد به مدت زمان خاص و با ولتاژ خاص جریان را عبور میدهند. دقت این الکتروفورز به حدی است که بهوسیله آن میتوان قطعات با اختلاف یک نوکلئوتید را جدا کرد. سپس یک ورقه فیلم عکاسی حساس به اشعه X روی ژل قرار میدهند، در نتیجه در آن نواحی که فسفر رادیواکتیو وجود داشته باشد بر روی فیلم نوارهای تیره ایجاد میشود، به این روش اتورادیوگرافی میگویند. برای تعیین تعداد نوکلئوتیدها در یک ستون جداگانه از الکتروفورز، تعدادی شاهد با نوکلئوتید مشخص قرار میدهند و سپس با استفاده از آنها تعداد نوکلئوتید قطعات دیگر را تعیین میکنند (شکل 1).
شکل 1: تصویر شماتیک از ژل پلیاکریلامید در روش ماکسام گیلبرت
همانطور که در بالا گفته شد، در روش ماکسام گیلبرت باز اول را نمیتوان تعیین کرد. پس بهجای آن علامت (-) گذاشته میشود. اگر به شکل توجه شود، مشاهده میشود ستونی که سبکترین قطعه که شامل یک نوکلئوتید است را دارد، ستون مربوط به باز سیتوزین است؛ زیرا سبکترین باز سریعتر حرکت کرده و زودتر به پایین ژل میرسد. پس باز دوم سیتوزین است (*P-C). ستونی که قطعه سبک بعدی را دارد، ستون تیمین است؛ بنابراین باز سوم تیمین است (*P-CT). قطعه بعدی در ستون آدنین است. به همین ترتیب میتوان بازهای بعدی را مشخص نمود. همانطور که مشاهده میشود هر نوار تیره بیانگر یک باز است و برای تعیین باز اول میتوان از رشته مقابل استفاده نمود و توالی آن را تعیین کرد.
آنچه در بالا در مورد روش ماکسام- گیلبرت بیان شد، مطالب تئوری این تکنیک بود که برای تفهیم مطلب گفته شد. در عمل فقط میتوان بازهای سیتوزین را بهطور انتخابی شکست و برای سه باز دیگر یعنی آدنین، گوانین و تیمین ماده شیمیایی برای ایجاد شکاف اختصاصی وجود ندارد، در عمل شکستهای ایجادشده بهصورت زیر میباشند:
- شکست فقط در سیتوزین
- شکست در سیتوزین و تیمین (C+T)
- شکست در آدنین و گوانین با ارجحیت برای آدنین (A>G)
- شکست در آدنین گوانین با ارجحیت برای گوانین (G>A)
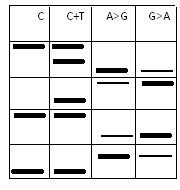
در مورد حالت 3 و 4 باید گفت که خطوط مربوطه در هر دو ستون وجود خواهد داشت، ولی در مورد باز آدنین لکه در ستون A>G پررنگتر خواهد بود. برای درک بهتر مطلب بار دیگر همان توالی ده نوکلئوتیدی در نظر گرفته شود: P-GCTAGTCGAC*
اصول کار تفاوتی با آنچه که در بالا گفته شد، ندارد و تصویر ژل بهصورت زیر خواهد بود.
همانطوری که در تصویر بالا دیده میشود، برای تعیین توالی در این روش باید ستونها را دوبهدو با هم در نظر گرفت؛ یعنی ستون (C+T) را با ستون (C) و ستون (A>G) را با ستون (G>A) خواند. در مورد دو ستون (C+T) و (C) اگر یک نوار در هر دو ستون وجود داشته باشد، مربوط به باز سیتوزین است، ولی اگر فقط در ستون (C+T) وجود داشته باشد مربوط به باز تیمین است. در مورد دو ستون (A>G) و (G>A) اگر یک نوار در ستون (A>G) پررنگ و در ستون (G>A) کمرنگ باشد مربوط به باز آدنین است و اگر در ستون (G>A) پررنگ و در ستون (A>G) کمرنگ باشد مربوط به باز گوانین خواهد بود.
روش سانجر
پس از ایجاد روش ماکسام- گیلبرت، سانجر که قبلاً به دلیل ابداع روش سریعی برای تعیین توالی پروتئینها جایزه نوبل گرفته بود، روش جدیدی را برای تعیین توالی قطعات DNA پیشنهاد کرد. این روش بر اساس استفاده از دیدزوکسیریبوز بنا شده بود. همانطور که میدانید برای اضافه شدن نوکلئوتیدها به زنجیره پلینوکلئوتیدی DNA، وجود عامل –OH بر روی کربن شماره ‘3 قند دزوکسی ریبوز ضروری است. حال اگر این عامل –OH با یک هیدروژن جایگزین شود، نوکلئوتیدهای بعدی نمیتوانند به این قند متصل شوند. در روش سانجر از قطعه کلنو (Klenow) DNA پلیمراز I استفاده میشود که خاصیت پلیمرازی دارد. این قطعه کلنو در محیط حاوی نوکلئوتیدهای فعال و یک رشته الگو قادر به ساخت رشته مکمل میباشد. حال اگر در محیط، دیدزوکسی نوکلئوتید وجود داشته باشد وارد زنجیره اصلی میشود و پس از آن نوکلئوتید دیگری نمیتواند به زنجیره در حال ساخت اضافه شود، به همین دلیل همانندسازی به پایان میرسد و در نتیجه قطعهای حاصل خواهد شد که نمایانگر باز انتهایی است. در این روش تعداد کمی از نسخههای قطعه مورد نظر لازم است، به این معنی که تعداد معدودی از قطعات در هر لوله موردنیاز میباشد.
همچنین در این روش احتیاج به آغازگر هست، زیرا همانندسازی DNA بهصورت خودبهخودی و ابتدا به ساکن شروع نمیشود و احتیاج به یک قطعه آغازگر دارد تا بازها به آن متصل شوند.
برای شروع کار، به داخل چهار لوله مقداری از قطعه DNA مورد نظر برای تعیین توالی، آغازگر و قطعه کلنو و مقادیر مساوی از چهار نوکلئوتید dTTP, dGTP, dATP, dCTP اضافه میکنند و سپس به ترتیب زیر عمل میشود:
لوله شماره 1: به این لوله کمی ddTTP (دیدزوکسی تیمیدین تریفسفات) اضافه میشود، در نتیجه قطعات مختلفی حاصل میشود که به باز تیمین (مکمل باز آدنین در زنجیره اصلی) منتهی میشوند.
لوله شماره 2: به این لوله کمی ddATP (دیدزوکسی آدنین تریفسفات) اضافه میشود، در نتیجه قطعات مختلفی حاصل میشود که به باز آدنین (مکمل باز تیمین در زنجیره اصلی) منتهی میشوند.
لوله شماره 3: به این لوله کمی ddCTP (دیدزوکسی سیتوزین تریفسفات) اضافه میگردد، در نتیجه با انتهای قطعات در حال ساخت سیتوزین (مکمل گوانین در زنجیره اصلی) خواهد بود.
لوله شماره 4: به این لوله کمی ddGTP (دیدزوکسی گوانین تریفسفات) اضافه میشود، در نتیجه قطعات در حال ساخت به باز گوانین (مکمل باز سیتوزین در زنجیره اصلی) منتهی میشوند.
باید توجه داشت که نسبت بین نوکلئوتیدهای دیدزوکسی به نوکلئوتیدهای دزوکسی در حدود یک به ده است، در نتیجه قطع شدن بهطور نسبی صورت میگیرد و امکان ایجاد تمامی قطعات وجود خواهد داشت. حال با یک مثال عملی موضوع بیشتر مورد بررسی قرار میگیرد:
اگر توالی زیر در نظر گرفته شود:
3′ GCACTGCACTCGATCG 5′
فرض میشود که آغازگر ما بهصورت *P-CGTG باشد که مکمل چهار باز اول است، این آغازگر به لولههای حاوی قطعه مورد نظر به همراه تمامی موادی که در بالا ذکر شد افزوده میشود، پس از مدت زمان لازم برای همانندسازی در هر لوله قطعاتی به شرح زیر حاصل خواهد شد:
لوله شماره 1: در این لوله ddTTP وجود دارد، در نتیجه در این لوله دو قطعه ایجاد میشود:
P-CGTGACGdT*
P-CGTGACGTGAGCdT*
لوله شماره 2: در این لوله ddATP وجود دارد، در نتیجه در این لوله سه قطعه ایجاد میشود:
P-CGTGdA*
P-CGTGACGTGdA*
P-CGTGACGTGAGCTdA*
لوله شماره 3: در این لوله ddCTP وجود دارد، در نتیجه در این لوله سه قطعه ایجاد خواهد شد:
P-CGTGAdC*
P-CGTGACGTGAGdC*
P-CGTGACGTGAGCTAGdC*
لوله شماره 4: در این لوله ddGTP وجود دارد، در نتیجه در این لوله چهار قطعه ایجاد خواهد شد:
P-CGTGACdG*
P-CGTGACGTdG*
P-CGTGACGTGAdG*
P-CGTGACGTGAGCTAdG*
حال مانند روش ماکسام- گیلبرت محتویات لولهها به ژل الکتروفورز منتقل شده و با زمان مشخص و ولتاژ مشخص الکتروفورز میگردد. سپس یک فیلم عکاسی حساس به اشعهX روی ژل قرار میدهند، چون در ابتدای آغازگر یک فسفر نشاندار وجود دارد هر کجا که آغازگر وجود داشته باشد، یک لکه تیره بر روی فیلم عکاسی ایجاد میشود. پس از ظهور فیلم عکاسی شکلی مشابه شکل زیر به دست خواهد آمد.
شکل 2: تصویر شماتیک از ژل پلیاکریلامید تعیین توالی DNA به روش سانجر
حال اگر ژل را به ترتیب از سبکترین نوار یعنی از پایین به بالا بخوانیم، توالی زیر حاصل خواهد شد:
5′ -ACGTGAGCTAGC 3′
همانطور که میدانیم این توالی مکمل توالی رشته اصلی است و برای مشخص شدن توالی رشته اصلی باید مکمل این توالی را تعیین کرد که عبارت است از:
3′ –TGCACTCGATCG 5′
همچنین باید توجه داشت که جهت تعیین توالی در روش سانجر ‘3 به ‘5 اســت. از آنجـــا که طبق قرارداد، توالی اســـــید نوکلئیــــــک از طرف ‘5 به سمــــــت ‘3 نوشـــــته میشود، پس توالی فــــوق بهصورت
5′ GCTAGCTCACGT 3′
نوشته میشود.
تهیه آغازگر جهت روش سانجر
همانطور که بیان شد مهمترین مرحله روش سانجر به دست آوردن یک آغازگر مناسب است که مکمل چند باز اولیه انتهای’3 رشته مورد نظر باشد. همچنین بهمنظور انجام بهتر و سریعتر همانندسازی لازم است قطعه مربوط به آغاز همانندسازی (OriC) به نحوی به قطعه DNA موردنظر برای تعیین توالی متصل شود. پیشرفتهترین تکنیک این کار استفاده از ژنوم اصلاحشده باکتریوفاژ M13 است. باکتریوفاژ M13 آلودهکننده باکتری اشریشیا کلی بوده و ژنوم آن درون باکتری بهصورت دو رشته و خارج از باکتری تکرشتهای است. حالت دو رشتهای این باکتریوفاژ در داخل باکتری به فرم همانندساز[2] (RF) موسوم است و بهراحتی میتوان آن را از باکتری جدا کرده و به کمک آنزیمهای محدودگر برید و قطعه مورد نظر را درون آن وارد نمود. بقیه مراحل کار همانند مراحل روش سانجر است.
بهمنظور انجام بهتر این تکنیک، دو ژنوم اصلاح شده از باکتریوفاژ M13 جدا شده است (M13mp19 و M13mp18). ژنوم این دو باکتریوفاژ مشابه هم بوده ولی قطعه مورد نظر در دو جهت متفاوت در آنها همانندسازی میشود. به همین دلیل امکان تعیین توالی DNA در دو جهت وجود دارد و به این وسیله دقت کار بالا میرود. آغازگر مورد استفاده در این روش بسیار ساده است. چون توالی ژنوم کامل M13 تعیین شده و قسمتی از ژنوم M13 در محل ورود DNA بهعنوان آغازگر استفاده میشود.
روش اتومات
روشهای تعیین توالی DNA که در بالا به آنها اشاره شد مشکل، ظریف و وقتگیر است. با این روشها قطعاتی با حداکثر چند صد نوکلئوتید را میتوان تعیین توالی کرد. این روشها بههیچوجه برای تعیین توالیهای عظیمی مانند تعیین توالی ژنوم انسان و یا حتی یک سلول مخمر مناسب نیست؛ مانند دیگر رشتههای علوم، رایانه نیز وارد عرصه زیست مولکولی شده است. در این زمینه روش اتومات یکی از دستاوردهای نوین علوم رایانه برای زیست مولکولی است.
اساس این روش همان روش سانجر است. تنها تفاوت این روش، استفاده از چهار نوع آغازگر متصل به چهار رنگ فلوروفور متفاوت است. هرکدام از این چهار نوع آغازگر را با یکی از انواع چهارگانه دی دزوکسیریبونوکلئوتید در داخل یک لوله اضافه میکنند. در نتیجه هنگامی که ژل در برابر نور U.V قرار بگیرد، هرکدام از آغازگرها با رنگی متفاوت مشخص میشود که هر رنگ نشاندهنده یک قطعه حاصل از بازهای دیدزوکسی خاص میباشد. محصول واکنش PCR را بر روی ژل الکتروفورز قرار داده و پس از اتمام الکتروفورز، ژل را در دستگاه اسپکتروفتومتر اتوماتیک متصل به رایانه قرار میدهند. دستگاه، رنگ فلورسانس را تعیین و دادهها را به رایانه میدهد و رایانه با تفسیر رنگ حاصل از اسپکتروفتومتر، توالی مورد نظر را تعیین میکند.
در سیستم مدرنتر این روش، ژل یکبار مصرف نبوده و ژل ثابت بر روی اسپکتروفتومتر نصب شده است. مخلوط قطعات از بالا تزریق میشود و به ترتیب که از مقابل اسپکتروفتومتر عبور میکنند، توالی آنها بهوسیله رایانه ثبت میشود.
[1] Sequence
[2] Replicating Form
آشنایی با کروماتوگرافی با کارایی بالا HPLC و کاربردهای آن
مقدمهای بر تکنیک واکنش زنجیرهای پلیمراز و انواع آن
تکنیکهای تکثیر همدمای اسید نوکلئیک
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام