تکنیکهای تکثیر همدمای اسید نوکلئیک
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیها… (عج))
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (دانشیار دانشگاه)
تکثیر اسید نوکلئیک در تحقیقات، پزشکی، پزشکی قانونی و کشاورزی بهطور گسترده انجام میشود. یکی از روشهای تکثیر که بهوفور مورد استفاده قرار میگیرد، PCR است که بر اساس تکثیر توالی هدف کار میکند. در فرایند PCR دو اولیگونوکلئوتید آغازگر در دو طرف توالی هدف قرار گرفته و آنزیم DNA پلیمراز طویلسازی آغازگرها را با افزودن dNTP کاتالیز میکند. با بالا و پایین رفتن دما، DNA دو رشتهای از هم جدا شده و تکثیر میشوند. با تکرار این فرایند مقدار بسیار زیادی از یک توالی را میتوان بدست آورد. اگرچه PCR بهطور گسترده مورد استفاده قرار میگیرد، اما نیاز به تغییر سریع و وسیع دمایی، محدودیتی را برای استفاده از این تکنیک بهوجود آورده است، به همین دلیل در دو دهه اخیر چندین تکنیک تکثیر همدمای اسید نوکلئیک[1] توسعه یافته است که نیازی به دستگاه ترموسایکلر ندارد. این تکنیکها بر پایه یافتههای جدید از علم زیستشناسی مولکولی طرحریزیشده است. مطالعه و شناخت فرایند ساخت DNA/RNA در داخل سلول و نقش پروتئینهای مختلف در این فرایند، موجب بهوجود آمدن این تکنیکها شد. البته این تکنیکها دارای محدودیتهایی نیز میباشند؛ بهعنوان مثال تکنیک SDA[2] نیاز به چهار آغازگر و dNTPهای تغییریافته دارد، اما برای تکثیر توالیهای بزرگ واجد کارآیی مناسبی است. تکنیک تکثیر همدمای وابسته به حلقه[3] (LAMP) به چهار یا شش آغازگر اختصاصی نیاز داشته که طراحی آنها پیچیده بوده و محصول واکنش مخلوطی از ساقه- حلقههای با ساختار گل کلم و در اندازههای مختلف خواهد بود. البته در این تکنیک تغییراتی بهوجود آمده که محصولات بهصورت تک رشتههای یکسان درخواهند آمد. در این سیستم از آنزیم محدودگر Tsp RI برای هضم محصول استفاده کرده و سپس آغازگر مکمل توالی 9 نوکلئوتیدی حاصل از برش آنزیم را اضافه میکنند. با طویلسازی آغازگر، DNA تکرشتهای جدا میشود. در تکنیک TMA[4] به سه مرحله آنزیمی متفاوت (رونویسی، ساخت cDNA و تخریبRNA ) نیاز بوده و فقط از RNA تکرشتهای میتوان بهعنوان الگو استفاده نمود. قدرت و سادگی تکثیر دایره چرخان[5] (RCA) در تشخیص DNA، آن را از دیگر روشهای تکثیر همدما متمایز میکند. در مقایسه با RCA، دیگر تکنیکهای تکثیر همدما پیچیدهتر بوده و نیاز به بهینهسازی دارند؛ اما RCA و SDA هر دو نیاز به یک مرحله گرمایی برای واسرشت سازی DNA دارند، اما تکنیکهایی مثل [6]HDA ساده بوده و فقط به دو آغازگر احتیاج دارند. یکی از مهمترین مزایای روشهای تکثیر همدما، تحمل آنها در مقابل مهارکنندههایی است که واکنش PCR را مختل میکنند. این واکنشها در حضور مواد بیولوژیک و محیط کشت انجام میشوند و نیازی به تخلیص DNA نیست؛ بهعنوان مثال در تکنیک HDA، عوامل پاتوژن را میتوان در نمونه خون تشخیص داد و در آزمایشهای تشخیصی میتوان بهراحتی از آن استفاده نمود. بهطور خلاصه این تکنیکها در مواد لازم برای آزمایش، حجم نمونه، آمادهسازی نمونه و روش تکثیر و تشخیص با PCR تفاوت دارند. در ادامه به مکانیسم و کاربرد تعدادی از تکنیکها اشاره میشود.
تکثیر با واسطه رونویسی/ تکثیر بر اساس توالی اسید نوکلئیک[7]
یکی از تکنیکهای تکثیر همدما، تکثیر با واسطه رونویسی (TMA) است که شباهت زیادی به تکثیر بر اساس توالی اسید نوکلئیک (NASBA) دارد. در این تکنیک از آنزیم RNA پلیمراز برای تولید RNA و آنزیم رونویس معکوس[8] برای ساخت cDNA استفاده میشود. در ادامه این تکنیک، تکثیر RNA توسعه یافته و از آنزیم RNase H برای حذف RNA از cDNA استفاده میگردد؛ بنابراین نیاز این تکنیک به حرارت مرتفع شده و تکثیر کاملاً همدما میشود؛ یعنی اینکه تمام واکنش در یک دما انجام میشود. همچنین به این حالت همانندسازی توالی خودتقویتشونده[9] (3SR) نیز میگویند. محصول نهایی این تکنیک را میتوان توسط الکتروفورز، کاوشگر فلورسنت (Real time NASBA) و روش رنگسنجی (NASBA-ELISA) شناسایی کرد. FDA[10] تکنیک NASBA را برای تشخیص بعضی از میکروارگانیسمها از قبیل HIV و HCV مورد تأیید قرار داده است.
فرایند NASBA بهصورت شماتیک در شکل زیر نمایش داده شده است:
مرحله 1: آغازگر Antisense برای RNA موردنظر طراحی میشود.
مرحله 2: آغازگر اختصاصی به RNA متصل میشود.
مرحله 3: آنزیم رونویس معکوس، ساخت cDNA از روی RNA را کاتالیز میکند.
مرحله 4: دو رگه RNA:DNA با آنزیم RNase H تیمار شده و RNA حذف میشود.
مرحله 5: آغازگر Sense حاوی پروموتر T7 به cDNA تکرشتهای متصل میشود.
مرحله 6: رشته مکمل cDNA توسط آنزیم رونویس معکوس ساخته میشود.
مرحله 7: cDNA دو رشتهای حاوی پروموتر T7 تولید شده و بهعنوان الگوی خود تقویت شونده عمل میکند. آنزیم RNA پلیمراز T7 شروع به رونویسی و تولید RNAsense میکند. هر کدام از RNA تولید شده میتواند دوباره وارد این فرایند شده و در نهایت میزان زیادی از RNA هدف در واکنش تولید میشود.
شکل 1: تصویر شماتیک فرایند NASBA
تکثیر RNA بهعنوان پیغام[11]:
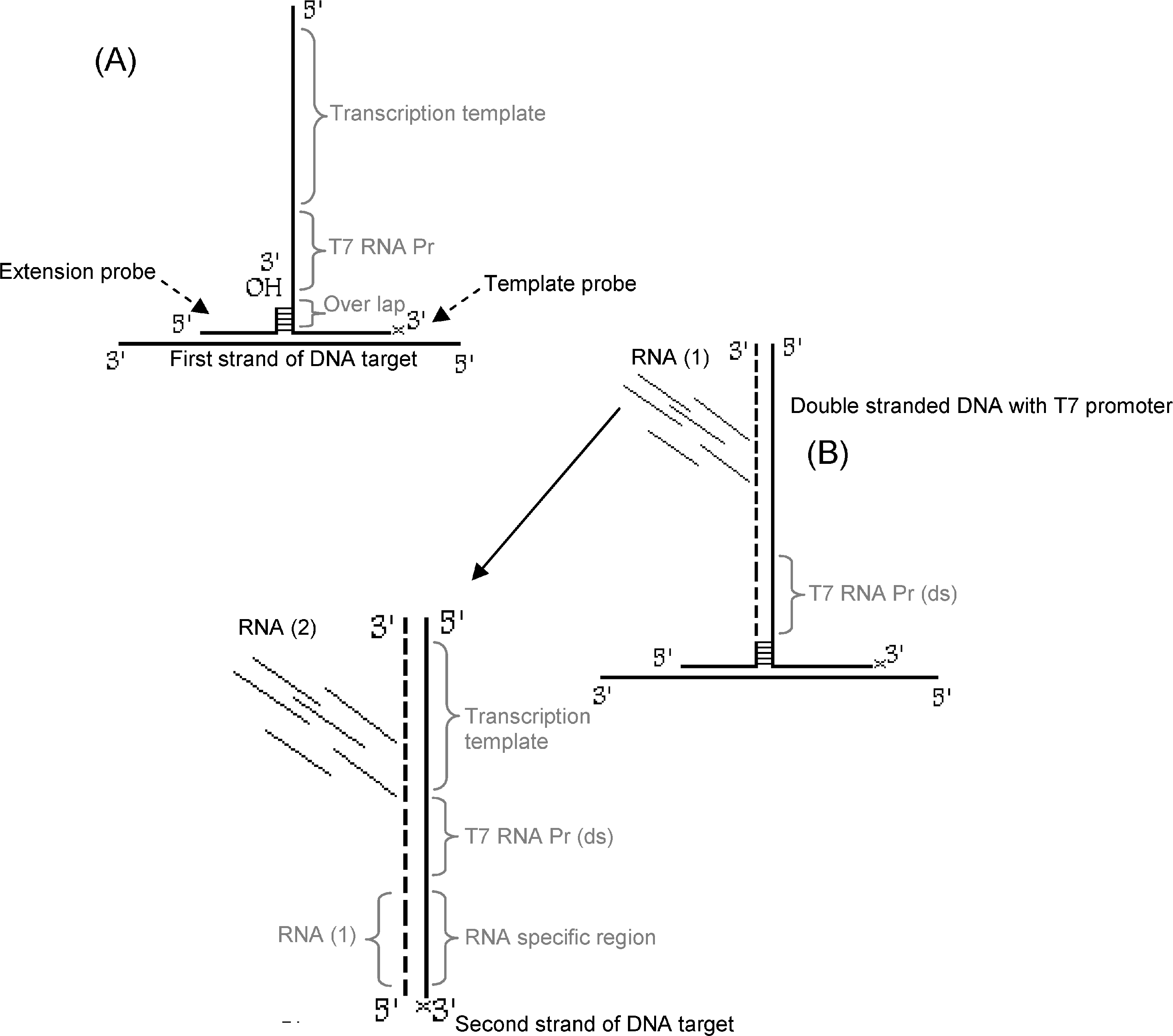
اساس این تکنیک بر پایه تشکیل یک ساختار اتصال سهراهی[12] است. در این تکنیک پیغام، تکثیر یافته و نیازی به چرخههای دمایی و تکثیر توالی هدف وجود ندارد. پیغام تولیدشده در این تکنیک کاملاً وابسته به هدف بوده و از آن برای تشخیص DNA یا RNA هدف استفاده میشود. در تکنیک SMART از دو کاوشگر اولیگونوکلئوتیدی تکرشتهای استفاده میشود که یکی بهعنوان الگو و دیگری برای طویلسازی بکار میرود. هر کدام از این کاوشگرها دارای یک منطقه کوچک مکمل توالی هدف هستند که باعث اتصال دو کاوشگر به هدف میشود. این دو کاوشگر باید نزدیک هم قرار گیرند. همچنین دو کاوشگر دارای توالی مکمل هم بوده و در یک منطقه کوچک به همدیگر متصل میشوند. در هنگام وجود توالی اختصاصی، دو کاوشگر به یکدیگر متصل شده و ساختار سهراهی (3WJ) را تشکیل میدهند. پس از این اتصال، آنزیم DNA پلیمراز Bst طویلسازی کاوشگر کوچک (کاوشگر طویلسازی) را از روی کاوشگر الگو کاتالیز میکند، در نتیجه DNA دو رشتهای حاوی پروموتر RNA پلیمراز T7 به وجود میآید. پروموتر حاصل به RNA پلیمراز T7 این اجازه را میدهد که نسخههای فراوانی از روی یک الگو تولید کند. هر کدام از RNA حاصل میتواند بهعنوان مکمل به کاوشگر الگو متصل و توسط DNA طویل شده و پروموتر دو رشتهای را بوجود آورد، سپس رونویسی از این پروموتر نیز انجام شده و بهصورت تصاعدی میزان RNA افزایش مییابد (شکل 2). RNA تولیدشده را میتوان به کمک آنزیمهای متصل به الیگونوکلئوتید (ELOSA[13]) یا تکنیک زمان واقعی[14] تشخیص و اندازهگیری نمود. این فرایند درواقع تکثیر و تقویت پیغام بوده و خود توالی هدف تکثیر نمیشود.
شکل 2: تصویر شماتیک فرایند تکنیک SMART
(A تشکیل 3WJ. کاوشگرهای الگو و طویلسازی به توالی هدف و سپس به یکدیگر متصل میشوند. کاوشگر کوچک (طویل سازی) دارای انتهای 3’OH آزاد بوده و امکان طویلسازی توسط پلیمراز را فراهم میکند. کاوشگر الگو حاوی توالی پروموتر تکرشتهای T7(pr) و توالی شناسایی و اتصال به RNA تولید شده (پیغام) است. انتهای ‘3 کاوشگر الگو با فسفریلاسیون مسدود و از طویل شدن آن جلوگیری شده است.
(B طویلسازی و رونویسی موجب تولید پیغام RNA میشود. DNA پلیمراز Bst طویلسازی کاوشگر طویلسازی را انجام داده و DNA دو رشتهای را تولید میکند. در این حالت پروموتر T7 فعال شده و اجازه رونویسی و تولید نسخههای متعدد RNA پیغام را به RNA پلیمراز T7 میدهد. در صورت لزوم RNA تولیدشده به کاوشگر الگو متصل و طویلسازی و رونویسی از آن به کمک DNA و RNA پلیمراز انجام شده و میزان پیغام RNA بهشدت افزایش مییابد.
تکثیر با برداشت رشته
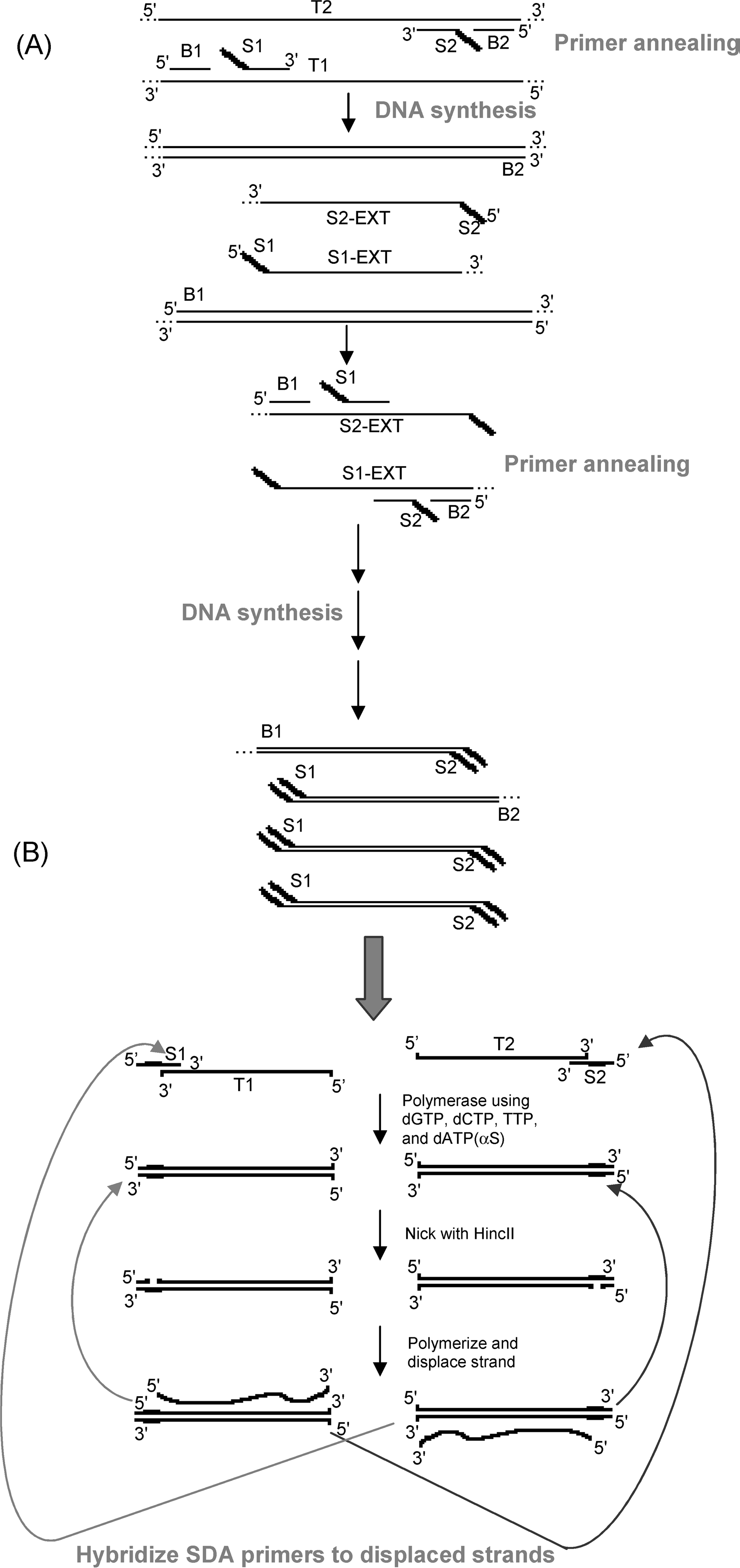
در تکنیک تکثیر با برداشت رشته (SDA) از آنزیم محدودگر بهمنظور ایجاد شکاف در DNA الگو و آنزیم DNA پلیمراز فاقد فعالیت اگزونوکلئاز برای طویلسازی انتهای ‘3 و برداشت (جداسازی) رشته در پاییندست شکاف استفاده میشود. رشته برداشتشده بهعنوان الگو برای واکنش بعدی بکار رفته و در نتیجه DNA هدف بهصورت تصاعدی تکثیر مییابد. در تکنیک SDA استاندارد، DNA الگو با حرارت واسرشت شده و چهار آغازگر
(B1, B2, S1, S2) به واکنش اضافه میشود. آغازگرها به انتهای DNA هدف متصل شده و تکثیر انجام میشــــود. آغازگر S1 و S2 در انتهای ‘5 خود دارای محل شناسایی آنزیم محـــــــــــــــــدودگر HincII (5′ GTTGAC 3’) میباشد. چهار آغازگر در حضور قطعه کلنو و dNTP تکثیر از روی رشته الگو را انجام میدهند. طویل شدن آغازگر B1 موجب برداشت قطعه حاوی آغازگر S1 (S1-ext) میشود. به همین ترتیب طویلسازی آغازگر B2 با برداشت S2-ext همراه است. آغازگر B1 و S1 به S2-ext آزاد متصل میشوند. واکنش طویلسازی و برداشت رشته، از روی S1-ext و S2-ext بهعنوان الگو انجام شده و دو رشته حاوی جایگاه آنزیم HincII در دو انتهای قطعه و دو رشته بزرگتر حاوی جایگاه آنزیم HincII در یک انتهای قطعه ایجاد میشود. واکنشهای ایجاد شکاف (توسط HincII) و طویلسازی و برداشت رشته (توسط کلنو) بر روی این چهار قطعه نیز انجام شده و این قطعهها وارد چرخه SDA میشوند. اکنون در SDA دو آغازگر S1 و S2 وجود دارد که انتهای ‘3 آغازگر S1 به ‘3 رشته جدا شدهT1 و انتهای ‘3 آغازگر S2 به ‘3 رشته جدا شده T2 متصل میشود. در ‘5 هر دو آغازگر توالی شناسایی HincII بهصورت آزاد[15] وجود دارد. قطعه کلنو طویلسازی آغازگرها را انجام داده و توالی شناسایی HincII را بر روی دو رشتهای S1:T1 و S2:T2 کامل میسازد. این آنزیم یک شکاف بر روی رشته تازه ساختهشده ایجاد میکند. کلنو از محل شکاف S1:T1 شروع به همانندسازی کرده و رشته پاییندست شکاف که همان T2 است، آزاد میشود. همین اتفاق در مورد S2:T2 نیز افتاده و رشته معادل T1 آزاد میشود. برش و همانندسازی/ جداسازی بهطور دائمی انجام میشود، زیرا طویل سازی شکاف موجب ایجاد محل برش آنزیمی میشود. این تکثیر بهصورت تصاعدی است چراکه رشته جداشده از S2:T2 بهعنوان الگوی S1 و رشته جداشده از S1:T1 بهعنوان الگوی S2 عمل میکند (شکل 3). تکنیک SDA بیشتر در بالین برای تشخیص عفونتهایی از قبیل کلامیدیا و نایسریا گونوره مورد استفاده قرار میگیرد. همچنین این تکنیک برای تکثیر همدمای RNA به کار میرود. در این حالت از آنزیم رونویس معکوس نیز استفاده شده و تحت عنوان RT-SDA شناخته میشود.
شکل 3: تصویر شماتیک تکنیک SDA
A) مراحل اولیه SDA برای انتقال توالی هدف به چرخه تکثیر. DNA ابتدا با آنزیم محدودگر بریده شده تا قطعه قابل تکثیر با انتهای مشخص ایجاد شود. وجود محل برش آنزیمی یکی از محدودیتهای این روش است. باید قطعهای انتخاب شود که جایگاه شناسایی آنزیم محدودگر را داشته باشد. جایگاه شناسایی آنزیم HincII بهصورت خط ضخیم نمایش داده شده است. B) چرخه SDA
تکثیر دایره چرخان
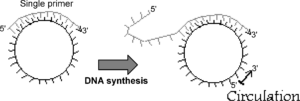
تکنیک RCA که میتواند نسخههای فراوانی را از روی یک توالی تکثیر کند، از روی همانندسازی DNA به شیوه دایره چرخان تقلید شده است. در این تکنیک آنزیم DNA پلیمراز 29Φ در شرایط دمایی ثابت، به کمک یک آغازگر از روی یک کاوشگر حلقوی بارها و بارها همانندسازی انجام میدهد. محصول این واکنش بهصورت DNA تکرشتهای است و علاوه بر تشخیص، برای دستکاریهای ژنتیکی کاربرد دارد (شکل 4). این تکنیک بهطور گسترده در موارد تشخیصی، بهمنظور شناسایی مستقیم یا غیرمستقیم DNA، RNA، پروتئین و دیگر نشانگرهای زیستی[16] به کار میرود.
شکل 4: تصویر شماتیک از RCA
فرایند RCA بر روی DNA حلقوی تکرشتهای آزاد انجام میگیرد. واکنش با اتصال DNA خطی تکرشتهای به DNA حلقوی اختصاصی شروع میشود. محصولات واکنش یک طیف وسیعی از لحاظ طول را داشته و در ژل الکتروفورز بهصورت پیوسته و آبشاری دیده میشود
یک تکنیک مشابه نیز برای شناسایی RNA معرفی شده است. در این تکنیک از RNA پلیمراز استفاده شده و احتیاجی به آغازگر نیست. از این تکنیک برای ساخت RNA فعال و عملگر[17] از قبیل نشانگر وزن مولکولی [18]RNA و ریبوزیم[19] استفاده میشود. اخیراً RCA از لحاظ تکنیکی توسعه یافته و بهصورت تکثیر دایره چرخان با چندین آغازگر درآمده است (شکل 5). در این سیستم به کمک خصوصیات منحصربهفرد آنزیم 29Φ، از آغازگرهای تصادفی استفاده شده و محصول تکثیر تا ده هزار برابر افزایش مییابد. از این تکنیک برای تکثیر DNA حلقوی استفاده میشود. RCA مبتنی بر RNA اخیراً مورد توجه شرکتهای بیوتکنولوژی و مراکز تحقیقاتی قرار گرفته و برای آزمایشهای ژنتیکی، ایمونواسی[20]، بررسی پلیمورفیسمهای تک نوکلئوتیدی، آمادهسازی نمونه تکرشتهای برای تعیین توالی، سیستمهای بررسی تکسلولی و مطالعه بیان ژن به کار میرود.
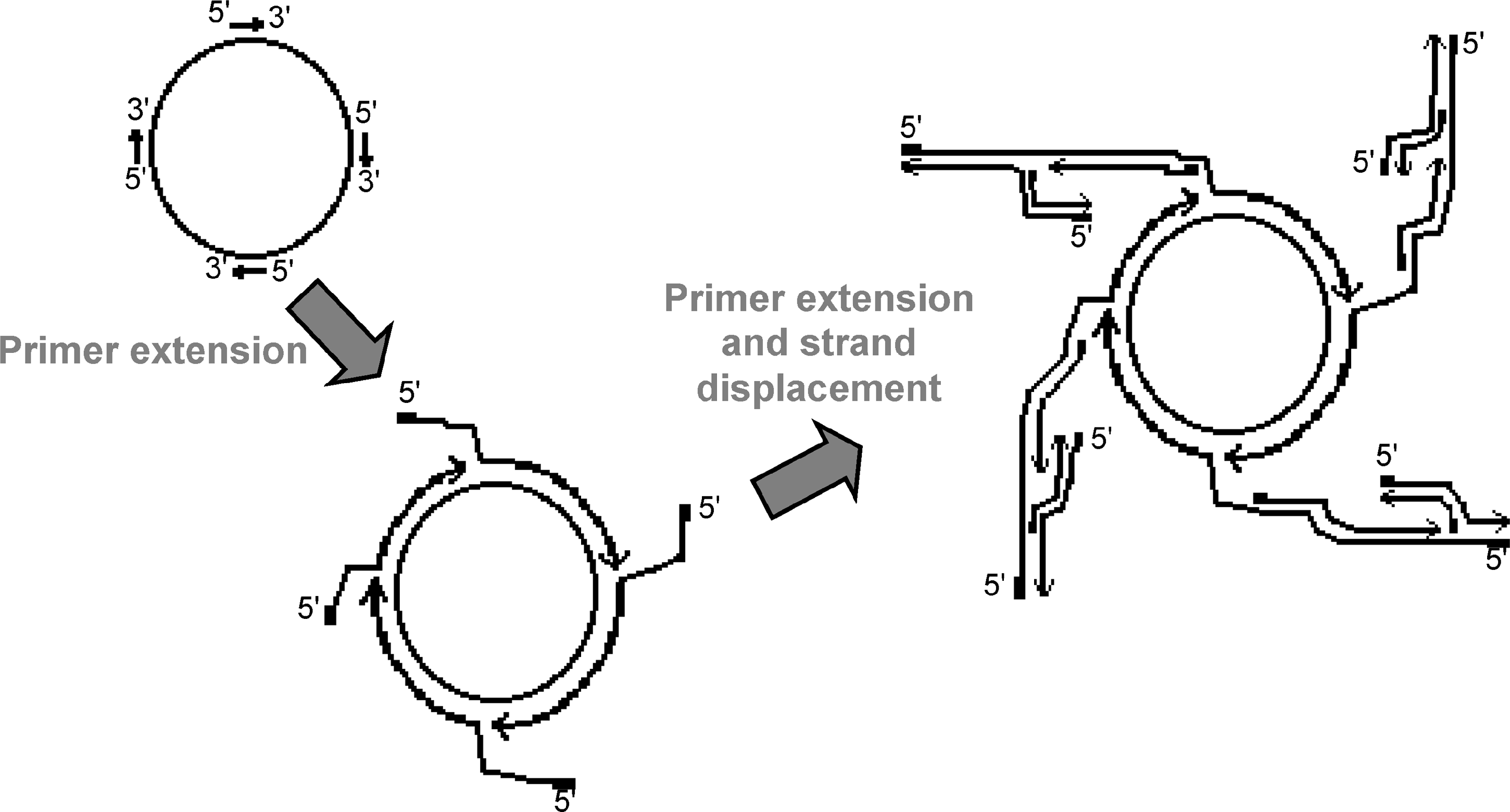
شکل 5: تصویر شماتیک RCA با چندین آغازگر
آغازگرهای مکمل به توالی هدف حلقوی متصل میشوند. انتهای ‘3 رشتههای DNA با فلش نمایش داده شده است تا جهت پلیمریزاسیون را مشخص کند. ابتدای رشتهها که با خطوط ضخیم ترسیم شده است، محل آغازگر را نشان میدهد. افزودن پلیمراز و dNTP موجب طویلسازی آغازگرها و جدا شدن رشتههای تازه ساخته شدۀ جلوی هر آغازگر میشود. آغازگرهای دیگر نیز به رشتههای جداشده متصل و واکنش بهسرعت ادامه مییابد.
تکثیر همدمای وابسته به حلقه
در این تکنیک DNA در شرایط دمایی ثابت (همدما) تکثیر میشود. در روش LAMP به 6-4 آغازگر اختصاصی و DNA پلیمراز دارای خاصیت برداشت رشته پاییندست نیاز هست. محصولات واکنش، ساختار ساقه- حلقه[21] به خود میگیرند (شکل 6). در این ساختار چندین تکرار از روی توالی هدف ساخته و بهصورت معکوس قرار میگیرد و ساختار گلکلمی حاوی چندین حلقه را بوجود میآورد. تکنیک LAMP یک تکنیک بسیار کارآمد بوده و توانایی ساخت میزان بالایی از توالی DNA را در کمترین زمان دارا است. در این واکنش مقدار زیادی پیروفسفات تولید شده و یون منیزیم را بهصورت رسوب سفید رنگ از محیط خارج میسازد. وجود این رسوب سفید رنگ خود بهعنوان نشانگر تکثیر اسید نوکلئیک به کار میرود؛ به عبارت دیگر هرگاه در لوله واکنش این رسوب مشاهده شد، واکنش تکثیر DNA انجام شده است. علاوه بر این از روشهای دیگر نیز برای بررسی واکنش و شناسایی محصول واکنش LAMP استفاده میشود. از جمله این روشها میتوان به الکتروفورز ژل، کدورت سنجی در زمان واقعی[22] و استفاده از کاوشگر فلورسنت اشاره نمود. این تکنیک برای تشخیص و شناسایی بسیاری از میکروارگانیسمها توسط محققین مورد استفاده قرار گرفته و میتواند بهعنوان یک روش مناسب و سریع در آزمایشهای مولکولی و تستهای تشخیصی مورد استفاده قرار گیرد.
شکل 6: تصویر شماتیک از مکانیسم LAMP
مراحل واکنش LAMP: در مرحله اول مواد اولیه و DNA دمبلی شکل ساخته میشود. مرحله دوم که چرخهای است، DNA بهطور مداوم و پیوسته ساخته میشود. از روی محصولات این مرحله نیز واکنش طویلسازی و ساخت DNA انجام شده و محصولات با طول متفاوت را به وجود میآورند.
مزایای استفاده از تکنیک LAMP
- این تکنیک قادر است DNA را با کارایی بالا تحت شرایط تکدمایی (Isothermal) تکثیر نماید و میتوان تشخیص را با تعداد اندک DNA شروع نمود. LAMP حتی قادر است DNA را در کمتر از 6 کپی در مخلوط واکنش شناسایی نماید.
- محصولات واکنش مخلوطی از DNAهای ساختار سنجاقسری با اندازههای متفاوت و ساختار گلکلم مانند با حلقههای متعدد میباشد که در زیر میکروسکوپ نوری بهراحتی قابل مشاهدهاند و امکان تشخیص انتخابی را فراهم مینمایند.
- بسیار اختصاصی عمل میکند، زیرا با 4 پرایمر قادر است 6 ناحیه ژنی از توالی هدف را در آغاز واکنش و 4 ناحیه را در طی واکنش LAMP مورد شناسایی قرار دهد.
- روش LAMP ساده و انجام آن آسان است و تنها نیاز به پرایمر، DNA پلیمراز و مخلوط واکنش دارد و نیازی به ترمو سایکلر ندارد و واکنش در حمام آب گرم یا بلوکهای حرارتی قابل انجام است.
- به وسیله ترکیب با نسخهبرداری معکوس، LAMP قادر است توالیهای RNA را با کارایی بالا تکثیر نماید.
- نیاز به واسرشت نمودن DNA اولیه و حتی نیاز به استخـــراج DNA اولیه از بــرخی نمونههای بیـــولـــوژیک (مانند محیــــط کشـــت مــایع) نمیباشد.
تکثیر همدمای رشتههای جداشده[23]
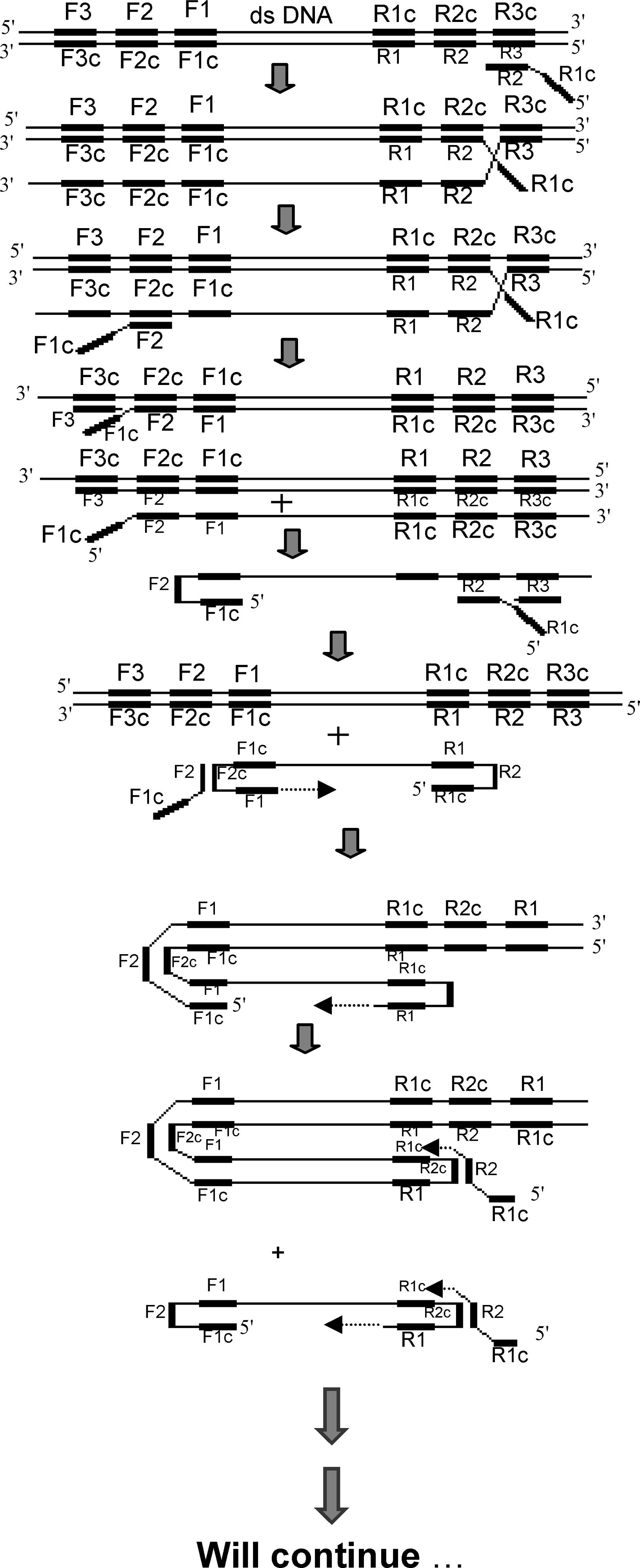
این تکنیک بر پایه ساخت رشتههای اسید نوکلئیک به کمک چندین آغازگر و جداسازی این رشتهها استوار شده است. در یک نوع از این روش که به نام تکثیر چندین رشته جداشده[24] معروف است، دو مجموعه آغازگر برای سمت راست و چپ توالی الگو طراحی شده است. آغازگرهای سمت راست مکمل یک رشته از توالی الگو بوده و آغازگرهای سمت چپ مکمل رشته دیگر میباشند. با اتصال آغازگرها به رشته الگو، همانندسازی و تکثیر قطعه موردنظر آغاز میشود. همانندسازی از انتهای ‘3 تمام آغازگرها شروع میشود. نکته کلیدی این تکنیک در جداسازی و برداشت رشتههای ساخته شده از آغازگرهای داخلی است؛ یعنی هنگامی که پلیمراز از انتهای ‘3 یک آغازگر خارجیتر (در سمت ‘5 آغازگر داخلی) شروع به همانندسازی میکند به آغازگر داخلی در حال طویل شدن میرسد و آن را از رشته الگو جدا میکند. در نوع دیگری از این روش که تحت عنوان تکثیر رشتههای جداشده از کل ژنوم[25] معروف است، یک مجموعه از آغازگرهای تصادفی به واکنش افزوده میشود. این آغازگرها بهطور تصادفی به نقاط مختلفی از ژنوم متصل شده و تکثیر و همانندسازی این ژنوم را آغاز میکنند. تکثیر و همانندسازی به کمک یک پلیمراز قوی از تمام آغازگرها آغاز شده و تا زمانی که بهطور خودکار متوقف شود، ادامه دارد. در این تکنیک نسخههای متعددی از کل ژنوم در زمان کوتاهی ساخته میشود. این رشتههای ساختهشده، دارای مناطق همپوشان میباشند (شکل 7).
شکل 7: تصویر شماتیک از مکانیسم IMDA
در بالای این شکل DNA دو رشتهای حاوی منطقه موردنظر (منطقه هاشورخورده) مشاهده میشود. آغازگرهای چپ و راست به توالی مکمل خود متصل شدهاند. در قسمت میانی تصویر، آغازگرهای متصلشده شروع به طویل شدن میکنند. پلیمراز هنگام فعالیت، رشته جلوی خود (که در حال طویل شدن است) را از الگو جدا میکند. قسمت انتهایی تصویر رشتههای تکثیر شده را نمایش میدهد. آغازگرها به رشتههای جدید نیز متصل شده و چرخه تکثیر ادامه مییابد.
تکثیر وابسته به هلیکاز[26]
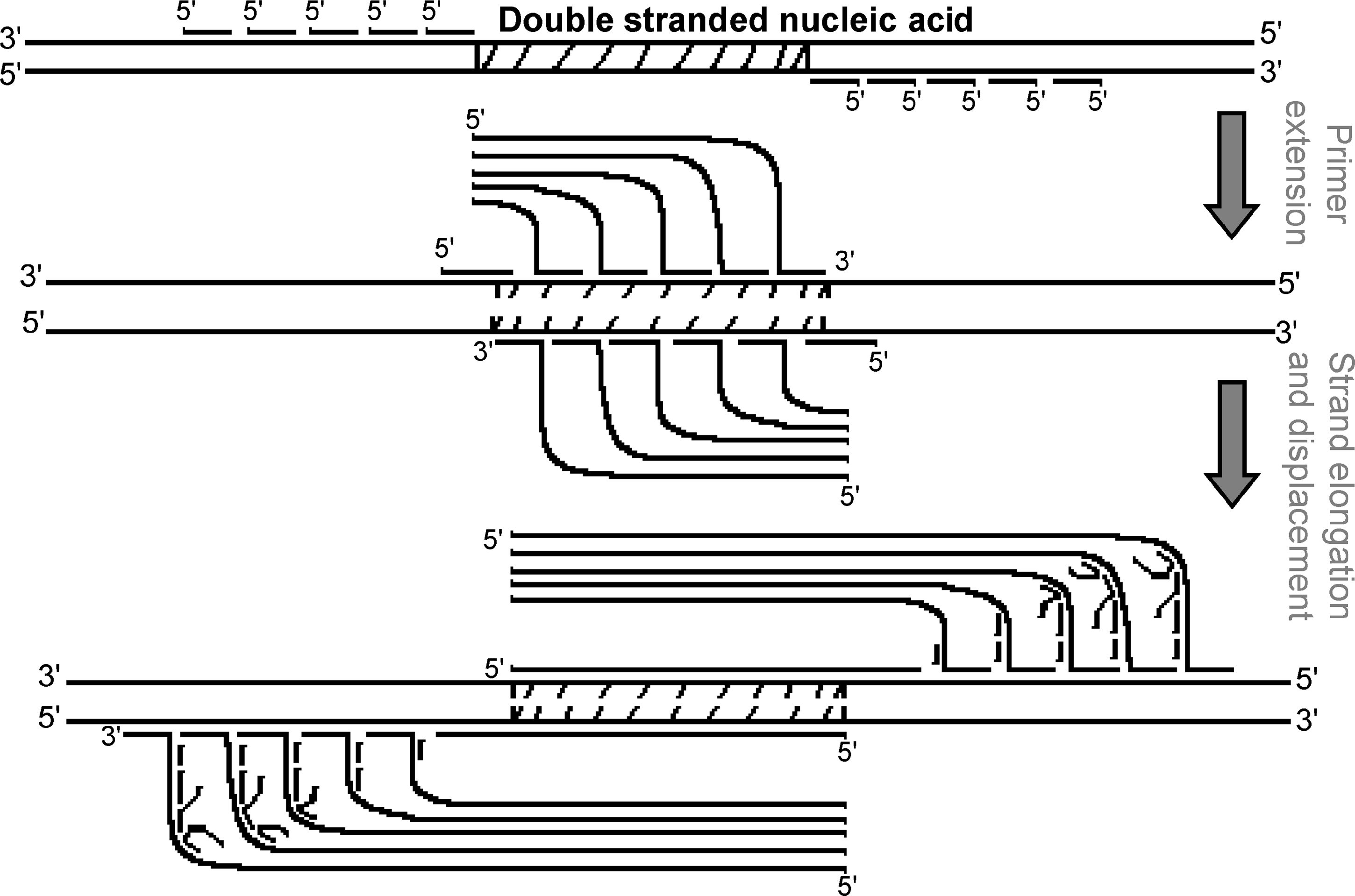
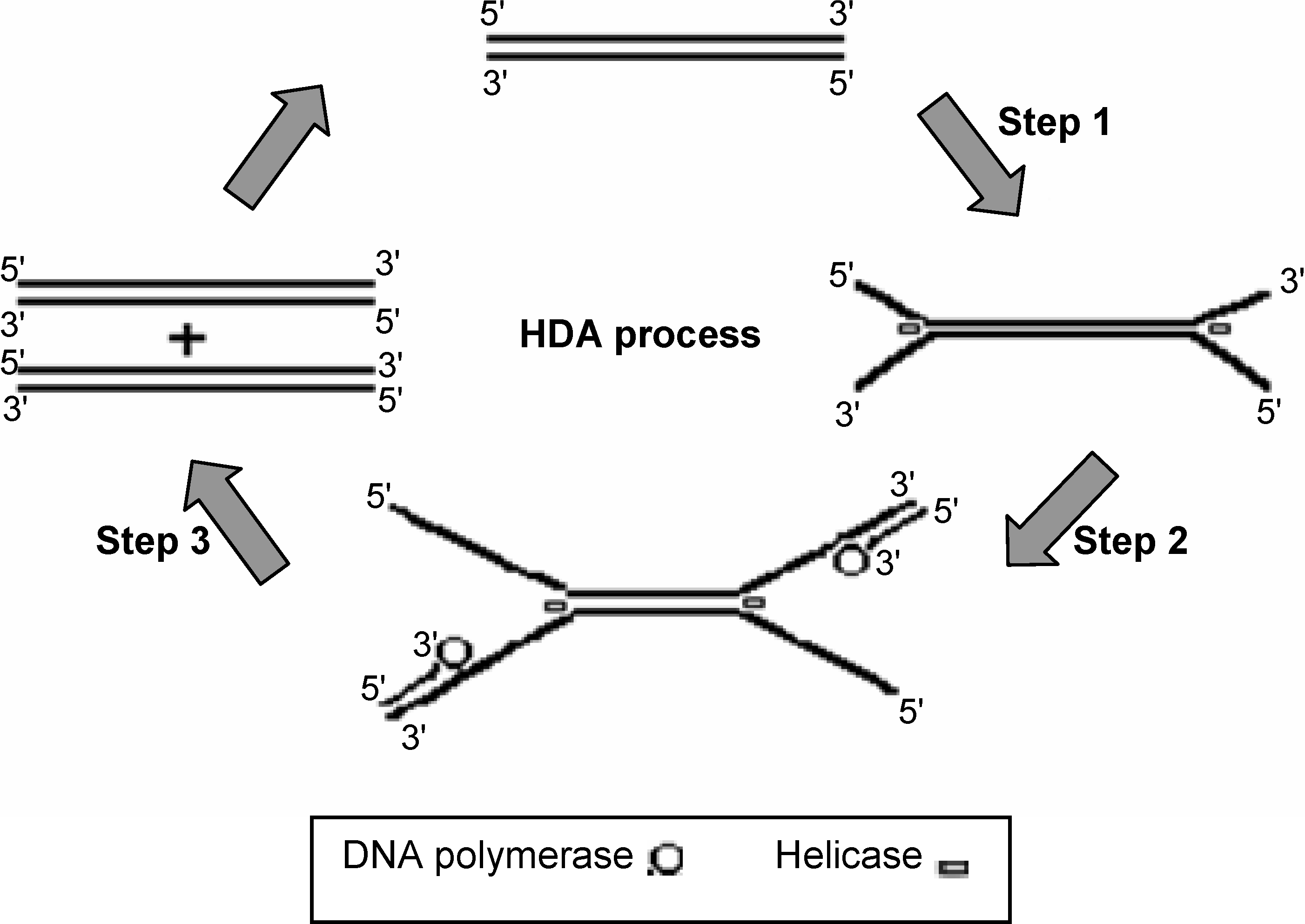
این تکنیک بر اساس فعالیت واسرشتسازی آنزیم DNA هلیکاز بنا شده است. در این فرایند بهجای حرارت از آنزیم هلیکاز برای واسرشت کردن دو رشته DNA استفاده میشود. تکرشتههای حاصل بهمنظور تکثیر قطعه موردنظر بکار میروند. آغازگر اختصاصی به توالی مکمل خود متصل و توسط DNA پلیمراز طویل شده و قطعه موردنظر حاصل میشود. این فرایند بهطور دائمی و در یک دمای ثابت تکرار شده و قطعه موردنظر بهطور تصاعدی تکثیر میشود. این تکنیک امکان چندین چرخه همانندسازی را در یک دمای ثابت بوجود آورده و نیاز به دستگاه ترموسایکلر را حذف میکند. محصول این واکنش را میتوان با الکتروفورز ژل، ELISA و یا بهصورت زمان واقعی بررسی کرد (شکل 8).
شکل 8: تصویر شماتیک فرایند HDA
مرحله اول: هلیکاز DNA دو رشتهای را از هم باز میکند. مرحله دوم: آغازگر به DNA تکرشتهای متصل میشود. مرحله سوم: DNA پلیمراز طویلسازی آغازگر را کاتالیز میکند. یک DNA دو رشتهای به دو قطعه DNA دو رشتهای تبدیل میشود. dsDNA توسط آنزیم هلیکاز واسرشت شده و واکنش زنجیرهای فوق تکرار میشود.
تکثیر همدما با یک آغازگر[27]
در این سیستم تکثیری از یک آغازگر کایمریک برای تکثیر DNA و RNA(ribo-SPIA) استفاده میشود. آغازگر کایمریک بهکار رفته در این سیستم در انتهای ‘3خود حاوی دزوکسی ریبونوکلئوتید بوده و در سمت ‘5 ریبونوکلئوتید دارد. آنزیمهای بهکار رفته در این سیستم شامل RNase H و DNA پلیمراز با قدرت زیاد جداسازی رشته پاییندست است. واکنش با اتصال آغازگر کایمریک به توالی مکمل خود بر روی DNA هدف آغاز شده و DNA پلیمراز طویلسازی آغازگر را پیش میبرد. بعد از طویلسازی آغازگر، قسمت 5’آغازگر که حاوی RNA است (دو رگه DNA:RNA) توسط آنزیم RNase H بریده میشود. در این حالت قسمتی از DNA هدف که برای اتصال آغازگر بود، آزاد شده و آغازگر جدید میتواند به آن متصل شود. DNA پلیمراز به آغازگر جدید متصل شده و با طویلسازی آغازگر، محصول چرخه قبل را از DNA هدف جدا میکند.
تکثیر وابسته به هلیکاز حلقوی[28]
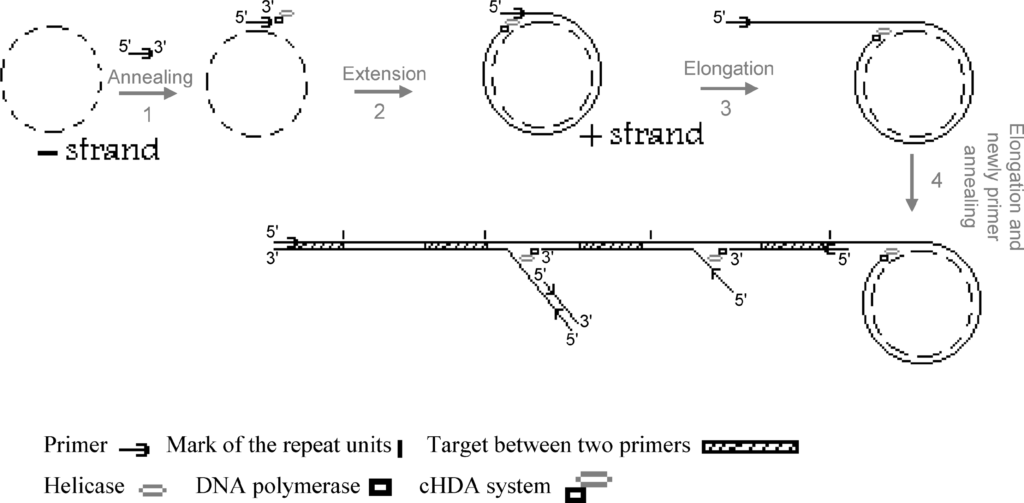
تکنیک cHDA بر اساس تکثیر DNA حلقوی شکل گرفته است. این سیستم ترکیبی از فعالیت هلیکاز و DNA پلیمراز بوده و DNA هدف حلقوی شده را تکثیر میکند. این تکنیک بر پایه دستگاه همانندسازی T7 بنا نهاده شده و شامل هلیکاز T7، DNA پلیمراز T7 فاقد فعالیت اگزونوکلئازی و پروتئین متصلشونده به DNA تکرشتهای[29] T7 Gp2.5 هست. بعد از واسرشت شدن DNA توسط هلیکاز، آغازگرها به تکرشتههای DNA متصل شده و DNA پلیمراز T7 به روش دایره چرخان تکثیر میشود. در این حالت نهتنها توالی هدف تکثیر شده، بلکه ساختارهای کانکاتمر[30] بوجود میآید. کل فرایند در یک دمای ثابت در حدود °25 سلسیوس صورت میگیرد. در این تکنیک میتوان پلاسمید خالص و یا لیز سلولی را بهعنوان الگو بهکار برد و توالیهای بیش از 10 کیلو باز را تکثیر نمود (شکل 9).
شکل 9: تصویر شماتیک فرایند cHDA:
در این تصویر یک آغازگر Antisense به الگو متصل شده و طویلسازی موجب تشکیل ساختار کانکاتمر میشود. آغازگرهای sense فراوانی به کانکاتمر متصل شده و توسط DNA پلیمراز طویل میشوند. هرگاه رشته بعدی به قطعه پاییندست برسد، هلیکاز/ پلیمراز آن را برداشته و تکثیر پیش میرود. چرخههای تکثیر/ جداسازی موجب تولید توالیهای بیشماری اختصاصی که توسط دو آغازگر مشخص شده و چندین توالی از DNA کامل میشود.
[1]Nucleic acid Isothermal amplification
[2]Strand displacement amplification (SDA)
[3]Loop-mediated isothermal amplification (LAMP)
[4] Transcription mediated amplification (TMA)
[5]Rolling Circle Amplification (RCA)
[6]Helicase-dependent amplification
[7]Nucleic acid sequence based amplification (NASBA)
[8]Reverse transcriptase
[9]Self-sustained sequence replication
[10] Food and Drug Administration
[11]Signal Mediated Amplification of RNA Technology (SMART)
[12]Three-way junction(3WJ)
[13] Enzyme Linked Oligo Sorbent Assay
[14]Real time
[15]– 5’overhang
[16]Biomarkers
[17]Functional RNA
[18]RNA ladder
[19]Ribozyme
[20]Immunoassay
[21]Stem-loop
[22]Real-time turbidimetry
[23]Isothermal multiple displacement amplification (IMDA)
[24]Multiple strand displacement amplification
[25]Whole genomestrand displacement amplification
[26]Helicase-dependent amplification (HDA)
[27] Singe Primer Isothermal Amplification (SPIA)
[28] Circular Helicase-Dependent Amplification (cHDA)
[29]Single-Stranded DNA Binding (SSB) protein
[30]Concatemer
مقدمهای بر تکنیک واکنش زنجیرهای پلیمراز و انواع آن
انواع تکنیک « واکنش زنجیرهای پلیمراز (PCR)» و انواع آنزیمهای DNA پلیمراز مقاوم به حرارت
پلیمورفیسم طولی قطعات تکثیرشده (AFLP)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام