مروری بر آنمی پرنیشیوز
سلمان پور. ز. کارشناسی ارشد خون شناسی. دانشگاه علوم پزشکی شهید بهشتی تهران
مقدمه
آنمی پرنیشیوز یک اختلال خودایمنی است که از نقص یا توقف جذب ویتامین B12 به علت فقدان فاکتور داخلی ایجاد میشود. شیوع آن 0/1 درصد در کل جمعیت عمومی و 1/9 درصد در میان افراد بالای 60 سال بوده و 20 تا 50 درصد علل فقر ویتامین B12 را تشکیل میدهد. این بیماری معمولاً با درگیری دستگاه گوارش، دستگاه عصبی، قلب و سیستم خونسازی همراه است.
تاریخچه
برای اولین بار در سال 1824 جیمز کامب، فردی با علائم این آنمی را توصیف کرد، بعدها توماس آدیسون شرح بالینی و پاتولوژیکی آن را ارائه داد. پیرو کارهای او یک پزشک فرانسوی به نام تروسو این بیماری را آنمی آدیسون نامید و میشائیل آنتون بیرمر آلمانی اولین شرح مختص آنمی پرنیشیوز را انجام داد که به احترام او آنمی پرنیشیوز را بیماری بیرمر نیز مینامند. اصطلاح پرنیشیوز به معنی وخیم یا کشنده میباشد زیرا در زمان نامگذاری آن هنوز درمانی برایش شناخته نشده بود. در سال 1934 مورفی و ویپل به افتخار کشف نقش جگر خام در درمان این کمخونی جایزهی نوبل دریافت کردند.
عوامل مستعد کنندهی ابتلا به آنمی پرنیشیوز
ابتلا به زخم معده، عفونت با هلیکوباکتر پیلوری، جنسيت مؤنث، رنگ روشن چشم (بخصوص رنگ آبی)، کمکاری پاراتیروئید، تیروئیدیت هاشیموتو، داشتن گروه خونی A، داشتن HLAهای A3، A2، B7 و B12، بیماریهای تیروتوسیکوز، میکسادم، بیماری آدیسون غدد فوق کلیوی، کارسینوم معده و روده، کولیت اولســــــــــراتیو، التهاب بعد از زایمان غدهی هیپوفیز، ناباروری، هایپوگاماگلوبولینمی، پیسی (ویتیلیگو یا دیسپیگمنتاسیون پوستی)، نقص انتخابی IgA مخاطی، اندوکرینوپاتی، بیماریهای اتوایمیون (مانند لوپوس، IDDM، میاستنی گراویس و آرتریت روماتوئید)، مونیلیازیس (عفونت کاندیدیا)، فقر آهن شدید (آتروفی معده)، داشتن نژاد اروپای شمالی (اهالی کشورهای اسکاندیناوی) و بعضی وقتها جنبههای خانوادگی یا فامیلی از جمله مواردی هستند که احتمال ابتلا به آنمی پرنیشیوز را افزایش میدهند. 1/8% مبتلایان به PBC (سیروز اولیهی صفراوی) به آنمی پرنیشیوز نیز مبتلا میشوند که ممکن است از واکنش متقاطع آنتیبادیهای ضد آنتیژنهای کبدی با آنتیژنهای بافت معده ناشی شده باشد.
جذب و متابولیسم ویتامین B12
ویتامین B12 یا کوبالامین خوراکی در معده، توسط آنزیم پپسین و اسید معده از پروتئینهای غذا رها شده و در ابتدا به ترانسکوبالامین1 و هاپتوکورین (R binder) متصل میشود. در ابتدای رودهی باریک آنزیمهای پانکراس، کوبالامین را از ترانسکوبالامین1 جدا کرده و به آن اجازه میدهند تا به فاکتور داخلی وصل شود. مجموعه کوبالامین- فاکتور داخلی در ایلئوم روده به cubam وصل میشود. cubam گیرندهی چند لیگاندی مرکب از ilincub و amnionless است. حال مجموعه cubam – فاکتور داخلی- کوبالامین از طریق اندوسیتوز به داخل سلولهای ایلئال روده برده میشود. در داخل این سلولها کوبالامین از اندوزوم رها شده و به ترانسکوبالامین2 وصل میشود. کوبالامین متصل به ترانس کوبالامین2 به گردش خون پرتال وارد شده و چرخهی رودهای-کبدی را در مسیر کبد- مجرای صفراوی و روده انجام میدهد. روزانه 1/4 میکروگرم کوبالامین از کبد وارد مجرای صفراوی میشود که 1 میکروگرم آن از ایلئوم باز جذب میشود.
هولوترانس کوبالامین فرم فعال کوبالامین است که توسط گیرندههایش (گیرنده 2TC) در سلولهای سراسر بدن بویژه کلیه، کبد و مغز استخوان برداشته میشود. در لیزوزوم این سلولها هولوترانس کوبالامین تجزیه شده و کوبالامین مورد نیاز واکنشهای متابولیک رها میشود. کوبالامین کوفاکتوز دو واکنش مهم بیوشیمیایی است؛ در واکنش نخست متیل کوبالامین بعنوان کوفاکتوز انزیم متیونین سنتتاز عمل میکند. این آنزیم از هوموسیستئین، متیونین میسازد. متیلاسیون مجدد کوبالامین نیازمند گرفتن گروه متیل از متیل تتراهیدروفولات و تبدیل آن به تتراهیدروفولات است. واکنش دوم که کوبالامین در آن دخیل است در میتوکندریها رخ میدهد.
در درون این اندامکها، کوبالامین به آدنوزیل کوبالامین تبدیل میشود. آدنوزیل کوبالامین کوفاکتور آنزیم متیل مالونیل COA موتاز است. این آنزیم، متیل مالونیل COA (حاصل از متابولیسم پروپیونات) را به سوکسینیل COA تبدیل میکند. متیونین حاصل از واکنش نخست، به آدنوزیل متیونین تبدیل میشود. آدنوزیل متیونین یکی از منابع حیاتی گروه متیل در یکسری از واکنشهای متیلاسیون پروتئینها، فسفولیپیدها، نوروترنسمیترها، RNA و DNA میباشد.
پاتوژنز و تظاهرات بالینی بیماری
تولید آنتیبادی بر علیه مخاط معده باعث آتروفی و نازک شدن دیوارهی معده میشود، به گونهای که در اندوسکوپی بخش فوقانی دستگاه گوارش مخاط آتروفیک به رنگ مایل به زرد به همراه رگهای شفاف قابل مشاهده است. یبوست، اسهال و درد دورهای شکم از علائم گوارشی بیماری است که از متاپلازی روده، ارتشاح پلاسماسلها و لنفوسیتها در لامینا پروپریای معده، عدم ترشح اسید (آکلریدی) و شیرهی معده (آچیلیا) ناشی میشود. علائم آنمی مگالوبلاستیک نیز به سایر علائم افزوده میشود. در واقع آنمی در اثر نرسیدن ویتامین 12B به پیشسازهای خونساز رخ میدهد که علت آن نیز نبود فاکتور داخلی (IF) میباشد.
علائم عصبی در 30% موارد آنمی پرنیشیوز مشاهده شده است که به علت نارسایی ویتامین 12B مورد نیاز برای متیلاسیون پروتئینهای بازی میلین میباشد. از جملهی این اختلالات عصبی میتوان به ناهنجاری بساوشی (parasthesia) اعصاب محیطی اشاره کرد. علائم روانی متعددی نیز در ارتباط با این آنمی شرح داده شده است که حتی ممکن است قبل از بروز و یا در غیاب کمخونی، ماکروسیتوز و یا علائم عصبی نیز تظاهر نمایند، از جملهی این علائم میتوان به مانیا (mania)، روان پریشی (psychosis)، زوال عقل (dementia) و جنون (catatonia) اشاره کرد. در صورت عدم تشخیص و درمان بهنگام، ممکن است آسیبهای روانی و عصبی از مرحلهی قابل برگشت بگذرد.
آنمی پرنیشیوز به دو شکل ارثی و اکتسابی بروز میکند:
آنمی پرنیشیوز ارثی یا مادرزادی
این نوع از آنمی پرنیشیوز بصورت مادرزادی و در اثر جهش در ژن IF رخ میدهد. بدلیل عدم دخالت آنتیبادیهای اتوایمیون، هیچگونه عوارض پاتولوژیک نظیر آتروفی و متاپلازی گوارشی، آکلریدی و آچیلیا وجود نداشته و تنها عوارض آنمی مگالوبلاستیک ناشی از عدم دریافت کوبالامین بروز میکند.
آنمی پرنیشیوز اکتسابی
این نوع از آنمی پرنیشیوز منشأ اتوایمیون دارد. وجود سه نوع آنتیبادی در سرم مبتلایان به این بیماری اثبات شده است که دو نوع اول آن که به ترتیب به عنوان آنتیبادی بلوکان و آنتیبادی متصل شونده شناخته میشوند بر ضد فاکتور داخلی ساخته میشوند و نوع سوم بر ضد پمپ پروتون واقع در مخاط سلولهای معده ترشح میشود.
- اتو آنتیبادی ضد IF یا آنتیبادی نوع 1 که به آنتیبادی بلوکان نیز معروف است زیرا از اتصال IF به کوبالامین جلوگیری کرده و با القای فقر ویتامین12B در شروع آنمی نقش ایفا میکند. این آنتیبادی در 50 درصد مبتلایان به آنمی پرنیشیوز حضور داشته و اختصاصیترین آنتیبادی این آنمی میباشد.
- اتو آنتیبادی ضد کمپلکس IF-Cobalamin یا آنتیبادی نوع 2 که به آنتیبــــــــــــــــادی متصل شونده (binding Ab، precipitating) نیز معروف است. این آنتیبادی مانع از اتصال کمپلکس فوق به cubam (گیرندهی کوبالامین بر سطح سلولهای ایلئوم روده) میگردد. شیوع آن در حدود 35 درصد است.
- اتو آنتیبادی ضد پمپ پروتون (پمپ H+\K+) سلولهای پریتال معده که باعث تخریب سلولهای این ارگان شده و در نتیجه منجر به آتروفی معده، آکلریدی، آچیلیا و نهایتاً عدم سنتز فاکتور داخلی میگردد. شیوع این آنتیبادی در مراحل اولیهی بیماری 90- 80٪ و در مراحل پیشرفته آن در حدود 55% میباشد. علت این کاهش شیوع با پیشرفت بیماری؛ تخریب پیشروندهی مخاط و کاهش آنتیژن هدف میباشد. آنتیبادی ضد پمپ پروتون اغلب با 2 آنتیبادی دیگر همزمان وجود دارد. این آنتیبادی از شیوع بالا ولی از اختصاصیت اندکی برخوردار است، زیرا 20 – 16 درصد افراد بالای 60 سال (بویژه خانمها) نیز این آنتیبادی را در خونشان دارند. پمپ ATPase\+K\+H هترودایمری است که از دو زیرواحد آلفا و بتا تشکیل شده است. لنفوسیتهای +4CD بر علیه زیرواحد بتای آن واکنش داده و با تحریک پلاسماسلها منجر به تولید آنتیبادی بر ضد آنها میشوند که نتیجهی آن هم آسیب به مخاط معده و گاستریت میباشد. مطالعات نشان میدهد در این گاستریت پلاسماسلهای +4IgG در محل التهاب تجمع مییابند که میتوان از آنها برای تشخیص بهره برد.
آنمی پرنیشیوز اکتسابی یا اتوایمیون به دو دستهی آنمی پرنیشیوز جوانان و آنمی پرنیشیوز بزرگسالان تقسیم میشود. نوع جوانان در سنین پایینتری رخ داده و اغلب با عفونت هلیکوباکتر پیلوری و زخم معده همراه نمیباشد ولی در مقابل با نقص انتخابی IgA، اندوکرینوپاتی، کمکاری تیروئید و بیماریهای اتوایمیون دیگر (مانند لوپوس، میاستنی گراویس، هاشیموتو و دیابت اتوایمیون) همراه است که با توجه به این موارد، پرنیشیوز جوانان به سه دسته تقسیم میشود:
1) آنمی پرنیشیوز جوانان اتوایمیون (گاستریت آتروفیک)
2) آنمی پرنیشیوز جوانان توأم با پلی اندوکرینوپاتی اتوایمیون
3) آنمی پرنیشیوز جوانان توأم با نقص IgA
ارتباط میان عفونت هلیکوباکتر پیلوری و آنمی پرنیشیوز ارتباط خیلی اثبات شدهای نیست اما در مراحل پیشرفتهی این آنمی به احتمال قوی عفونت هلیکوباکتر پیلوری منفی میباشد زیرا این باکتری در شرایط قلیایی شدهی مخاط معده که از تخریب پمپ پروتون حاصل شده است قادر به زیستن نخواهد بود.
بجز تست پنتاگاسترین مابقی تستها یا غیر اختصاصی هستند یا متغیر. افزایش گاسترین سرم، آنتیبادیهای ضد IF، نرمال بودن مخاط روده، نرمال یا بالا بودن میزان فولات سرم و افت فولات درون گویچههای سرخ از یافتههای متغیر در آنمی پرنیشیوز هستند. گاستریت آتروفیک فوندوس معده و آکلروهیدری نیز مختص این آنمی نبوده و در اکثر موارد ارتباطی به آنمی پرنیشیوز ندارد. در نیمی از موارد این آنمی که آنتیبادی ضد فاکتور داخلی به همراه هایپرگاسترینمی وجود دارد تشخیص قطعی امکان پذیر است که در نبود افزایش گاسترین سرم میتوان در پنل تشخیصی، گاستریت آتروفیک مخاط معده را جایگزین آن کرد.
تشخیص آزمایشگاهی
در تشخیص آزمایشگاهی آنمی پرنیشیوز سه آزمایش اصلی وجود دارد:
- بررسی وجود یا عدم وجود IF در شیرهی معده با دادن پنتاگاسترین به بیمار
این تست یکی از بهترین تستهای تشخیص آنمی پرنیشیوز است. برای انجام آن میبایست توباژ معده انجام شده و میزان ترشح فاکتور داخلی بررسی شود. اگر بعد از دادن پنتاگاسترین به بیمار میزان تولید IF کمتر از 200 واحد به ازای هر یک ساعت باشد آنمی پرنیشیوز مثبت تلقی میشود و اگر بیشتر از 200 واحد به ازای هر یک ساعت باشد بیمار به آنمی پرنیشیوز مبتلا نيست.
- تست شیلینگ
در هر سه نوع آنمی پرنیشیوز مادرزادی، جوانان و بزرگسالان تست شیلینگ 1 (فقدان IF) غیرنرمال و تست شیلینگ 2 (با افزودن IF) نرمال است، ولی در موارد ناشی از سوء جذب (مانند سندرم ایمرسلوند گراسبک، سلیاک، اسپرو و …) نتیجهی هر دو تست غیر طبیعی خواهد بود و در مقابل مقادیر IF، HCL، پپسین و شیرهی معده طبیعی میباشد. در آنمی ناشی از سوء جذب، اتو آنتیبادیها نیز حضور ندارند. این تست به مرور از پنل تشخیصی کنار گذاشته میشود.
- شناسایی آنتیبادیهای مرتبط با آنمی پرنیشیوز که به تفصیل شرح داده شد.
در بحث کاربرد تشخیصی آنتیبادیهای فوق اشاره به این نکات ضروری است که در آنتیبادیهای ضد IF اختصاصیت و حساسیت به ترتیب 100% و50% و در آنتیبادی ضد پمپ پروتون 90% و 80% میباشد که در مجموع سنجش این دو نوع آنتیبادی از اختصاصیت 100% و حساسیت 73% برخوردار است. در نوعی از آنمی پرنیشیوز که با سیروز اولیه صفراوی اتوایمیون همراه است آنتیبادی ضد میتوکندری نیز ممکن است در سرم فرد وجود داشته باشد.
در کنار آزمایشات فوق سنجش گاسترین سرم نیز میتواند کمک کننده باشد. سطح سرمی گاسترین در این بیماری افزایش مییابد.
علائم هماتولوژیک
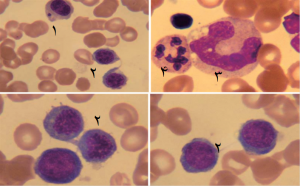
در آزمایش CBC آنمی نرموکرومیک ماکروسیتیک با لکوپنی و ترومبوسیتوپنی ملایم گزارش میشود. گستره خون محیطی حاوی گویچههای سرخ بزرگ دمدار و یا ماکرواوالوسیت به همراه اجسام هاولژولی و بازوفیلیک استیپلینگ است. گرانولوسیتها نیز درشت بوده و دچار هایپرسگمنتاسیون (شیفت به راست) شدهاند. در گستره آسپیرهی مغز استخوان پرسلولی یا هایپرپلازی اریتروئیدی مشهود است. مگالواریتروبلاستها به همراه سایر سلولهای ردهی اریتروئیدی در مغز استخوان حضور دارند. متامیلوسیتهای غولآسا از دیگر یافتههای مغز استخوان است. عدم هماهنگی بلوغ هسته و سیتوپلاسم با منظرهی هستههای نابالغ و سیتوپلاسم اسیدوفیلیک شدهی بالغ به اثبات میرسد. در موارد آنمی پرنیشیوز غیر مگالوبلاستی، مغز استخوان فاقد تظاهر مگالوبلاستی بوده ممکن است نرموبلاستها در اثر تقسیم ناقص توسط پلهای سیتوپلاسمی بصورت متصل به یکدیگر دیده شوند (تصویر زیر):
- 1. جسم هاولژولی در درون نرموبلاست 2. پلهای سیتوپلاسمی بین نرموبلاستها 3. متامیلوسیت غولآسا در آسپیرهی مغز استخوان نوتروفیل هایپرسگمانته
آنمی پرنیشیوز و بدخیمی
یکی از مهمترین علل ضرورت توجه به این آنمی ارتباط آن با برخی از بدخیمیها است. در 7- 4 درصد مبتلایان به آنمی پرنیشیوز تومور کارسینوئید معده رخ میدهد. علاوه بر کارسينوئید شایع، آدنوکارسینومای نادر و لنفوم غیر هوچکین نیز ممکن است بروز نماید. از این رو در این بیماران توصیه میشود دستگاه گوارش فوقانی از طریق اندوسکوپی هر شش ماه یکبار بررسی شود تا هم از اثربخشی درمان و هم از عدم ایجاد بدخیمی مطمئن شویم.
درمان
تزریق عضلانی ویتامین 12B درمان انتخابی میباشد. درمان با دوز 1000 میکروگرم بصورت هفتگی به مدت 2 ماه (یا در موارد شدید بصورت روزانه 1000 میکروگرم تا 1 هفته) شروع شده و سپس با 1000 میکروگرم بصورت ماهانه برای یک دورهی طولانی مدت ادامه مییابد. انواع مختلف دارویی آن میتواند به فرمهای سیانوکوبالامین، متیل کوبالامین و هیدروکسی کوبالامین باشد. گفته میشود از این میان، هیدروکسی کوبالامین برداشت بافتی و نیمه عمر بهتری نسبت به سایر فرمها در بدن دارد. با این وجود فرم سیانوکوبالامین مصرف بیشتری در این مورد دارد.
- Sinclair L. Recognizing, treating and understanding pernicious anaemia .
- Combe JS. History of a case of anaemia. Trans Med-Chirurg Soc (Edinburgh) 1824;1:193–8
- Cattan D. pernicious anemia: What are the actual diagnosis criteria?. Paris. January 28, 2011. Volume 17. Issue 4
- Jauhar J. , Allison B., Srireddy P. and J. McKenna p. anaemia or macrocytosis Pernicious anaemia presenting as catatonia without signs of anaemia or macrocytosis. BJP 2010, 197:244-245
- Stephan M. Tanner , Zhongyuan Li, James D. Hereditary juvenile cobalamin deficiency causedby mutations in the intrinsic factor gene.
- Vannella L., Lahner E. , Osborn J. & Annibale B . Systematic review: gastric cancer incidence in pernicious anaemiaş.
- Remacha A. F. & Del Río & Sardà M. P. & Canals C. & Simó M. & Baiget M . Role of (Glu→Arg, Q5R) mutation of the intrinsic factor in pernicious anemia and other causes of low vitamin B12.
- Andres , Khalid S. Optimal management of pernicious anemia. DOVE press journal of blood medicine. 7 sptember 2012.
- Chen-Shuan Chung MD , Primary biliary cirrhosis associated with pernicious anemia, Canadian Family Physician, Vol 56, september 2010.
- Yasushi Ito , Susumu Mitsutani. Non-Megaloblastic Pernicious Anemia with Normoblast Possessing Cytoplasmic Bridge. Intern Med 49: 2645-2646, 2010
- Vazife cellular and molecular hematology. Shahid beheshti university of medical sciences
https://www.healthline.com/health/pernicious-anemia
https://medlabnews.ir/rdw-%d9%88-%d8%a2%d9%86%d9%85%db%8c-%d9%81%d9%82%d8%b1-%d8%a2%d9%87%d9%86/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام