آنتی بیوتیک ها
دكتر رضا ميرنژاد (استاد تمام دانشگاه)
بخش اول
تاریخچه پیشرفت آنتی بیوتیک ها
پیشرفت آنتی بیوتیک ها در اوایل قرن بیستم صورت گرفت. اگرچه بعضی درمانهای اولیه با مواد شیمیائی ضد میکروبی مؤثر بودند، ولی کاربرد آنها عموماً محدود به تعداد کمی از بیماریها بود. در آن زمان احتمالاً، بهترین داروی شناخته شده Cinchona bark بود که با داشتن ماده کینین، توسط افراد مبتلا به مالاریا جویده میشد.
اولین ماده ضد میکروبی که در فرهنگ غرب کاربرد وسیع داشت، جیوه بود که برای درمان سیفلیس مورد استفاده قرار گرفت. سه مانع بر سر راه درمان با جیوه وجود داشت: اول آنکه این ماده همیشه مؤثر نبود، دوم، جیوه یک داروی با طیف اثر بسیار کم بود، چرا که تنها علیه باکتری عامل سیفلیس مؤثر بود. سوم، جیوه هم برای باکتری و هم برای انسان سمی بود. جیوه سیستم اعصاب را تخریب میکند، پدیدهای که سبب مرگ لوئیس کاررولس نویسنده داستان Alice و سازندگان کلاه شد.
کلاهها از پشمهای آغشته به جیوه ساخته میشدند و به دلیل برخورد زیاد با جیوه سیستم عصبی سازندگان كلاه تخریب ميشد و آنها بسیار عصبی بودند. این موضوع باعث ارائه مفهوم واقعی در پیشرفت آنتیبیــــــــــــوتیک بنام سمیت انتخابی (Selective Toxicity) شد. سمیت انتخابی مفهومی در بحث آنتیبیوتیکها است که اشاره به میزان سمیت دارو برای بیمار دارد؛ یعنی ضمن اثر بر روی باکتری و کشتن آن، روی بیمار اثری نداشته باشد.
تحقیقات در زمینه آنتیبیوتیکها در اواخر قرن بیستم که عامل بیماریها، یعنی باکتریها، ویروسها و انگلها کشف شدند، با جدیت زیادی شروع شد. شیمیدان پاول ارلیش در اواخر قرن نوزده، به دنبال “گلولههای نقرهای” بود که پاتوژنها را بکشد. صدها رنگ را برای این منظور امتحان کرد. در 1905، ششصد و شصتمین مادهای که امتحان کرد ترپونما را کشت. این رنگ آرسینکی را سالوارسان نامید و با آن سیفلیس را درمان کرد.
اولین پیشرفت غیرمنتظره در توسعه آنتیبیوتیکهای جدید در دهه 1930 با کشف اولین سولفونامید (Sulfonamide) بنام پرونتوسيل (Prontosil) توسط جرارد دوماک، رخ داد. مکانیسم اثر سولفونامیدها توسط وود با بیان درک اثر مهاری سولفونامیدها بر رشد باکتریها با افزودن پاراآمینوبنزوئــــــــیک اسید Para aminobenzoic acid (PABA) به محیط کشت کشف شد، چرا که با افزودن پاراآمینو بنزوئیک اسید به محیط کشت، رشد باکتری زیاد میشد. این کشف منجر به این بحث شد که سولفونامید (یک آنتیبیوتیک سولفونامید قدیمی) ساختمانی شبیه پاراآمینو بنزوئیک اسید دارد.
در 1929 الکساندر فلمینگ، پنیسیلین G را کشف کرد. منتها چون او زیاد مشتاق تحقیقات نبود، تحقیقات خود را ادامه نداد تا اینکه دو دانشمند انگلیسی بنامهای فلوری و چاین در سال 1939 پنیسیلین را جدا و خالص کردند. در این زمان انگلستان درگیر جنگ جهانی دوم بود و دانشمندان انگلیسی و آمریکایی برای استفاده کلینیکی این ماده با هم متحد شده بودند. تلاش آنها در سال 1942 نتیجه داد و پنیسیلین بهعنوان ماده مؤثر در درمان زخمیها در جنگ مورد استفاده قرار گرفت.
امروزه، تلاشهای داروسازان بیشتر معطوف به تولید آنتی بیوتیک های با اثر بیشتر، طیف اثر وسیعتر و سمیت کمتر متمرکز شده است. این رقابت نه تنها در مورد کشف داروهای جدید است، بلکه در جهت ازدیاد آنتیبیوتیکهای مناسب نيز هست. با به وجود آمدن یک پیشرفت شاخص در ایجاد آنتیبیوتیک جدید، باید تلاشها جهت تغییر یک قسمت از ساختمان آنتی بیوتیکی صورت بگیرد تا داروهای جدیدتر به دست بیایند. تغییرات ساختمانی در آنتیبیوتیک، بعضی از خصوصیات داروها نظیر میزان متابولیسم، نفوذ به بافتها، محل غیرفعال شده یا طیف استفاده را تغییر داده و تغییر در فعالیت، مبنایی برای فروش آنتیبیوتیکهای جدید است. تغییرات معمولاً مفید است اما همیشه زیاد نیست.
مفاهیم عمومی در فعالیت آنتی بیوتیک ها
آنتیبیوتیکهای باکتریوسیدال در مقابل آنتیبیوتیکهای باکتریواستاتیک
اگرچه آنتی بیوتیک های باکتریوسیدال سبب کشتن باکتری میشوند، ولی آنتیبیوتیکهای باکتریواستاتیک فقط سبب توقف رشد آنها میشوند. البته در یک فضای ایدهال، تمام آنتی بیوتیک ها کشندهاند، چرا که آنتی بیوتیک های استاتیک، با توقف رشد باکتری به سیستم ایمنی زمان و فرصت کافی جهت حذف عوامل عفونی را میدهند.
بیان زیر به تفاوت کلیدی بین آنتیبیوتیکهای استاتیک و سیدال اشاره میکند. اگر یک آنتیبیوتیک استاتیک از یک محیط کشت خارج شود، باکتری به رشد ادامه میدهد، اما اثر کشندگی آنتیبیوتیکهای سیدال برگشتناپذیر است. البته همیشه بهراحتی مشخص نمیشود که آنتیبیوتیک مصرفی باکتریوسیدال است یا باکتریواستاتیک. آنتیبیوتیکهایی که سبب لیز باکتری میشوند، کشندهاند، اما همه آنتیبیوتیکهای کشنده، لیزکننده باکتری نیستند.
همانطور که در شکل 1 مشاهده میشود، میتوان تأثیر آنتیبیوتیکها را در رشد گونههای خاص باکتری با استفاده از اسپکتروفتومتری و مقایسه جذب نوری (تراکم یا کدورت) سوسپانسیون باکتری که در مجاورت آنتیبیوتیک قرار گرفته، تعیین کرد. این امر را میتوان با استفاده از شمارش روی پلیت برای تخمین تعداد باکتریهای زنده، در سوسپانسیون نیز انجام داد. در شکل 1 مقایسه بین اثر چهار آنتیبیوتیک روی باکتری اشریشیا کلی نشان داده شده است، پنیسیلین به دلیل کشندگی، سبب کاهش جذب نوری و تعداد باکتریهای زنده میشود.
کلرامفینکل و استرپتومایسین هر دو سریعاً بعد از اضافه شدن به محیط کشت سبب توقف رشد شده و جذب نوری این امر را نشان میدهد. برخلاف کلرامفنیکل، استرپتومایسین سیدال بوده چرا که تعداد باکتریهای زنده را کاهش میدهد. سولفونامید خاصیت استاتیک دارد و به بعضی باکتریها، بعد از افزوده شدن به محیط کشت اجازه تکثیر میدهد.
شکل 1: مقایسه اثرات سولفونامید، کلرامفنیکل، استرپتومایسین و پنیسیلین روی رشد باکتری گرم منفی اشریشیا کلی
شکل A مقایسه جذب (شدت و کدورت) سوسپانسیونهای باکتری را در برخورد با آنتیبیوتیکهای مختلف با روش اسپکترفتومتری نشان میدهد.
شکل B مقایسه بین مقدار Log باکتریهای زنده در سوسپانسیونهای مختلف را با روش شمارش در پلیت نشان میدهد.
زمان اضافه کردن آنتیبیوتیک به سوسپانسیون با فلش نشان داده شده است.
(برگرفته از کتاب میکروب شناسی پزشکی واکر)
ملاحظات کلینیکی:
درمان دو گروه از بیماران، آنتیبیوتیکهای استاتیک موفقیتآمیز نیست:
1) بیماران دچار نقص ایمنی مبتلا به عفونت حاد
2) بیماران مبتلا به عفونت در نقاط خاص ایمونولوژیکی
دو مثال در این گونه موارد عبارت است از:
اولاً، بیماران با نوترپنی شدید مبتلا به پنومونی باکتریایی نمیتوانند بدون استفاده از درمانهای وسیع با آنتیبیوتیکهای سیدال زنده بمانند، زیرا بهبودی از پنومونی باکتریایی به فعالیت نوتروفیلها بستگی دارد.
ثانیاً، بیماران مبتلا به مننژیت باکتریایی درخطرند، زیرا در اين افراد فضای سابآراکنوئید بهخوبی توسط سیستم ایمنی محافظت نمیشود. اگر این بیماران یک داروی آنتیبیوتیکی استاتیک دریافت نمایند، پاسخ فاگوسیتیکی کمی برای حذف باکتری موجود است. وقتی آنتیبیوتیک استاتیک از محیط خارج شود، باکتری سریعاً تکثیر یافته و منجر به مرگ بیمار میشود.
تعیین کشنده یا استاتیک بودن آنتیبیوتیک به میزان دارویی که به محل هدف برسد، نیز بستگی دارد. بعضی از آنتیبیوتیکها در غلظت بالا کشندهاند و در غلظت پایین استاتیک هستند، در نتیجه، در مورد باکتریهای موجود در یک جوش (جایی که دسترسی آنتیبیوتیک به آن ضعیف است) ممکن است آنتیبیوتیکی استاتیک باشد، هرچند که این آنتیبیوتیک در خون علیه این باکتریها کشنده باشد.
اگر آنتیبیوتیک در غلظت سیدال برای فرد بیمار سمی باشد، نمیتوان بهعنوان یک عامل کشنده از آن استفاده کرد. بههرحال، از آنجایی که اهداف عمل هر آنتیبیوتیک بر روی باکتریها فرق میکند، بعضی آنتیبیوتیکها برای برخی از گونههای باکتریایی کشندهاند و برای عدهای استاتیک هستند. درمان سالم و مؤثر و ایمن بیماران نیاز به این دانش دارد که یک آنتیبیوتیک در غلظتهای مختلف، در محلهای عفونی گوناگون و بر ضد انواع عوامل عفونی چگونه عمل میکند.
آنتیبیوتیکهای محدودالاثر و وسیعالطیف
طیف اثر ضدمیکروبی یک آنتیبیوتیک، دامنه باکتریهایی است که میتواند آنها را بکشد یا به آنها صدمه وارد کند. برای مثال پنیسیلین G که ابتدا برای درمان باکتریهای گرم مثبت استفاده میشد، فقط علیه تعداد کمی از باکتریهای گرم منفی پاتوژن، مؤثر است، بنابراین، به نظر میرسد که طیف فعالیت آن محدود باشد. برخلاف آن تتراسایکلین که علیه تعداد زیادی از باکتریهای گرم مثبت و گرم منفی مؤثر است دارای طیف اثر وسیع است.
این امر ممکن است این تصور را القاء کند که بهتر است تتراسایکلین به دلیل طیف وسیع ضد میکروبی استفاده شود، اما در مصرف آنتیبیوتیکها چند عامل دیگر را نیز باید در نظر گرفت؛ برای مثال بعضی آنتیبیوتیکها از بقیه سمیترند و وقتی لازم است که داروئی با سمیت بالا استفاده شود، بهتر است زیر نظر پزشک در غلظت پایینتر استفاده گردد. بعضی از آنتیبیوتیکها به میزان کافی به محل عفونت نمیرسند و نیمهعمر بعضی از آنتیبیوتیکها هم پائین است. همچنین در بعضی از عفونتها نیز لازم است از آنتیبیوتیکهای باکتریوسیدال استفاده شود.
درمان با چند دارو
پزشکان معمولاً مصرف همزمان چند آنتیبیوتیک را در شرایط زیر استفاده میکنند:
(1) درمان بیماران ایمونوساپرس یا دیابتیک جهت جلوگیری از هجوم بیماریهاي مختلف
(2) درمان بیماریهای مزمنی که در آنها باکتری ممکن است در طی درمان نسبت به آنتیبیوتیکها مقاوم شده باشد.
(3) درمان تجربی بیماریهای با عوامل ناشناخته
(4) درمان عفونتهایی که عامل آن بیش از یک گونه باکتری است.
(5) درمان عفونتهای حاصل از باکتریهایی که ریشهکنی آنها مشکل است. بطورکلی در بیشتر موارد، هدف اصلی درمان با چند دارو، گسترش طیف ضدمیکروبی یا افزایش تأثیر آنتیبیوتیک علیه یک گونه باکتری است.
اثرات سینرژیکی:
عموماً در یک درمان معمول، از آنتیبیوتیکهایی که بهصورت سینرژیک (Synergistic effects) عمل میکنند، استفاده میشود. به نظر میرسد آنتیبیوتیکهایی که اثر سینرژیک دارند، وقتی بهصورت همزمان مصرف میشوند اثرشان چهار برابر یا بیشتر از مواقعی است که هرکدام بهتنهایی مورد استفاده قرار ميگيرند. اثر سینرژیسمی وقتی روی میدهد که به بیمار، یک پنیسیلین یا یک سفالوسپورین با یک آمینوگلیکوزید همزمان داده شود. همچنین در مصرف همزمان تریمتوپریم و سولفومتاکسازول اثر سینرژیسمی حاصل میشود.
پنیسیلین و سفالوسپورین باکتریها را با ممانعت از سنتز دیواره سلولی میکشند، درحالیکه آمینوگلیکوزیدها ساخت پروتئین را بلوکه میکنند. در بعضی موارد، یک باکتری در استفاده تکی آنتیبیوتیکها، فقط به مقدار مختصری به آنها حساس است، ولی وقتی این آنتیبیوتیکها با هم مصرف میشوند بسیار به آنها حساس است. به نظر میرسد که مهار سنتز دیواره سلولی توسط یک پنیسیلین یا سفالوسپورین، باکتری را نسبت به آمینوگلیکوزید بسیار نفوذپذیرتر میسازد. باکتری با تجمع هر چه بیشتر آمینوگلیکوزیدها درون آن، خیلی سریعتر توسط آنتیبیوتیک کشته میشود.
این امر، امکان استفاده مقادیر کمی از آمینوگلیکوزیدهای نسبتاً سمی در درمان بیماران را میدهد. استفاده ترکیبی یک آمینوگلیکوزید با پنیسیلین یا سفالوسپورین در درمان عفونتهای حاصل از باسیلهای گرم منفی نظیر سودوموناس ائروژینوزا یا باکتریهايي که کنترل آنها مشکل است، مفید است.
سولفومتاکسازول (SXT) و تریمتوپریم (TMP) با هم نیز اثر سینرژیسمی دارند، زیرا این دو آنتیبیوتیک، مراحل جداگانهای از مسیر تبدیل پاراآمینو بنزوئیک اسید و پتریدین به تتراهیدروفولات را متوقف میسازند. SXT و TMPبرای درمان عفونتهای باکتریایی و انگلی متفاوتی تجویز میشوند.
اثرات آنتاگونیسم
متأسفانه مصرف همزمان همه آنتیبیوتیکها اثر سینرژیسمی یا افزایشی ندارند. بعضی مصارف همزمان، سبب آنتاگونیست میشود، بطوریکه یک آنتیبیوتیک فعالیت آنتیبیوتیک دیگر را مهار میکند. مثالی در این مورد مصرف همزمان کلرامفینکل با یک پنیسیلین نظیر آمپیسیلین است. آمپیسیلین در زمان رشد سریع باکتری، عامل ممانعت از سنتز دیواره سلولی است.
وقتی باکتری به تنهایی در برابر کلرامفنیکل و آمپیسیلین قرار بگیرد، کلرامفنیکل باکتریواستاتیک، نه تنها تکثیر باکتری را متوقف نمیسازد، بلکه نیاز به سنتز دیواره سلولی را نیز از بین میبرد، چون سنتز سلولی دیگر صورت نمیگیرد، آمپیسیلین نمیتواند بر روی باکتری مؤثر باشد، بنابراین فعالیت باکتریوسیدال آمپیسیلین کاملاً توسط فعالیت باکتریواستاتیک کلرامفنیکل بلوکه میشود. معمولاً توصیه میشود که آنتیبیوتیکهای استاتیک و سیدال با هم مصرف نشوند.
آنتیبیوتیکهایی که بر روی پوشش سلولی اثر میگذارند
اصول کلی
باکتریهای گرم مثبت دارای غشاء سیتوپلاسمی داخلی و دیواره سلولی پپتیدوگلیکانی چند لایه بهاضافه تیکوئیک اسید که به هرکدام از این ساختمانها متصل است، هستند. در مقابل، باکتریهای گرم منفی دارای غشاء سیتوپلاسمی داخلی، دیواره سلولی نازک و یک غشاء خارجی میباشند که مملو از پورینها و لیپو پلیساکاریدها است. در باکتریهای گرم مثبت چون دیواره سلولی خیلی در دسترس است، کاملاً حساس به آنتیبیوتیکهای متوقفکننده سنتز مراحل مختلف پپتیدوگلیکان، هستند.
بعضی مواد که سنتز دیواره سلولی را مهار میکنند، علیه باکتریهای گرم منفی نیز مفیدند، اما آنها باید برای رسیدن به مکانیسم سنتز دیواره سلولی بهگونهای طراحی شوند که امکان عبور از منافذ غشاء خارجی را داشته باشند. باکتریهای گرم منفی نیز به آنتیبیوتیکهای مشابه دترجنتها که غشاء خارجی سلول را حل میکنند، حساس هستند.
آنتیبیوتیکهای توصیهشده برای درمان بیماریهای ناشی از باکتریها در جدول 1 لیست شده است و در مقالات بعدی به تفصیل توضیح داده میشوند.
جدول 1: آنتیبیوتیکهای توصیهشده در درمان بیماریهای ناشی از باکتریها
کوکسی چرکزای گرم مثبت
| باکتریها | آنتیبیوتیکهای مؤثر در درمان |
| انتروکوک فکالیس | آمپیسیلین، وانکومایسین، پنیسیلین/ جنتامایسین، وانکومایسین/ آمینوگلیکوزیدها |
| انتروکوک فاسیوم | آمپیسیلین، وانکومایسین، پنیسیلین/ جنتامایسین، وانکومایسین/ آمینوگلیکوزیدها |
| استافیلوکوک اورئوس | پنیسیلینهای مقاوم به پنیسیلیناز، سفالوسپورینهای نسل اول، وانکومایسین، کلیندامایسین |
| استافیلوکوک اپیدرمیدیس | وانکومایسین |
| استافیلوکوک ساپروفیتیکوس | TMP/SMX، آمپیسیلین، آموکسی سیلین، فلوروکینولونها |
| استرپتوکوک آگالاکتیه | پنیسیلین، آمپیسیلین |
| استرپتوکوکهای گروه C و G | پنیسیلین، وانکوماسین، سفالوسپورینهای نسل اول یا نسل دوم |
| گروه استرپتوکوک اینترمدیوس | پنیسیلین، وانکوماسین |
| استرپتوکوک موتانس | پنیسیلین/ جنتامایسین، وانکومایسین/ جنتامایسین/ ریفامپین |
| استرپتوکوک پنومونیه | پنیسیلین، سفوتاکسیم، سفتریاکسون، وانکومایسین، ایمی پنم |
| استرپتوکوک پیوژنز | پنیسیلین G یا V یا سفالوسپورینهای خوراکی نسل اول، اریترومایسین |
| استرپتوکوک سانگوئیس | پنیسیلین/ جنتامایسین، وانکومایسین/ جنتامایسین/ ریفامپین |
باکتریهای چرکزای گرم منفی
| بوردتلا پرتوسیس | اریترومایسین، TMP/SMX، آمپیسیلین |
| هموفیلوس اجیپتیکوس | نژادهای BPF: آموکسی سیلین، آموکسی سیلین/ کلاولانات، TMP/SMX، سفوروکسیم، سفیکسیم
سایر نژادها: نئومایسین/ پلیمیکسین |
| هموفیلوس دوکرهای | آزیترومایسین، سفتریاکسون |
| هموفيلوس آنفلوانزا | سفتریاکسون، سفوتاکسیم، آموکسی سیلین/ کلاولانات، سفالوسپورینهای خوراکی نسل دوم یا سوم، ماکرولیدها، آمپیسیلین/ سولباکتام |
| هموفیلوس پاراآنفلوانزا | سفتریاکسون، سفوتاکسیم، آموکسی سیلین/ کلاولانات، سفالوسپورین های خوراکی نسل دوم یا سوم، ماکرولیدها، آمپیسیلین/ سولباکتام |
| موراکسلا کاتارالیس | آموکسی سیلین/ کلاولانات، سفالوسپورینهای خوراکی نسل دوم یا سوم، آزیترومایسین/ TMP/SMX |
| نایسریا گونورهآ | سفتریاکسون، سفوتاکسیم، سفتیزوکسیم، آموکسی سیلین/ پروبنسید |
| نایسریا مننژیتیدیس | پنیسیلین، سفتریاکسون |
انتروباکتریاسه و باکتریهای مشابه با آنها:
| کمپیلوباکتر فتوس زیرگونه فتوس | ایمیپنم، جنتامایسین |
| کمپیلوباکتر ژژونی | فلوروکینولون، اریترومایسین |
| گونههای مختلف سیتروباکتر | ایمیپنم، فلوروکینولون، آمینوگلیکوزیدهای ضدسودوموناسی |
| گونههای مختلف ادواردسیلا | آمپیسیلین |
| گونههای مختلف انتروباکتر | ایمیپنم، آمینوگلیکوزیدهای ضد سودوموناسی/پنیسیلینهای ضد سودوموناسی |
| اشریشیا کلی | آمپیسیلین/جنتامایسین، TMP/SMX، فلوروکینولون، سفالوسپورینهای نسل سوم، تیکارسیلین/کلاولانات، آمینوگلیکوزیدهای ضد سودوموناسی/پنیسیلینهای ضد سودوموناسی |
| گونههای مختلف هافنیا | آمینوگلیکوزیدهای ضد سودوموناسی، ایمیپنم |
| هلیکوباکتر پیلوری | مترونیدازول/آموکسی سیلین/ ساب سالیسیلات بیسموت، مترونیدازول/ تتراسایکلین/ ساب سالیسیلات بیسموت |
| گونههای مختلف کلبسیلا | نژادهای اوزونه و رینواسکلروما: ریفامپین/ TMP/SMX |
| گونههای مختلف مورگانلا | ایمیپنم، آمینوگلیکوزیدها/ ضد سودوموناسی، فلوروکینولون |
| گونههای مختلف پانته آ | آمینوگلیکوزیدهای ضد سودوموناسی/ پنیسیلینهای ضدسودوموناس، ایمیپنم |
| پروتئوس میرابیلیس | آمپیسیلین، TMP/SMX |
| پروتئوس ولگاریس | سفالوسپورینهای تزریقی نسل سوم، فلوروکینولون |
| گونههای مختلف پروویدنسیا | آمیکاسین، فلوروکینولون، TMP/SMX |
| سالمونلا تیفی | آموکسی سیلین، TMP/SMX کلرآمفنیکل، سیپروفلوکساسین، سفالوسپورینهای نسل سوم |
| سراشیا مارسیسنس | جنتامایسین، سفالوسپورینهای تزریقی نسل سوم، ایمیپنم، فلوروکینولونها |
| گونههای مختلف شیگلا | فلوروکینولونها، TMP/SMX، آمپیسیلین |
| یرسینیا انتروکولیتیکا | سفالوسپورینهای تزریقی نسل سوم/ آمینوگلیکوزیدهای ضد سودوموناسی، داکسی سایکلین، TMP/SMX |
| یرسینیا سودوتوبرکلوزیس | سفالوسپورینهای تزریقی نسل سوم/ آمینوگلیکوزیدهای ضد سودوموناسی، داکسی سایکلین، TMP/SMX |
سودوموناسها
| بورخولدریا (سودوموناس) سپاسیا | TMP/SMX، سفتازیدیم، سیپروفلوکساسین |
| بورخولدریا (سودوموناس) سودومالئی | سفتازیدیم، انواع مختلفی از داروهای انتخاب دوم |
| سودوموناس آئروژینوزا | پنیسیلینهای ضدسودوموناسی، سفالوسپورینهای تزریقی ضدسودوموناسی نسل سوم، ایمیپنم، آمینوگلیکوزیدهای ضد سودوموناسی، آنتیبیوتیکهای بتالاکتام/ آمینوگلیکوزیدهای ضد سودوموناسی |
| سودوموناس اشتوتزری | انواع مختلفی از آنتیبیوتیکهای با طیف اثر وسیع |
| استنوتروفوموناس (گزانتوموناس) مالتوفیلیا | کلرامفنیکل، مینوسایکلین، TMP/SMX، تیکارسیلین/ کلاولانات |
باکتریهای قارچ مانند
| گونههای مختلف اکتینومادورا | استرپتومایسین، TMP/SMX، استرپتومایسین/ داپسون |
| اکتینومایسس اسرائیلی | پنیسیلین، آمپیسیلین، داکسی سایکلین، سفتریاکسون |
| مایکوباکتریوم آویوم اینتراسلولار | کلاریترومایسین/ اتامبوتول، کلاریترومایسین/ کلوفازیمین، کلاریترومایسین/ سیپروفلوکساسین، ریفابوتین/ اتامبوتول |
| مایکوباکتریم کانزاسی | ریفامپین/ INH / اتامبوتول |
| مایکوباکتریوم لپره | چندین داروی مختلف از جمله داپسون، کلوفازیمین، ریفامپین و اتیونامید |
| مایکوباکتریم مارینوم | ریفامپین/ اتامبوتول، مینوسایکلین، TMP/SMX |
| مایکوباکتریم اسکروفولاسئوم | INH / ریفامپین/ سیکلوسرین، استرپتومایسین/ ریفامپین/ سیکلوسرین |
| مایکوباکتریم توبرکلوزیس | چندین داروی انتخاب اول و دوم: داروهای انتخاب اول شامل INH، ریفامپین، اتامبوتول، پیرازینامید و استرپتومایسین. داروهای انتخاب دوم شامل آمیکاسین، کوپرئومایسین، سیپروفلوکساسین، کلوفازیمین، داپسون، اتیونامید، افلوکساسین، PAS و ریفابوتین |
| نوکاردیا آستروئیدس | دوزهای بالایی از سولفونامیدها، TMP/SMX، TMP / سفتریاکسون/ آمیکاسین |
| نوکاردیا برازیلینسیس | آموکسی سیلین/ کلاولانات، آمیکاسین/ سفتریاکسون |
| گونههای مختلف استرپتومایسس | به دارو نیازی نیست (به جراحی نیاز دارد) |
| تروفریما ویپلی | پنیسیلین/ استرپتومایسین همراه با تتراسایکلین، کلرآمفنیکل یا TMP/SMX |
باکتریهای مشترک انسان و حیوان
| گونههای مختلف بروسلا | تتراسایکلین/ استرپتومایسین، داکسی سایکلین/ ریفامپین، داکسی سایکلین، سفتریاکسون/ ریفامپین، استرپتومایسین/ داکسی سایکلین، استرپتومایسین/ مینوسایکلین |
| گونههای مختلف کاپنوسایتوفاگا | پنیسیلین، آموکسی سیلین، اریترومایسین، سفوکسیتین، کلیندامایسین |
| اریزوپلوتریکس روزیوپاتیا | پنیسیلین، آمپیسیلین، سفالوسپورینهای نسل اول |
| فرانسیسلا تولارنسیس | استرپتومایسین، جنتامایسین |
| لیستریا منوسیتوژنز | آمپیسیلین، TMP/SMX |
| پاستورلا مالتوسیدا | پنیسیلین، داکسی سیلین، آموکسی سیلین/ کلاولانات |
| اسپیریلوم مینور | آمپیسیلین، پنیسیلین، استرپتومایسین |
| استرپتوباسیلوس مونیلی فورمیس | آمپیسیلین، پنیسیلین، استرپتومایسین |
| یرسینیا پستیس | استرپتومایسین، کلرامفنیکل، تتراسایکلین، جنتامایسین |
مایکوپلاسماها، ریکتزیاها و سایر باکتریهای غیرمعمول
| بارتونلا باسیلی فورمیس | تتراسایکلین، پنیسیلین، کلرامفنیکل |
| بارتونلا (روچالیما) هنسله | ریفامپین، سیپروفلوکساسین، جنتامایسین، TMP/SMX، اریترومایسین، داکسی سایکلین |
| بارتونلا (روچالیما) کوئین تانا | تتراسایکلین، برخی از داروهای انتخاب دوم |
| کلامیدیا پنومونیه | تتراسایکلین، داکسی سایکلین |
| کلامیدیا پسیتاسی | یکی از تتراسایکلینها |
| کلامیدیا تراکوماتیس | داکسی سایکلین، آزیترومایسین، اریترومایسین، فلوروکینولون، سولفومتاکسازول، |
| کوکسیلا بورنتی | عفونت حاد: داکسی سایکلین
عفونت مزمن: فلوروکینولون، فلوروکینولون/ ریفامپین |
| گونههای ارلیشیا | یکی از تتراسایکلینها |
| مایکوپلاسما فرمنتانس | دارویی توصیه نمیشود |
| مایکوپلاسما هومینیس | اریترومایسین، داکسی سایکلین |
| مایکوپلاسما پنومونیه | ماکرولیدها، داکسی سایکلین |
| ریکتزیا آگاری | یکی از تتراسایکلینها، کلرامفنیکل |
| ریکتزیا پرووازکی | داکسی سایکلین، کلرامفنیکل |
| ریکتزیا ریکتزیه | کلرآمفنیکل، داکسی سایکلین |
| ریکتزیا تسوتسوگاموشی | یکی از تتراسایکلینها، کلرامفنیکل |
| ریکتزیا تیفی | داکسی سایکلین، کلرامفنیکل |
| اوره آپلاسما اوره لیتیکوم | اریترومایسین، داکسی سایکلین |
اسپیروکتها
| بورلیا بورگدورفری | داکسی سایکلین، آموکسی سیلین، سفتریاکسون |
| بورلیا هرمسی | داکسی سایکلین، اریترومایسین، پنیسیلین |
| بورلیا رکورنتیس | داکسی سایکلین، اریترومایسین، پنیسیلین |
| لپتوسپیرا اینتروگانس | داکسی سایکلین، اریترومایسین، پنیسیلین |
| ترپونما کاراتئوم | پنیسیلین |
| ترپونما پالیدوم | پنیسیلین، پنیسیلین/ پروبنسید |
لژیونلاها
| گونههای مختلف لژیونلا | اریترومایسین، اریترومایسین/ ریفامپین، ماکرولیدهایی با طیف اثر وسیع، تتراسایکلین، داکسی سایکلین |
باکتریهای سمزا
| ائروموناس هیدروفیلا | جایگزین کردن آب و مایعات در بدن/ فلوروکینولون ها |
| آرکانوباکتریوم همولیتیکوم | پنیسیلین G، اریترومایسین |
| باسیلوس آنتراسیس | پنیسیلین G یا V، سیپروفلوکساسین، داکسی سایکلین، اریترومایسین، |
| باسیلوس سرئوس | دارویی توصیه نمی شود.
(جایگزینی آب و مایعات ضروری است) |
| كلستريديوم بوتولینم | آنتی توکسین |
| كلستريديوم دیفیسیل | مترونیدازول، وانکومایسین |
| كلستريديوم پرفرنژنز | پنیسیلین/ جراحی |
| كلستريديوم سپتیکوم | پنیسیلین |
| كلستريديوم تتانی | آنتیتوکسین/ جراحی / پنیسیلین/ توکسوئید، آنتیتوکسین/ جراحی/ مترونیدازول/ توکسوئید |
| کورینه باکتریم دیفتریه | اریترومایسین/ آنتیتوکسین، پنیسیلین/ آنتیتوکسین |
| کورینه باکتریم جیکیوم | وانکومایسین، سیپروفلوکساسین |
| کورینه باکتریم مینوتیسیموم | اریترومایسین |
| پلزیوموناس شیگلوئیدوز | فلوروکینولون، TMP/SMX |
| ویبریو کلرا | جایگزینی آب و مایعات/ TMP/SMX، جایگزینی آب و مایعات/ فلوروکینولون، جایگزینی آب و مایعات/ تتراسایکلین |
| ویبریو فلوویالیس | دارویی توصیه نمی شود.
(جایگزینی آب و مایعات ضروری است) |
| ویبریو میمیکوس | جایگزینی آب و مایعات/ تتراسایکلین، جایگزینی آب و مایعات/ فلووروکینولون |
| ویبریو پاراهمولیتیکوس | جایگزینی آب و مایعات/ تتراسایکلین، جایگزینی آب و مایعات/ فلووروکینولون |
| ویبریو ولنیفیکوس | تتراسایکلین/ آمینوگلیکوزیدهای ضد سودوموناسی، داکسی سایکلین/ سفتازیدیم |
باکتریهای بیهوازی فاقد اسپور
| باکتریوئیدس فراژیلیس | مترونیدازول، کلیندامایسین، سفوکسیتین، ایمیپنم، سفمتازول، سفوتتان، پنیسیلین/ مهارکنندههای بتالاکتامازی |
| گونههای مختلف بیفیدوباکتریوم | پنیسیلین، کلیندامایسین |
| گونههای مختلف یوباکتریوم | آمپیسیلین، پنیسیلین |
| فوزوباکتریوم نکروفوروم | پنیسیلین، کلیندامایسین، سفالوسپورین های نسل سوم، سفامایسین |
| فوزوباکتریوم نوکلئاتوم | پنیسیلین، کلیندامایسین، سفالوسپورینهای نسل سوم، سفامایسین |
| گونههای مختلف ژملا | پنیسیلین، کلیندامایسین |
| گونههای مختلف لاکتوباسیل | آمپیسیلین، پنیسیلین، کلیندامایسین، کلرامفنیکل |
| گونههای مختلف موبیلنکوس | دارویی توصیه نمیشود |
| گونههای مختلف پپتواسترپتوکوک | پنیسیلین، کلیندامایسین |
| گونههای مختلف پورفیروموناس | مترونیدازول، کلیندامایسین، سفوتاکسیم، سفوپرازون، آمپیسیلین/ سولباکتام |
| پروتلا ملانينوجنيكوس | مترونیدازول، کلیندامایسین، سفوکسیتین، آمپیسیلین |
| گونههای مختلف پروبیونی باکتریوم | پنیسیلین، آمپیسیلین، سفالوسپورینهای نسل سوم، سفامایسین |
| گونههای مختلف استرپتوکوک | پنیسیلین، وانکومایسین، آمپیسیلین |
| گونههای مختلف وایلونلا | مترونیدازول، آمپیسیلین، سفوکسیتین |
بخش دوم
آنتیبیوتیکهای مهارکننده سنتز دیواره سلولی
بدون شک مهمترین آنتیبیوتیکها، آنتیبیوتیکهای مهارکننده سنتز دیواره سلولی هستند. این آنتیبیوتیکها شامل آنتیبیوتیکهای بتالاکتام (کارباپنمها[1]، سفالوسپورینها، سفامایسینها[2]، منوباکتامها[3] و پنیسیلینها)، آنتیبیوتیکهای گلیکوپپتیدی[4] (تیکوپلانین و وانکومایسین و آنتیبیوتیکهای باسیتراسین[5] و سیکلوسرین[6]) میباشند.
همانگونه که در شکل 1 مشاهده میگردد، سنتز دیواره سلولی شامل ساخت واحدهای دیساکارید N استیل گلوکزامین- N استیل مورامیک اسید (GIcNAc-MurNAc) که به مولکول حامل لیپیدی بنام باکتوپرنول در غشاء سلولی متصل میشوند، است. آنزیمهای اتولیتیک محلهایی را در غشاء سلولی باز میکنند که دیساکاریدهای جدید بتوانند در آنجا وارد شوند. باکتوپرنول واحدهای GIcNAc-MurNAc متصل به خود را به محل رشد پپتیدوگلیکان ارائه میکند و واحد تازه سنتزشده دیساکارید از طریق پیوند β 1 و 4 گلیکوزیدی به داربست مورینی اتصال مییابند.
در مرحله بعد، آنزیم ترانسپپتیداز، زنجیره پپتیدی جدید متصل به GIcNAc-MurNAc را به زنجیره پپتیدی GIcNAc-MurNAc دیگری با پیوند متقاطع وصل میکند. در این هنگام باکتوپرنول دیفسفات برای اینکه بتواند یک واحد جدید GIcNAc-MurNAc را دریافت نماید، دفسفریله شده و به باکتوپرنول منوفسفات تبدیل میشود.
در این پروسه، اهداف کلیدی اثر آنتیبیوتیک شامل (1) انتقال مولکول GIcNAc-MurNAc از حامل لیپیدی به زنجیره در حال رشد پپتیدوگلیکان، (2) واکنش ترانس پپتیداسیون و (3) دفسفریله شدن باکتوپرنول دیفسفات برای آماده شدن برای حمل است. آنتیبیوتیکهای گلیکوپپتیدی از انتقال دیساکارید به محل سنتز دیواره ممانعت میکنند. آنتیبیوتیکهای بتالاکتام، گلیکوپپتیدی و سیکلوسرین مانع از واکنش ترانس پپتیداسیون (البته با مکانیسمهای متفاوت) میشوند. باسیتراسین دفسفریله شدن حامل لیپیدی را متوقف مینماید.
آنتیبیوتیکهایی که سنتز دیواره باکتری را مهار میکنند اغلب باکتریها را لیز میکنند. چرا که آنزیمهای اتولیتیک شکستن داربست پپتیدوگلیکان را، حتی وقتی واحدهای GIcNAc-MurNAc به آن الحاق نشده یا واکنش متقاطع ندارند، نیز ادامه میدهند. در حقیقت به نظر میرسد که اتولیزینهای سلولی، حداقل توسط بعضی از آنتیبیوتیکهای بتالاکتام فعال شوند؛ بنابراین وقتی این آنتیبیوتیکها حضور دارند، اتولیزینها به تضعیف داربست پپتیدوگلیکان ادامه میدهند تا اینکه فشار اسموتیک ابتدا دیواره را متورم و سپس آن را تخریب میکند.
شكل 1: سنتز ديوارة سلولي
نمودار بالا نشان میدهد كه چگونه استافيلوكك اورئوس، سنتز واحد ديساكاريد GlcNAc- MurNAc را با بكارگيري مولكول ناقل باكتوپرنول پیروفسفات کامل میکند و ديساكاريد را به داخل مکان رشد مورين (پپتیدوگلیکان) قرار میدهد. وانكومايسين و ریستوستين مانع اتصال ديپپتيد به نقطة رشد مورين ميشود و باسیتراسين، مانع ديفسفوريله شدن مولكول ناقل كه براي سنتز مجدد به صورت باكتوپرنول پیروفسفات فعال نياز است، ميشود.
N استيل گلوكز آمين = GLcNAc، N استيل موراميك اسيد = MurNAc، یوریدين دي فسفات = UMP. یوریدين منوفسفات= UMP، باكتوپرنول منوفسفات= باكتوپرنول– P
و باكتوپرنول دی فسفات= باكتوپرنول- P-P
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
آنتیبیوتیکهای بتالاکتام
آنتیبیوتیکهای بتالاکتام نامشان را از این مسئله میگیرند که هرکدام دارای یک حلقه بتالاکتام (محل اثر آنتیبیوتیک) هستند. حلقه بتالاکتام بهعنوان آنالوگ اسیل- د– آلانین– د– آلانین، محکم به محل فعال آنزیمهای ترانس پپتیداز که ترانس پپتیداسیون واحدهای MurNAc را در دیواره سلول کاتالیز میکند، متصل میشود. ترانس پپتیداسیون مهم است، چرا که واکنشهای متقاطع، داربست مورینی را کامل کرده و آن را با نیروی کششی لازم برای مقاومت به لیز اسموتیک آماده میسازند.
آنزیمهایی که به آنتیبیوتیکهای بتالاکتام میچسبند، بهعنوان پروتئینهای باندکننده به پنیسیلین نیز نامیده میشوند؛ زیرا آنها ابتدا به دلیل توانائیشان برای کمپلکس شدن با پنیسیلینهای مختلف شناسایی شدهاند. PBPها، گروههای مختلفی از ترانس پپتیدازها و کربوکسی پپتیدازها هستند که به صورتهای مختلف در سنتز دیواره سلولی نقش دارند.
در اشریشیا کلی دوPBP1-b ,PBP-1a باسیل را طویل میسازند، درحالیکه PBP-2 در پایدار کردن شکل باسیلی باکتری نقش دارد. آنتیبیوتیکهای بتالاکتام که به PBP1-b,PBP-1a میچسبند، سبب میشوند که اشریشیا کلی سریعاً لیز شود، درحالیکه آنهایی که ترجیح میدهند به PBP-1 بچسبند، قبل از لیز آن، سبب گرد شدن باکتری میشوند. PBP-3، دیواره میانی اشریشیا کلی را در هنگام تقسیم میسازد و غلظت زیرکشندگی بتالاکتامهایی که به این آنزیم باند میکنند، سبب میشود که اشریشیا کلی بهصورت رشتهای بلند دربیاید.
PBP -1 PBP-2 , PBP-3, آنزیمهای دو سر با دو مکان فعال هستند. یک سر آنها، خاصیت ترانس گلیکوزیلاز و سر دیگرشان خاصیت ترانس پپتیداز دارند. PBP-6 ,PBP-5 ,PBP-4 D،D -کربوکسی پپتیدازهایی هستند که در طی سنتز دیواره سلولی، آلانین انتهایی را میشکنند و به این ترتیب به آلانین نزدیک به انتها، امکان شرکت در واکنش متقاطع را میدهند.
هر آنتیبیوتیک بتالاکتام ترجیح میدهد که به یک PBPبچسبد؛ برای مثال آمیدینوسیلین[7] (کارباپنمی که پیومیسیلینام[8] نیز نامیده میشود) از فعالیت PBP-2 جلوگیری میکند. درحالیکه آزترونام[9] (یک منوباکتام) از PBP-3 بهعنوان هدف استفاده میکند. هر باکتری دارای تعداد مختلفی از PBP مخصوص به خود است. نوع و میزان PBPهای موجود با تعیین مقاومت یا حساسیت باکتری به یک آنتیبیوتیک بتالاکتام خاص مشخص میگردد.
به نظر میرسد که دو کلاس از اتولیزینها، دارای اثر لیتیک آنتیبیوتیکهای بتالاکتام هستند. آمیداز پیوند بین تتراپپتیدها و گلیکان را میشکند، درحالیکه گلیکوزیداز پیوند 4 ,1β گلیکوزیدی بین واحدهای دیساکارید را میشکند. این آنزیمها وقتی سنتز دیواره سلولی کامل نیست، عمل میکنند و سویههای موتانتی که این آنزیمها را ندارند توسط آنتیبیوتیکهای بتالاکتام لیز نمیشوند؛ بنابراین رشد این موتانتها مهار میشود، ولی لیزی صورت نمیگیرد و گفته میشود که باکتری به آنتیبیوتیک بتالاکتام تحمل پیدا کرده است.
چهار دسته آنتیبیوتیک بتالاکتام عبارتند از: پنیسیلینهای طبیعی، پنیسیلینهای نیمه صنعتی، آنالوگها و دو آنتیبیوتیک شبه پنیسیلین (کارباپنمها و منوباکتامها) و سفالوسپورینها، سفامایسینها و آنتیبیوتیکهای وابسته.
پنیسیلینهای طبیعی
در شکل 2 ساختمان پنیسیلین G و پنیسیلین V که پنیسیلینهای طبیعی هستند، نشان داده شده است.
شکل 2: ساختمان پنیسیلین طبیعی G و V (برگرفته از کتاب میکروبشناسی پزشکی واکر)
- پنیسیلین G:
پنیسیلین در سال 1929 توسط الکساندر فلمینگ کشف و سپس توسط فلوری و چاین بهصورت پنیسیلین G درآمد. هسته آن یک دارای ساختمان دو حلقهای، یک حلقه تیازولیدین و یک حلقه بتالاکتام است و فنیل استیک اسید از طریق یک پیوند پپتیدی به حلقه بتالاکتام متصل است. حلقه بتالاکتام سایت فعال پنیسیلین است. وقتی یک مولکول پنیسیلین به یک PBP میرسد، باند بین N,CO در حلقه بتالاکتام میشکند و ترانس پپتیداز بهصورت کووالانت به CO متصل میشود. این امر ترانس پپتیداز را برای سنتز پپتیدوگلیکان دست نایافتنی میکند و واکنش متقاطع پپتیدوگلیکان را متوقف میسازد. تجمع پیشسازهای پپتیدوگلیکانی که فاقد واکنش متقاطع هستند آنزیمهای اتولیتیک را فعال ساخته و ترکیب، فقدان واکنش متقاطع و فعالیت بالای اتولیزین، باکتری را از نظر اسموتیکی شکننده میسازد.
پنیسیلین G ابتدا برای درمان باکتریهای گرم مثبت نظیر پنوموکک، استافیلوکوک و استرپتوکوک بکار میرفت، همچنین برای درمان عفونتهای ناشی از نایسریا گونورهآ و نایسریا مننژیتیدیس که گرم منفی هستند نیز استفاده میشد. متأسفانه، امروزه عفونتهای حاصل از بیشتر این باکتریها با پنیسیلین G درمان قابل قبولی نمییابند، چرا که بسیاری از این سویهها مکانیسمهای مقاومت در برابر فعالیت پنیسیلین G را کسب کردهاند.
حلقه بتالاکتام پنیسیلین G تحت فشار است، بطوریکه نسبت به هیدرولیز اسیدی حساس میشود. تنها حدود یک پنجم از پنیسیلین G جذب میشود؛ بنابراین، پنیسیلین G کاندیدای خوبی برای استفاده خوراکی نیست. به همین دلیل معمولاً بهصورت تزریقی استفاده میشود.
مخلوط پنیسیلین G که بهصورت تجاری در دسترس است، آلرژنی فوقالعاده است. خود پنیسیلین G اجزای آلرژن نیست، بلکه مولکولهای ناقص پنیسیلین G است که به فراوانی در مخلوط وجود دارد. بعضی از این مولکولهای ناقص در نتیجه تجزیه خودبخودی پنیسیلین در طی نگهداری حاصل شده و برخی نیز آن در سرم بیماران بهصورت هاپتن عمل کرده و میتوانند به شدت سیستم ایمنی را تحریک نمایند.
شدیدترین پاسخ ایمنی پنیسیلین وابسته به IgE است و طیف آن از تورم و سوزش در ناحیه تزریق تا یک آنافیلاکسی سریع و قوی که منجر به مرگ در عرض چند ثانیه بعد از مصرف آنتیبیوتیک میشود، متغیر است. مواجهه اول ممکن است سبب واکنش خفیفتری نظیر کهیر، آسم و خارش شود، اما آنافیلاکسی سیستمیک ممکن است علاوه بر اولین مواجهه، در مواجهات دوم و سوم روی بدهد. آنافیلاکسی سیستمیک یک وضعیت خطرناک است، به همین دلیل، پزشکان معمولاً درباره تاریخچه واکنش بیماران نسبت به پنیسیلین سؤال میکنند و مدتی بعد از تزریق بیمار را نگه میدارند و همچنین داروها و تجهیزات مناسب را در تمام مدت در دسترس خود دارند.
واکنش IgE به این نیاز دارد که بعد از مواجهه اولیه، تحریک شده و به ماست سل در بافت زیرجلدی متصل گردد. این بدان معنی است که بیماری که هرگز با پنیسیلین مواجه نشده است، نمیتواند واکنش وابسته به IgE را نشان دهد. لازم است بدانیم، تمام پنیسیلینها با یکدیگر واکنش متقاطع میدهند و حساسیتهای متقاطع به وجود میآورند.
تمامی واکنشهای جانبی پنیسیلین وابسته به IgE نیست. ممکن است بیماران، از واکنش بیماری سرم بهصورت کهیر، خارش، تورم مفاصل و مشکلات تنفسی تا 12 روز بعد از تزریق پنیسیلین رنج ببرند و این واکنشها میتواند متعاقب اولین مواجهه با پنیسیلین رخ دهد.
بعضی بیماران دچار یک آنمی همولیتیک وابسته به IgE میشوند که به دلیل لیز وابسته به کمپلمان گلبولهای قرمزی است که با مولکولهای پنیسیلین پوشیده شدهاند. ممکن است پرستاران، کارکنان داروخانهها و سایر افراد خاصی که مکرراً با پنیسیلین در تماسند، مبتلا به نوعی درماتیت تماسی شوند که بهصورت پاسخ ایمنی سلول رخ داده و از نظر تظاهرات و مکانیسم شبیه درماتیت آلرژیک حاصل از سم پیچک[10] است.
از آنجایی که بهطور تخمینی 5-1 درصد افراد بالغ به پنیسیلین حساسیت دارند، باید با دقت در مورد تاریخچه هر بیمار از آلرژی به پنیسیلین سؤال شود. اگر بیمار تاریخچه مشخصی نداشت و از طرفی نیاز داشت که پنیسیلین مصرف نماید، باید از نظر حساسیت وابسته به IgE با تزریق داخل جلدی مقدار بسیار کمی از پنیسیلین تجاری آماده، تست گردد. اگر به پنیسیلین حساسیت داشته باشد در محل تزریق دچار درد و تورم میشود.
البته این کار خطرناک بوده و بهتر است آنتیبیوتیک دیگری بهعنوان جایگزین مصرف شود. اگر بیمار به پنیسیلین حساسیت داشته باشد و استفاده از پنیسیلین به مرگ و زندگی او بستگی داشته باشد، باید با طریقه خوردن متناوب دوزهای کم پنیسیلین طی ساعات متوالی، حساسیتزدایی شود.
به نظر میرسد، حدود 5 درصد از بیماران حساس به پنیسیلین، به سفالوسپورین نیز آلرژی داشته باشند. بیمارانی که حساسیت غیر وابسته به IgE، نسبت به پنیسیلین داشته باشند را میتوان با سفالوسپورین درمان کرد، اما به بیمارانی که حساسیت وابسته به IgE دارند را نمیتوان با سفالوسپورین درمان کرد، چرا که واکنشهای بعدی در آنها بسیار وخیم بروز میکند.
- پنیسیلین V:
در طی دهه 1950 میلادی، محققین دریافتند که اگر پنیسیلینومها را در محیطهای متفاوت کشت دهند، نوع پنیسیلینی که توسط آنها ترشح میشود، باهم تفاوت دارد. آنها با تهیه کردن محیطهای کشت حاوی اسیدهای آلی متفاوت، توانستند انواع مختلفی از پنیسیلین را تولید نمایند.
پنیسیلین G در محیط کشت حاوی فنیل استیک اسید تولید میشود، درحالیکه پنیسیلین V در محیط کشت حاوی فنوکسی متیل تولید میگردد. پنیسیلین V به سبب پایداری بیشتر نسبت به پنیسیلین G در برابر اسید، موجب پیشرفتهای زیادی شد؛ بنابراین برخلاف پنیسیلین G که بهصورت تزریقی باید مصرف میشد، پنیسیلینV را خوراکی تجویز میکردند. امروزه، پنیسیلینV در کودکان استفاده فراوانی دارد.
پنیسیلینهای نیمه صنعتی و مشابهات آن:
کشف محیطهای کشتی که پنیسیلینوم در آن قدرت رشد دارد، منجر به این فکر شد که با تغییر گروه R پنیسیلین میتوان پنیسیلینهایی مختلفی با خواص جدید تولید کرد. محققین بزودی دریافتند که میتوان پیشساز بسیار فعالی از پنیسیلین یعنی 6– آمینوپنی سیلانیک اسید[11] را هم از طریق اثر آمیدازها بر روی پنیسیلین G و هم از طریق رشد پنیسیلینوم در محیطی که فاقد دهنده آسیل است، تهیه کرد. در مرحله بعد برای تولید پنیسیلینهای نیمه صنعتی، باید تقریباً تمام مواد اسیدهای آلی صنعتی را به 6– آمینوپنی سیلانیک اسید متصل کرد (شکل 3).
شکل 3 : تغییر ساختمان پنیسیلین بهوسیله آنزیمها
آمیداز برای ایجاد 6 -آمینوپنی سیلانیک اسید بکار میرود که با اسیدهای آلی برای ساخت پنیسیلینهای سنتتیک ترکیب میشود. تعدادی باکتری با تولید آنزیمهای بتالاکتاماز، حلقه بتالاکتام پنیسیلین را شکسته و آن را غیرفعال میکنند.
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
دستکم برای ساخت پنیسیلینهای نیمه صنعتی، سه هدف اصلی دنبال میشود:
اول، تهیه پنیسیلینهای مقاوم به اسید که بتوان آنها را بهصورت خوراکی تجویز کرد. عفونتهای قابل درمان با پنیسیلین بیشتر در کودکان ایجاد میشود و تجویز خوراکی آن برای آنها و والدینشان بهترو راحتتر است.
دوم، برخی از سویههای باکتریهایی که به درمان با پنیسیلین حساس بودند، بعداً به آن مقاوم میشوند. این کسب مقاومت اکتسابی ناشی از توانایی باکتری برای تولید یک آنزیم (پنیسیلیناز) است که پنیسیلین G را به واسطه شکستن حلقه بتالاکتام غیرفعال میکند.
امروزه آنزیم پنیسیلیناز بهعنوان عضوی از یک گروه بزرگ آنزیم بتالاکتاماز است که تعداد زیادی از آنتیبیوتیکهای بتالاکتام را غیرفعال میکند. محققین متوجه شدند که گروه Rی که به پنیسیلین متصل میشود، پنیسیلین را از هیدرولیز توسط بتالاکتامها محافظت کرده و امکان رسیدن آنها به هدف ترانس پپتیداز را میدهد.
سوم، پنیسیلین V و Gدامنه اثر کمی دارند. درحالیکه بر ضد بیشتر باکتریهای گرم مثبت مؤثرند، تنها بر ضد تعداد کمی از باکتریهای گرم منفی فعالیت میکنند. محققین برای جانشینی گروه R، دنبال موردی هستند که به پنیسیلینها اجازه کشتن باکتریهای گرم منفی باسیل رودهای و سودوموناس ائروژینوزا را بدهد.
امروزه سه گروه پنیسیلین نیمه صنعتی در دسترس است: پنیسیلینهای مقاوم به پنیسیلیناز، پنیسیلینهای وسیع الطیف و پنیسیلینهای ضدسودوموناسها.
(1) پنیسیلینهای مقاوم به پنیسیلیناز. برای درمان سویههای اورژانسی استافیلوکوک که به پنیسیلین G مقاومند، یک سری پنیسیلین مقاوم به پنیسیلیناز طراحی شده است. این سری شامل متیسیلین، نافیسیلین[12]، ایزوکسازیل پنیسیلین[13] (اگزاسیلین[14]، گلوکزاسیلین[15]، دی گلوکزاسیلین[16] و فلوکلوگزاسیلین[17]) هستند. این پنیسیلینها نسبت به پنیسیلین G سمیترند و فعالیت کمتری دارند، ولی نسبت به هیدرولیز شدن توسط بتالاکتامازهای استافیلوکوکی، مقاوم هستند.
هرچند متیسیلین در درمان عفونتهای استافیلوکوکی استفاده میشود، ولی امروزه ارزش آن با پیدایش استافیلوکوکهای اورئوس مقاوم به متیسیلین، کاهش یافته است.
(2) پنیسیلینهای وسیعالطیف. دومین گروه از پنیسیلینهای نیمه صنعتی، پنیسیلینهای وسیعالطیفی هستند که علیه باکتریهای گرم منفی هم مؤثر میباشند. این گروه شامل آمینوپنیسیلین[18] (آمپیسیلین[19]، آموکسیسیلین[20]، بک آمپیسیلین[21]) و آمیدینوسیلین (پیوی میسیلینام) است.
آمیدینوپنیسیلین بر ضد بیشتر باکتریهای گرم منفی مؤثر است. این آنتیبیوتیک تقریباً نصف پنیسیلین G بر ضد باکتریهای گرم مثبت مؤثر است. گروه آمینی آمیدینوپنیسیلین به آن امکان میدهد که از شارژ منفی غشاء خارجی باکتریهای گرم منفی عبور نماید؛ بنابراین، این آنتیبیوتیک، علاوه بر وسیعالطیف بودن، مقاوم به اسید است و به صورت خوراکی مصرف میگردد.
تنها محدودیت کاربرد این آنتیبیوتیکها علاوه بر مؤثر نبودن روی سودوموناس ائروژینوزا این است که بهوسیله آنزیمهای بتالاکتاماز هیدرولیز میشوند. آمینوپنیسیلینها بر ضد سویههای غیر تولیدکننده بتالاکتاماز اشریشیا کلی، هموفیلوس آنفلوانزا، پروتئوس، سالمونلا و شیگلا مؤثر است.
آمیدینوپنیسیلین از این جهت که شدیداً علیه اشریشیا کلی، انتروباکتر و کلبسیلا مؤثر بوده و بر ضد باکتریهای گرم مثبت مؤثر نیست، آنتیبیوتیک غیرمعمولی است. مطالعات نشان داده که دوز موردنیاز آمیدینوپنیسیلین جهت کشتن بعضی از باکتریهای گرم مثبت 60 برابر بیشتر از میزانی است که برای کشتن اشریشیا کلی نیاز است. آمیدینوپنیسیلین روی سودوموناس ائروژینوزا اثری ندارد.
(3) پنیسیلینهای ضد سودوموناس. امروزه سه نوع پنیسیلین ضدسودوموناس ائروژینوزا تجویز میشود: کربوکسی پنیسیلین[22]، پیپرازین پنیسیلین[23] و یوریدو پنیسیلین[24].
اولین پنیسیلینهای ضد سودوموناسی، کاربنیسیلین[25] و تیکارسیلین[26] (که کربوکسی پنیسیلین هستند)، بودند. این دو آنتیبیوتیک بر روی گرم مثبتها اثری نداشته، ولی بروی باسیلهای رودهای و سودوموناسها بهخوبی مؤثر هستند. پیپرازین پنیسیلین مثل پیپراسیلین[27] و یوریدو پنیسیلینها، نظیر مزلوسیلین[28] و آزلوسیلین[29] حتی از کربوکسی پنیسیلینها نیز مؤثرترند و علاوه بر اثر بروی باکتریهای گرم مثبت، بهPBP باکتریهای گرم منفی تمایل زیادی دارند.
متأسفانه، پنیسیلینهای ضدسودوموناس به بتالاکتامازها حساسند و باید با احتیاط تجویز شوند. این دسته از آنتیبیوتیکها، عموماً از پیشسازهایشان سمیتر هستند.
(4) ترکیبها و مشابههای پنیسیلین. باید به دو موضوع در بحث پنیسیلینهای وسیعالطیف و ضد سودوموناسی که اثر این آنتیبیوتیکها را مشخص میکند، توجه داشت:
اولین مسئله، پنیسیلینهای ضد سودوموناسی و آنتیبیوتیکهای آمینوگلیکوزیدی را میتوان همزمان مصرف کرد. آمینوگلیکوزیدها آنتیبیوتیکهای نسبتاً سمی میباشند که سنتز پروتئین را مهار میکنند و بیشتر علیه باسیلهای گرم منفی مؤثر هستند. تأثیر آنها مستقیماً بستگی به مقدار آنتیبیوتیکی که در یک باکتری حساس تجمع مییابد، دارد. اگر عفونت توسط باسیلهای گرم منفی رخ دهد، آن به پنیسیلین یا یک آمینوگلیکوزید نسبتاً غیرحساس است، ولی ممکن است نسبت به ترکیب دو آنتیبیوتیک پاسخ دهد.
این دو آنتیبیوتیک وقتی با هم مصرف میشوند، اثر سینرژیسمی دارند. به نظر میرسد که پنیسیلین سبب افزایش نفوذپذیری باکتری برای آمینوگلیکوزیدها شده و آمینوگلیکوزیدها عوامل باکتریوسیدال هستند. این فعالیت سینرژیکی به آمینوگلیکوزیدها امکان میدهد که در غلظتی کمتر از آستانه سمی دارو، برای بیمار تجویز شوند.
دومین مسئله، حول پیشرفت مولکولهای پنیسیلینی دور میزند که نسبتاً فعالیت ضد میکروبی کمتری دارند اما میتوانند بتالاکتامازها را غیرفعال کنند. به نظر میرسد که بتالاکتامازها، حلقه بتالاکتام آنالوگهای پنیسیلین را میشکنند و یک کمپلکس ثابت اما غیرفعال با حلقه بتالاکتام ایجاد میکنند. این مکانیسم را خودکشی[30] از طریق غیرفعال شدن میگویند.
سه آنالوگ پنیسیلین بهصورت تجاری در دسترس قرار دارد:
کلاولانیک اسید[31]، سولباکتام[32] و تازوباکتام[33] (شکل 4).
کلاولانیک اسید بهوسیله استرپتوماسیس کلاوولی گروس[34] و سولباکتام از 6– آمینوپنیسیلین اسید ساخته میشود. امروزه ترکیب پنیسیلینها و آنالوگهای آن بهصورت آمپیسیلین/سولباکتام، آموکسی سیلین/کلاوولانات، تیکارسیلین/کلاوولانات و پیپراسیلین/تازوباکتام وجود دارد؛ مثلاً ترکیبهای آمپیسیلین/سولباکتام و آموکسی سیلین/کلاوولانات سبب افزایش طیف اثر بر روی سویههای تولیدکننده بتالاکتام مانند باکتروئیدس فراژیلیس، انتروباکتر، اشریشیا کلی، هموفیلوس دوکرهای، هموفيلوس آنفلوانزا، موراکسلا کاتارالیس، نایسریا گونورهآ، پروتئوس، پروویدنسیا، استافیلوکوک اپیدرمیدیس و استافیلوکوک اورئوس حساس به متیسیلین میشود.
شکل 4. ساختمان کلاولونیک اسید، سولباکتام و تازوباکتام
این آنالوگهای پنیسیلین دارای فعالیت ضد باکتری ضعیف بوده، اما بازدارنده رقابتی واقعی بیشتر بتالاکتامازها هستند. آنها در ترکیب با پنیسیلینهای وسیعالطیف برای درمان عفونتهای ایجادشده بهوسیله باکتریهای تولیدکننده پنیسیلیناز مورد استفاده قرار میگیرند
سایر آنتیبیوتیکهای شبه پنیسیلین
توسط محققین دو کلاس جدیدتر آنتیبیوتیکهای شبه پنیسیلین با استفاده از رادیکالهای متفاوت در تولید آنتیبیوتیکهایی که دارای حلقه بتالاکتام هستند ولی بسیار متفاوت از پنیسیلینهای استاندارد به نظر میرسند، به وجود آمده است. این آنتیبیوتیکها، کارباپنمها و مونوباکتامها نام دارند.
(1) کارباپنمها. کارباپنمها از مشتقات صنعتی تینامایسین هستند که توسط باکتری استرپتوماسیس کاتلیا[35] تولید میشوند. اگرچه تینامایسین برای مصرف انسانی مناسب نیست، اما یکی از مشتقات فورمی میدول آن که ایمیپنم نام دارد، وسیعالطیفترین آنتیبیوتیک بتالاکتامی است که در دسترس است.
کارباپنم دارای ساختمان دو حلقهای شامل یک حلقه بتالاکتام و یک حلقه پنج كربنه است که بجای C استخلاف 1 در حلقه پنج كربنه، يك S قرار گرفته و حلقه اشباع نيست. ایمیپنم با باند شدن محکم به PBP-1 وPBP-2، از ترانس پپتیداسيون ممانعت میکند. اين آنتیبیوتیک در حضور بسیاری از بتالاکتامازها، مثل بتالاکتامازهای کلاس I کروموزومی که سفالوسپورینهای نسل سوم را تجزیه میکنند، پایدار است.
ایمیپنم بهخوبی در باکتریهای گرم منفی نفوذ میکند و بر ضد بیهوازیها مؤثر است؛ بنابراین، بر ضد سویههای تولیدکننده بتالاکتاماز یعنی اسینتوباکتر، لیستریا، نایسریا گونورهآ، نایسریا مننژیتيدیس، سودوموناس ائروژینوزا، استرپتوکوک پنومونیه، باکتریهای رودهای گرم منفی و تعدادی از بیهوازیهای اجباری مؤثر است. البته بر ضد بورخولدریا سپاسیا، انتروکوکوس فاسیوم، استنوتروفوموناس (گزانتوموناس) مالتوفیلیا یا باکتریهای درون سلولی اجباری تأثیری ندارد.
به نظر میرسد که مقاومت استنوتروفوموناس به ایمیپنم، براثر تولید یک بتالاکتاماز خاص است. ایمیپنم اگرچه اغلب بهعنوان یک عامل کشنده علیه انتروکوکوس فکالیس مؤثر نیست، ولی بهعنوان یک عامل استاتیک بر ضد این باكتری عمل میکند.
ایمیپنم سبب القاء بیان کروموزمی بتالاکتاماز کلاس I میشود. اين امر وقتی آنتیبیوتیک به تنهایی مصرف میشود، مشکلزا نیست، زیرا ایمیپنم توسط این آنزیمها تجزیه نمیشود. البته، در تجويز همزمان اين آنتیبیوتیک با سفالوسپورینها ممکن است مشکل حاصل شود، چرا که بتالاکتاماز کلاس I که با کلاوولانات، یا سولباکتام غیرفعال نمیشود، میتواند تمام سفالوسپورینها را غیرفعال نماید.
طیف اثر ایمیپنم میتواند در مصرف همزمان با یک آمينوگلیکوزید افزایش یابد. ایميپنم در سلولهای پرزدار پروکسیمال توبولار کلیوی توسط دهیدروپپتیدازI[36] غیرفعال میشود. سیلاستاتین[37] كه یک مهارکننده اختصاصی دهیدروپپتیداز I است، با ایمیپنم به نسبت 1 به 1 برای مهار غیرفعالسازی ایمیپنم مصرف میشود و خطر نکروز توبولار کلیوی را کاهش میدهد.
ایمیپنم/ سیلاستاتین براي كساني که ضایعات اعصاب مرکزی دارند (مثل ضربه مغزی یا جراحات سر) نباید تجویز شود. همچنین برای کسانی که سابقه تشنج، یا مشکلات نارسایی کلیوی دارند، نباید این آنتیبیوتیک را تجويز کرد چرا که گزارشها نشان میدهد، 12 درصد تا 30 درصد این بیماران در نتیجه این درمان دچار تشنج شدهاند.
به دلیل تمایل ایمیپنم به ایجاد حمله ناگهانی در این بیماران و به دلیل هزینه بالای آن، عموماً این آنتیبیوتیک در بیمارانی که دچار عفونتهای بیمارستانی حاصل از چند پاتوژن شدهاند، تجویز میشود.
مروپنم، کارباپنم دیگري است كه اخیراً در ایالات متحده آمریکا مورد استفاده قرار میگیرد، اگرچه در مورد طیف اثر شبیه ایمیپنم است، ولی این آنتیبیوتیک میتواند، بدون سیلاستاتین مصرف شود و خطر تشنج کمتری دارد.
(2) مونوباکتامها. اولین آنتیبیوتیک مونوباکتام، آزترونام است. مونوباکتام را به این دلیل، چنین مینامند که فقط دارای یک حلقه است و هسته مرکزی آن 3- آمینوباکتامیک اسید[38] است. آزترونام برخلاف ایمیپنم، آنتیبیوتیکی با طیف باریک است و با اتصال به PBP-3، سبب مهار تقسیم سلولی میشود و بهطور ضعیف و یا ناقص به PBP گرم مثبتها و بیهوازیها متصل میگردد. در حضور آزترونام، باکتریهای گرم منفی اول بهصورت رشتههای طویل رشد میکنند و بعد میمیرند.
آزترونام در حضور بتالاکتاماز بسیاری از گرم منفیها پایدار است، اما توسط بتالاکتامازهایی که توسط پلاسمیدها کد میشوند (SHV-2,TEM-7,TEM-5, TEM-3) و غیرفعالكننده سفالوسپورینهای نسل سوم (سفوتاکسیم و سفتازیدیم) هستند، غیرفعال میشوند.
طیف اثر آزترونام بعضی اوقات در استفاده همزمان با پنیسیلینهای ضد باکتریهای گرم مثبت (مثل نفیسیلین یا گلوکزاسیلین) یا به همراه یک آمینوگلیگوزید وسیعتر میشود. آزترونام بر روی نايسريا گونورهآ، نايسريا مننژیتیدیس، سودوموناس ائروژینوزا و بیشتر باکتریهای گرم منفی رودهای مؤثر است. به نظر میرسد که بیمارانی که به پنیسیلین حساسیت دارند به آزترونام حساسیت نداشته باشند.
[1] -Carbapenems
[2] -Cephamycins
[3] -Monobactams
[4] -Glycopeptide antibiotics
[5] -Bacitracin
[6] -Cycloserine
[7] -Amdinocillin
[8] -Pivmecillinam
[9] -Aztreonam
[10] -Poison Ivy
[11] -6-aminopenicillanic acid
[12] -Nafcillin
[13] -Isoxazolyl penicilins
[14] -Oxacillin
[15] -Cloxacillin
[16] -Dicloxacillin
[17] -Flucloxacillin
[18] -Aminopencillin
[19] -Ampicillin
[20] -Amoxicillin
[21] -Bacampicillin
[22] -Carboxypenicillins
[23] -Piperazine penicillins
[24] -Ureidopenicillins
[25] -Carbenicillin
[26] -Ticarcillin
[27] -Piperacillin
[28] -Mezlocillin
[29] -Azlocillin
[30] -Suicide inactive
[31] -Clavulanic acid
[32] -Sulbactam
[33] -Tazobactam
[34] -Streptomyces clavuligerus
[35] Streptomyces cattleya
[36] Dehydropeptidase-1
[37] cilastatin
[38] 3-aminobactamic acid
بخش سوم
ادامه مبحث آنتیبیوتیکهای مهارکننده سنتز دیواره سلولی
در بخش گذشته در خصوص گروهی از آنتیبیوتیکهای مهارکننده سنتز دیواره سلولی یعنی خانواده پنیسیلینها بهطور مفصل بحث گردید. در این بخش به دیگر آنتیبیوتیکهایی که مانع سنتز دیواره سلولی میشوند و بسیار هم رایج هستند اشارهای کوتاه میگردد.
سفالوسپورینها، سفامایسین و آنتیبیوتیکهای وابسته:
سفالوسپورینها و همخانواده آنها، سفامایسینها، گروه بزرگی از آنتیبیوتیکهای بتالاکتام را تشکیل میدهند.
سفالوسپورینها نیمه سنتتیک هستند و از 7- آمینوسفالوسپورانیک اسید[1] مشتق شدهاند و دارای حلقه بتالاکتام و حلقه شش عضوي دی هیدروتیازین میباشند (شكل 1).
سه گروه R به هر سفالوسپورین متصل است:
گروه 1 R به همان سایت گروه R پنیسیلین متصل میشود و تفاوت در این گروه، بر فعالیت ضدمیکروبی آنتیبیوتیک از طریق پایدار شدن آن در برابر بتالاکتامازهای خاص، اثر میگذارد.
گروه 2 R که به محل 3 حلقه دی هیدروتیازین چسبیده، تأثیر بر روی متابولیسم و خواص فارماکوکینتیک دارو دارد.
چند سفالوسپورین و تمام سفامایسین ها گروه R سومی هم دارند که به حلقه بتالاکتام چسبیده است. این گروه آنتیبیوتیک را در برابر فعالیت بسياري از بتالاکتامازها مقاوم میسازد.
هسته سفالوسپورین (7-آمینوسفالوسپورانیک اسید) توسط کپک سفالوسپورینوم آکرومونیوم[2] ترشح میشود. هرکدام از سفامایسینها که بهواسطه داشتن یک گروه 7-α- متوکسی با سفالوسپورینها فرق میکنند، بهصورت نیمهصنعتی از منابع مختلف مشتق شدهاند.
سفوكسیتين از سفامايسين C، سفوتتان از ارگانومايسين G و سفمتازول از آمینوسفالوسپورانیک اسید مشتق شدهاند. سفالوسپورینها نسبت به عمل پنیسیلیناز مقاومند و بعضی از سفالوسپورینها (نسل سوم) در برابر غیرفعال شدن توسط بتالاکتامازها بجز بتالاکتامازهای کلاس I کروموزومی و یک کلاس جدید از بتالاکتاماز کد شونده توسط پلاسمیدها که فقط در باکتریهای کمی یافت میشوند، مقاومت میکنند.
سفالوسپورینها بر اساس تأثیر بر باکتریهای گرم منفی، به سه گروه یا نسل اصلی تقسیم میشوند. پیشرفتهای اخیر در تولید سفالوسپورینها منجر به پیدایش نسل چهارم نیز شده، اما این تقسیمبندی هنوز بهطور وسیع مورد قبول واقع نشده است. مثالهایی از اختلاف ساختمانی كه سبب اختلاف در نسلهای مختلف سفالوسپورینها است، در شكل 1 ارائه شده است.
شکل 1: هسته سفالوسپورینها و مثالهایی از ساختمان سفالوسپورینهای نسل اول و دوم و سوم و سفامایسین
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
(1) سفالوسپورینهای نسل اول:
سفالوسپورینهای نسل اول، اولین سفالوسپورینهايي بودند كه تولید شدند. این آنتیبیوتیکها ابتدا بر روی دستهای از باکتریهای گرم مثبت مثل پنوموککها، استرپتوکوکها، کلستریدیوم پرفرنژنز، کورینه باکتریوم دیفتریه، استافیلوکوکوس اپیدرمیدیس و استافیلوکوکوس اورئوس حساس به متیسیلین مؤثر بودند و بر روی سایر گروههای گرم مثبت که به تمام نسلهای سفالوسپورین مقاومند، مثل انتروکوکوس فکالیس، لیستریا منوسیتوژنز و استافیلوکوکوس اورئوس مقاوم به متیسیلین مؤثر نیستند.
همچنین نسل اول سفالوسپورینها بر روی سویههای تولیدکننده بتالاکتاماز استرپتوکوک پنومونیه اثری ندارند. طیف کلینیکي فعالیت سفالوسپورینهاي نسل اول بر ضد باکتریهای گرم منفی محدود به باکتریهای رودهای اشريشیا کلی، کلبسیلا و پروتئوس میرابیليس است. بیشتر سفالوسپورینهای خوراکی از گروه نسل اول هستند.
(2) سفالوسپورینهای نسل دوم:
سفالوسپورینهاي نسل دومی از سفالوسپورینهاي نسل اول بیشتر اصلاح شدهاند. بعلاوه، بیشتر سفامایسینها، مشابه سفالوسپورینهاي نسل دوم هستند. سفالوسپورینهاي نسل دوم بر روی باکتریهای گرم منفی مؤثرتر هستند و تأثیر آنها بر روی باکتریهای گرم مثبت، مشابه یا فقط کمی کمتر از سفالوسپورینهاي نسل اول است. سفوروکسیم بیشترین تأثیر بر روی سویههای تولیدکننده بتالاکتاماز هموفيلوس انفلوانزا و نایسریا مننژیتیدیس (دو عامل عمده مننژیت کودکان) را داشته است. بعلاوه سفوتتان و سفوکسیتین بر روی نایسریا گونورهآی که تولید پنیسیلیناز میکند، نیز تأثیر دارند.
سفوتتان و سفومایسین که بسیاری آنها را جزو سفالوسپورینهاي نسل سوم میدانند، بر روی باکتریهای رودهای (مثل اشریشیا کلی، کلبسیلا یا پروتئوس) بسیار مؤثر هستند.
البته سفالوسپورینهاي نسل دوم زیاد برای درمان باکتریهای گرم مثبت توصیه نمیشوند، زیرا خیلی گرانتر از سفالوسپورینهاي نسل اول هستند و بیشتر بهصورت جانبی مصرف میگردند. نسل دوم سفالوسپورینها، روی سودوموناس ائروژینوزا مؤثر نیستند.
(3) سفالوسپورینهای نسل سوم:
بسیاری از سفالوسپورینهاي نسل سوم در مقابل فعالیت بتالاکتامازها مقاومند، چراکه دارای گروههای R بزرگتر و غیرمعمول میباشند. اگرچه اثر این آنتیبیوتیکها، بر ضد باکتریهای گرم منفی از تمام نسلهای سفالوسپورینها بیشتر است، اما آنها تأثیر کمی بر باکتریهای گرم مثبت دارند. معمولاً، نسل سوم بیشتر بر ضد باکتریهای گرم منفی نظیر نایسریا گونورهآ (سویههای تولیدکننده پنیسیلیناز)، نایسریا مننژیتیديس، هموفيلوس انفلوانزا، موراکسلا کاتارالیس و بیشتر باکتریهای رودهای (مثل بیشتر سویههای سیتروباکتر، اشريشیا کلی، کلبیسلا، مورگانلا، پروتئوس، پروویدنسیا، سالمونلا و شیگلا) مؤثر است.
اثر عالی سفالوسپورینهاي نسل سوم بر روی این باکتریها به دلیل تمایل زیاد اين آنتیبیوتیکها به PBP باکتریهای گرم منفی و مقاومت غیرمعمولشان در برابر غیرفعالسازی با بتالاکتامازها است. سفالوسپورینهای نسل سوم توسط بتالاکتامازهای کلاس I کروموزومی (که توسط بعضی از سویههای سیتروباکتر، انتروباکتر و سودوموناس تولید میشود) غیرفعال میگردند، اما در برابر غیرفعال شدن توسط بیشتر بتالاکتامازها مقاومت میکنند. سفتازیدین قویترین فعالیت را و سفوپرازون فعالیت ملايمي بر ضد سودوموناس دارند.
(4) سفالوسپورینهای نسل چهارم:
شامل سفالوسپورینهای پیشرفته جدید نظر سفيپیم و سفپرین میباشند. اگرچه این داروها از نظر فعالیت علیه باکتریهای گرم منفی مشابه سفالوسپورینهاي نسل سوماند، اما از نظر تأثیر بر باکتریهای گرم مثبت شدیداً شبیه سفالوسپورینهاي نسل اول هستند.
بعضی پزشکان و داروسازان به سفالوسپورین نسل چهارم اعتمادی ندارند، ولی برخی، آنها را نظیر سفالوسپورینهاي نسل سوم، منتها با اثر وسیعتر بر روی باکتریهای گرم مثبت میدانند. در ضمن این آنتیبیوتیکهای جدید، تمایل کمتری از سفالوسپورینهاي نسل سوم به بتالاکتامازهای کلاس I دارند.
عوارض سفالوسپورینها آنافیلاکسی، نفریت، گرانولوسیتوپنی، آنمی همولیتیک، ترومبوفلیت است.
(5) موکسالاکتام و لوراکاربف:
آنتیبیوتیکهای موکسالاکتام و لوراکاربف از خویشاوندان نزدیک سفالوسپورینها هستند. موکسالاکتام به واسطه داشتن یک اکسیژن در کربن یک حلقه ششوجهی خود، با سفالوسپورینها فرق میکند، درحالیکه لوراکاربف در همان محل، یک کربن دارد؛ بنابراین موکسالاکتام یک اوگزاسفام[3] و لوراکاربف یک کرباسفام[4] هستند. موکسالاکتام از لحاظ طیف اثر شبیه سفالوسپورینهای نسل سوم است؛ اما بندرت برای درمان انتخاب میشود، زیرا مصرف آن سبب ناهنجاریهایی در خونریزی میشود.
اين آنتیبیوتیک اكنون در ایالات متحده آمريكا مصرف نمیشود. لوراکاربف یک آنتیبیوتیک خوراکی است که از نظر طیف اثر بسیار شبیه سفالوسپورینهاي نسل اول و دوم است و بیشتر برای درمان عفونت گوش میانی در کودکان مصرف میشود.
مقاومت به آنتیبیوتیکهای بتالاکتام:
مقاومت اکتسابی باکتریها به آنتیبیوتیکهاي بتالاکتام، احتمالاً از طريق جهش ژنهای کروموزومی یا انتقال از راه پلاسمید بدست آمده است. عموماً تغییرات وابسته به کروموزوم در حساسیت به آنتیبیوتیکهای بتالاکتام شامل تغییر در نفوذپذیری آنتیبیوتیک یا تغییر در توانایی PBPها برای شناسایی آنتیبیوتیکها است؛ اما بعضی از بتالاکتامازها توسط کروموزوم کد میشوند. مقاومت کد شده توسط پلاسمید نسبت به بتالاکتامها، همیشه بهصورت معرفی یک ژن بتالاکتاماز است.
(1) تغییر در نفوذپذیری باکتری: نفوذپذیری باکتریها نسبت به بتالاکتامها ممکن است در اثر تغییر در پورینها یا تغيير در لیپوپلیساكاریدهای غشاء خارجی، کاهش یابد. غشاء خارجی باکتریهای گرم منفی بهصورت غیر قرینه است، یعني پورینها و لیپوپلیساکارید در قسمت خارجی آن قرار دارند.
اشريشیا کلی حدود 105× 1 مولکول پورین در هر سلول دارد كه میتواند بهصورت کانالهای بزرگ (OmpF) یا کوچک (OmpC) باشد. در ابتدا، وقتی كه غشاء خارجی اشریشیا کلی دارای کانالهای OmpC شده است، کاربنیسیلین و سایر داروهایی که معمولاً به آهستگی نفوذ میکنند، بهطور اساسی قادر به ورود به باکتری نیستند. برخلاف سویههای اشریشیا کلی، سویههای انتروباکتر کلوآكه و سودوموناس ائروژینوزا بهوضوح با تغییر در ترکیب لیپوپلیساکاریدشان در مورد حساسیت به پنیسیلین با اشریشیا کلی تفاوت دارند.
(2) تأثیر بتالاکتامازها: پردردسرترين مکانیسمهای مقاومت به آنتیبیوتیک، متعلق به بتالاكتامازها بوده است. يك بتالاکتاماز، آنزیمی است که بهصورت غیرکووالانت به آنتیبیوتیکهاي بتالاکتام باند میکند و با تشکیل یک پیوند کووالانت، سبب هیدرولیز باند آمیدی حلقوی حلقه لاکتام و آزاد شدن آنتیبیوتیک تغییریافته (غیرفعال) میگردد. بتالاکتامازها براي آنتیبیوتیکهای بتالاکتام، با PBPها رقابت میکنند.
امروزه بیشتر از 80 نوع بتالاکتاماز شناخته شده که هر کدام الگو، اختصاصیت و تمایل مربوط به خود را دارند. اگرچه بتالاکتامازها در بین باکتریهای گرم مثبت و منفی بسیار پخش شدهاند، اما به نظر میرسد که توزیع آنها بهصورت چند دستهبندی بزرگ است که دو نوع طبقهبندی زیر بسیار معمول است.
اولین سیستم، بر اساس اندازه مولکول و همولوژی آنها، بتالاکتامازها را به سه گروه بزرگ (تیپ A,B,C) تقسیمبندی میکند.
این سیستم زیرمجموعه سیستمهای M.H.Richmond R.B.Sykes است.
سيستم Richmond-Sykes بتالاکتامازها را بر اساس نوع سوبسترا و مطالعات مهاری طبقهبندی میکند. بتالاکتامازهای باکتریهای گرم مثبت که در این سیستم در یک کلاس واحد قرار دارند، آنزیمهایی هستند که به مقدار زیاد تولید شده و به محیط خارج ترشح میشوند، بطوریکه در خارج سلول میتوانند، بتالاکتامها را غیرفعال کنند. در این حالت، آنها از باکتریهایی که خودشان بتالاکتاماز تولید نمیکنند، نیز حفاظت میکنند.
این پدیده اثر تلقيح[5] نامیده میشود و به هر آنزیم غیرفعالکننده آنتیبیوتیکی که توسط باکتریهای مقاوم به محیط ترشح میشود، مرتبط است. در باکتریهای گرم منفی، بتالاکتامازها به شش کلاس اصلی تقسیم میشوند. احتمالاً مهمترین بتالاکتامازهای سیستم ريچموند- سایکس در كلاس I قرار دارند. بتالاکتامازهای کلاس I توسط کلاوولانات یا سولباکتام مهار نمیشوند و بعضی از آنها، سفالوسپورینهای نسل سوم را میتوانند هیدرولیز نمایند.
بیشتر بتالاکتامازها ساختمانیاند، اما بتالاکتامازهای استافیلوکوکی و کلاس I توسط سفامندول، سفوکسیتین و ایمیپنم القاء میشوند. بتالاکتامازهای کلاس II تا کلاس IV همگی توسط کلاولانات یا سولباکتام مهار میشوند. این بتالاکتامازها به میزان کم تولید شده و محدود به فضای پریپلاسمیک هستند؛ بنابراین نفوذپذیری غشاء خارجی بسیار بر عملکرد آنها اثر میگذارد و اثر تلقیحی نیز وجود ندارد. اگر تغییری در پورین روی دهد که سبب کم شدن نفوذپذیری شود، تأثیر بتالاکتامازها احتمالاً به میزان زیادی افزایش مییابد.
(3) تغییر در افینیتی اهداف آنتیبیوتیک: سومین مکانیسم مقاومت به آنتیبیوتیکهای بتالاکتام شامل تغییر در تمایل PBPها نسبت به آنتیبیوتیکهای بتالاکتام است. بزرگترین ضربه کلینیکی حاصل از این مکانیسم، ظهور استافیلوکوک اورئوسهای مقاوم به پنیسیلین بوده است. سایر باکتریهایی که مقاومتشان نسبت به بتالاکتامها به دلیل تغییر در PBP است عبارتند از: کلستریدیوم پرفرنژنز (مقاومت به تمام پنیسیلینها)، هموفيلوس انفلوانزا و سراشیا (مقاومت به سفالوسپورینهاي نسل سوم و بعضی از پنیسیلینها) و نایسریا گونورهآ و استرپتوکوک پنومونیه (مقاومت به پنیسیلین G).
(4) نقص در القاء اتولیز: به نظر میرسد که بعضی از باکتریها نسبت به بتالاکتامها تحمل پیدا کردهاند. آنتیبیوتیکهای بتالاکتام در این باکتریها نمیتوانند آنزیمهای اتولیتیک را القا كنند و نسبت MBC به MIC بیشتر یا مساوی 32 است. این بدان معنی است که پنیسیلین یا سفالوسپورین بیشتر از اينكه باکتریوسید باشد، باکتریواستاتیک است، مگر اینکه میزان بسیار زیادی آنتیبیوتیک مصرف شود.
این امر در درمان افراد با ایمنی سرکوب شده و یا بیماران نوتروپنی مشکل ایجاد میکند. باکتریهایی که گاهگاهی تحمل به بتالاکتاماها را نشان میدهند عبارتند از: لیستریا منوسیتوژنز، استافیلوکوکوس اورئوس، استافیلوکوکوس اپیدرمیدیس، استرپتوکوکوس آگالاکتیه و استرپتوکوکوس سانگوئیس. تمام این باکتریها گرم مثبت هستند.
وانکومایسین و سایر آنتیبیوتیکهای گلیکوپپتیدی
ویژگی:
وانکومایسین اولین آنتیبیوتیک گلیکوپپتیدی است كه در اواخر دهه 1950 بهعنوان روش جديدي در درمان عفونتهای استافیلوکوکی مقاوم به پنیسیلین G معرفی شد. از آنجا که وانکومایسینهای اولیه، نسبتاً خالص نبودند، پزشکان دریافتند که سمیت آنتیبیوتیک برای مصرف قابل قبول نیست. بهزودی وانکومایسین با پنیسیلینهای مقاوم به بتالاکتاماز و سفالوسپورینها جایگزین شد. با ظهور استافیلوکوک اورئوسهای مقاوم به متیسیلین و سایر کوکسیهای گرم مثبت بسیار مقاوم، دوباره وانکومایسین به یکی از مهمترین آنتیبیوتیکها تبدیل شد.
علاوه بر وانکومایسین، اکنون فامیل گلیکوپپتید شامل تیکوپلانین، ریستوستین و راموپلانین است. در حالی که وانکومایسین و تیکوپلانین بهصورت تجاری، مصارف انسانی قرار دارند، راموپلانین فقط بهصورت داروی تحقیقاتی قابل دسترسی است. ریستوستین نیز برای مصرف کلینیکی بسیار سمی است، اما اغلب در آزمایشگاههای هماتولوژی بهعنوان یک ماده تجمعدهنده پلاکت مصرف میشود
آنتیبیوتیکهای گلیکوپپتیدی بزرگ هستند و آنتیبیوتیکهای کمپلکس توسط گونههای اکتینوپلان[6] و استرپتومایسس[7] تولید میشوند و هرکدام دارای یک ریشه 7 اسیدآمینهای در هسته خود هستند که پنج تا از اسیدآمینهها در تمام گلیکوپپتیدها یکسان است. ساختمان تيكوپلانين در شكل 2 توضيح داده شده است.
شکل 2- ساختمان و مکانیسم اولیه فعالیت تیکوپلانین (یک آنتیبیوتیک گلیکوپپتیدی)
شکل A ساختمان شیمیایی تیکوپلانین را نشان میدهد.
شکل B مکانیسم اولیه فعالیت مهار، ارائه N–استیل گلوکز آمین–N– استیل مورامیک اسید
(GlcNAC – urNAC) بهوسیله باکتوپرنول دی فسفات به نقطه رشد مورین (پپتیدوگلیگان) را نشان میدهد.
دیاگرام C نشان میدهد که اغلب، گلیکوپپتیدها بهطور کامل واکنش ترانس پپتیداسیون را متوقف میسازند.
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
مکانیسم عمل دارو:
از آنجایی که گلیکوپپتیدها مولکولهای بزرگی هستند، نمیتوانند از غشاء خارجی باکتریهای گرم منفی یا غشاء سیتوپلاسمی باکتریهای گرم مثبت بگذرند، بنابراین، فعالیت آنها محدود به اتفاقاتی است که در خارج از غشاء سیتوپلاسمی باکتریهای گرم منفی روی میدهد. هر آنتیبیوتیک گلیکوپپتیدی شبیه بازوبندی است که به اهداف خود محکم میچسبد.
مشخص شده که سایت فعال وانکومایسین و تیکوپلانین، تریپپتیدهایی با شکل استروشیمیایی L-D-D را تشخیص میدهند. این ساختمان تریپپتیدی فقط در MurNAC- پنتاپپتید در جایی که یک اسیدآمینه L در موقعیت سوم به دنبال یک D-آلانین قرار دارد، یافت میشود.
وقتی وانکومایسین برای باکتریهای حساس تجویز میشود، ابتدا (از طریق پیوند هیدروژنی) به تمام واحدهای آسیل– D- آلانین– D- آلانین موجود در دیواره سلولی میچسبد. بعد از اشباع این مولکولها، به آسیل– D- آلانین– D- آلانین قطــــــــــــعات GlcNAC-MurNAC که به باكتوپرنول دیفسفات (P-P باکتوپرنول) متصل میباشند و در قسمت خارجی غشاء سیتوپلاسمی قرار دارند، میچسبد.
در این حالت، وانکومایسین فعالیتش را در دو نقطه اعمال میکند؛ اول، وانکومایسین که به -GlcNAC-MurNAC باکتوپرنل وصل شده، بهعنوان یک جسم اشغالکننده فضا که توانایی ترانس گلیکوزیداز پپتیدوگلیکان را مهار میکند، عمل مینماید.
در این حالت دیساکاریدهای کافی به نقطه رشد مورینی (پپتیدوگلیکان) نمیتوانند برسند. دوم، با اتصال وانکومایسین به آسیل- D- آلانین–D- آلانین (دیپپتیدهایی بدون پلهای تقاطعی) مانع کراس لینک آنها میگردد. در تمامی مراحل، اثر آنتیبیوتیک، بستگی به توانایی آن برای محافظت سوبسترای خود از آنزیم مربوطه دارد. عموماً به نظر میرسد، مرحله مهم در تأثیر وانکومایسین، مربوط به توانایی آن برای مهار ارائه واحدهای دیساکارید به نقطه رشد مورینی باشد.
کاربرد و عوارض دارو:
وانکومایسین و تیکوپلانین برای درمان عفونتهای وخیم حاصل از کلستریدیوم دیفیسیل، استافیلوکوک اورئوسهای چند مقاومتی (مثل سویههای مقاوم به متیسیلین)، استافیلوکوکهای کوآگولاز منفی و سویههای تولیدکننده پنیسیلیناز استرپتوکوکوس پنومونیه و استرپتوکوکوس پیوژنز استفاده میشوند.
اگرچه مصرف وانکومایسین گاهگاهی منجر به اتوتوکسیسیته، نفروتوکسیسیته و واکنشهای آزادسازی غیرایمونولوژیکی هیستامین میگردد، ولی موارد بسیار خالص وانکومایسین که بسیار نیز ایمن هستند وجود داشته و در درمان بیماران استفاده میگردد.
مقاومت باکتریها به آنتیبیوتیکهای گلیکوپپتیدی:
مقاومت به آنتیبیوتیکهای گلیکوپپتیدی بیشتر در میان گونههای انتروکوک روی میدهد و مربوط به تولید پروتئین متصل به غشاء سلولی بنام VanA است. VanA یک D- آلانین– D- آلانین لیگاز است و تولید دیپپتیدهای دیگری میکند که در ان-استیل مورامیک اسید میتوانند جانشین D- آلانین– D- آلانین شوند. انتروکوکهای دارای VanA به دلیل نداشتن اهداف D- D برای اتصال به آنتیبیوتیک، به گلیکوپپتیدها مقاوم هستند. VanA از طریق کونجوگیشن به سایر باکتریها منتقل میگردد. عمل پروتئینهای B Van و VanC که کمتر معمول هستند، شبیه به VanA است، با این تفاوت که از طریق کونجوگیشن منتقل نمیگردند.
باسیتراسین و سیکلوسرین
ویژگی و مکانیسم عمل:
پپتیدوگلیکان، تیکوئیک اسید، لیپوپلیساکارید و کپسول متوقف میسازد. سیکلوسرین آنالوگ D- آلانین– D-آلانین است و با عمل مهار رقابتی با آنزیمهای ترانس پپتیداز، مانع تشکیل پلهای تقاطعی در پپتیدوگلیکان میگردد.
کاربرد و عوارض دارو:
مصارف تزریقی، باسیتراسین بسیار سمی است، بنابراین، فقط بهصورت پماد و خوراکی مصرف میگردد. در پمادهای چشمی و پوستی برای درمان عفونتهای استافیلوکوکی و استرپتوکوکی و در قرصهای خوراکی برای درمان کولیت سودوممبران حاصل از كلستريديوم دیفیسیل (یک بیهوازی گرم مثبت)، یافت میشود. وقتی باسیتراسین بهصورت خوراکی مصرف شود، جذب نمیگردد.
سیکلوسرین بهعنوان درمان ثانویه سل استفاده میشود. باید توجه داشت که با مصرف آن احتمال بروز تشنج وجود دارد.
عوامل برهمزننده یکپارچگی غشاء سلولی
آنتیبیوتیکهای پلیمیکسین، آنتیبیوتیکهای بزرگ پلیپپتیدی کاتیونی هستند که دارای اسید چرب، شارژ مثبت و یک زنجیره جانبی آلکیلی بلند میباشند. پلیمیکسین بهصورت یک دترجنت کاتیونیک عمل کرده و محکم به لیپوپلیساکارید و فسفاتیدیل اتانول آمین غشاء خارجی باکتریهای گرم منفی میچسبد.
این آنتیبیوتیک اتصال ضعیفی به فسفاتیدیل کولین که در سلولهای انسانی وجود دارد و در غشاء سلولی باکتریها یافت نمیشود، دارد؛ بنابراین، پلیمیکسینها بر ضد باکتریهای گرم منفی تأثیر دارند. چون این آنتیبیوتیکها یکپارچگی غشاء خارجی را به هم میزنند، آنها بدون نیاز به تقسیم باکتری مورد هدف، باکتریوسیدال هستند.
دو پلیمیکسین در ایالات متحده آمریکا ساخته میشود: پلیمیکسین B و پلیمیکسین E. به دلیل سمیت پلیمیکسینها، در درمان هیچکدام از عفونتهای باکتریایی، داروی انتخابی نیستند. آنتیبیوتیکها بهعنوان درمان ثانویه در عفونتهای وخیم یا طولانی مدت حاصل از سودوموناس ائروژینوزا یا سایر باسیلهای گرم منفی که به درمانهای استاندارد پاسخ نمیدهند، مصرف میشوند.
[1]– 7-Aminocephalosporanic acid
[2]– Cephalosporium acromonium
[3]-Ooxacepham
[4] -Carbacepham
[5]– Inoculum effect
[6]-Actinoplanes
[7] -Streptomyces
آنتیبیوتیکهایی که سنتز پروتئین را مهار میکنند
اصول کلی
برخلاف سلولهای انسانی که دارای ریبوزوم s80 هستند، باکتریها سنتز پروتئینشان را با استفاده از ریبوزوم 70s انجام میدهند. ریبوزوم باکتری از قطعات 50s و 30s تشکیل شده و اطراف mRNA پلیسیسترونی که از روی کروموزوم نسخه برداری شده است را گرفتهاند.
هدف تعدادی از آنتیبیوتیکها، مراحل اختصاصی سنتز پروتئین است که به قطعات 50s یا 30s ریبوزوم وابسته است. از آنجایی که مکانیسم سنتز پروتئین در باکتریها با سلولهای انسانی متفاوت است، این آنتیبیوتیکها برای باکتریها سمیت انتخابی دارند. البته، آنتیبیوتیکهایی که سنتز پروتئین باکتریها را مهار میکنند، ممکن است در غلظت بالا بر روی سنتز پروتئین یوکاریوتی نیز تأثیر بگذارند.
از طرفی، میتوکندری دارای ریبوزوم 70s است. بعضی از آنتیبیوتیکها که به میزان کافی در سلول میزبان تجمع مییابند، میتوانند به بافتهایی (نظیر مغز استخوان) که غنی از میتوکندریاند، صدمه بزنند. بیشتر آنتیبیوتیکهای مهارکننده سنتز پروتئین باکتریواستاتیکاند، البته آمینوگلیگوزیدها در غلظت فیزیولوژیک، برای بیشتر باکتریهای حساس باکتریوساید هستند.
عوامل مؤثر بر زیرواحد 50s ریبوزوم
کلرامفنیکل، ماکرولیدها و لینکوزامیدها بررویزیرواحد 50s ریبوزم اثر میگذارند.
کلرامفنیکل
ویژگی و مکانیسم عمل: کلرامفنیکل (شکل 1) یک آنتیبیوتیک باکتریواستاتیک است که مانع عمل آنزیم پپتیدیل ترانسفراز و تشکیل باند پپتیدی میشود. به دلیل اثر داروهای باکتریواستاتیک، عموماً این داروها در ترکیب با آنتیبیوتیکهای باکتریوساید (مثل بتالاکتام ها یا آمینوگلیکوزیدها) مصرف نمیشوند.
کاربرد و عوارض دارو: کلرامفنیکل از اولین عوامل ضدمیکروبی کشفشده است که مانع سنتز پروتئین میگردد. از آنجایی که کلرامفنیکل یک آنتیبیوتیک وسیعالطیف است و بهخوبی در سلول میزبان تجمع مییابد، بسیاری معتقد بودند که ممکن است گلوله نقرهای[1] باشد و بتواند تمام پاتوژنها را بکشد. همچنین کلرامفنیکل بهخوبی در سیستم اعصاب مرکزی نفوذ کرده و در مایع مغزی نخاعی تجمع مییابد.
در طی اولین سالهای معرفی این دارو، کلرامفنیکل تقریباً یکسره مصرف میشد، اما وقتی برخی بیماران به دنبال مصرف آن، دچار آنمی آپلاستیک شدند، معلوم شد که اغلب از این دارو استفاده مناسب نشده است. امروزه مشخص شده که این توانایی عالی دارو برای نفوذ به سلول میزبان به خودی خود هم مفید و هم مضر است. برخلاف آنتیبیوتیکهای بتالاکتام که خیلی کم به سلول میزبان نفوذ میکنند، کلرامفنیکل بهخوبی در سیتوپلاسم تجمع مییابد.
در این جا هم میتواند باکتریهای درونسلولی را بکشد و هم با سنتز پروتئین میتوکندری تداخل ایجاد کند. همین امر، عامل توانایی کلرامفنیکل برای متوقف و سرکوب کردن فعالیت مغز استخوان و ایجاد آنمی آپلاستیک است. همچنین کلرامفنیکل برای نوزادان نارس سمی است که ممکن است سبب ایجاد سندرم گری در کودکان[2] شود، به همین دلیل، در ایالات متحده آمریکا پزشکان زیاد از کلرامفنیکل برای درمان بیماران استفاده نمیکنند.
البته مصرف مناسب آن سبب درمان عفونتهای ناشی از کلامیدیا سیتاسی (پسیتاکوزیس)، هموفيلوس انفلوانزا (مننژیت)، سویههای ریکتزیا (تب دانهدار کوههای راکی)، تیفوس و سایر بیماریهای ریکتزیائی)، سروتایپ سالمونلا تیفی (تیفوئید)، یرسینیا انتروکولیتیکا (انتروکولیت) و یرسینیا پستیس (طاعون) میشود.
همه این پاتوژنها بهجز هموفیلوس، پاتوژنهای اجباری و اختیاری داخل سلولی هستند. فایده کلرامفنیکل در درمان مننژیت حاصل از هموفيلوس انفلوانزا بهطور وسیع به توانایی دارو برای تجمع درون مایع مغزی- نخاعی بستگی دارد. در دنیا، کلرامفنیکل یکی از پرمصرفترین آنتیبیوتیکها است.
مقاومت باکتریها به کلرامفنیکل: باکتریهای رودهای ارگانیسمهایی هستند که مکرراً به کلرامفنیکل مقاومت نشان میدهند. در این مورد، مقاومت معمولاً توسط یک فاکتور R پلاسمیدی حاوی ژن مقاومت به کلرامفنیکل و تتراسایکلین روی میدهد. این پلاسمید آنزیمی را کد میکند که با استیلاسيون، کلرامفنیکل را غیرفعال میسازد. معمولاً این نوع مکانیسم مقاومت، در سالمونلا تیفی و سویههای شیگلا روی میدهد. کلرامفنیکل استیلاز به محیط آزاد شده و ایجاد پدیده تلقیح میکند (مترجمین: همانند بتالاکتامازهای تولیدی توسط باکتریهای گرم مثبت).
دو مکانیسم دیگر هم برای مقاومت به کلرامفنیکل گزارش شده است. باکتریهای رودهای و سودوموناس گاهی يك فاکتور R دارند که سبب کاهش نفوذپذیری دارو به داخل باکتری میشوند. ساير باکتریها گاهی دچار جهش در ژنهای کروموزومی میشوند که مربوط به زيرواحد 50s ریبوزومی است و سبب میگردد که آنتیبیوتیک بهسختی توسط هدفش شناسایی شود.
شکل 1- ساختمان کلرامفنیکل، اریترومایسین و کلیندامایسین
این آنتیبیوتیکها روی عملکرد زیرواحد s50 ریبوزوم اثر میکنند. اریترومایسین یک آنتیبیوتیک ماکرولیدی و دارای گروه لاکتون است. کلیندامایسین از نظر ساختاری با ماکرولیدها مرتبط نبوده ولی دارای طیف اثر مشابه است و بهوسیله مکانیسمهای مقاومت مشابه غیرفعال میشود
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
اریترومایسین و سایر ماکرولیدها
ویژگی و مکانیسم عمل: آنتیبیوتیکهای ماکرولیدی، مولکولهای بزرگ حلقوی هستند که دارای یک حلقه لاکتون هستند. اریترومایسین[3] (شکل 1)، سالها تنها ماکرولید موجود بود، اما افزایش سطح مقاومت به این آنتیبیوتیک در باکتریها، منجر به پیدایش ماکرولیدهای جدید آزیترومایسین[4]، کلاریترومایسین[5]، ديریترومایسین[6] و تروليندومایسین[7] شد. آنتیبیوتیکهای ماکرولیدی در غلظت پایین باکتریواستاتیک و در غلظت بالا باکتریوساید هستند.
بیشتر مطالعات مربوط به مکانیسم عمل ماکرولیدها بر روی اریترومایسین متمرکز شده است. اریترومایسین بهطور برگشتناپذیر به ریبوزومهای آزاد میچسبد، اما به پلیزومها (چند ریبوزوم که قطعهای از mRNA پلیسیسترونیک را میخوانند) متصل نمیشود. اریترومایسین در زمان شروع سنتز به ریبوزوم میچسبد و اجازه میدهد پپتید کوچکی تشکیل شود، اما بعداً هرگونه سنتز بعدی را مهار میکند.
در این مرحله هم ترانسلوکاسیون و هم طویل شدن متوقف میشود. به دلیل ناپایدار بودن کمپلکس متوقف شده، قطعات ریبوزوم از mRNA جدا میشوند. این قطعات که فعالیتشان همچنان بلوکه است، میتوانند به mRNA جدید متصل شوند.
کاربرد و عوارض دارو: اریترومایسین یک آنتیبیوتیک معمولی است، طیف ضدمیکروبی شبیه به پنیسیلین G دارد (توسط بتالاکتامازها غیرفعال نمیشود)، میتوان آن را بهصورت خوراکی مصرف کرد و در صورت استفاده مناسب، خیلی سمی نیست. بیشتر واکنشهای مضر اریترومایسین مربوط به بهم زدن معده و روده است. اریترومایسین در درمان بیماری لژیونرها، دیفتری، سیاه سرفه و پنومونی آتیپیک حاصل از مایکوپلاسما و کلامیدیا مصرف میشود.
ماکرولیدهای جدید، طیف اثر وسیعتری دارند و راحتتر از اريترومايسين توسط دستگاه گوارش جذب میشوند. به نظر میرسد آزیترومایسین بر ضد بورلیا بورگدوفری (عامل بیماری لایم)، هموفيلوس انفلوانزا و انگل توکسوپلاسما گوندی مؤثر باشد. کلاریترومایسین به این دلیل غیرمعمول است که بر روی مایکوباکتریوم آویوم داخل سلولی و چند مایکوباکتریوم غیرتيپیک مؤثر است.
ترولیندومایسین برای درمان پنومونی پنوموککی و ریشهکنی حاملین استرپتوكك پیوژنز در گلو استفاده میشود. روکسی ترومایسین[8] یک داروی تحقیقاتی است که بر ضد هلیکوباکتر پیلوری، موراکسلا کاتارالیس و بعضی سویههای استافيلوكك و بيشتر سويههاي استرپتوكك مؤثر است، بعلاوه دارای طیف اثر معمول ماکرولیدها است.
مقاومت باکتریها به ماکرولیدها: باکتریها با دو مکانیسم نسبت به ماکرولیدها مقاوم میشوند. اولاً، بسياري از باکتریها در ژن کروموزمی سازنده پروتئین L4 یا L12 زیرواحد 50s ریبوزومی دچار جهش میشوند. ثانیاً، بعضی باکتریها دارای فاکتور R هستند که آنزیمی را کد میکنند که rRNA 23s را در زیرواحد 50s ریبوزوم دی متیله میکند. در اثر هرکدام از اين مکانیسمها، زیرواحد 50s نمیتواند آنتیبیوتیک را شناسایی نماید. وقتی مکانیسم مقاومت، به علت فاکتور R است، باکتری به تمام ماکرولیدها و لینکوزامیدها مقاوم میشود.
لینکومایسین، کلیندامایسین و سایر لینکوزامیدها
ویژگی و مکانیسم عمل: معمولاً لینکوزامیدها با ماکرولیدها به دلیل تشابه طیف فعالیت و مکانیسم عمل نه از نظر شیمیایی در یک گروه قرار میگیرند. لینکوزامیدها شامل آنتیبیوتیکهای لینکومایسین و کلیندامایسین (شكل 1) هستند. تفاوت کلیندامایسین با لینکوزامیدها داشتن یک گروه کلرین در لینکومایسین بجای گروه هیدروکسیل کلیندامایسین در کربن 7 است. این تفاوت کلیندامایسین را قادر میسازد که راحتتر جذب شده و برعلیه بیهوازیها مؤثرتر باشد.
لینکوزامیدها به همان گیرنده روي زیرواحد 50s ریبوزوم که کلرامفنیکل میچسبد، متصل میشوند. در اینجا، لینکوزامیدها تشکیل باند پپتیدی را بلوکه میکنند. برخلاف کلرامفنیکل، لینکوزامیدها سبب جدا شدن سریع زیرواحدهای 50s و s30 ریبوزوم از همدیگر میشوند. مکانیسم دقیق عمل لینکوزامیدها هنوز بهخوبی معلوم نیست، اما به نظر میرسد که با مكانهای مشابه آمینوآسیل– tRNA و پپتیدیل tRNA در سرهم کردن ریبوزوم تداخل میکنند.
کاربرد و عوارض دارو: طیف اثر کلیندامایسین شبیه پنیسیلین G و اریترومایسین است، اما کلیندامایسین در درمان عفونتهای حاصل از باکتروئیدس فراژیلیس بیهوازی اجباری، خصوصاً در افراد حساس به پنیسیلین استفاده میشود. گاهی برای درمان آبسهها یا سپسیس حاصل از گونههای باکتروئیدس، اکتینوباسیلوس، اکتینومایسس، کاپنوسایتوفاگا، کلستریدیوم، فلاووباکتریوم، فوزوباکتریوم، یا پپتواسترپتوكوکوس استفاده میشود.
بیشتر این باكتریها بیهوازی يا میکروائروفیليک هستند. کلیندامایسین میتواند برای درمان عفونتهای عمیق استافیلوکوکی مصرف شود. کلیندامایسین در ترکيب با جنتامایسین (یک آمینوگلیکوزید)، برای درمان بیماریهای التهابی لگن استفاده میشود.
مقاومت باکتریها به لینکوزامیدها:
مقاومت باکتریایی به لینکوزامیدها با مقاومت به ماکرولیدها مربوط است. مقاومت به لینکوزامیدها، معمولاً با RNA متیلاز القايي اریترومایسین، كه قبلاً توضيح داده شد، همراه است.
عوامل مؤثر بر زیرواحد 30s ریبوزوم
آمینوگلیکوزیدها و تتراسایکلینها بر روی زیرواحد 30s ریبوزوم اثر میگذارند.
آمینوگلیکوزیدها
ویژگی: آمینوگلیکوزیدها گروه بزرگی از آنتیبیوتیکها هستند که دارای یک هسته آمینوسیکلیتول میباشند. اين حلقه یک مولکول حلقوی نظیر اینوزیتول یا یک قند مشتق از اینوزیتول است که چند گروه هیدروکسیل با گروه آمین آن جانشین شدهاند. كازاگامايسين[9] (که در ایالات متحده آمریکا کاربرد درماني ندارد) سادهترين آمینوگلیکوزیدی است که داراي اینوزیتول تعویضشده است.
استرپتومایسین دارای قند آمینی استرپتامین است و آمیکاسین[10]، جنتامایسین[11]، کانامایسین[12]، توبرامایسین[13] دارای 2- اکسی استرپتامین هستند. ساختمان چند آمینوگلیکوزید در شكل 2 ارائه شده است.
معمولاً، آمینوگلیکوزیدهایی که داراي پسوند”مایسین” هستند، توسط سویههای استرپتومایسس تولید میشوند و پسوند “میسین” مربوط به آنهایی است که توسط میکرومونوسپورا[14] ساخته میشوند. البته، به دلیل اینکه بعضی از آمینوگلیکوزیدها قبل از تعیین این تقسیمبندی نامگذاری شدهاند، استثنائاتی در این زمینه وجود دارد. امروزه آمینوگلیکوزیدها توسط موتاسنتتیک تولید میشوند که پروسهای است که در آن موتانتها در مراحل مختلف بلوکه شده و واحدهای جدید بهصورت صنعتی به آنتیبیوتیک ناقص اضافه میشوند.
شکل 2- ساختمان استرپتومایسین، جنتامایسین و آمیکاسین
این آمینوگلیکوزیدها بر روی زیرواحد 30s ریبوزوم عمل میکنند
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
مکانیسم عمل: قدیمیترین و شناختهشدهترین آمینوگلیکوزید، استرپتومایسين است. استرپتومایسين در غلظت کم به پروتئین S12 زیرواحد 30s ریبوزوم میچسبد. استرپتومایسين به علت تخریب شکل mRNA، سبب اشتباه خوانده شدن كدهای ژنتيكي میشود و سبب میگردد که آمینوآسیل– tRNA بطور اشتباه به کدون متصل گردد.
توانایی آمینوگلیکوزیدها در ایجاد اشتباه خوانده شدن كد ژنتيكي و توانايي كشتن باكتريها به دلیل وجود یک هسته استرپتامین یا 2- داکسی استرپتامین است؛ اسپكتينومایسین که دارای یک هسته آمینوسیکلیتول غیرمشتق از استرپتامین است، سبب اشتباه خوانده شدن كدهای ژنتيكي نمیشود.
استرپتومایسین در غلظت بالا، به ریبوزوم چسبیده و با mRNA کمپلکس تشکیل میدهد. در این شرایط tRNA – F-met سنتز پروتئين را آغاز میکند، اما این سنتز بعد از آغاز، ادامه نمییابد. بعد از 5 دقیقه ریبوزوم تغییریافته از mRNA میافتد. اگر این ریبوزوم با mRNA جدیدی کمپلکس شود، خواندن پیام توسط هر ریبوزوم دیگری را متوقف میکند. اين مهار پلیزومها، منجر به توقف كامل سنتز پروتئين میشود.
کاربرد و عوارض دارو: آمینوگلیکوزیدها طیف اثر وسیعی داشته و باکتریوساید هستند. البته چند مورد محدودیت هم دارند:
اولاً، فعالیت باکتریوسیدال آمینوگلیکوزیدها حداقل به سنتز چند پروتئین نیاز دارد؛ بنابراین، کمبود یا مهار برگشتپذیر سنتز پروتئین، با فعالیت آمینوگلیکوزیدها تداخل ایجاد میکند. به همین دلیل آمینوگلیکوزیدها در حضور کلرامفنیکل باکتریوساید نیستند.
دوم، دامنه اثر باکتریوسایدی آمینوگلیکوزیدها با افزایش غلظت دارو زیاد میشود و میزان آنتیبیوتیکي كه به باکتری وارد ميگردد، فاکتور محدودکننده تأثیر آمینوگلیکوزیدها است.
سوم، آمینوگلیکوزیدها در شرایط بیهوازی بیتأثیرند؛ بنابراین بر ضد بیهوازیهای اجباری مؤثر نیستند. وقتی بیهوازیهای اختیاری، در محيط بیهوازی اجباری قرار میگیرند، قدرت آمینوگلیکوزیدها در مورد اين باكتريها ده بار کاهش مییابد.
چهارم، آمینوگلیکوزیدها بر ضد باکتریهایی که در محلهایی قرار گرفتهاند كه غلظت اسید و نمک بالا است، بیتأثیر هستند.
پنجم، به دلیل نفوذ کم آمینوگلیکوزیدها به درون سلول، بر ضد باكتريهاي داخل سلولي نیز تأثیر ندارند. بالاخره، اينكه آمینوگلیکوزیدها نسبتاً سمیاند و طيف درمانی باریکی دارند و مصرفشان منجر به آسیب عصب هشتم صورتی (اتوتوکسیته[15]) و آسیب کلیوی میشوند.
آمینوگلیکوزیدها بر روی باسیلهای گرم منفی هوازی یا بیهوازی اختیاری مؤثرند و در درمان عفونتهاي حاصل از بیهوازیهاي اجباري غيرمؤثر هستند. پزشكان متوجه شدهاند كه براي غلبه بر سمیت آمینوگلیکوزیدها میتوان آنها را همزمان با آنتیبیوتیکهای بتالاکتام مصرف کرد.
چنانكه در بالا توضيح داده شد، آنتیبیوتیکهای بتالاكتام و آمینوگلیکوزیدها بهصورت سینرژیسم بر ضد بسياري از باسيلهاي گرم منفي عمل میکنند. احتمالاً چون پنیسیلینها يا سفالوسپورینها سبب افزایش ميزان ورود آمینوگلیکوزیدها به داخل باکتری هدف میشوند. استفاده ترکیبی سبب افزایش وسيع طيف درمانی و طیف ضد ميكروبي آمینوگلیکوزیدها میگردد.
امروزه، در ایالات متحده آمريكا تقریباً از تمام آمینوگلیکوزیدها بهصورت درمان ترکیبی بر ضد باسیلهای گرم منفی، حتی سودوموناس استفاده میشود؛ براي مثال، معمولاً جنتامایسین در ترکیب با کاربنیسیلین و توبرامایسین همراه پیپراسیلین یا تیکارسیلین مصرف میگردد.
آمیکاسین، جنتامایسین، نتليمایسین و توبرامایسین بدليل فعالیت ضد سودوموناسی بهعنوان آمینوگلیکوزیدهای ضد سودوموناسی شناخته شده اند که فعالیت ضد سودوموناس آمیکاسین از همه بیشتر است.
اسپکتينومايسين آمینوگلیکوزید غیرمعمول است. این آنتیبیوتیک بر ضد نایسریا گونورهآ، باکتریوستاتیک است. به نظر میرسد به دلیل فقدان قند آمینی بهعنوان هسته آمینوسیکلیتول، فاقد فعالیت باکتریوسایدي است.
مقاومت باکتریها به آمینوگلیکوزیدها: تأثیر آمینوگلیکوزید مستقیماً به میزان تجمع آن در درون باکتری بستگی دارد. اين امر سبب تفاوت آمینوگلیکوزیدها از بتالاکتامها میشود که تأثیرشان به میزان تکثیر باکتری بستگی دارد. آمینوگلیکوزیدها توسط حامل اختصاصی که نیروی خود را از نیروی حرکتی پروتونها (PMF) میگیرد، از غشاء سیتوپلاسمی عبور میکند.
انحصاراً باکتریهایي كه PMF کم دارند يا فاقد آن هستند، مقاومند. چون بی هوازیها PMF ضعیفی دارند و تخمیرکنندههای اجباری (مثل استرپتوکوکها) فاقد PMF هستند، این باکتریها نمیتوانند، آمینوگلیکوزیدها را وارد خود بکنند و نسبت به آنها مقاومند؛ بنابراین عفونتهای ناشی از بیهوازیها یا استرپتوككها بهطور مؤثر با این آنتیبیوتیکها درمان نمیشوند.
مقاومت اکتسابی به آمینوگلیکوزیدها نیز به دلیل حضور پلاسمیدی (فاکتور R) است که آنزیمهای غیرفعالکننده آمینوگلیکوزیدها را با اتصال یک گروه استیل، فسفات، یا آدنیل به آنها تولید میکند. آنزیم تغییردهنده در غشاء سیتوپلاسم قرار دارد. در طی انتقال آنتیبیوتیک، آنزیم یک گروه به آن چسبانده و آنتیبیوتیک غیرفعال به درون سیتوپلاسم رها میگردد. این امر سبب تأثیر ثانویهای بهصورت انتقال آهسته آنتیبیوتیکها میشود.
در غیاب آنزیم تغییردهنده، آمینوگلیکوزیدها فوراً بعد از ورود به باکتری با ریبوزومها واکنش نشان میدهند. اتصال آمینوگلیکوزیدها به ریبوزوم سبب کاهش ظهور آمینوگلیکوزید آزاد در باکتری میشود و سبب تسریع انتقال آمینوگلیکوزید به داخل سلول میگردد. اگر آنزیم تغییردهنده حضور داشته باشد، چون آنتیبیوتیک به ریبوزوم نمیچسبد، پس تسریع در ورود هم دیده نمیشود.
دو نوع مکانیسم کمتر معمول مقاومت ديگر هم برای آمینوگلیکوزیدها توضيح داده شده است؛ در مدل اول، سودوموناس ائروژینوزا و گاهی باکتریهای رودهای دچار تبدیل پلیساکارید صاف به خشن میشوند که توانایی آمینوگلیکوزید برای عبور از غشاء خارجی را بشدت کاهش میدهند. در مدل دوم، انتروکوک (کوکسی گرم مثبت جزء استرپتوككها) و سودوموناس، دچار جهشی در ژن پروتئین S12 میشوند که پروتئین دیگر قدرت تشخیص و اتصال به استرپتومایسین را ندارد.
تتراسایکلینها
ویژگی و مکانیسم عمل: تتراسایکلینها آنتیبیوتیکهای وسیعالطیف باکتریو استاتیکی هستند كه بهخوبی در سلول میزبان نفوذ میکنند. این آنتیبیوتیکها، فقط بر ضد باکتریهای سریعالرشد مؤثرند. گروه تتراسایکلین (شكل 3) شامل تتراسایکلین، كلروتتراسایکلین[16]، دمكلوسايكلين[17]، اكسي تتراسایکلین[18]، داكسي سايكلين[19] و مينوسايكلين[20] هستند که تفاوتشان مربوط به گروه R جانشین موقعیت چهارم هسته مرکزی تتراسایکلین است.
تتراسایکلینها به زیرواحد s 30 ریبوزوم چسبیده و امکان ورود یک آمینوآسیل- tRNA را به سایت A میدهند. آمینوآسیل- tRNA نمیتواند بهصورت پایدار به سایت A متصل شود و طويلسازي[21] پپتید بلوکه میشود.
کاربری و عوارض دارو: تتراسایکلینهای خوراکی قدیمی تمایل زیادی برای کشتن فلور دستگاه گوارش دارند که سبب خلأ باكتريایی در دستگاه گوارش و امکان جانشينی پاتوژنها بجای آنها میشود؛ بنابراین، مصرف تتراسایکلینها سبب کولیت میشود. تتراسايکلینهاي نیمه صنعتي (داکسی سایکلین و مینوسایکلین) بیشتر لیپوفیلیک هستند و البته، جذب بیشتر آنها در روده کمتر سبب کولیت میگردد.
تتراسایکلین بر روی مغز استخوان اثر میگذارد و مصرف آن در کودکان زیر دوازده سال ممکن است بر روی رشد استخوانی و رنگ دندانها هم اثر بگذارد. در زنان حامله مصرف داخل رگی آنها، ممکن است منجر به نکروز کبد شود.
تتراسایکلین برای درمان اوليه عفونتهاي ناشي از باكتريهاي داخل سلولي نظير کلامیدیا ریکتزیا، پنومونی حاصل از مایکوپلاسما پنومونیه و عفونت ادراری ناشی از باسیلهای گرم منفی استفاده میشود. داکسیسایکلین در ترکيب با سایر آنتی بیوتیكها برای درمان اورتریت ناشی از کلامیدیا تراکوماتیس و نایسریا گونورهآ که اغلب يك عفونت مخلوط است، استفاده میگردد. چون تتراسایکلینها از مجاری گوارشی جذب میشوند، مصرف خوراکی دارند. آنها از سد خونی- مغزی عبور نمیکنند، پس در درمان مننژیت مصرف نمیشوند.
مقاومت باکتریها به تتراسایکلین: مقاومت اکتسابی به تتراسایکلینهاي چندگانه مثل مینوسایکلین و داکسیسایکلین در باکتریهای گرم منفی گزارش شده و معمولاً هنگامي ایجاد میشود که باکتری، پلاسمید القاکننده سیستم افلوکس فعال را کسب میکند. این سیستم بر روی ورود تتراسایکلینها تأثیری ندارد. تتراسایکلینها بهصورت طبیعی وارد باکتری میشوند، اما در عوض سریعاً به خارج باكتري پمپ میگردند.
در باکتریهای رودهای، پنج ژن كه اين عمل را انجام میدهند، شناسايي شدهاند. اگرچه نوع استاندارد مقاومت به تتراسایکلین افلوکس وابسته به پلاسمید است، اما بعضی از سویههای باكتروئيدس فراژیلیس، نايسريا گونورهآ و استرپتوكك پیوژنز به دلیل جهش ژنهای کروموزومی، کاهشي در اثر تتراسایکلین نشان میدهند.
سایر عوامل ممانعتکننده از سنتز پروتئین
موپیراسین آنتیبیوتیک سودومونیک اسیدی است که با مهار فعالیت سنتز ایزولوسیل- tRNA در باکتریهای حساس، از سنتز پروتئین جلوگیری میکند؛ بنابراین، وقتی که سنتز پروتئین احتیاج به ایزولوسیل- tRNA دارد، اين ماده در دسترس نیست و سنتز پروتئین متوقف میشود. موپیراسین باکتریوساید است ولی چون اگر بهصورت سیستمیک مصرف شود، سریعاً متابولیزه میشود، فقط بهصورت پماد تهیه میگردد.
موپیراسین بر روی بیشتر استافيلوككها و استرپتوككها، اشريشیا کلی، هموفيلوس انفلوانزا و نایسریا مؤثر است. بهعنوان پماد برای درمان زردزخم (حاصل از استافيلوككها یا استرپتوككها) تجویز میشود و بهصورت داخل بینی برای حذف حاملین استافيلوكك اورئوس استفاده میگردد.
شکل 3- ساختمان تتراسایکلین
چهار نوع تتراسایکلین طبیعی و دو نوع تتراسایکلین نیمه سنتتیک وجود دارد که هرکدام دارای گروه R متفاوت در چهار سایت هستند
[1] -Silver bullet
[2] -Gray baby syndrome
[3] -Arythromycin
[4] -Azithromycin
[5] -Clarithromycin
[6] -Dirithromycin
[7] -Troleandomycin
[8] -Roxithromycin
[9]– kasugamycin
[10]– Amikacin
[11] -Gentamicin
[12]– Kanamycin
[13]– Tobramycin
[14] -Micromonospora
[15]– Ototoxicity
[16]– Chlor tetracycline
[17] -Demeclocycline
[18] -Oxytetracycline
[19] -Doxycycline
[20]– Minocycline
[21]– Elongation
بخش پنجم
آنتیبیوتیکهایی که بر روی سنتز و ساختمان اسید نوکلئیک تأثیر میگذارند
اصول کلی
یکی از مهمترین اهداف اثر آنتیبیوتیکها، ماشین حفظ و تکثیر اسید نوکلئیک باکتریهاست. برخلاف سلولهای یوکاریوتي، باکتریها هاپلوئیدند، هستهای ندارند و دارای کروموزومی بهصورت سوپرکویل در سیتوپلاسم خود هستند. چون آنزیمهایی که سبب پایداری سوپرکویل طبیعی کروموزوم میشوند، کروموزوم را کپی میکنند و سنتز RNA را انجام میدهند با آنچه در یوکاریوتها وجود دارد، متفاوت است، این آنزیمها اهداف خوبی برای آنتیبیوتیکها هستند. بیشتر آنتیبیوتیکهايی که با عمل یا سنتز اسید نوکلئیک باکتریها تداخل میکنند، باکتریوساید هستند.
مهارکنندههای اختصاصی اسید نوکلئیک
در اینجا بر روی پنج آنتیبیوتیک يا گروه اصلی آنتیبیوتیک بحث میشود: ریفامپین و سایر ریفامایسینها، نالیدیکسیک اسید و فلوروکينولونها، نووبیوسین، مترونیدازول و کلوفازیمین.
ریفامپین و سایر ریفامایسینها
ویژگی و مکانیسم عمل: ریفامپین (شكل 1) مشتق نیمه صنعتی ریفامایسین B است. ریفامایسینها دارای یک سیستم حلقه آروماتیک با یک زنجیره بلند آلفاتیک هستند. ریفامپین، آنتیبیوتیک باکتریوساید با طیف وسیع فعاليت است.
ریفامپین مهارکننده نسخهبرداری است، به زیرواحد β در RNA پلیمراز وابسته به DNA میچسبد و ضمن تشکیل باند دی استر اولیه، مانع تشكيل باندهاي فسفودي استر بعدي میگردد، بنابراين، به نظر میرسد كه در طی سنتز RNA، مرحله آغاز زنجيره را متوقف نماید.
عوارض دارو و مقاومت به ریفامپین: مقاومت به ریفامپین معمولاً به علت جهش در ژن زیرواحد β در RNA پلیمراز رخ میدهد، چرا که در اثر جهش، ریفامپین دیگر توسط پلیمراز شناخته نمیشود.
چون باکتریها اغلب در طی درمان با ریفامپین در اثر جهش مقاوم میشوند، مصرف ریفامپین به موارد زیر محدود میشود:
(1) درمان طولانی سل و جذام؛ (2) کموپروفیلاکسی برای مواجهه با بیماران مننژیتی حاصل از هموفيلوس انفلوانزا تیپ B یا نایسریا مننژیتیدیس؛ و (3) درمان ترکیبی (با وانکومایسین یا متیسیلین) اندوکاردیت یا استئومیلیت حاصل از استافيلوكك اورئوس یا استافيلوكك اپیدرمیدیس.
گزارش شده است كه ريفابوتين، مكانيسم عمل مشابه ريفامپين دارد، اما فعاليت بيشتري علیه كمپلكس داخل سلولي مايكوباكتريوم آويوم را دارا است. در حال حاضر از ريفابوتين براي درمان اوليه يا پيشگيري از عفونتهای حاصل از اين كمپلكس در بيماران مبتلا به سندرم نقص ايمني اكتسابي (ايدز) استفاده ميشود.
شکل 1- ساختمان ریفامپین
این آنتیبیوتیک بازدارنده سنتز اسید نوکلئیک است
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
ناليديكسيك اسيد و فلوروكينولونها
ویژگی و مكانيسم عمل: ناليديكسيك اسيد (شكل 2) آنتیبیوتیک قديمي است كه در درمان عفونتهای ادراري استفاده ميشود. چون باکتریها در حضور آن سريعاً مقاوم ميشوند، اگر آنتیبیوتیک بهتر ديگري در دسترس نباشد ، باید از آن استفاده گردد. البته، اخيراً يك گروه كينولون صنعتي بنام فلوروكينولونها ساخته شدهاند (شكل 2). برخلاف موارد قبل، فلوروكينولونها آنتیبیوتیکهای وسيعالطيفياند كه بر ضد بيشتر باکتریهای گرم منفي و بعضي از باکتریهای گرم مثبت مؤثرند.
فلوروكينولونهاي تجارتي در دسترس عبارتند از: سيپروفلوكساسين، انوكساسين، لومه فلوكساسين، نورفلوكساسين و افلوكساسين. دو فلوروكينولون ديگر يعني پفلوكساسين و رافلوكساسين، داروي تحقیقاتیاند. تمام فلوروكينولونها آنتیبیوتیکهای باكتريوسايد هستند.
ناليديكسيك اسيد و فلوروكينولونها به زيرواحد α در DNA ژيراز (يا توپوايزومراز II) ميچسبند و از توانايي ژيراز براي تشكيل باند فسفودي استر جلوگيري ميكنند. اين امر با تداخل در سوپر كويلينگ[1] DNA كه براي تكثير DNA ضروري است، باكتري را ميكشد.
کاربرد، عوارض دارو و مقاومت: ناليديكسيك اسيد در هنگام مصرف تقریباً غيرفعال است، اما در ادرار به فرم فعالش شكسته ميشود. بر ضد پاتوژنهاي ادراري مثل اشریشیا كلي، كلبسيلا و پروتئوس مؤثر است. در عوض، فلوروكينولونها در هنگام مصرف فعالند و براي درمان عفونت در بسياري از محلهای بدن، مثل عفونت ادراري، سوزاك، اسهال باكتريايي، عفونت پوست و استخوان و مفاصل قابل استفاده هستند.
تأثیر فلوروكينولونها در باکتریهای مختلف متفاوت است: عموماً بر ضد تمام پاتوژنهاي ادراري و بر ضد نايسريا گونورهآ و استافيلوكوك اورئوس مؤثرند؛ همچنین بر ضد سودوموناس ائروژينوزا مؤثرند و در توانايي كشتن سويههاي مزمن كوكسيلا بورنتي كه باكتري درون سلولي عامل تب Q و اندوكارديت است، بینظیرند. فلوروكينولونها اثر مطلوبي بر ضد استرپتوكك، پنوموكك و ليستريا نشان ندادهاند و بنابراين در درمان عفونتهای مجاري تحتاني تنفسي تأثیر مفيدي ندارند.
مقاومت به كينولونها معمولاً به دلیل جهش در ژن gyrA رخ میدهد. در طی درمان با ناليديكسيك اسيد، از 2 تا 14 درصد بيماران باکتریهای مقاوم جدا ميشوند. مطالعاتي براي ارزيابي شيوع مقاومت به فلوروكينولونها انجام شده است.
گاهي بيماران با مصرف ناليدیكسيك اسيد دچار تهوع، استفراغ و كهير ميشوند و بعضي دچار حساسيت به نور ميگردند. البته عموماً، ناليديكسيك اسيد و فلوروكينولونها به راحتي تحمل ميگردند.
شکل 2- ساختمان ناليديكسيك اسيد و سه فلوروكينولون وابسته (سيپروفلوكساسين، نورفلوكساسين و افلوكساسين)
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
نووبيوسين
نووبيوسين آنتیبیوتیک باكتريواستاتيكي است كه براي آدنوزين تري فسفات با زيرواحد β در DNA ژيراز رقابت كرده و هم سنتز DNA و هم سنتز تيكوئيك اسيد را مهار ميكند. مقاومت در نتيجه جهش ژن gyrB در DNA ژيراز رخ ميدهد. نووبيوسين كمي سمي است و بهعنوان آنتیبیوتیک ثانويه در درمان عفونتهای استافيلوكك اورئوس مصرف ميگردد.
مترونيدازول
مترونيدازول آنتیبیوتیک باكتريوسيدالي است كه يك گروه نيترو دارد و در شرايط بيهوازي توسط باکتریهایی كه نيترو ردوكتاز مناسب دارند، احياء ميگردد. واسطههای بسيار سمي و با عمر كوتاه ایجاد شده در اثر احیاءمترونیدازول، سبب تخريب كروموزوم باکتریها ميگردند.
مترونيدازول اغلب براي درمان عفونتهای پروتوزوآيي (خصوصاً عفونتهای حاصل از آميب، ژيارديا و تريكوموناس) استفاده ميشود، ولي يكي از درمانهای اصلي باكتروئيدس فراژيليس (باكتري بيهوازي)، است. تأثیر مترونيدازول در درمان واژينيت مرتبط با گاردنرلا واژيناليس، بيشتر به دلیل توانايي آنتیبیوتیک براي از بين بردن باکتریهای بيهوازي است که عامل عفونت مخلوط شدهاند. مترونيدازول در درمان عفونتهای حاصل از بيهوازيهاي گرم مثبت بدون اسپور مؤثر نيست.
معمولترین عارضه جانبي مصرف مترونيدازول، به هم زدن دستگاه گوارش است. نشان داده شده است كه این دارو در جوندگان آزمايشگاهي كارسينوژن و در باکتریها جهشزا است، اما جهشزا بودن آن در سلولهای يوكاريوت اثبات نشده است. عموماً بهتر است مترونيدازول در سه ماهه اول حاملگي مصرف نشود.
كلوفازيمين
كلوفازيمين آنتيبيوتيك باکتریوسیدال ملايم است، در درمان تركيبي جذام مصرف ميشود و گاهي در درمان عفونتهای مايكوباكتريوم آويوم اينتراسلولار مصرف میگردد. نوع فعاليتش دقيقاً معلوم نيست، اما كلوفازيمين با چسبيدن به DNA مايكوباكتريها، سبب مرگ آنها ميشود. كلوفازيمين تركيب قرمز رنگي است كه بيشتر بيماران مصرفکننده آن پوست و ملتحمه و عرق و اشكشان قرمز ميشود كه با قطع درمان برطرف ميشود. همچنین نيمي از بيماراني كه دوز بالاي كلوفازيمين ميگيرند، دچار تهوع و استفراغ ميگردند.
آنتیبیوتیکهای آنتي متابوليت
اصول كلي
اگرچه باکتریها چرخههاي متابوليسمي شبيه يوكاريوتها دارند، اما بعضي از مواد را كه انسان از محيط اطراف خود دريافت مینماید، باکتریها بايد بسازند و سوبستراهاي غيرمعمولي براي توليد انرژي توسط باکتریها مصرف میشود. میکروبیولوژیستها و فارماكولوژيستها بر روی اين مسيرها مطالعه كردند و ساخت آنتیبیوتیکهايي را كه مشابه سوبستراهايي است كه باكتري به آنها احتياج دارند ولي انسان نياز ندارد، بررسي كردهاند.
بيشتر اين آنتیبیوتیکهای آنتي متابوليتی مشابه P- آمينوبنزوئيك اسيد (PABA) هستند كه توسط باکتریها براي سنتز تتراهيدروفولات استفاده ميشود. عموماً، رقابتكنندههاي آنتی متابوليت با تقليد سوبستراي آنزیمهای كليدي باكتري، آنها را مهار میکنند. اثر، با افزايش غلظت سوبستراي خالص قابل دسترسي آنزيمها ميتواند كاهش یابد.
آنتیبیوتیکهای آنتي متابوليتی خاص
مثال آنتیبیوتیکهای آنتي متابوليتی خاص سولفوناميدها، تريمتوپريم، آمينوساليسيلات سديم، داپسون، ايزونيازيد، اتيوناميد و اتامبوتول ميباشد.
سولفاناميدها
كشف پرونتوسيل، يا سولفاناميد، در دهه اول 1930 انجام شد. اين آنتیبیوتیک در شرايط آزمايشگاهي فعال نبود، اما در بدن به شكل فعال خود درمیآمد. از آن موقع تا به حال آنتیبیوتیکهای زيادي توليد شدهاند. اين آنتیبیوتیکها در ایالات متحده آمريكا در دسترس هستند: سولفاسيتين، سولفاديازين، سولفامرازين، سولفامتازين، سولفامتي زول، سولفامتاكسازول، سولفاسالازين و سولفي سوكسازول.
سولفاناميدها آنتیبیوتیکهای باكتريواستاتيكي هستند كه در باکتریهای حساس بهصورت مهاركننده رقابتي دي هيدروپتروات سنتتاز از تشكيل اسيدفوليك جلوگيري ميكنند (شكل 3). سنتز اسيد فوليك در بسياري از باکتریها از اتصال پتريدين (2-آمينو 4-دهيدروكسي 6-ديهيدروپتريدينيل متيل پيروفسفات) به PABA براي تشكيل ديهيدروپتروئيك اسيد شروع ميشود.
سولفاناميدها كه آنالوگ PABA هستند (شكل 3) اين واكنش را با عمل بهعنوان سوبستراي ديگري براي ديهيدروپترات سنتتاز بهصورت رقابتي مهار ميكنند. مقاومت به سه دليل روي میدهد:
(1) جهش كروموزومي رخ داده كه سبب ايجاد آنزيم، با تمايل کم براي سولفاناميدها میگردد، (2) کسب فاكتور Rي كه يك ديهيدروپترات سنتتاز جديد را كد ميكند، (3) يا کسب فاكتور Rي كه آنزيمي كد ميكند كه سولفاناميدها را غيرفعال میسازد.
سولفاناميدها به تنهايي در درمان عفونت ادراري ساده حاصل از اشریشیا كلي يا پروتئوس ميرابيليس و بهعنوان درمان جانبي براي عفونتهای جديد گوش مياني، درمان پيشگيرانه سویههای نايسريا مننژيتيديس حساس به سولفاناميد و درمان آبسههاي ناشي از نوكارديا آستروئيدس به كار ميروند.
چون باكتري از اسيدفوليك براي ساخت پورين، گليسين، متيونين و تيمين استفاده ميكند، وقتي اين مواد در دسترس باشند، سولفاناميدها غيرمؤثراند، پس سولفاناميد براي درمان عفونتهایی كه در آنها تخريب گسترده بافت صورت ميگيرد (زخم يا سوختگي) يا ترشح چركي وجود دارد، مناسب نيست. مهمترین مصرف سولفوناميد در تركيب با تريمتوپريم است.
شکل 3- مسیر به کار رفته توسط باکتریها جهت سنتز تتراهیدروفولات از P-آمینوبنزوئیک اسید (PABA)، پتریدین و گلوتامات. سولفونامید بازدارنده فعالیت ديهيدروپتروات سنتتاز است، درحالیکه تریمتوپریم فعالیت دي هيدروفولات ردوكتاز را مهار میکند
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
تريمتوپريم
ديهيدروپتروئيك اسيد[2] حاصل از PABA و پتريدين، توسط افزودن گلوتاميك اسيد به ديهيدروفوليك اسيد تبديل شده و آن نيز با فعاليت آنزيم دي هيدروفولات ردوكتاز (شكل 3) تبديل به تتراهيدروفولات ميشود. تريمتوپريم كه از نظر ساختماني شبيه بخش پتريدين در ديهيدروفولات است اين واكنش را مهار ميكند (شكل 21-4). مقاومت با دریافت فاكتور Rي كه داراي ژن كدكننده ديهيدروفولات ردوكتاز جديد است، رخ ميدهد.
تريمتوپريم (TMP) گاهي به تنهايي براي درمان عفونت مجاري ادراري استفاده ميشود، اما مهمترین مصرف آن در تركيب با يك سولفوناميد و معمولاً سولفومتاكسازول (SMX) است. چون SMX و TMP مراحل مختلف سنتز تتراهيدروفولات را بلوكه ميكنند، بر ضد باکتریهای حساس و بعضي از انگلها بهصورت سينرژيكی عمل ميكنند.
از SMX/TMP براي درمان عفونت حاد گوش مياني، عفونتهای ادراري ساده (سيستيت و پيلونفريت)، اسهال، پنوموني در مبتلايان به سيستيك فيبروزيس، برونشيت و سينوزيت حاد استفاده ميشود. در درمان عفونتهای باكتريايي حاصل از ائروموناس هيدروفيلا، بوردتلا پرتوسيس، بروسلا، بورخولدريا (سودوموناس) سپاسيا، بورخولدريا (سودوموناس) سودومالئي، فلاووباكتريوم، هموفيلوس دوكرهاي، هموفيلوس آنفلوانزا، ليستريا منوسيتوژنز، موراكسلا كاتاراليس، نوكارديا آستروئيدس، پروتئوس ميرابيليس، پروويدنسيا، سالمونلا تيفي، شيگلا، استئوتروفوموناس (گزانتوموناس) مالتوفيليا، ويبريوكلرا و يرسينيا انترکولیتيكا كاربرد دارد و در درمان عفونتهای انگلي حاصل از ايزوسپورا بلي و پنوموسيستيس كاريني نیز استفاده ميشود.
از آنجايي كه TMP/SMX وسیعالطیف و ارزان قیمت است و توسط بسياري از بيماران تحمل ميشود، در خيلي از موارد يك داروي اعجابانگیز است.
شکل 4- ساختمان سولفونامیدهائی که آنالوگ P-آمینوبنزوئیک اسید (PABA) هستند
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
ساير آنتي متابوليتها
آمينوساليسيلات سديم: آمينوساليسيلات سديم، يا P- آمينوساليسيلات (PAS)، از نظر ساختماني شبيه PABA است (شكل 5). نحوه فعاليتش مثل سولفوناميد بوده و باكتريواستاتيك است. PAS بهخوبی به داخل سلول ميزبان نفوذ كرده و گاهي بهصورت تركيبي در درمان سل به كار ميرود.
داپسون: داپسون يك آنتیبیوتیک سولفون است (شكل 5) و از نظر فعاليت شبيه سولفوناميدهاست. داپسون سالها درمان انتخابي مايكوباكتريوم لپره بوده است، اما با افزايش مقاومت به آن در سالهای اخير، درمان استاندارد جذام مصرف داپسون با يك آنتي مايكوباكتر ديگر است. داپسون باكتريواستاتيك است.
ايزونيازيد و اتيوناميد: ايزونيازيد كه ايزونيكوتينيك اسيد هيدرازيد[3](INH) نيز ناميده میشود، باكتريوسايدي است كه هم شبيه نيكوتين آميد است هم شبيه پيريدوكسامين (شكل 5). ايزونيازيد با سنتز ميکولیك اسيد كه يك تركيب اصلي ديواره سلولي پيچيده مايكوباكتريوم توبركلوزيس است تداخل ايجاد ميكند. اين دارو در درمان تركيبي سل استفاده میشود. اتيوناميد داروي ضدمايكوباكتریوم ديگر، بسيار شبيه ايزونيازيد است و نوع فعاليتش نيز مشابه آن است.
اتامبوتول: اتامبوتول آنتیبیوتیک باكتريوسايدي است كه سنتز متابوليتهاي سلولي را به روش ناشناختهاي مهار ميكند و در تركيب با ساير داروها در درمانهای کوتاهمدت سل مصرف ميشود. اتامبوتول در حدود 0/8 درصد از بيماران سبب التهاب بينايي میشود كه اين مسئله در افرادي كه عملكرد طبيعي كليه دارند، بندرت ديده ميشود.
شکل 5- ساختمانهای آمینوسالیسیلات سدیم، داپسون، تریمتوپریم و ایزونیازید
اینها، چهار آنتیبیوتیک آنتی متابولیک هستند. آمینوسالیسیلات سدیم (P-آمینوسالیسیلات یا PAS) و داپسون، آنالوگهای P-آمینوبنزوئیک اسید (PABA)، تریمتوپریم، آنالوگ پتریدین و ایزونیازید (ایزونیکوتینیک اسید هیدرازید یا INH)، آنالوگ پیردوکسامین و نیکوتین آمید هستند
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
ساير عوامل ضد باكتريايي
اصول كلي
بيشتر آنتیبیوتیکها تشابه متابوليكي دارند يا عواملي هستند كه ديواره سلولي، سنتز پروتئين، ساختمان و يا عمل DNA در باكتري را هدف ميگيرند. شمار كمي از آنتیبیوتیکها هستند كه از اين طبقهبندی خارجند يا نوع عملشان ناشناخته است. این آنتیبیوتیکها عبارتند از متنامين، نيتروفورانتوئين يا پيرازين آميد.
آنتیبیوتیکهای خاص
متنامين
متنامين (شكل 6) يك ساختمان حلقوي شامل فرمآلدئيد و آمونياك است که در شرايط آزمايشگاهي غيرفعال است و با مصرف خوراكي شكل فعال آن در ادرار تجمع مييابد. وقتي PH ادرار كمتر از 5 است متنامين شكسته و توليد فرمآلدئيد كرده و سبب كشتن باکتریهای موجود در ادرار ميشود.
براي اطمينان از اسيدي شدن كافي ادرار براي فعال كردن آنتیبیوتیک به همراه متنامين، مندليك اسيد[4] مصرف ميشود. به دليل قليايي شدن ادرار با توليد آمونياك و دياكسيد كربن توسط مهمترین پاتوژن ادراري يعني پروتئوس، اين باكتري نسبت به عمل متنامين مقاوم است.
نيتروفورانتوئين
نيتروفورانتوئين (شكل 6) و ساير نيتروفورانها متابوليسم باکتریها را با مكانيسم ناشناختهاي مهار ميكنند. نظرات زيادي در اين مورد وجود دارد، از جمله، مهار فعاليت آنزیمهای تري كربوكسيليك اسيد و مهار ترجمه آنزیمهای القاگر متابوليسم كربوهيدرات. نيتروفورانتوئين طيف اثر وسيعي دارد و باكتريواستاتيك است. نيتروفورانها به دليل تجمع در ادرار براي درمان عفونتهای ادراري ساده استفاده ميشوند.
شکل 6- ساختمانهای متنامین، نيتروفورانتوئين و پیرازینامید
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
پيرازيناميد
پيرازيناميد (شكل 6) يك عامل ضد مايكوباكتريايي است كه مكانيسم عملش به خوبي معلوم نيست. دارو در زمان مصرف فعال نيست، اما توسط مايكوباكترياهايي كه داراي فعاليت پيرازيناميدازي هستند، به فرم پيرازينوئيك اسيد تبديل ميشود. مطالعات قبلي نشان میداد كه اين امر در فضاي اسيدي فاگوليزوزومها صورت ميگيرد که با مطالعات اخير اين عقيده زير سؤال رفته است. پيرازيناميد در درمان تركيبي سل به کار میرود.
[1] -Supercoiling
[2]-Dihydropteroic acid
[3]– Isonicotinic acid hydrazide
[4] -Mandelic acid
حساسیت و مقاومت باکتریها به آنتیبیوتیکها
سمیت انتخابی
یکی از عوامل اصلی که اجازه اثر آنتیبیوتیکها بر ضد باکتریها را امکانپذیر میسازد، این است که باکتریها پروکاریوت هستند و بنابراین بهطور متمایزی با سلولهای انسانی متفاوتند. این تفاوتها شامل ساختمان و عمل سلولی است که آنتیبیوتیکها علیه آنها عمل میکنند و همین امر است که به آنتیبیوتیکها خاصیت سمیت انتخابی را میدهد. همانطور که در دستورالعمل جدول 1 و بهطور کلی ارائه شده، چهار دسته اصلی آنتیبیوتیک وجود دارد که اهداف عمل متفاوتی دارند:
1. آنتیبیوتیکهایی که بر پوشش سلولی تأثیر میگذارند.
2. آنتیبیوتیکهایی که مانع سنتز پروتئین میشوند.
3. آنتیبیوتیکهایی که بر روی ساختمان و سنتز اسید نوکلئیک تأثیر میگذارند.
4. آنتیبیوتیکهای آنتیمتابولیک
عموماً آنتیبیوتیکهای دسته اول و سوم سیدال هستند، دسته دوم ممکن است سیدال یا استاتیک باشند و دسته چهارم استاتیک هستند.
تعداد آنتیبیوتیکهای ضد باکتریایی، خیلی بیشتر از آنتیبیوتیکهای ضد قارچی، انگلی و ویروسی است، چرا که قارچها و انگلها شباهت زیادی با سلولهای انسانی دارند و ویروسها نیز از مکانیسمهای تکثیری سلولهای انسانی استفاده میکنند. متأسفانه به دلیل شباهتهای زیاد با سلولهای یوکاریوتی، آنتیبیوتیکهایی که ضد قارچها و انگلها و ویروسها عمل میکنند، برای انسان بسیار سمی هستند.
حتی آنتیبیوتیکهای ضد باکتری نیز برای انسان سمی هستند. در تعدادی از داروها نظیر آمینوگلیکوزیدها، مرز درمانی (Therapeutic Margin) (مرز بین دوز مؤثر و دوز سمی) کوچک است، بنابراین سطح خونی این آنتیبیوتیکها باید با دقت اندازهگیری و مراقبت شود.
جدول 1: تقسیمبندی آنتیبیوتیکها بر اساس مکان اثر آنها
آنتیبیوتیکهایی که روی پوشش سلولی اثر میگذارند
عوامل مهار ديواره سلولي:
آنتیبیوتیکهای بتالا كتام:
پنيسيلينهاي طبيعي
- پنيسيلين G
- پنيسيلين V
پنيسيلينهاي نيمه سنتتیک و آنالوگها
1- پنيسيلينهاي مقاوم به پنيسيليناز (كلوکساسیلین، دی کلوکساسیلین، فلوکساسیلین، متیسیلین، نفیسیلین و اگزاسیلین)
2- پنيسيلينهاي با طیف گسترده (آميدینوسیلين، آموكسيسیلین، آمپيسیلین و بکآمپیسيلين)
3- پنيسيلينهاي ضد سودوموناسی (آزلوسيلين، كاربنیسيلين، پيپراسيلين، مزلوسیلین و تيكارسيلين)
4- آنالوگها (كلاولانيك اسيد، سولباكتام و تازوباكتام)
- ساير آنتيبيوتيكهاي شبه پنيسيلين
1- كارباپنمها (ارتاپنم، دوروپنم، ايميپنم و مروپنم)
2- مونوباكتامها (آزترونام)
- سفالوسپورينها، سفامايسينها و آنتيبيوتيكهاي وابسته
1- سفالوسپورينهای نسل اول (سفادوراکسیل، سفپروزیل، سفازولين، سفالكسين، سفالوتين، سفاپيرين و سفرادین)
2- سفالوسپورينهای نسل دوم {سفوکسیتین، سفوتتان، سفوپیروزیل، سفومتازول، سفاکلور، سفامندول، سفونيسيد، سفورانيد، سفوروكسيم و لورکارابف (فقط در ایالات متحده امریکا تجویز میشود.)}
3- سفالوسپورينهای نسل سوم {سفكسيم، موگسالاکتام (فقط در ایالات متحده امریکا تجویز میشود)، سفوپرازون، سفوتاكسيم، سفودوكسيم، سفتازيديم، سفتی بوتن، سفدینیر، سفدیتورن، سفتيزوكسيم و سفتریاکسون}
4- سفالوسپورينهای نسل چهارم (سفيپيم و سفپیروم)
5- سفامايسينها (سفامتازول، سفوتتان و سفوکسیتین)
آنتيبيوتيكهاي گليكوپپتیدی (تيكوپلانين و وانكومايسين)
آنتيبيوتيكهاي لیپوگلیکوپپتیدی (تلاوانسین، دالباوانسین و اوریتاوانسین)
باسیتراسین
سيكلوسرين
عوامل برهمزننده يكپارچگي غشاء سلولي
پليميكسين B
پليميكسين E
آنتيبيوتيكهاي ممانعتكننده از سنتز پروتئين
عوامل مؤثر بر زيرواحد 50s ريبوزوم
كلرامفنيكل
ماكروليدها (آزيترومايسين، كلاريترومايسين، تلیترمایسین، ديريتومايسين، اريترومايسين و ترولیندومایسین)
لينكوزاميدها (كليندامايسين و لينكومايسين)
عوامل مؤثر بر زيرواحد 30s ريبوزوم
آمينوگليكوزيدها (آميكاسين، جنتامايسين، کانامایسین، نتیلمایسن، اسپكتينومايسين، استرپتومايسين و توبرامایسین)
تتراسايكلينها (كلرتتراسايكلين، دمکلوسایکلین، داكسيسايکلين، مينوسايكلين، اكسي تتراسايكلين، تتراسايكلين)
لینزلایدها
ساير عوامل مهار سنتز پروتئين
موپیروسین و داروهای دیگر
آنتيبيوتيكهاي مؤثر بر ساختمان و سنتز اسيدهاي نوكلئيك
ريفاميسينها (ريفابوتين و ريفامپين)
نالیديكسيك اسيد
فلوروكینولونها (سيپروفلوكساسين، گاتی فلوکساسین، مکسی فلوکساسین، انوكساسين، لومفلوکساسین، نورفلوکساسین و افلوكساسين/لووفلوکساسین)
نووبيوسين
مترونيدازول
کلوفازیمین
آنتيبيوتيكهاي آنتيمتابوليك
سولفاناميدها (سولفاسيتين، سولفاديازين، سولفامرازين، سولفامتازين، سولفامتی زول، سولفامتاكسازول سولفاسالازين و سولفيسوكسازول)
تري متوپريم
آمينوساليسيلات سديم
داپسون
ايزونيازيد
اتیونامید
اتامبوتول
ساير عوامل ضد باكتريايي
متینامین
نيتروفورانتوئين
پپرازين آميد
حساسیت باکتریها به آنتیبیوتیکها
بعضی باکتریها در پاسخ به عوامل ضد میکروبی، به یک شکل عمل نمیکنند، لذا بایستی حساسیت باکتریهای جدا شده زیر از خون، ادرار، خلط یا مایع مغزی نخاعی نسبت به آنتیبیوتیکهای مناسب، مورد آزمایش قرار گیرند: باکتریهای گرم منفی (شامل انتروباکتر، اشریشیا کلی، کلبیسلا، پروتئوس، سالمونلا، سراشیا، شیگلا و یرسینیا)، انتروکوکوس فکالیس، هموفيلوس انفلوانزا، سودوموناس ائروژینوزا و استافیلوکوکوس اورئوس.
بعلاوه باکتریهای کواگولاز منفی و پنوموکوکهای جدا شده از خون اغلب تست تعیین حساسیت میشوند و در مورد سایر باکتریها، وقتی پزشک چنین تستهایی را درخواست کند، تعیین حساسیت میگردند.
در این بخش بهطور کوتاه انواع تستهای تعیین حساسیت توضیح داده میشود و در مقاله بعدی بهطور کامل تعیین حساسیت به عوامل ضدمیکروبی (آنتی بیوگرام) توضیح داده خواهد شد.
انواع تستهای تعیین حساسیت
روش تعیین رقت یا میکرودیلوشن (Microdilution):
برای تعیین حساسیت باکتریها، روش تعیین رقت، معمولیترین روشی است که استفاده میشود. چاهکهای میکروپلیت، حاوی سری رقتهای دوتایی از آنتیبیوتیکها و غلظت استانداردی از باکتری است (شکل 1). یک شب این میکروپلیت انکوبه شده و سپس چاهکها از نظر رشد باکتری بررسی میگردند.
کمــترین غلظت از آنتیبیوتیکی که مانع رشد باکتری میگردد، بهعنوان حداقل غلظت بازدارندگی {Minimum Inhibitory Concentration (MIC)} آنتیبیوتیک در نظر گرفته میشود (شکل 2).
بهطور معمول در بیشتر بیمارستانها، حداقل غلظت کشندگی {Minimum Bactericidal Concentration (MBC)} آنتیبیوتیکها تعیین نمیشود، اما در مورد برخی نمونههای خاص، وقتی پزشک درخواست میکند، این غلظت تعیین میگردد. MBC با کشت دادن مایع رویی چاهکهایی که رشد باکتری را نشان ندادند، تعیین میشود و MBC بهصورت کمترین غلظتی از آنتیبیوتیک که 99/9 درصد از باکتریهایی که به چاهک تلقیح شدهاند را کشته است، تعریف میگردد.
در بیشتر موارد، MBC و MIC آنتیبیوتیکهای سیدال برابرند، در این حالت چاهکها فاقد رشد باکتری هستند، زیرا همه باکتریها کشته شدهاند، البته برخی از باکتریها در آنزیمهای اتولیتیک خود نقص دارند و غلظتی از آنتیبیوتیک که برای کشتن آنها لازم است 32 برابر غلظتی است که سبب توقف رشد آنها میگردد. این باکتریها را بهعنوان باکتریهای تولرانس به آنتیبیوتیک میشناسند.
شکل 1: روش تعیین رقت یا میکرودیلوشن
نوعی از روش تعیین رقت را میتوان در آزمایش نمونههای سرمی، برای تعیین سطح باکتروسیدال آنتیبیوتیک مصرفی، برای درمان خاص مورد استفاده قرار داد.
شکل 2: روش تعیین رقت که با آن میتوان MIC آنتیبیوتیکها را تعیین کرد
روش انتشار دیسک (تست کربی- بایر):
اگر باکتری در محیطهای روش میکرودیلوشن رشد ضعیفی داشته باشد، تست حساسیت آنها به آنتیبیوتیک به روش دیسک دیفیوژن که به تست کربی- بایر نیز معروف است، انجام میشود. در این مورد، سوسپانسیون استانداردی از باکتری بر روی یک پلیت استاندارد بزرگ كه حاوی محیط کشت مولرهینتون آگار است را پخش میکنند، سپس دیسکهایی از جنس کاغذ صافی که حاوی مقادیر استانداردی از آنتیبیوتیک است را بر روی سطح پلیتها قرار داده و پلیتها در شرایط مناسب انکوبه میگردند.
باکتری بهصورت یک لایه در روی سطح آگار رشد میکند، ولی در محلهایی که رشد باکتری مهار شده است، هالههای دایرهای در اطراف آن دیسک آنتیبیوتیک ظاهر میشود (شکل 3). میکروبیولوژیستها قطر این هاله را اندازهگیری کرده و این هاله را با استانداردهای موجود مقایسه میکنند. باکتریها نسبت به هر آنتیبیوتیک بهصورت حساس، اینترمدیيت یا مقاوم طبقهبندی میشوند.
شکل 3: روش انتشار دیسک (تست کربي- بایر)
تستهای کالریمتریک (رنگسنجی):
برای تست برخی از گونههای باکتری مثل نایسریا گونورهآ، طیف کاملی از حساسیت به آنتیبیوتیک لازم نیست، بلکه این مهم است که بدانیم آیا باکتریهای جدا شده فعالیت بتالاکتاماز را دارند یا خیر. تستهای ساده کالریمتری برای تشخیص سریع سویههای مولد بتالاکتاماز یک گونه باکتریایی موجود است.
تفسیر نتایج
تستهای حساسیت یکی از مفیدترین آزمایشها برای پزشکان است، اما چندین دلیل وجود دارد که باید تستها با احتیاط تفسیر شوند:
یکم، تستها به تغییرات روشها حساسند؛ مثلاً نتایج آزمایشگاههای مختلف به علت شرایط متفاوت از جمله دما، pH یا میزان تلقیح تا حدودی متفاوت است.
دوم، تستهای حساسیت آنتیبیوتیکی تحت شرایط استانداردی طراحی شده که ممکن است کاملاً با شرایط داخل بدن فرق داشته باشد، برای مثال از آنجایی که تأثیر آمینوگلیکلوزیدها نسبت به pH موجود، متفاوت است، عجیب نیست که وقتی باکتری در pH برابر 7/4 آزمایشگاه به آمینوگلیگوزید حساس است، در محیط اسیدی بدن به آنتیبیوتیک حساس نباشد.
سوم، مقادیر استانداردی که جهت تعیین حساسیت و مقاومت به آنتیبیوتیک استفاده میشود، به میزان آنتیبیوتیکی بستگی دارد که بتواند در خون حاصل شود؛ بنابراین، تستهای تعیین حساسیت اغلب تأثیر آنتیبیوتیک علیه پاتوژنهای موجود در مجاری ادراری را کم تخمین میزنند، زیرا در این محل بسیاری از داروها تغلیظ میشوند.
چهارم، حساسیت در شرایط آزمایشگاهی، تنها عاملی نیست که بر نتیجه درمان آنتیبیوتیکی در داخل بدن تأثیرگذار باشد. سایر عوامل شامل مکان و وسعت عفونت، حضور بیماریهای زمینهای که سیستم ایمنی را مختل میکند، وجود عفونتهای مخلوط، صحت تشخیص، دوز مناسب، سن بیمار، کسب مقاومت توسط باکتری در طول درمان و احتیاج به اعمال جراحی یا تخلیه محل عفونت است.
مقاومت نسبت به آنتیبیوتیکها
الگوهای مقاومت
علیرغم وجود آنتیبیوتیکهای فراوان و کارخانههای چندین میلیارد دلاری داروسازی، راه درازی تا تحت کنترل در آوردن بیماریهای باکتریایی وجود دارد. یک دلیل اصلی این امر، آن است که بسیاری از باکتریها نسبت به آنتیبیوتیکها مقاوم شدهاند. یک آنتیبیوتیک برای اعمال اثر خود چه کاری باید انجام دهد؟ باید یک هدف مناسب را شناسایی کند، در آن هدف به غلظت مناسب برسد و در همان غلظت برای مدت زمان مشخصی باقی بماند.
بعضی از مشکلات درمانی زمانی رخ میدهد که آنتیبیوتیک انتخابی، به دلیل عدم توانایی عبور از سد مغزی- خونی نمیتواند به هدف برسد یا نمیتواند به باکتریهای درون یک آبسه دسترسی پیدا کند. مشکل دیگر مربوط به غلظت آنتیبیوتیک است. در بعضی از موارد آنتیبیوتیک سریعاً دفع یا متابولیزه میشود و باعث میگردد که سطح خونی دارو فقط بهصورت مختصر در بالاترین حد باقی بماند.
این حالت، آنتیبیوتیک را در درمان عفونتهایی که در اثر باکتریهایی بوجود میآیند که فقط در مواجهه طولانی با میزان بالای دارو کشته میشوند، بیاثر میکند. در بعضی از موارد، آنتیبیوتیک سریعاً در عضو یا بافت خاصی تغلیظ میشود و آنتیبیوتیک نمیتواند به سایر محلهای عفونت دسترسی پیدا کند.
مکانیسم غیرژنتیکی مقاومت
باکتریها معمولاً به سه روش نسبت به اثر آنتیبیوتیکها مقاوم میشوند:
یکم، بعضی باکتریها آنزیمی تولید میکنند که یک آنتیبیوتیک را با اتصال یک گروه متیل، آسیل یا فسفات یا با شکستن یک باند کلیدی (مثل حلقه بتالاکتام پنیسیلین) غیرفعال میکنند.
دوم، وقتی که نفوذپذیری برخی از باکتریها نسبت به آنتیبیوتیک تغییر نماید، به آنتیبیوتیک نسبتاً مقاوم میشوند.
این تغییر در نفوذپذیری اغلب به دلیل تغییر در مولکولهای پورین یا اجزاء لیپوپلیساکارید است. تغییر در لیپوپلیساکارید بر روی نفوذپذیری یا تغییر شارژ سطحی ارگانیسم، تأثیر میگذارد؛ برای مثال در مورد مقاومت به تتراسایکلین، دفع (Efflux) دارو بشدت افزایش مییابد.
سوم، ممکن است هدف آنتیبیوتیک طوری تغییر نماید که دیگر توسط آنتیبیوتیک قابل تشخیص نباشد. دو مثال مهم از این مکانیسم عبارتست از:
(1) مقاومت استافیلوکوکها به متیسیلین که با از دست دادن تمایل پروتئینهای باندکننده به پنیسیلین برای متیسیلین رخ میدهد.
(2) توانایی برخی از سویههای اشریشیا کلی که برای مقاوم شدن به استرپتومایسین، پروتئین S12 خود را تغییر میدهند.
این تغییرات، الگوی حساسیت بسیاری از باکتریها را تغییر داده و بر روشهای درمانی تأثیر عظیمی گذاشته است. در دهه 1960 میلادی، درمان استاندارد سوزاک، تزریق 1/2 میلیون واحد پنیسیلین G بود. در اوایل دهه 1970 گنوکک بهطور پیشروندهای نفوذپذیری خود را به دارو کاهش داد؛ بنابراین دوز تجویزی پنیسیلین G به 2/4 میلیون واحد افزایش یافت.
سپس مقدار مصرفی به 4/8 میلیون واحد پنیسیلین G رسید. نایسریا گونورهآ تولیدکننده پنیسیلیناز ابتدا در اواخر سال 1970 مشاهده شد و حالا آنقدر زیاد شده است که دیگر از پنیسیلین G برای درمان معمول سوزاک استفاده نمیشود، بهجای آن بیماران با سفالوسپورینهای نسل سوم (معمولاً سفتریاکسون یا سفکسیم)، فلوروکینولونها یا استرپتومایسین درمان میشوند. به نظر میرسد، باکتریهای تولیدکننده پنیسیلیناز در حال افزایش هستند، زیرا احتمال ميرود یک فاکتور (TME-I) R از باکتریهای رودهای به گنوکوکها منتقل شده است.
مکانیسمهای ژنتیکی مقاومت
مثال نایسریا گونورهآ نشان میدهد که چگونه باکتریها، ابتدا یک نوع از مکانیسم مقاومت (در این مورد تغییر در نفوذپذیری) را نشان داده و بعداً، نوع دیگری از مکانیسم مقاومت (در این مورد تشکیل یک بتالاکتاماز) را از طریق انتقال ژن نشان میدهند. نه تنها ترانسفورمیشن در کسب مقاومت پنیسیلین در پنوموککها دخیل است، بلکه استافیلوکوکهایی دیده شده که بتالاکتاماز، حاوی فاکتور R را از طریـــق ترانسداکشن کسب میکنند.
بسیاری از باکتریهای گرم منفی، فاکتور R را از طریق کونژوگیشن مبادله میکنند. بعضی از فاکتورهای R دامنه بسیار محدودی از میزبانها را دارند (نظیر آنهایی که در سالمونلا تیفی و ویبریو کلرا یافت میشوند)، اما سایر فاکتورهای R در باکتریهای گوناگون به فراوانی یافت میشوند؛ برای مثال پلاسمید مقاومت pAMB1 از باسیلوس ها، کلستریدیومها، انتروکوکها، لاکتوباسیلوسها، استافیلوکوکها و استرپتوکوکها جدا شده است و فاکتور R دیگر (RP4) در بین اسینتوباکترها و سودوموناسها و باسیلهای رودهای وجود دارد.
بعضی از ژنهای مقاومت به آنتیبیوتیک در پلاسمید غیرکانژوگاتیو وجود دارند که میتوانند با پلاسمید کانژوگاتیو منتقل شوند (پلاسمید به نادرستی در طی کونژوگیشن منتقل میشود). همچنین این ژنها ممکن است از طریق نوترکیبی وابسته به RecA یا ترانسپوزون، از یک پلاسمید به پلاسمید دیگر منتقل شوند. به نظر میرسد که ژنهای Tem-1 از باسیلهای رودهای به گنوککها از طریق نوترکیبی ترانسپوزونی منتقل شده باشند.
پلاسمید رودهای، در آنجا نمیتوانست تکثیر یابد، اما ژن Tem-1 از پلاسمید رودهای به روی پلاسمید گنوککی “پریده است”. این امر سبب انتشار ژنهای مقاومت و جاودانی شدن در یک جمعیت جدید ميشود.
در گذشته محققین تصور میکردند که مقاومت نمیتواند از باکتریهای گرم منفی به گرم مثبتها یا بالعکس منتقل شود؛ اما امروزه با آزمایشهاي کلونینگ مشخص شده که این انتقال صورت میگیرد و دلایلی وجود دارد که حدس زده میشود که در شرایط بدن این حالت رخ دهد. یکم، فاکتور R TetM ابتدا فقط در انتروکوکهای گرم مثبت، وجود داشت، اما حالا در گنوککها و هموفیلوسها (که گرم منفی هستند) نیز یافت میشود.
دوم، ترانسپوزون انتروکوکی tn917 دارای ژن مقاومت به اریترومایسین است (این ژن ermB نیز نامیده میشود) که به نظر میرسد شبیه ژن ermBc در اشریشیا کلی و کلبیسلا و ژن Tn1545 استرپتوکوکوس پنومونیه و ژن ermAM در استرپتوکوکوس سانگوئیس باشد و بالاخره tn4400 که حامل ژن مقاومت به کلیندامایسین است از باکتروئیدس فراژیلیس به اشریشیا کلی (باکتری که بتالاکتاماز تجزیهکننده سفوکسیتین و ایمیپنم را کد میکند) منتقل میگردد.
نكته: در مقالات بعدي بهطور كامل انواع تستهاي تعيين حساسيت و مقاومت (آنتيبيوگرام) ارائه خواهد شد.
بخش هفتم
تعيين حساسيت آنتیبیوگرام
مقدمه تعيين حساسيت:
همانطور که در مقاله گذشته اشاره شد حداقل غلظت مهاری[1](MIC) بهعنوان پایینترین غلظتی از آنتیبیوتیک که رشد قابلمشاهدهی یک ارگانیسم را در شرایط آزمایشگاهی مهار میکند، تعریف میشود. این از مفهوم نقطه بحرانی (Breakpoint) که غلظتی از آنتیبیوتیک میباشد که تعیینکنندهی طبقهبندی ارگانیسم بهعنوان حساس، نیمه حساس یا مقاوم است، متمایز میباشد.
همانطورکه قبل گفته شد مقدار MIC با روشهای مهاری در آزمایشگاه شامل براث دایلوشن، آگار دایلوشن و انتشار گرادیان (استفاده از اپسیـــــــلومتر که بهعنوان E-test هم شناخته میشود) تعیین میشود.
آزمایش دیسک دیفیوژن که بیشتر روش کیفی میباشد تا کمی، مستقیماً شاخص MIC را نشان نمیدهد، اما رابطه مستقیم اندازهی هاله عدم رشد با شاخص MIC مشاهده میگردد. تستهای مولکولی نیز منجر به تعیین MIC نمیشوند اما بهطور وسیعی برای تعیین سریع حضور ژنهای مقاومت در ارگانیسم استفاده میشوند. هر روشی که استفاده میشود، باید در نظر گرفته شود که مکانیسمهای مقاومت پیچیده هستند و بهسرعت تغییر مییابند، بنابراین ضروری است که کارکنان آزمایشگاه از دستورالعملهای جدید آگاه باشند.
بهطورکلی هر روش تعیین حساسیتی که استفاده میشود، بایستی در آن شرایط استاندارد مربوط به محیط کشت، غلظت تلقیح شده، زمان انکوباسیون، دمای انکوباسیون جهت کسب نتایج صحیح و تکرارپذیر رعایت گردد. تقریباً هر ساله استانداردهای این متغیرها توسط سازمان استانداردهای بالین و آزمایشگاه (CLSI)[2]در ایالاتمتحده آمریکا تهیه و استانداردهای عملی برای آزمایشگاههای میکروبی را ارائه میکند که مبنای کار در آزمایشگاههای بالینی کشورمان قرار میگیرد
. امروزه تکنیکهای خودکار پرسرعت تجاری برای تعیین حساسیت حجم بالا در دسترس هستند، بااینوجود، علیرغم مزایای سرعت و کارایی که این سیستمها ارائه میکنند، باید به خاطر داشته باشیم که این سیستمها نیز دارای نقاط ضعفی هستند. علاوه بر گران بودن این سیستمها برخی با مشکلاتی در شناسایی دقیق فنوتیپهای مقاومتی خاص همراه میباشند. بهمنظور کمک به حل برخی از این مشکلات در راستای گزارشهای دقیقتر، قواعد تخصصی در نرمافزار این سیستمها میتواند برنامهریزی شود.
این مسئولیت بر عهده مسئول آزمایشگاه است که از ضعف سیستمهای مورداستفاده و یافتن روشهای جایگزین و مکمل مناسب برای آزمایش آگاه باشد.
انجام تستهای تعیین حساسیت و انتخاب ترکیبات ضد میکروبی برای آزمایش و گزارش، باید توسط آزمایشگاهها بهطور مجزا بر اساس توصیههای منتشرشده توسط CLSI و مشاوره نزدیک با مراکز درمانی و مراکزی که آزمایشگاه به آنها خدمات ارائه میدهد، تعیین شوند. بهطورکلی، تا زمانی که تعیین حساسیت یک ارگانیسم عامل عفونی از روی ماهیت آن امکانپذیر نیست بایستی تستهای تعیین حساسیت انجام گیرد.
بهتر است در مراکز درمانی کشور گزارشهای تجمعی حساسیت ضد میکروبی (آنتیبیوگرام) بهصورت سالانه بر اساس دستورالعملهای CLSI توسط آزمایشگاهها منتشر شود. این گزارشات برای استفادهی پزشکان در شروع درمان تجربی مناسب قبل از در دسترس قرار گرفتن نتایج آزمایشها مهم بوده و برای داروسازان در نظارت بر مصرف و نیاز به ترکیبات ضدمیکروبی خاص و تلاش برای کنترل هزینههای دارو و نیز تعیین روند الگوهای حساسیت آنتیبیوتیکی در یک بیمارستان یا ناحیهی خاص در گذر زمان کمککننده میباشند.
همانطورکه که قبلاً اشاره شد پارامتر مهاری که اساس تفسیر روشهای تعیین حساسیت آنتیبیوتیکی را تشکیل میدهد، حداقل غلظت مهاری (MIC) میباشد که پایینترین غلظتی از یک آنتیبیوتیک است که رشد قابلمشاهدهی ارگانیسم را در شرایط آزمایشگاهی مهار میکند. نتایج حداقل غلظت مهاری تنها به برهمکنش بین عامل ضد میکروبی و ارگانـیســم وابسته نیست بلکه به شرایط آزمایش نیز بستگی دارد.
این شرایط شامل pH و غلظت یونهای محیط کشت، دمای انکوباسیون، اتمـسفــر انکوباسیون، میزان ارگانیسم مورد آزمایش و طول دورهی انکوباسیون میباشند. به همین دلیل جهت کسب نتایج تکرارپذیر در آزمایشگاهها، شرایط این تستها توسط سازمانهای استاندارد متعددی در نواحی مختلف جهان مانند سازمان استانداردهای بالین و آزمایشگاه (CLSI) ایالاتمتحده امریکا استاندارد شده است.
با وجود اینکه حداقل غلظت مهاری (MIC) بسیار سودمند و شاخص قابل تفسیری از برهمکنش بین آنتیبیوتیک و یک ارگانـیســــــم خاص میباشد، اما اطلاعاتی که برای پزشک درزمینهی بیمار مبتلا به عفونت فراهم میکند محدود است، چراکه حداقل غلظت مهاری (MIC)، یک ارزیابی لحظهای از برهمکنش غلظت ثابتی از یک دارو با ارگانیسم در نقطهی خاصی از زمان و شرایط خاصی آزمایشگاهی میباشد.
حداقل غلظت مهاری (MIC) باید با محیط متغیر و پیچیده فیزیولوژیک بیمار همبستگی داشته باشد، تا پزشک بتواند پیشبینی کند که آیا درمان با آنتیبیوتیک خاص میتواند موفقیتآمیز باشد. این کار با استفاده از نقطهی بحرانی که اجازهی ارزیابی کارایی کشتن یا مهار رشد ارگانیسم توسط ترکیب ضد میکروبی را میدهد، انجام میگیرد. تاکنون انواع مختلفی از نقاط بحرانی شامل میکروبیولوژیک، فارماکوکنتیک، فارماکودینامیک و بالینی در این تستها شناسایی شدهاند.
اصولاً افرادی که نقاط بحرانی بالینی را تعیین میکنند تمایل دارند سویهها را به گروههایی تقسیمبندی کنند تا پیشبینی نمایند که آیا درمان در یک بیمار موفقیتآمیز خواهد بود؟ تعیین نقطه بحرانی بالینی پیچیده، مشکل و وابسته به فرد میباشد.
این فرایند میتواند شامل آزمایشهای بالینی متعدد باشد و نقاط بحرانی بالینی بسته به سازمان تعیینکنندهی استاندارد ممکن است متفاوت باشد. همچنین نقاط بحرانی در طول زمان تغییر میکنند، همانطور که بر اساس آخرین متون راهنما مجدداً بازبینی و تصحیح میشوند.
نقاط بحرانی همچنین بر اساس جایگاه عفونت بالینی نیز متفاوت میباشند: بهعنوانمثال نقطهی بحرانی برای مننژیت ناشی از استرپتوکوکوس پنومونیه از پنومونی ایجاد شده توسط همان ارگانیسم متفاوت میباشد. در ایالاتمتحده امریکا، نقاط بحرانی بالینی برای ترکیبهای آنتیبیوتیک – ارگانیسم خاص جهت استفادهی آزمایشگاههای بالینی توسط CLSI تعیین و منتشر شده و هر ساله بهروزرسانی میشود.
نقاط بحرانی تعیینشده توسط CLSI ممکن است به دلایل مختلفی ازآنچه توسط سازمان تستهای تعیین حساسیت آنتیبیوتیکی اروپا[3](EUCAST) یا سایر سازمانهای کشورهای مختلف تعیین شده است، متفاوت باشند.
یکی از این دلایل شامل تفاوت دوز و برنامهی زمانی تجویز مورداستفاده برای داروی مشابه در کشورهای مختلف میباشد. در ایالت متحده، هنگامیکه نقطهی بحرانی بین CLSI و سازمان غذا و دارو (FDA) متفاوت باشـد، چالشها بیشتر میشود، چراکه نقاط بحرانی و تفاسیر FDA آنهایی هستند که شرکتهای سازنده سیستمهای آزمایش خودکار باید به آن پایبند باشند، درحالیکه نقاط بحرانی و تفاسیر CLSI میکروبشناسهای بالینی را راهنمایی میکند و بر اساس آخرین متون مرتبط که بهطور منظم بهروزرسانی میشوند، میباشند.
درنهایت، نقاط بحرانی به دلایل مختلف مثل تفاوت در ویژگی بیمار و سیستم ایمنی و همچنین تفاوت در بیماریزائی یک ارگانیــســــــم و نوع و جایگاه عفونت، پیشبینی بالینی کاملی را ارائه نمیدهد. در این زمینه لازم است برای کسب تفسیر کاملتر از نقاط بحرانی، تعیین آن، بقا و ارتباط آن به مقالات مروری مراجعه نمایید.
دستهبندیهای تفسیری ایجاد شدهاند که اجازه درک ساده و فهم آسان نتایج گزارشهای تعیین حساسیت را به آزمایشگاهها میدهند. آزمایشگاههای متعددی این دستهبندیها را علاوه بر گزارش حداقل غلظت مهاری (MIC) یا در برخی موارد بهجای گزارش حداقل غلظت مهاری (MIC)، گزارش میکنند. اگرچه، پزشکان باتجربه بیماریهای عفونی، ممکن است قادر باشند تصمیمهای کنترلی هوشمندانه دربارهی حداقل غلظت مهاری (MIC) بگیرند، این کار در مورد پزشکانی که در این حوزه متخصص نیستند، کمی مشکل است.
تجویز دارو توسط پزشکان به مشاوره آزمایشگاهها با توجه به تفاسیر نقاط بحرانی واقعی وابسته میباشد. دستهبندی تفسیری اصلی شامل حساس، نیمه حساس و مقاوم میباشد. همچنین دستهی غیر حساس و اخیراً دستهی جدید حساس وابسته به دوز (SDD)[4] برای تست تعیین حساسیت ضد باکتریایی نیز ارائه شده است.
حساس به این معنی است که درمان با دوز توصیهشده از یک آنتیبیوتیک خاص احتمالاً در حذف عفونت مؤثر میباشد و مقاوم به این معنی است که آنتیبیوتیک با دوز مناسب بهاحتمالزیاد درمان موفقی را آزمایشهای بالینی نشان نمیدهد.
گزارش کردن دسته تفـــسیری نیمه حساس پیچیدگیهایی دارد. این تفسیر پیشنهاد میکند که ایزولههای تستشده توسط دوز معمول آنتیبیوتیک نسبت به ایزولههای دستهی حساس کمتـر مهار میشوند. همچنین، نشان میدهد که ممکن است درمان با دوز بالاتر آنتیبیوتیک مؤثر بوده و همچنین درمان ممکن است در جایگاه آناتومیکی که غلظت آنتیبیوتیک بالاست مؤثر باشد. برای مثال این تفسیر، استفاده از آنتیبیوتیکهای بتالاکتام در درمان عفونتهای دستگاه ادراری میباشد.
این دسته آنتیبیوتیکها دارای یک ناحیهی بافری (Buffer zone) هستند که فاکتورهای دخیل در اجرای آنتیبیوگرام ممکن است سبب به وجود آمدن خطاهای بزرگی در تفسیر گردند. تفسیر گزارش حساس وابسته به دوز این میباشد که حساسیت یک ایزوله وابسته به دوز بالاتر تجویز (دوز بالاتر و / یا تکرار فواصل دوز بهدفعات بیشتر) نسبت به دوز معمول استفاده شده و دوزی که بیمار با آن مواجه میشود نسبت به وقتیکه نقطهی بحرانی حساس مطرح است، بالاتر میباشد.
این دسته برای تعییـن حساسیت آزمایشگاهی ضدقارچی مورداستفاده بوده است؛ اما امروزه برای تعیین حساسیت آزمایشگاهی ضدباکتریایی نیز استفاده میگردد، چراکه اغلب اوقات سویههای نیمه حساس اشتباهاً توسط پزشکان بهصورت سویههای مقاوم تفسیر شــده و انتخابهای درمان را برای آنها محدود میکنند.
گروه غـیرحسـاس بـه مـواردی که ایزولههای مقاوم و نیمه حساس پیدا نشده است با گروه مقاوم و نیمه حساس تعریف نشده است اطلاق میشود. این مورد در ابتدا برای آنتیبیوتیکهای جدید استفاده شده است. اگر نتیجهی تست حداقل غلظت مهاری (MIC) یک ایزوله بالاتر از غلظت Cut off پایهریزی شده برای نقطهی بحرانی گروه حساس باشـد، آزمایشگاه میتواند ایزوله را غیر حساس گزارش کند.
این الزاماً بر این نکته که مقاومت به آنتیبیوتیک وجود دارد دلالت نمیکند؛ اما به این معنی میباشد که بررسی ایزولههایی که حداقل غلظت مهاری (MIC) با این سطح را نشان میدهند محدود است؛ بنابراین ارزیابی قطعی نمیتواند انجام شود.
اگرچه گزارش آزمایش حساسیت ضد میکروبی و طبقهبندی ایزوله در یک دستهی تفسیری، برای پزشکان در کنترل عفونت بیماران کمککننده است، باید به یاد داشته باشیم که فعالیت ضدمیکروبی در شرایط آزمایشگاهی وابسته بــه فاکتورهای متعددی میباشد. علاوه بر دوز دارو، راه تجویز، خصوصیات فارماکوکینتیک/ فارماکودینامیک، دارو، محل عفونت، فاکتورهای اختصاصی بیمار مثل وضعیت ایمنی، عملکرد کلیوی و کبدی، رژیم غذائی و درمان همراه با سایر داروها نیز در پاسخ بیمار به درمان تعیینکننده هستند و باید در برنامهی درمانی در نظر گرفته شـود.
تعيين حساسيت آنتیبیوگرام
همانطورکه در بالا اشاره شد تعيين حساسيت يك باكتري نسبت به آنتيبيوتيكها، براي پزشك به همان اندازه تعيين نوع باكتري اهميت دارد. با دانستن نوع باكتري بهتر ميتوان بيماري را درمان و كنترل نمود، اما مواقعي پيش ميآيد كه تعيين حساسيت ميكروب نسبت به آنتيبيوتيك اهميت بيشتري دارد. تعيين حساسيت باكتري نسبت به آنتيبيوتيك براي پزشك بهمنظور انتخاب روش اساسي درمان بيمار، اهميت زيادي دارد.
يكي از فوايد آنتيبيوگرام اين است كه به دليل مقاوم شدن اكثر سوشهاي ميكروبي نسبت به آنتيبيوتيكها با تعيين حساسيت باكتري نسبت به آنتيبيوتيكها، اين مشكل را نيز ميتوان حل كرد.
آنتيبيوگرام عبارت از تعيين و سنجش حساسيت ميكروارگانيسم نسبت به آنتيبيوتيكها و داروهاي ضد باكتريايي و قارچي ميباشد و به روشهاي مختلف انجام ميگيرد. بهطورکلی هدف از آنتیبیوگرام مشخص کردن حداقل غلظت بازدارندگی (MIC) هر یک از آنتیبیوتیکها است که بهصورت mg/l یا g/mlμ گزارش میشود.
آنتيبيوگرام پس از تشخيص بيماري و جدا نمودن عامل عفونت بهصورت خالص يا كاملاً ايزوله انجام ميشود، پس محيط كشت بايد حاوي يك نوع ميكروارگانيسم باشد. پزشك با در نظر گرفتن
- حساسيت ميكروارگانيسم
- الگوهای ذاتی مقاومت داروئی
- محل عفونت
- شرايط ميزبان (سن- جنس- حاملگي……)
- خصوصیات فارماکودینامیک و فارماکوکنتیک مانند مقدار سميت انتخابی دارو Selective toxicity))
اقدام به تجويز دارو ميكند، ازاینرو جواب آزمايش برای ایشان داراي اهميت است.
اگرچه در بسیاری از موارد، انتخاب اولیهی یک عامل ضد میکروبی توسط پزشکان تجربی میباشد؛ نتایج آزمایشگاهی تعیین حساسیت عامل بیماریزا جداشده نـسبـت بـه آنتیبیوتیکها متعاقباً به مدیریت بیمار و کنترل عفونت در بیمارستان کمک مهمی میکند. تغییر درمان ممکن است مطلوب باشـد اگر 1) عامل عفونتزا به درمان جاری مقاوم باشد. (۲) دوز آنتیبیوتیک مناسب نباشد (۳) آنتیبیوتیکی با اثر برابر ولی ارزانتر در دسترس باشد یا (4) کاهش اثر درمان آنتیبیوتیکی مشاهده گردد. (مثلاً اگر ارگانیسم یافت شده ازآنچه پیشبینی میشد، مقاومت کمتری نشان بدهد).
روشهای تعیین حساسیت آنتیبیوتیکی در شرایط آزمایشگاهی (AST) [5]در آزمایشگاههای بالینی در درجه اول با استفاده از روشهای فنوتیپی انجام میشود. روشهای فنوتیپی در درجه اول نیازمند جداسازی عامل بیماریزا مورد آزمایش و به دنبال آن مواجههی آن با ترکیب ضد میکروبی و سپس ارزیابی مقاوم بودن یا نبودن به آنتیبیوتیک میباشد. این فرایند میتواند پرزحمت و زمانبر باشند که در برخی از شرایط برای بیمار و آزمایشگاه خطرناک میباشد.
علیرغم این حقیقت، امروزه روشهای فنوتیپی شامل براث دایلوشن، آگار دایلوشن، دیسک دیفیوژن و گرادیانت دیفیوژن (E-test)، شایعترین و در بسیاری موارد باصرفهترین روش برای انجام تستهای تعیین حساسیت میباشند. امروزه سیستمهای تجاری بر پایهی روشهای فنوتیپی، به دلیل اینکه نیروی کار و زمان لازم برای تشخیص مقاومت آنتیبیوتیکی را کاهش میدهند در بسیاری از آزمایشگاهها استفاده میشوند.
در آخر روشهای جدید تعیین مقاومت (روشهای مولکولی) که برخی از آنها مستقیماً روی نمونهی بیمار قابل انجام هستند ازآنجاییکه تأخیر در تشخیص مربوط به جداسازی پاتوژن را کاهش میدهند، اخیراً پرطرفدار شدهاند.
تستهای حساسیت آنتیبیوتیکی بر اساس نقطهی انتهایی (Endpoint) مورداستفاده که شامل مهار رشد یا مرگ است، طبقهبندی میشوند. در بسیاری از موارد، هاله عدم رشد که نشاندهنده عدم رشد، پارامتر استفاده شده در آزمایشگاه میباشد و بهصورت محدود از نقطهی پایانی مرگ در شرایط خیلی خاصی استفاده میشود.
انواع روشهاي آنتيبيوگرام
1- روشهاي رقيقسازي متوالی (Serial dilution)
در تستهای رقیقسازی (دایلوشن) میزان استانداردی از ارگانیسم در داخل لولهها، چاهکها یا پلیتهائی که دارای رنجی از غلظت ماده ضد میکرویی هستند ازجمله محیط براث (در روش میکرودایلوشن براث یا ماکرودایلوشن براث) یا آگار (روش آگار دایلوشن) که معمولاً با انتگرالی از ۲ شروع شده (مثلاً 128 میکروگرم بر میلیلیتر) و بر اساس کمترین غلظت موردبررسی بهصورت log2 کاهش مییابد، تلقیح میشود.
در این روشها بهمنظور راحتی کار و کم کردن هزینهها محدود کردن دامنهی غلظت هر ترکیب ضدمیکروبی موردبررسی به آن غلظتی که دربرگیرندهی نقطهی بحرانی مشخصکنندهی بین حساس و مقاوم میباشد، محدود شده است.
روش ماکرودایلوشن براث با استفاده از لولههای استاندارد آزمایش انجام میشود و لولهها توسط چشم غیرمسلح برای تعیین وجود رشد مشاهده میگردند. سیستم ماکرودایلوشن براث به دلیل زحمت فراوان در آزمایشگاهها استفاده نمیشود، اما این روش اساس اکثر تستهای تعیین حسـاسـیـت مدرن میباشد. بهطور مشابه، روش آگار دایلوشن که آنتیبیوتیک موردبررسی داخل محیط آگار جامد در پلیت ریخته میشود، روشی قدیمیتر و پرزحمتتر میباشد که بهندرت بهصورت تست روزانه در آزمایشگاههای مدرن امروزی استفاده میشود.
با این وجود، به دلیل اینکه ایزولهها بهصورت نقطه در آگار قرار میگیرند، این روش اجازهی بررسی چند ایزوله را بر روی یک پلیت میدهد. علاوه بر این، برخی از ایزولهها که در براث بهخوبی رشد نمیکنند و یا اینکه روش براث برای آنها بهاندازه کافی تکرارپذیر نمیباشد میتوانند با این روش بررسی شوند. بهعنوانمثال، به جزء گروه باکتروئیدس فراژیلیس، آگار دایلوشـن روش مرجع توصیهشده توسط CLSI برای تعیین حساسیت باکتریهای بیهوازی میباشد.
روش میکرودایلوشن براث، معمولترین روش رقیقسازی استفاده شده در آزمایشگاه مدرن میکروبشناسی میباشد؛ این روش اساس اکثر سیستمهای تجاری است که امروزه در بسیاری از آزمایشگاهها برای انجام آنتیبیوگرام استفاده میشوند. پلیتهای میکروتیتر تجاری یکبارمصرف که بهصورت دستی تلقیح شده و با مشاهده خوانش میگردند (شکل 1).
به دلیل زحمت زیاد تهیهی پلیت میکروتیتر در داخل آزمایشگاه و تعداد آزمایشهای تائید کیفیت هنگام آمادهسازی پلیت، سیستمهای تجاری تهیهکنندهی آنها بسیار شهرت دارند.
از معایب این روشها پرهزینه بودن این روش و منطبق نبودن آنتیبیوتیکهای کوت شده در میکروپلیتها با نیازهای یک منطقه است. پلیتهای میکروتیتر دارای آنتیبیوتیک جزئی از سیستمهای خودکار نیز هستند که توسط روشهای اسپکتروفتومتری و نورسنجی خوانش میگردند. سیستمهای متعددی که به مدت چند سال وجود داشتند، پایگاههای اطلاعات گستردهای را به وجود آوردهاند و نرمافزارهای کامپیوتری را ارائه دادند که اجازه میدهد دادههای آنتیبیوگرام را جمعآوری و با آنها نتایج را تفسیر کرد.
در سیستمهای تخصصی خودکار نتایج بر اساس تقاطع بحرانی بالینی و همچنین گردآوری سایر اطلاعات مهمی مانند مقاومت ذاتی شناختهشده در ارگانیسمها، پروفایل مقاومت غیرمعمول و قواعد تفسیر میشوند.
بهطورکلی اين روشها خيلي دقيق و حساس ميباشند، ولي ازنظر اقتصادي گرانقیمت و وقتگير بوده و معمولاً در موارد زیر انجام میشوند:
- زماني كه حساسيت دارويي باكتري با روش انتشار از ديسك قابلتعیین نميباشد.
- در بيماراني كه ظاهراً به مقادير كافي و مناسب آنتيبيوتيكتراپي جواب نميدهند.
- براي تعيين ميزان واقعي آنتیبیوتیک
- در بيماران مبتلا به مننژيت.
- در بيماران دچار نقص سيستم ايمني
- در بيماران كليوي و بيماران مبتلا به اندوكارديت
- در افرادي كه بهطور مكرر دچار عود عفونت ميشوند.
- در كارهاي تحقيقاتي و غيره.
در اين روش، پس از تهیه رقتهاي موردنظر و متوالي از آنتيبيوتيك موردنظر، از كشت ميكروبي استاندارد شده به محيط اضافه کرده، بعد از قرار دادن در اتوکلاو 37-35 درجه سانتیگراد به مدت 20-16 ساعت، حداقل غلظت ممانعت كننده (MIC) و يا حداقل غلظت كشنده (MBC) تعیین میگردند.
شکل 1: تعیین حداقل غلظت مهاری (MIC) با روش میکرودایلوشن براث
آنچه در این شکل مشاهده میگردد پلیت میکروتیتر آماده تجاری میباشد که دارای غلظتهای مختلفی از آنتیبیوتیک در چاهکهای مختلف میباشد، غلظتها بهصورت mcg/ml توسط اعداد نوشته شده در زیر هر چاهک مشخص شدهاند و انواع مختلف عوامل ضدمیکروبی توسط علائم اختصاری در نزدیکی هر چاهک دارای بالاترین غلظت مشخص میباشند. ارگانیسم بهصورت دستی درون هر چاهک تلقیح شده و نتیجه توسط مشاهدهی مستقیم خوانش میشود. رشد با کدورت مشخص میشود (در این شکل پیگمان نیز مشاهده میشود) و ارگانیسم در چاهک دارای غلظتی از آنتیبیوتیک که به آن مقاوم است، رشد خواهد کرد.
شاخص حداقل غلظت مهاری (MIC) کمترین غلظتی میباشد که در آن رشد دیده نمیشود. در مواردی که تمامی چاهکهای دارای آنتیبیوتیک منفی هستند، حداقل غلظت مهاری (MIC) پایینتر از کمترین غلظت دارو تعریف میشود، بالعکس وقتیکه رشـد در تمامی چاهکها مشاهده میشود MIC بالاتر از بالاترین غلظت دارو میباشد. در این شکل آخرین آنتیبیوتیک در پایینترین ستون سمت راست سیپروفلوکساسین (CP) با حداقل غلظت مهاری (MIC) کمتر یا مساوی mcg/ml 520 میباشد. سفوتتان در سمت چپ پایین میکروپلیت با رشد واضح در چاهکهای با اعداد 1،2 و ۴ و عدم رشد در چاهک با عدد ۸ با حداقل غلظت مهاری (MIC) برابر mcg/ml 8 مشخص میشود. برای مقایسه (و نیز برای استفاده بهعنوان شاخص صحت آزمایش) چاهک کنترل منفی (C) و کنترل مثبت (G) در سمت چپ بالا مشاهده میشود
(برگرفته از کتاب Henry’s Clinical Diagnosis and Management by Laboratory Methods
چاپ 2017)
2- اپسیلومتر یا E-test
در این روش نوار کاغذی که گرادیانتی از غلظت آنتیبیوتیک روی آن قرار گرفته پس از کشت باکتری روی محیط قرار میگیرد (شکل 2). با این تست میتوان MIC را مشخص کرد، ولی این تست به دلیل گران بودن در آزمایشگاههای ما قابلاجرا نمیباشد و بیشتر در آزمایشگاههای تحقیقاتی یا مرجع مورداستفاده قرار میگیرند. روش اپسیلومتر یا E-test بر پایهی ترکیب مفاهیم هر دو روش براث دایلوشـن و دیفیوژن میباشد.
نوار E-test، یک نوار کاغذی دارای گرادیان غلظت آنتیبیوتیکی در یک سمت خود و مقیاس حداقل غلظت مهاری (MIC) در سمت مقابل است، بنابراین همانند روش براث دایلوشن، حداقل غلظت مهاری (MIC) میتواند توسط آن تعیین شود. استریپ کاغذی در سطح آگاری که با ایزولهی موردبررسی تلقیح شده است، قرار میگیرد. همانند دیسک دیفیوژن، آنتیبیوتیک از نوار به محیط آگار انتشار مییابد با این تفاوت که در این روش انتشار بهصورت گرادیان و بر اساس گرادیان روی نوار رخ میدهد.
اگر ایزوله حساس باشد، ناحیهی مهاری تخممرغی شکل در سطح پلیت که باکتری رشد کرده ایجاد خواهد شد و MIC برابر نقطهای از مقیاس حداقل غلظت مهاری (MIC) که ناحیهی مهاری تخممرغی را قطع میکند، میباشد (شکل 2).
حداقل غلظت مهاری (MIC) بهدستآمده از روش E-test ارتباط نزدیکی را با MIC بهدستآمده از طریق آگار با براث دایلوشن برای اکثر مواد ضدمیکروبی –سویههای باکتریایی دارند. این روش در موارد زیر بسیار کارآمد و مفید است: این روش اجازهی بررسی آنتیبیوتیکهای تکی را علیه ایزولههایی میدهد که استفادههای اختصاصی دارند؛ اگر آزمایش یک ایزوله بر ضد یک دارویی ضروری باشد که در برنامهی آنتیبیوتیکی از پیش طراحیشدهی آزمایشگاه نیست یا اگر آزمایش یک با تعداد کمی از داروها بر ضد گونههای سخت رشد که نیازمند محیط ویژه هستند، لازم باشد (مثل هموفيلوس انفلونزا).
شکل 2- اپسیلومتر یا E -test
گرادیانتی از آنتیبیوتیک (در این مثال پنیسیلین) که در داخل نوار پلاستیکی گنجانده شـده است در سطح آگاری که یک ارگانیسم روی آن پخش شده است (استرپتوکوکوس پنومونیه) قرار میگیرد. محل مقاطع ناحیهی مهاری با مقیاس عددی در سطح نوار بهعنوان حداقل غلظت مهاری (MIC) که در این شکل 50 میباشد محاسبه میگردد
(برگرفته از کتاب Henry’s Clinical Diagnosis and Management by Laboratory Methods
چاپ 2017)
3- دیسک دیفیوژن
آزمایش دیسک دیفیوژن (کربی بایر)، به میزان زیادی به باکتریهای هوازی سریعالرشد و بیهوازی اختیاری محدود میباشد. یک دیسک کاغذی دارای میزان خاصی (نه غلظت) از ترکیب ضدمیکروبی در سطح آگاری قرار میگیرد که حجم استانداردی از ایزولهی موردبررسی بر روی آن کشت داده شده است. آزمایش بر روی پلیتهای 15 سانتیمتری انجام میشود که اجازه بررسی همزمان بیش از ۱۲ آنتیبیوتیــــــــــــک را میدهد.
آنتی بیوتیک موجود در دیسک در محیط آگار انتشار مییابد و باعث ایجاد هاله عدم رشد در نقطهای میشود که غلظت حیاتی ترکیب ضدمیکروبی در محیط، رشد باکتری را بعد از گذشت مدتزمان استانداردی مهار میکند (24-16 ساعت) شکل (3).
نشان داده شده است که قطر ناحیهی مهاری رشد بهصورت معکوس با MIC مرتبط میباشد. رابطهی بین این دو بهصورت خط رگرسیون خطی بیان میشود و تفسیر قطر ناحیههای معادل حساس، نیمه حساس و مقاوم میتواند از روی تقاطع آنها روی خط رگرسیون با شاخص MIC متناظر با آن استخراج گردد. توجه داشته باشید، قطرهایی که نشاندهنده نقاط بحرانی تفـسیری هستند در انواع مختلف ترکیبات دارو – ارگانیسم متفاوت میباشند.
برای مثال قطر ۱۳ میلیمتر برای یک ترکیب دارو – ارگانیسم ممکن است حساس تفسیر شـود، درحالیکه برای یک ماده ضدمیکروبی دیگر ممکن است مقاوم در نظر گفته شود.
دیسک دیفیوژن یک روش ساده میباشد که نتایج حساسیت را بهصورت کیفی نشان میدهد. این تست اجازهی تغییر آسان در آنتی بیوتیک های موردبررسی را فراهم میکند و نسبت به تعدادی از روشهای دیگر ارزانتر و در دسترستر میباشد. این روش در درجه اول یک روش دستی است. اگرچه یک وسیله خوانش پلیت به کمک تصویربرداری بهعنوان بخشی از یک سیستم مدیریت دادههای تعیين حساسيت سيستم BIOMIC چند سال است که در دسترس میباشد.
در آزمایشگاههایی با حجم بالای آزمایشها، به دلیل وابستگی به کار با دست در این روش ممکن است استفاده از روش دیسک دیفیوژن بهعنوان روش روتین تعیین حساسیت جلوگیری گردد. علاوه بر این، گونههای خاصی از باکتریهای سخت رشد ممکن است محیط اختصاصی با شرایطی ویژه برای انجام دیسک دیفیوژن نیاز داشته باشند که میتواند مانع انجام آن بهصورت آزمایش روتین در برخی از آزمایشگاهها گردد، همچنانکه در دسترس نگهداشتن محیط ضروری برای مواقع نادری که انجام این تستها لازم میشود، ممکن است مقرونبهصرفه نباشد.
ارجاع این ایزولهها به آزمایشگاههای مرجع برای انجام تستهای تعیین حساسيت در برخی موارد در چنین موقعیتهایی خیلی بهصرفهتر میباشد.
شکل 3: دیسک دیفیوژن
ناحیهی مهاری اطراف دیسک آنتیبیوتیک (در این شکل وانکومایسین) در سطح محیط آگاری که استرپتوکوکوس پنومونیه بر روی آن رشد یافته اندازهگیری شده است. نتیجه ممکن است بر اساس اندازهی ناحیهی عدم رشد، حساس، نیمه حساس یا مقاوم گزارش گردد
(برگرفته از کتاب Henry’s Clinical Diagnosis and Management by Laboratory Methods
چاپ 2017)
[1] Minimum inhibitory concentration(MIC)
[2] Clinical and Laboratory Standards Institute (CLSI)
[3] European Committee on Antimicrobial Susceptibility Testing (EUCAST)
[4] -Susceptible dose dependent (SDD)
[5] Antibiotic susceptibility testing (AST)
https://www.nhs.uk/conditions/antibiotics/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام

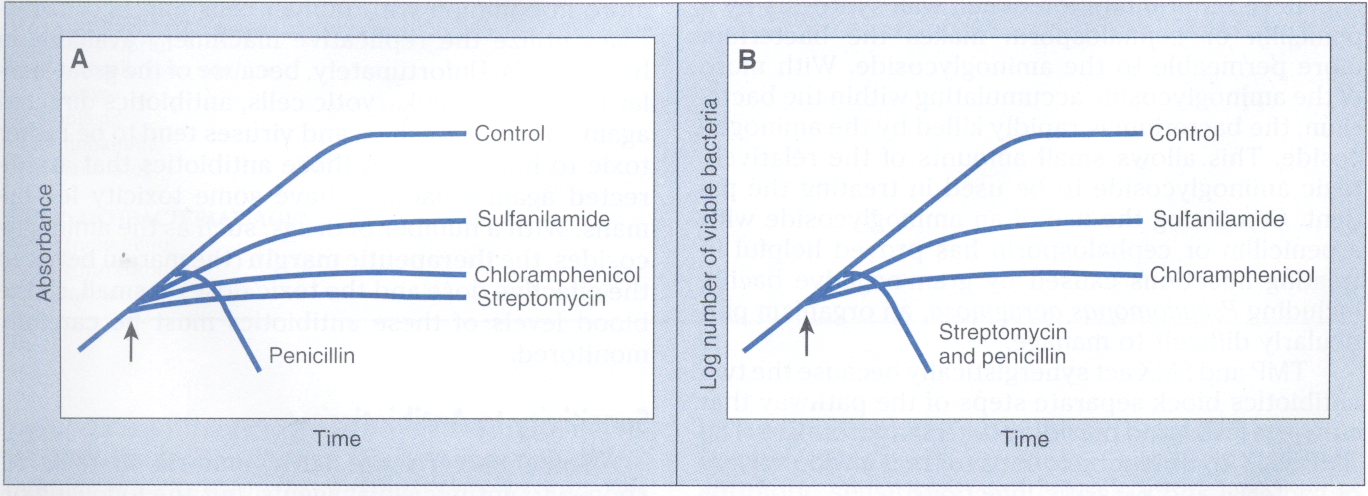
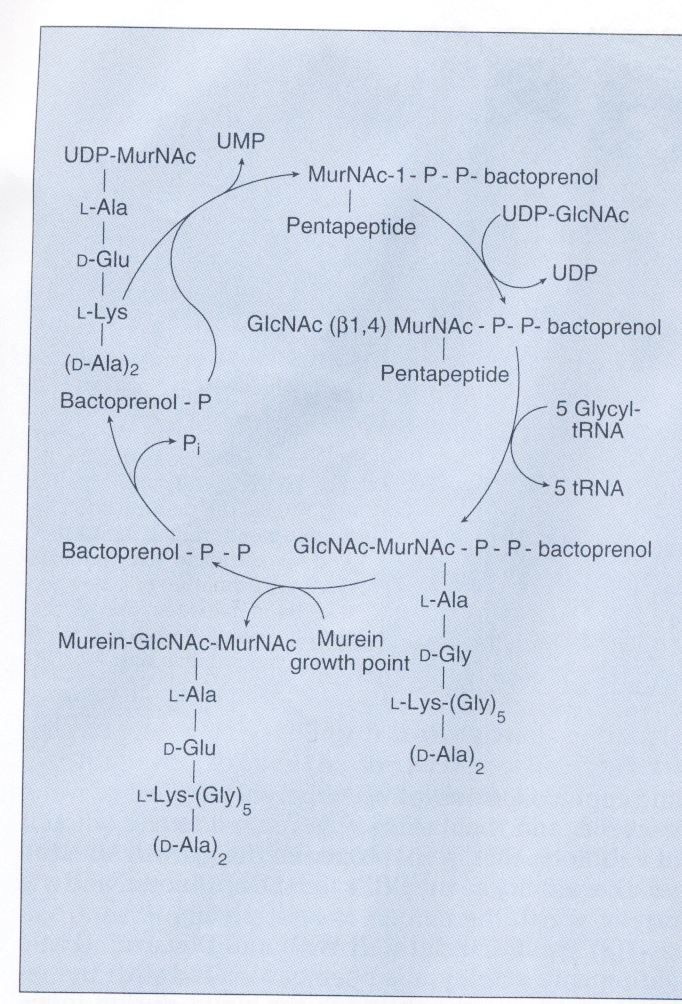
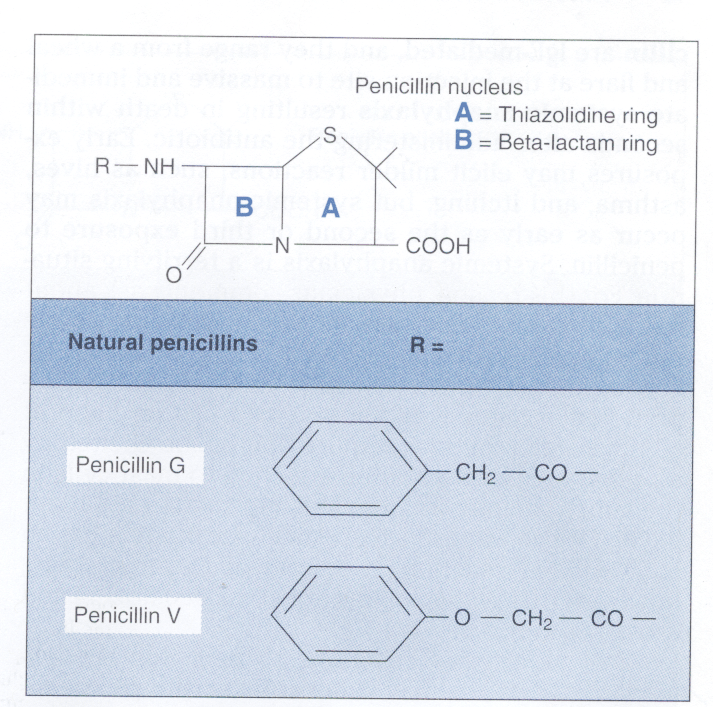
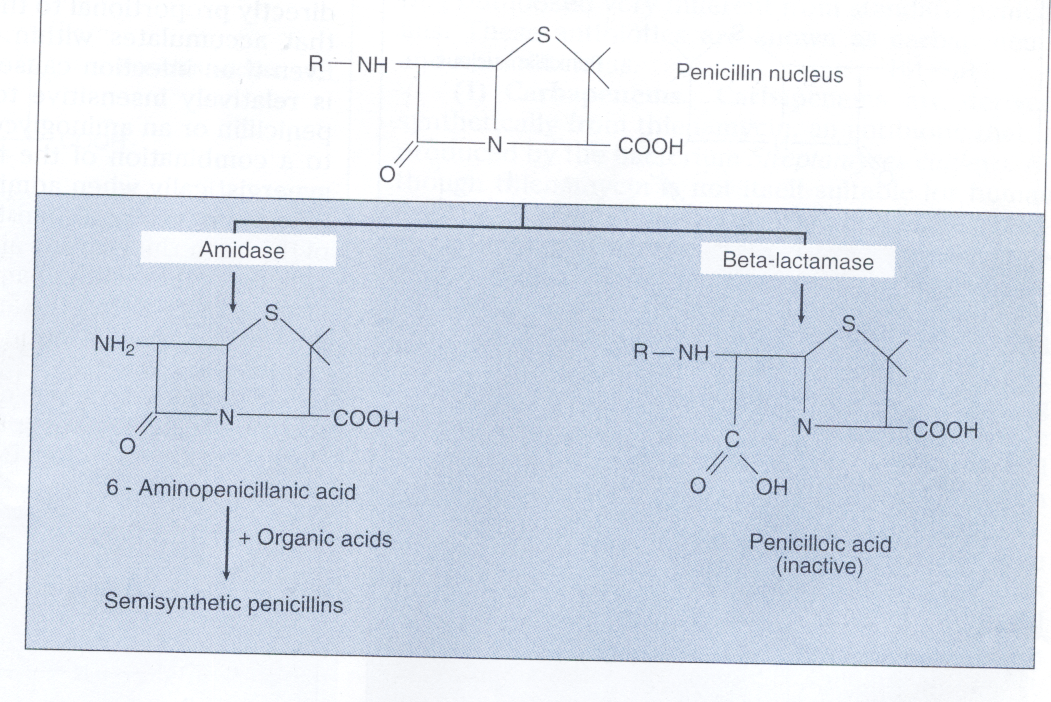
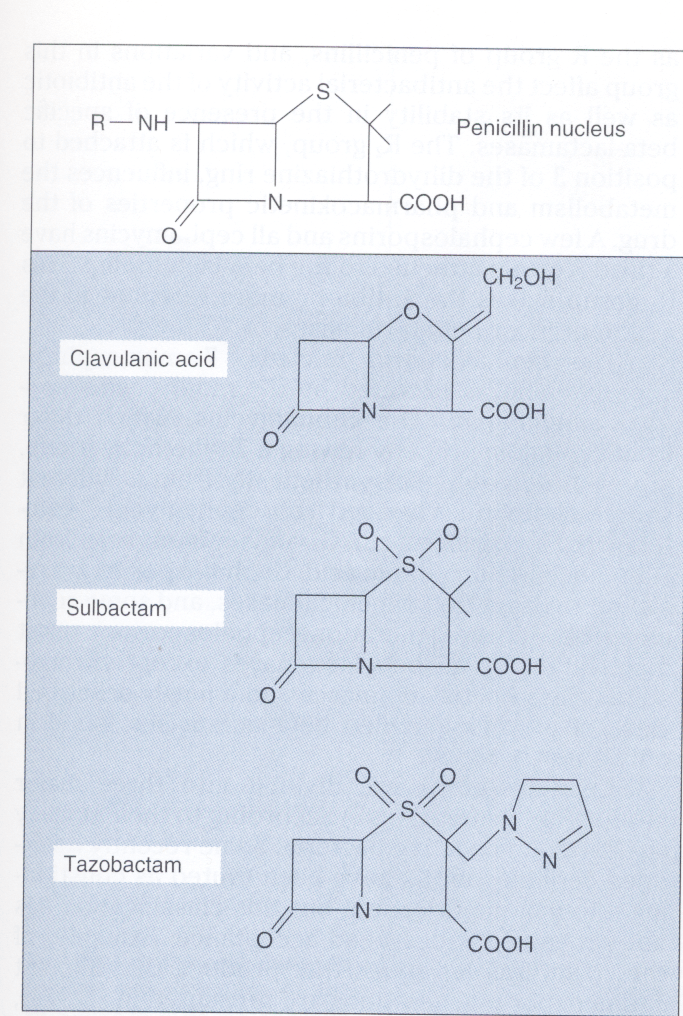

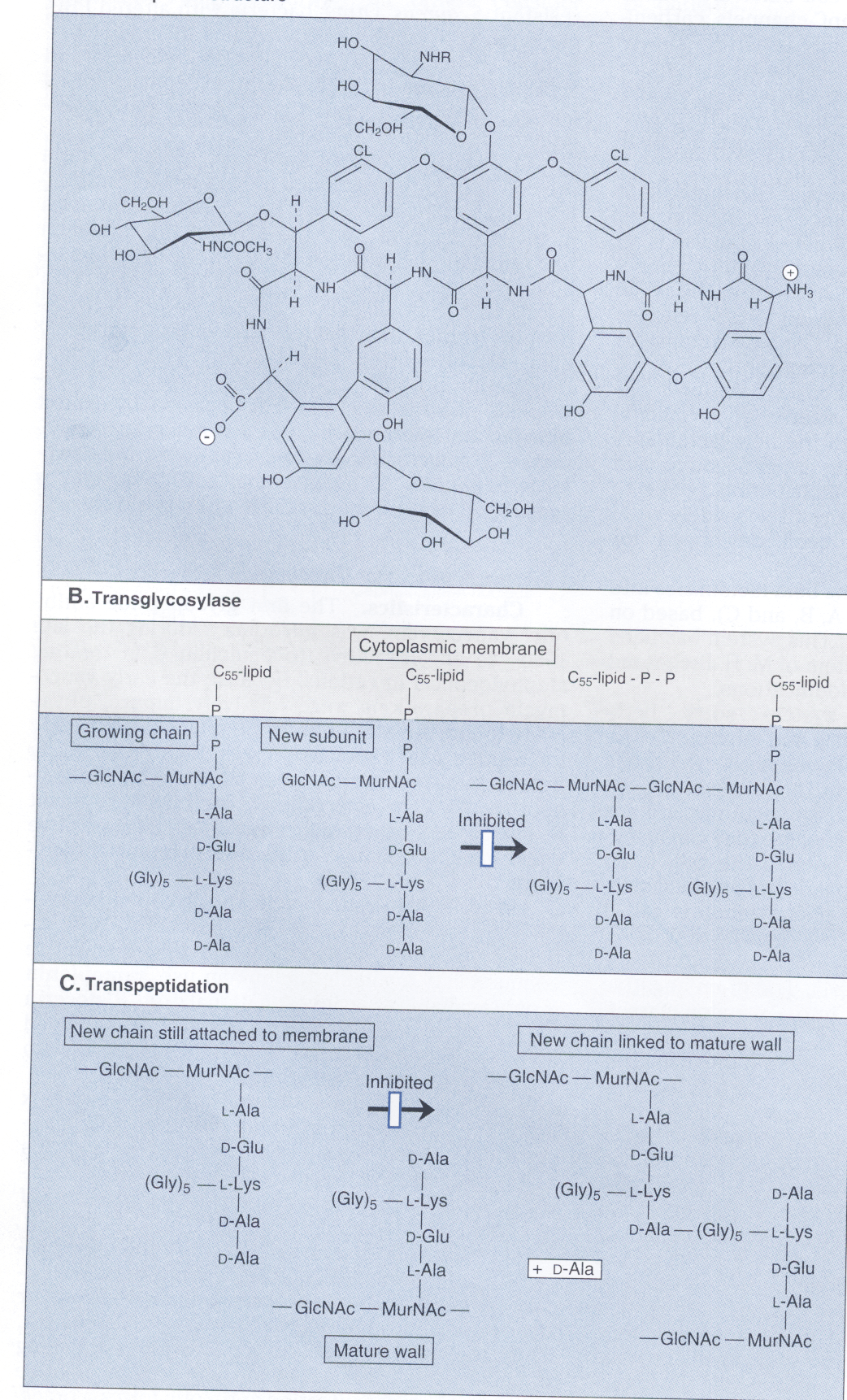
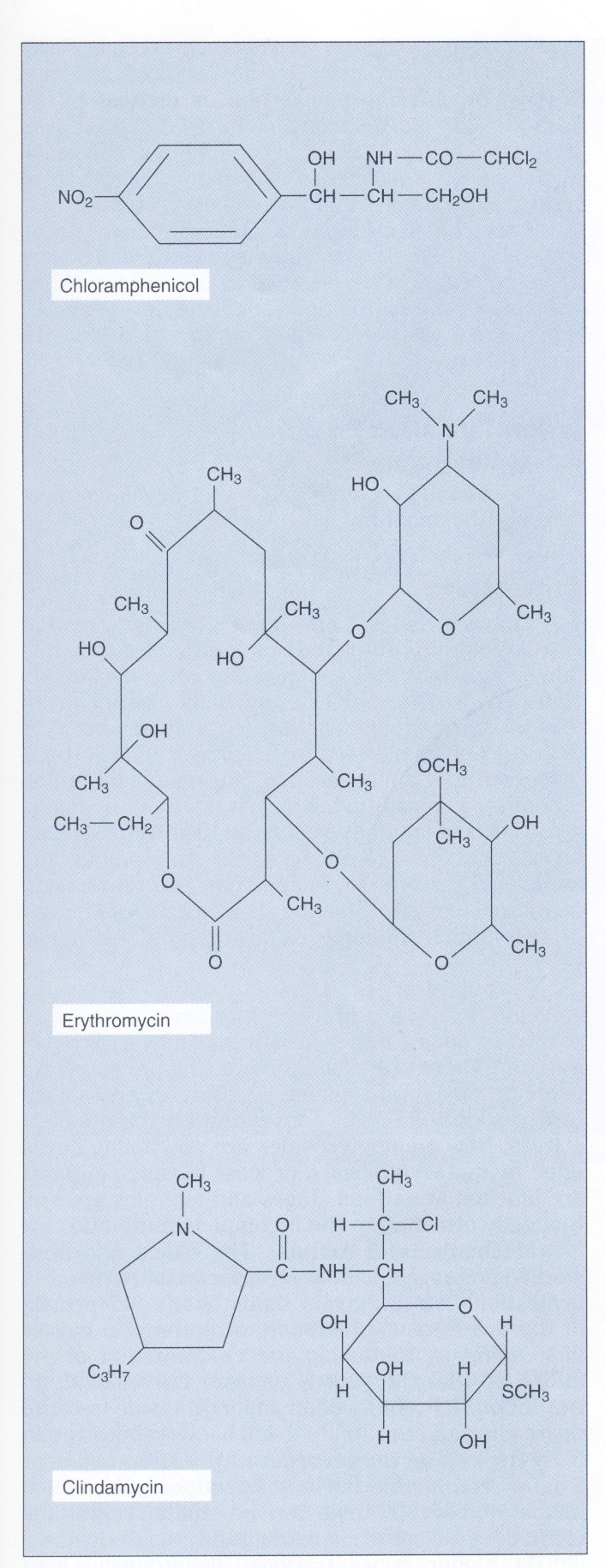
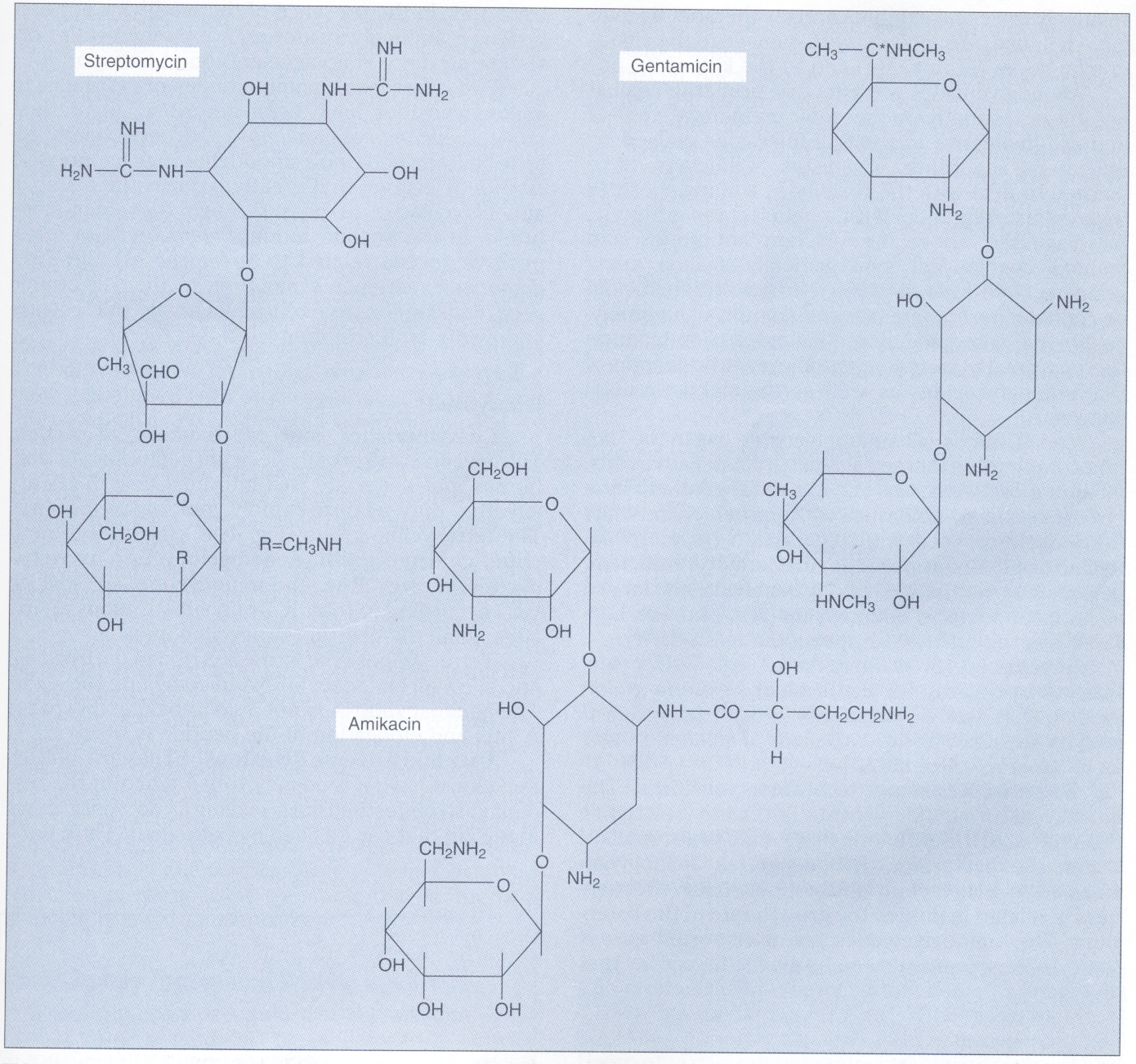
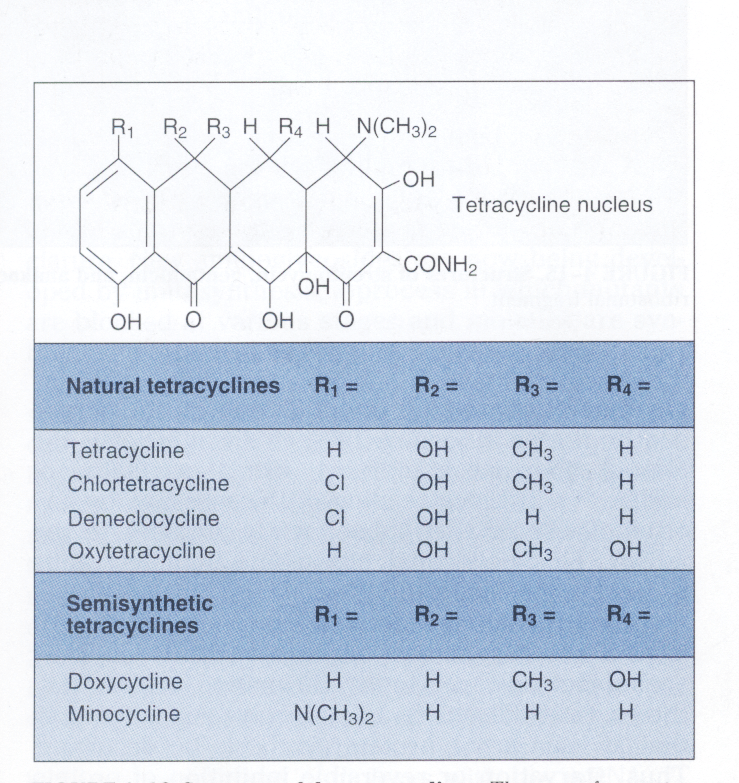

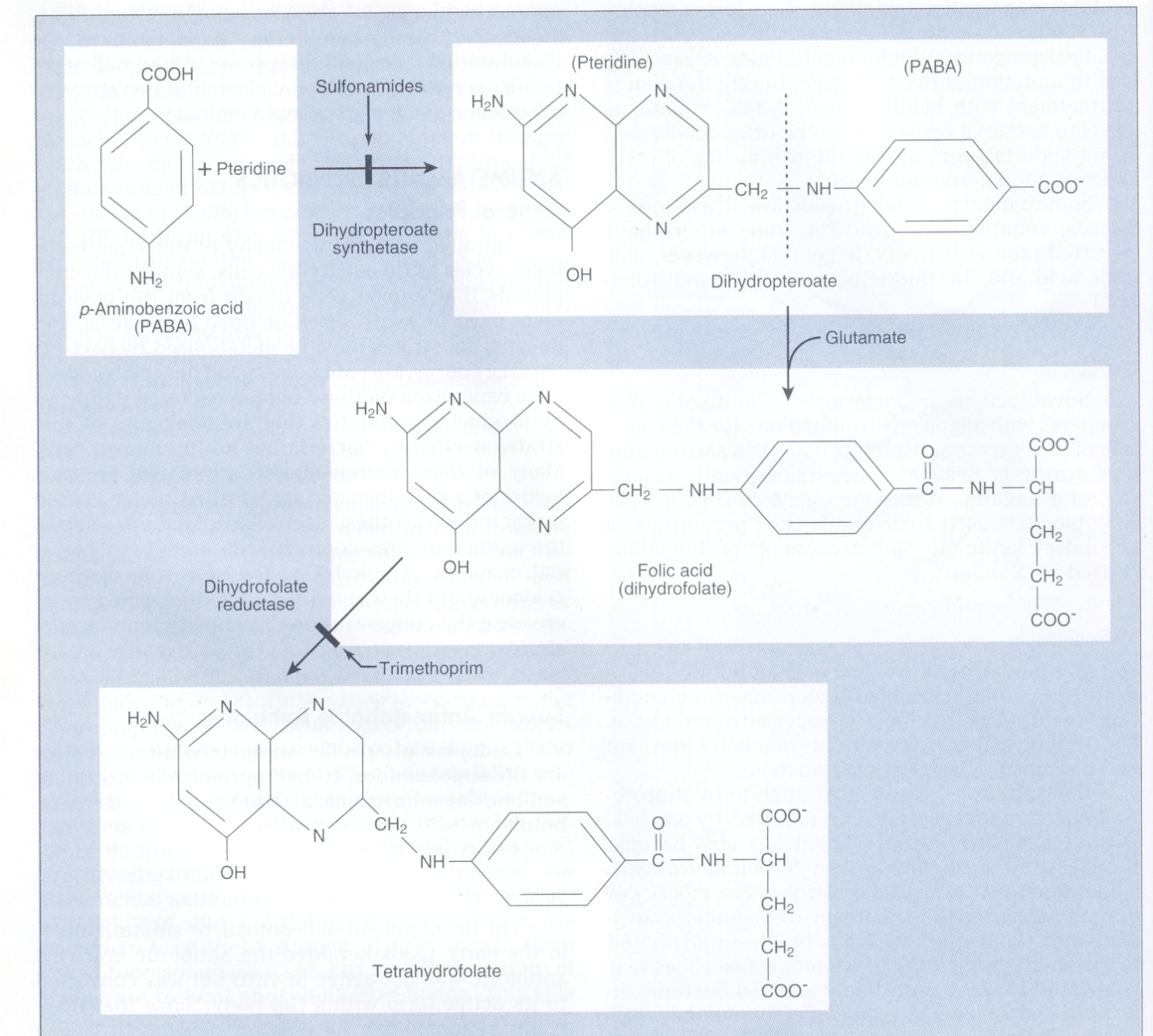
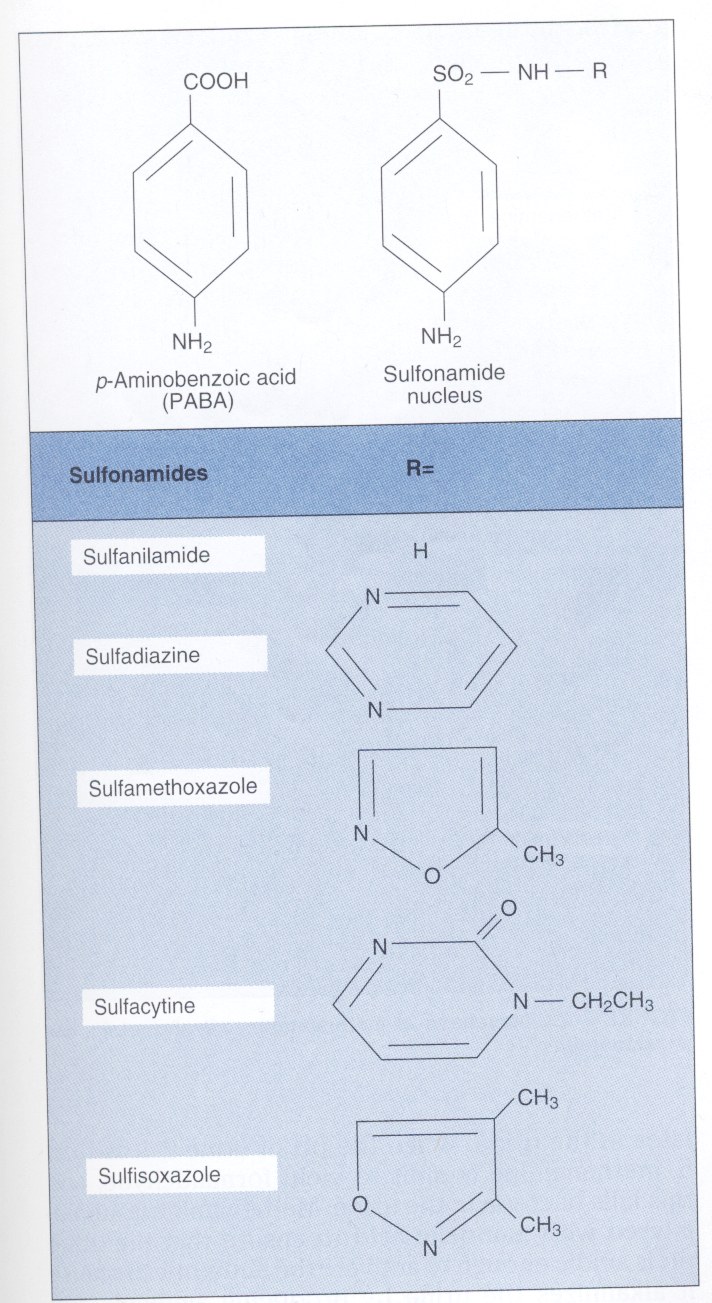
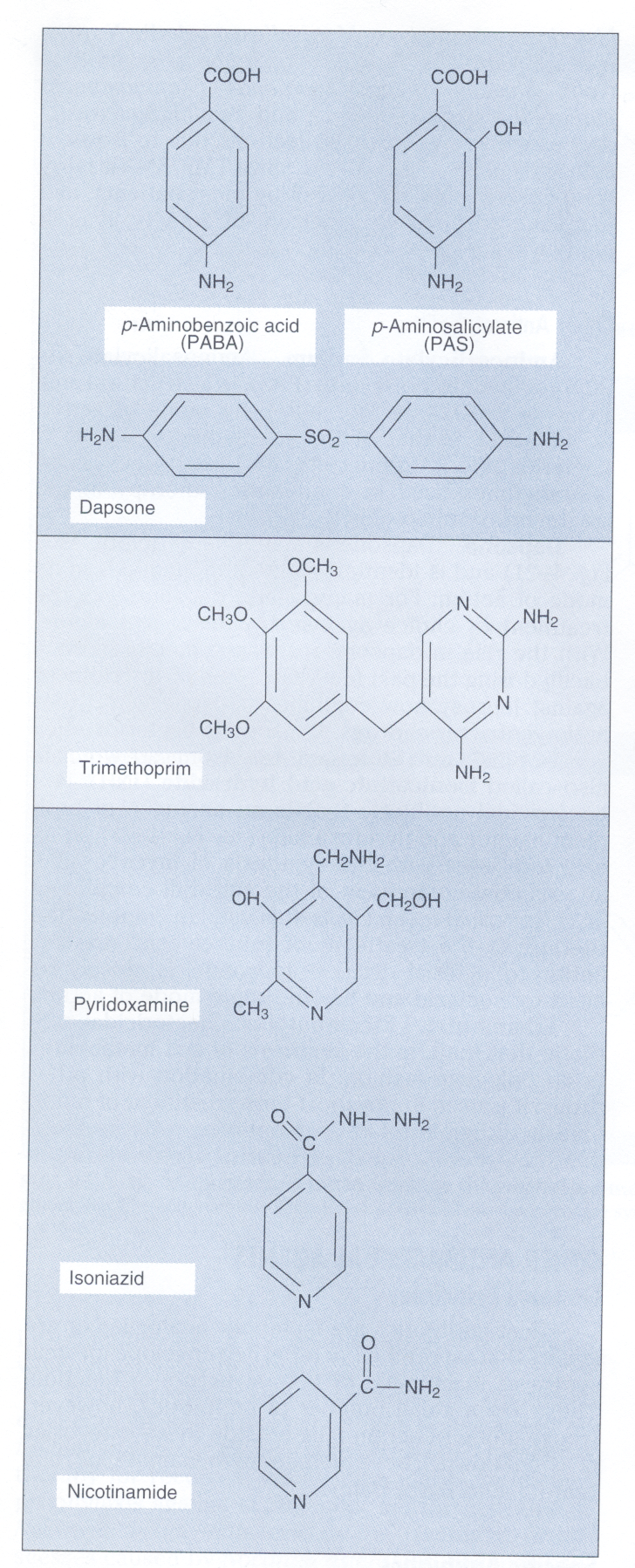

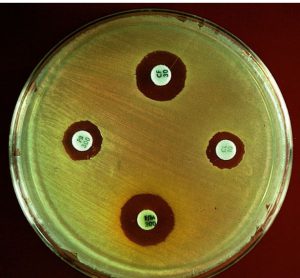



سپاس