آلوایمونیزاسیون گلبولهای قرمز در کودکان بتاتالاسمی ماژور
با تزریق مکرر خون
ماریه بوباش
معرفی
تالاسمی اختلالی خونی، اتوزومال و مغلوب است که در اثر تضعیف و تخریب گلبولهای قرمز بهعلت تغییر یا حذف ژنهای دخیل در فرایند ساخت هموگلوبین ایجاد میشود. حالت هموزیگوت آن یعنی تالاسمی مینور خفیفتر است و ممکن است بدون علامت، همراه با آنمی خفیف یا بدون بروز آنمی باشد. بسته به زنجیره هموگلوبین درگیر، تالاسمی به انواع آلفا، بتا و دلتا تقسیم میشود. درمان پیشنهادی برای بتاتالاسمی ماژور تزریق خون منظم، هر 3 تا 4 هفته یکبار، با هدف اصلاح آنمی برای جلوگیری از اریتروپوئز بیش از حد و جذب آهن اضافه از دستگاه گوارش است. تزریق منظم خون با مشکلات متعددی مواجه است.1
تقریباً در همه بیماران، نیاز به تزریق خون طی سالها بهتدریج افزایش مییابد. عوامل مختلفی در این افزایش نیاز دخالت دارند که عبارتند از پیشرفت هایپراسپلنیسم، آلوایمونیزاسیون علیه آنتیژنهای مختلف گروههای خون، عفونتهای مزمن، کمبود فولات (در صورت عدم اصلاح از طریق مصرف منظم و مادامالعمر فولات)، فیبروز پیشرونده مغز استخوان در نتیجه اثرات سمی آهن آزاد، بحران آپلاستیک و بحران همولیتیک و …
توزیع آنتیژنهای گروههای خونی مختلف در هر فرد از هر جمعیت متفاوت است،2 بنابراین، علاوه بر گروههای ABO و Rh D، تفاوتهای بیشتری در ارتباط با سیستمهای گروههای خونی بین دهنده و گیرنده خون وجود دارد که قبل از انتقال خون عادی بررسی نمیشوند، در نتیجه در برخی مراحل مدیریت انتقال خون، این اختلاف در سیستمهای خونی باعث آلوایمونیزاسیون و در نتیجه پیچیدگی آنتیبادیها در برابر سیستم آنتیژنهای ایمونوژن میشود،3 بنابراین، این مطالعه برای بررسی شیوع سرمی آلوآنتیبادیهای ضد گلبول قرمز در بیماران تالاسمی ماژور که تزریق خون مکرر داشتند، انجام شد.
روشها:
این مطالعه بهصورت مشاهده بیمارستانی در مرکز طبی کودکان دانشگاه علوم پزشکی SMS جیپور از مِی 2015 تا آوریل 2016 انجام شد. قبل از آغاز مطالعه، مجوز کمیته اخلاقی دانشگاه علوم پزشکی S.M.S جیپور گرفته شد. تعداد 150 بیمار بهصورت تصادفی انتخاب شدند و با فاصله اطمینان 95% و خطای قابلقبول 10% در مطالعه شرکت داده شدند. ردیابی آلوآنتیبادیهای ضد گلبولهای قرمز با تکنیک SPRCA (تکنیک چسبندگی RBC به فاز جامد) و با استفاده از دستگاه IMMUCOR انجام شد.
بیماران تالاسمی ماژور مراجعهکننده به این مرکز که تزریقات مکرر خون داشتند، برای انجام این مطالعه انتخاب شدند. از همه بیماران مورد بررسی رضایت گرفته شد. اطلاعات بالینی آنها در فرمهای از پیش تهیهشده وارد شد.
تجزیهوتحلیلهای آماری با استفاده از نرمافزار کامپیوتری (SPSS نسخه 20 و پایینتر) انجام شد. دادههای کیفی بهصورت نسبی و درصد و دادههای کمی بهصورت میانگین با استفاده از آزمون خی دو (x2) و تفاوت میانگین با استفاده از آزمون student t بررسی شد. سطح معنادار برای آزمایشها 95% در نظر گرفته شد (P<0.05).
نتایج:
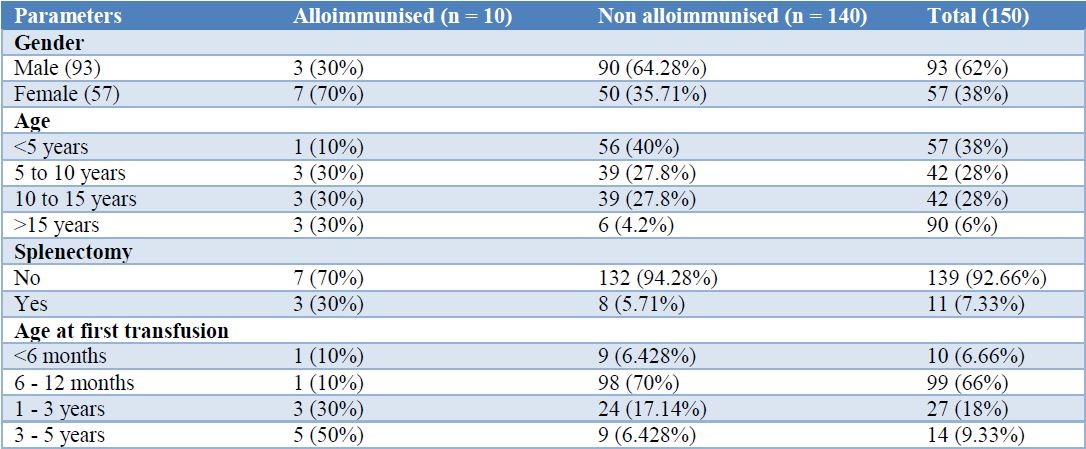
در این مطالعه 150 بیمار بتاتالاسمی ماژور بررسی شدند که 93 نفر از آنها (62%) مرد و 57 نفر (38%) زن بودند و نسبت زنان به مردان 1: 1/63 بود. در 10 بیمار (6/67%) آلوآنتیبادی ایجاد شده بود. از نظر آماری تفاوت جنسیتی در ایجاد آلوآنتیبادیها دخالت نداشت. بیماران مورد مطالعه در محدوده سنی 1 تا 17 سال بودند. 57 بیمار (38%) زیر 5 سال بودند. 11 بیمار سابقه طحالبرداری داشتند. اولین تزریق خون در 72/6% بیماران در سن زیر 1 سال انجام شده بود (جدول 1). سن متوسط بیماران آلوایمننشده و آلوایمنشده به ترتیب 3/95±7/34 سال و 4/28±11/90 سال بود.
جدول 1
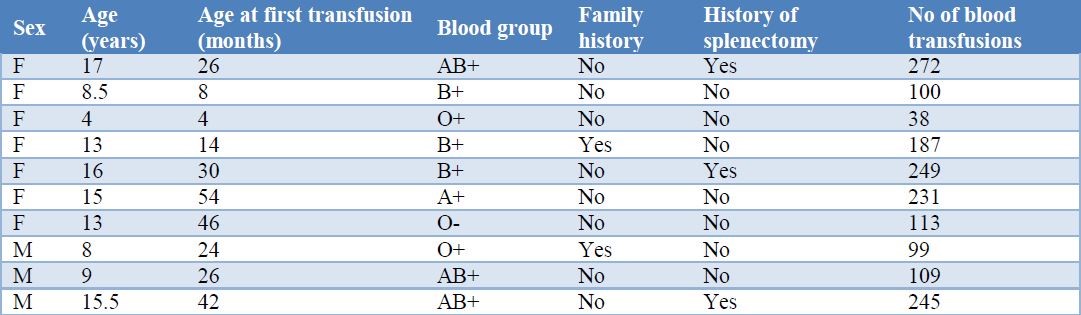
میانگین سن بیماران آلوایمننشده در مقایسه با بیماران آلوایمنشده به میزان قابلتوجهی بالاتر بود (P<0/001). میانگین سن اولین تزریق خون در بیماران آلوایمنشده (27/40 ماه) در مقایسه با بیماران آلوایمننشده (12/9 ماه) بالاتر بود. مجموع دفعات تزریق خون در بیماران آلوایمنشده (81/85±164/30 در مقابل 65/56±93/28) به میزان قابلتوجهی بالاتر بود (جدول 2). بین 10 بیمار آلوایمنشده 2 مورد از آنها دارای سابقه خانوادگی بودند و 3 مورد از آنها سابقه طحالبرداری داشتند (جدول 3)
جدول 2
جدول 3
بحث:
عوامل مؤثر در آلوایمنشدن پیچیدهاند؛ 3 عامل اصلی مؤثر عبارتند از: تفاوت آنتیژنی RBCهای دهنده و گیرنده، وضعیت ایمنی گیرنده و اثرات ایمونومودولاتور سیستم ایمنی در انتقال خون آلوژن.4 در این مطالعه 150 بیمار بتاتالاسمی ماژور انتخاب شدند که 93 نفر از آنها (62%) مرد و 57 نفر (38%) زن بودند و نسبت مرد به زن 1:1/63 بود.
سن بیماران مورد مطالعه بین 1 تا 17 سال بود. میانگین سنی بیماران آلوایمننشده و آلوایمنشده به ترتیب 3/9516±7/341 و 4/28±11/90 سال بود. میانگین سنی در بیماران آلوایمنشده در مقایسه با بیماران آلوایمننشده بیشتر بود. برای بررسی آلوآنتیبادیهای گلبولهای قرمز از پنل RBC تجاری استفاده شد. شیوع کلی آلوایمنشدن RBCها کم و حدود 6/67% بود. این شیوع کم با مطالعه جودری و دیگران و مطالعه پرادان و دیگران که شیوع آن را 5 تا 8% عنوان کرده بودند، همخوانی داشت.5و6 مطالعهای در ایتالیا شیوع آلوایمونیزاسیون را 5/2% گزارش کرد.7 درصورتیکه آنتیبادیهای RBC دهنده و گیرنده یکسان باشند، احتمال آلوایمونیزاسیون گیرنده کمتر است.
میکائیل و دیگران میزان آلوایمونیزاسیون در تزریق خونهایی که تنها از نظر آنتیبادیهایABO و Rh بررسی شدند (گروه سازگارنشده) را 23/43% و در تزریق خونهایی که از نظر ABO، Rh و کِل بررسی شدند (گروه سازگارتر) را 14/28% گزارش کردند.8 میزان آلوایمونیزاسیون در مطالعاتی که در یونان و کویت انجام شد بالا گزارش شد که به ترتیب 22% و 30% بود.4،9 میزان بالاتر آلوایمونیزاسیون میتواند به علت هتروژن بودن جمعیتی که در یونان و کویت زندگی میکنند و عدم تطابق فنوتیپ RBC بین گیرنده و دهنده باشد.
عوامل مختلفی از جمله عوامل نژادی، اختلاف بین توزیع آنتیژنی دهنده و گیرنده، جنس، سن اولین تزریق، مجموع دفعات تزریق خون، طحالبرداری و … در میزان آلوایمونیزاسیون اثر دارند. از بین 10 بیمار آلوایمنشده 3 نفر آقا و 7 نفر خانم بودند. از نظر آماری ارتباط قابلتوجهی بین جنس و آلوایمونیزاسیون یافت نشد. مطالعات بسیاری هم نشان دادند که جنس عامل مهمی در ایجاد آلوایمونیزاسیون نیست.9-11 بااینحال، رِیزنِر و دیگران ارتباط قابلتوجهی بین آلوایمونیزاسیون و جنسیت، بهویژه در کشورهای در حال توسعه، گزارش کردند. آنها همچنین دریافتند که آنمی و بارداری ریسک فاکتورهای مهمی برای آلوایمونیزاسیون هستند.12
در این مطالعه میزان آلوایمونیزاسیون در بیمارانی که اولین تزریق خون آنها در کمتر از 3 سالگی انجام شده بود، کمتر بود (40%). سن متوسط (ماه) اولین تزریق خون در بیماران آلوایمن شده به ترتیب 10/71±12/09 و 21/60±27/40 ماه بود. اختلاف از نظر آماری معنادار بود (P<0/001). اِسپانوس و دیگران نشان دادند آلوایمونیزاسیون بیمارانی که تزریق خون در آنها از سن کمتر از 3 سال آغاز شده بود، به میزان قابلتوجهی کمتر از بیمارانی که تزریق خون در آنها از سن بالاتر آغاز شده بود بروز پیدا میکند (20/9% در مقابل 47/5%).13 خطر آلوایمونیزاسیون در بیماران مبتلا به هموگلوبینوپاتی که درمان با تزریق خون را از سن پایین (<3 سال) آغاز کردند در مقایسه با بیمارانی که درمان را در سنین بالاتر آغاز کردند، به میزان قابلتوجهی پایینتر بود که سیستم ایمنی تکاملنیافته و انواعی از تحمل اکتسابی نسبت به آنتیژنهای آلوژن RBC بهعنوان عامل قابلقبول برای کاهش این خطر در نظر گرفته میشود.
در این مطالعه تعداد کل دفعات تزریق خون در بیماران آلوایمنشده بیشتر گزارش شد. میانگین تعداد دفعات تزریق خون در بیماران آلوایمننشده و آلوایمنشده به ترتیب 65/65±93/28 و 81/847±164/30 بار بود. در بیماران آلوایمنشده میانگین تعداد دفعات تزریق خون در مقایسه با بیماران آلوایمننشده بهطور قابلتوجهی بالاتر بود. در تعداد کمی از مطالعات ارتباط بسیار محکمی بین تعداد واحدهای خون تزریق شده و ایجاد آلوآنتیبادی مشاهده شد،7،14 درحالیکه در سایر مطالعات هیچ ارتباطی بین تعداد تزریق و میزان آلوایمونیزاسیون یافت نشد.8،15 اِسپانوس و دیگران مشاهده کردند که ارتباط بین تعداد واحدهای خون تزریقشده و ایجاد آنتیبادی در تالاسمی ماژور ناشناخته است، اما عامل مهمی برای افزایش آلوایمونیزاسیون است.13
طحالبرداری هم بهعنوان ریسک فاکتور آلوایمونیزاسیون در نظر گرفته میشود. از نظر آماری تفاوت قابلتوجهی از نظر میزان آلوایمونیزاسیون بین بیماران طحالبرداریشده و طحالبردارینشده وجود داشت (27/27% در مقابل 0/5%، P=0/027). این مشاهده مشابه مطالعه حسین و دیگران است که میزان آلوایمونیزاسیون را در بیماران طحالبرداریشده بالاتر گزارش کردند.16 بااینحال، برخی مطالعات ارتباط اندکی بین طحالبرداری و میزان آلوایمونیزاسیون در بیماران تالاسمی پیدا کردند.15،7 این نتایج متناقض ممکن است با عوامل مختلفی از جمله بار تزریق RBC، زمان اولین بیان آنتیژن RBC (قبل از طحالبرداری در برابر بعد از طحالبرداری) و طول عمر RBCهای تزریقشده در ارتباط باشد.
در این مطالعه تنها بررسی آلوآنتیبادیها انجام شد. ما آلوآنتیبادیهای خاص را شناسایی نکردیم. در صورت نیاز، تعیین فنوتیپ دقیقتر با استفاده از 11 پنل سلولی تجاری RBC ضروری است.
نتیجه:
شروع درمان با خون سازگار از نظر آنتیژن، پس از تشخیص، میزان آلوایمونیزاسیون را در بیماران بتاتالاسمی ماژور کاهش داد.
اگر بیمار در غربالگریهای منظم دارای آلوآنتیبادی علیه گلبولهای قرمز باشد، باید شناسایی آنتیبادی انجام شود و تزریق خونی که آنتیژنهای مربوطه در آن منفی باشد در بیماران تالاسمی که نیاز به تزریق خون دارند بهشدت توصیه میشود.
این مقاله ترجمهای است از:
Red cell alloimmunization in repeatedly transfused children with beta thalassemia major
Ravi Kumar Jeengar, AlokUpadhyaya*, NehaAgarwal, Amarjeet Mehta
Department of Pediatrics medicine, Sawai Man Singh Medical College, Jaipur, Rajasthan, India
Downloaded from:http://www.ijpediatrics.com on may 2017
منابع:
- Michael R. DeBaun, Melissa J. Thalassemia Syndromes. In: Nelson Textbook of Pediatrics. 20th ed. Elsevier. 2016;2349-53.
- Hassan K, Ikram N, Dodhy M, Burki UF and Tahir M. Prevalence of beta-thalassemia trait in and around Islamabad. JRMC. 1997;1:18-21.
- Rehman M and Lodhi Y. Prospects of future of conservative management of beta-thalassemia major in a developing country. Pak. J. Med. Sci. 2004;20(2):105-7
- Singer ST, Wu V, Mignacca R, Kuypers FA, Morel P, Vichinsky EP. Alloimmunization and erythrocyte autoimmunization in transfusion-dependent thalassemia patients of predominantly Asian descent.Blood. 2000;96:3369-73.
- Choudhary R, Sukla JS, Pradhan D, Pahi J. Red Cell Alloimmunization in Multiply Transfused Patients. Indian J Hematol Blood Transfusion. 1997;15(4):10-2.
- Pradhan V, Badakere S, Vasantha K, Koraonkar S, Panjawani S, Jajoo N. Antibodies to red cells in beta thalassemia major patients receiving multiple transfusion. Indian J Hematol Blood ransfuse. 2001;19(4):100-1.
- Sirchia G, Zanella A, Parravicini A, Morelati F, Rebulla P, Masera G. Red cell alloantibodies in thalassemia major. Results of an Italian cooperative study.Transfusion. 1985;25:110-2.
- Michail-Merianou V, Pamphili-Panousopoulou L, Piperi-Lowes L, Pelegrinis E, Karaklis A. Alloimmunization to red cell antigens in Thalassemia: Comparative study of usual versus Better-Match Transfusion. Vox Sang. 1987;52:95-8.
- Ameen R, Al-Shemmari S, Al-Humood S, Chowdhury RI, Al-Eyaadi O, Al-Bashir A. RBC alloimmunization and autoimmunization among transfusion-dependent Arab thalassemia patients. Transfusion. 2003;43:160410.
- El Danasoury AS, Eissa DG, Abdo RM, Elalfy MS. Red blood cell alloimmunization in transfusion-dependent Egyptian patients with thalassemia in a limited donor exposure program. Transfusion. 2012;52:43-7.
- Hendrickson JE, Desmarets M, Deshpande SS, Chadwick TE, Hillyer CD, Roback JD, et al. Recipient inflammation affects the frequency and magnitude of immunization to transfused red blood cells. Transfusion. 2006;46:1526-36.
- Reisner EG, Kostyu DD, Phillips G, Walker C, Dawson DV. Alloantibody responses in multiply transfused sickle cell patients.Tissue Antigens. 1987;30:161-6.
- Spanos T, Karageorga M, Ladis V, Peristeri J, Hatziliami A, Kattamis C. Red cell alloantibodies in patients with Thalassemia. Vox Sang. 1990;58:50-5.
- Pandey H., Das SS, and Chaudhary R. Red cell alloimmunization in transfused patients: A silent epidemic revisited. Asian J Transfus Sci. 2014;8(2): 75-7.
- Rosse WF, Gallagher D, Kinney TR. Transfusion and alloimmunization in sickle cell disease. Blood. 1990;76:1431-7.
- Hussein E, Desooky N, Rihan A, Kamal A. Predictors of red cell alloimmunization in multitransfused Egyptian patients with beta-thalassemia. Arch Pathol Lab Med. 2014;138:684-8.
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام