الزامات پرهآنالیتیک آزمایش ادرار
دکتر امیر هوشنگ نژاده، دکترای علوم آزمایشگاهی
چکیده:
ادرار یک مایع دفعی است اما اطلاعات زیادی در آن نهفته است. در یک استراتژی جامع انجام آزمایش ادرار، وجود روشهای استاندارد جهت جمعآوری، انتقال، آماده کردن نمونه و انجام آزمایش اساس تشخیص صحیح است. در سالهای اخیر با توسعه تکنولوژی، تکرارپذیری انجام آزمایش ادرار بهبود قابلتوجهی یافته است و لذا توجه به مراحل پرهآنالیتیک اهمیت بیشتری مییابد. از آنجایی که جمعآوری نمونه ادرار اغلب بر عهده خود بیمار است، لذا آزمایش ادرار میتواند از مراحل پرهآنالیتیک بسیار تأثیرپذیر باشد. روشهای نمونهگیری مختلف و حملونقل ناصحیح نمونه میتوانند منشأ خطاهای پرهآنالیتیک باشند. استفاده از مواد نگهدارنده برای برخی آنالیتها میتواند مفید باشد. متأسفانه یک ماده نگهدارنده همگانی که برای تمامی اجزاء مورد آزمایش در ادرار مفید باشد وجود ندارد. در کاربریهای جدید (مثل متابولومیکس) هم خطاهای پرهآنالیتیک تأثیرگذار هستند.
در مقاله مروری حاضر به مشکلات فعلی مربوط به مرحله پرهآنالیتیک و الزامات ضروری برای انجام آزمایش جهت متداولترین آنالیتهای ادراری میپردازیم.
مقدمه
بعد از آزمایشهای شیمی سرم/ پلاسما و CBC ، آزمایش تجزیه ادرار سومین آزمایش متداول در آزمایشگاهها است (1، 2). در طی دههها آزمایش میکروسکوپی ادرار استاندارد طلایی در این حوزه بوده است (3). ظهور تجهیزات اتوماسیون، دقت و تکرارپذیری این آزمایش را افزایش داده است (4)، از طرف دیگر متمرکز شدن آزمایشگاهها فاصله بین بیمار و آزمایشگاه را افزایش داده و این خود میتواند منجر به خطاهای پرهآنالیتیک شود، لذا برای بهبود نتایج آزمایش باید بر روی حوزه پرهآنالیتیک تمرکز بیشتری داشت (5) که این امر خود موجب کاهش هزینهها میگردد (6).
در آزمایشگاه بالینی، کیفیت تام بستگی به صحت انجام فعالیتها در تمامی روند انجام آزمایش دارد که نهایتاً منجر به تشخیص قابل اعتماد و مراقبت مؤثر از بیمار میگردد. ایجاد بهبود در روشهای آنالیتیک، معرفها و تجهیزات سبب شده که در طی سی سال اخیر خطاهای آنالیتیک ده برابر کمتر شوند. پیشرفت در تکنولوژی اطلاعات و روشهای اطمینان کیفی به کاهش بیشتر خطاهای تشخیصی کمک کرده است، لذا سهم عمده خطاهای تشخیص آزمایشگاهی (و بهویژه آزمایش تجزیه ادرار) در خارج از حیطه آنالیتیکال یعنی قسمت پرهآنالیتیکال و پست آنالیتیکال قرار گرفته است (7).
مراحل مختلفی در قسمت پرهآنالیتیکال تجزیه ادرار وجود دارد؛ تشخیص نیاز به انجام آزمایش، جمعآوری و انتقال نمونه به آزمایشگاه، دریافت نمونه توسط آزمایشگاه و آمادهسازی آن برای انجام آزمایش و تحویل آن به بخش مربوطه همگی میتوانند منشأ خطاهای پرهآنالیتیکال باشند (8)، لذا جهت کاهش خطا در مرحله پرهآنالیتیکال تلاشهای بیشتری لازم است و در این مقاله ما تلاش میکنیم که مروری کلی به چالشهای پرهآنالیتیکال تجزیه ادرار داشته باشیم.
آمادهسازی بیمار و روش تهیه نمونه
آزمایشگاه مسئولیت دارد اطلاعات صحیح را در خصوص آمادهسازی بهینه بیمار و روش جمعآوری نمونه فراهم سازد و در دسترس قرار دهد. تفسیر صحیح نتایج آزمایش زمانی ممکن میگردد که این شرایط رعایت شده باشند. آگاهسازی بیمار فراتر از این است که صرفاً در خصوص جنبههای عملی تهیه نمونه توضیح داده شود، بهویژه در خصوص عوامل تأثیرگذار در نتیجه آزمایش همچون رژیم غذایی، دیورز، ورزش و سایر عوامل باید توضیحات کافی ارائه گردد. در صورت لزوم راهنمای تهیه نمونه بهصورت مصور ارائه شود (10). علیرغم وجود دستورالعملها، اهمیت جمعآوری صحیح نمونه توسط بیماران معمولاً درک نمیشود. در مقالهای که اخیراً توسط Miler etal منتشر گردید مشخص شد که جمعآوری نمونه ادرار 24 ساعته در بیش از نیمی از موارد در خصوص بیمارانی که مسن هستند (اغلب بالاتر از 65 سال) و بیماری مزمن دارند، بهطور صحیح انجام نمیشود. این افراد راهنمای مکتوب را بهطور دقیق توجه نمیکنند و جمعآوری ناقص انجام میدهند و یا اینکه نمونه را در ظرف مناسب جمعآوری نمیکنند.
برای کاهش خطاهای پرهآنالیتیک باید پرسنل آزمایشگاه، پزشکان و بیماران همگی آموزش ببینند و در مواردی که روش جمعآوری غلط بوده باید نمونهگیری تکرار شود (11).
کیفیت نتایج گزارششده میتواند از متغیرهای فرآیند آمادهسازی نمونه نیز تأثیر بپذیرد. اهمیت آمادهسازی نمونه در مورد آنالیز پارتیکلهای مختلف ادرار در مقایسه با انجام تست نواری یا کشت ادرار اهمیت بیشتری دارد؛ بهعنوان نمونه در خصوص اهمیت مواد مداخلهگر میتوان از اثر مداخلهگر صابون بچه در سنجش tetrahydrocannabinol (THC) به روش ایمونواسی یاد کرد. علاوه بر حوزه سلامت، غربالگری در خصوص داروهای نوزادان تبعات قانونی هم دارد. ترکیب ادرار عاری از دارو با محصولات مختلفی که بهطور معمول با پوست کودکان تماس دارند به روش ایمونواسی آزمایش گردید. افزودن صابون کودکان به ادرار عاری از دارو منجر به تغییرات چشمگیری در سنجش THC به روش ایمونواسی گردید. صابون و محصولات تمیزکننده کودکان میتوانند منجر به نتایج مثبت کاذب در سنجش THC گردند.
چه اقدامات احتیاطی باید اجرا گردد؟
با اقدامات ساده احتیاطی میتوان میزان آلودگی را به حداقل رساند. تنها با شستشوی قسمت خارجی دستگاه ادراری در زنان و مردان میتوان 20% از میزان موارد مثبت کاذب در کشت ادرار کاست (10، 13، 14). استفاده از صابون یا مواد ضدعفونیکننده در این خصوص توصیه نمیشود چرا که بر روی باکتریها اثر مهاری دارند (10، 15).
انتخاب روش نمونهبرداری
روشهای متعددی جهت نمونهبرداری ادرار وجود دارد که هر یک مزایا و معایب خاص خود را دارند. برای انتخاب بهترین روش باید شرایط بیمار (وجود کاتتر، نوع میکروارگانیسم که مشکوک به آن هستیم) را در نظر گرفت. کیفیت نمونهبرداری در صورتی تضمین میشود که دستورالعمل استاندارد برای جمعآوری ادرار در دسترس باشد (10، 13). معمولترین روش در کارهای روتین جمعآوری ادرار میانی صبحگاهی در ظرف استریل است. گرچه احتمال رشد باکتریها در طی شب در مثانه وجود دارد که بر روی کستها و سلولها اثر میگذارد. تکرارپذیری آزمایشهای مرفولوژیک وقتی که زمان ماندن ادرار در مثانه حدود 2-1 ساعت باشد افزایش مییابد، به همین لحاظ ممکن است 4-2 ساعت پس از گرفتن نمونه صبحگاهی درخواست گرفتن یک نمونه دیگر بشود (16). در یک مطالعه جدید (17) نتایج آزمایش قسمت اول ادرار با قسمت میانی آن مقایسه شده است. آزمایش روتین تجزیه ادرار بهوسیله دستگاههای اتوماتیک نوارخوان و نیز دستگاه اتوماتیک سنجش پارتیکلها بر روی دو نمونه انجام گردید. نمونهها از افراد سالم جمعآوری شده بود. در نمونه اولیه تعداد سلولهای اپیتلیال، گلبولهای قرمز و گلبولهای سفید بهطور قابلتوجهی بالاتر بود، اما در مورد CAST اینطور نبود. همچنین در نمونه اول تعداد سلولهای اپیتلیال، گلبول قرمز و سفید در نمونه اولیه زنان از مردان بیشتر بود، اما در مورد نمونه میانی اینچنین نبود. در مجموع تعداد افرادی که سلولهای ادرار آنها بالاتر از حد طبیعی بود، در خصوص نمونه اولیه بیشتر از نمونه میانی بود، لذا نمونه میانی بهواسطه اینکه عناصر آلودهکننده همچون باکتریها و ذرات دیگر در آن کمتر است بهعنوان مناسبترین نمونه مورد تأیید است (10).
کنفدراسیون اروپایی طب آزمایشگاهی (ECLM) در خصوص آزمایش ادرار روشهای اندازهگیری را طبقهبندی کرده است. بر اساس این طبقهبندی سطوح مختلفی از دقت تعریف شده است (سطح 1 تا 4).
سطح یک شامل روشهای سریع یا غربالی است که در آزمایشهای بر بالین بیمار (POCT) و اغلب با نتیجه توصیفی انجام میشود. برخی از این آزمایشها در صورتی که ویژگی و حساسیت آنها افزایش یابد برای غربالگری در آزمایشگاههای بزرگتر هم مناسب هستند. آزمایشهای سطح دو در آزمایشگاههای روتین انجام میشود و بسیاری از آنها قابلیت اتوماسیون را دارند و یا حتی در حال حاضر هم به شکل اتوماتیک انجام میشوند.
سطح سه شامل آزمایشهای “روزآمدی” میشود که جهت مقایسه رضایتبخش هستند و نهایتاً سطح چهار شامل آزمایشهایی هستند که بهترین روشها (روشهای رفرانس و قطعی) را استفاده مینمایند.
مثالهایی از سطحبندی ECLM در مورد برخی آزمایشها به شرح ذیل ارائه میگردد:
- آزمایش گلبولهای سفید و قرمز
سطح یک: آزمایش با نوار
سطح دو: مشاهده میکروسکوپی رسوب ادرار
سطح سه: شمارش سلولها در لام مدرج
- آزمایش آلبومین و پروتئین ادرار
سطح یک: آزمایش با نوار
سطح دو: سنجش کمی
سطح سه: سنجش دقیق قابلردیابی: استاندارد پروتئین CRM470
- آزمایش باکتری
سطح یک: کشت با دیپ اسلاید
سطح دو: کشت با لوپ استاندارد یک بار مصرف µl1
سطح سه: تیتراسیون کلنی با تلقیح 100-10 میکرولیتر نمونه به دو محیط مختلف CLED و هماتین آگار
- آزمایش مقدار دفع ادرار (دیورز)
سطح یک: نوار
سطح دو: کراتینین و رفراکتومتری
سطح سه: سنجش اسمولالیتی
ظروف نمونهبرداری
جمعآوری نمونه ادرار منشأ خطاهای پرهآنالیتیک متعددی است. برای کشت ادرار جمعآوری نمونه بهصورت استریل ضرورت دارد. طراحی ظرف جمعآوری باید بهگونهای باشد که امکان جمعآوری راحت نمونه، حملونقل بهینه و شناسایی حساس پاتوژنها را بدهد. علاوه بر این باید از مواد تداخلکننده عاری بوده و از مواد غیرقابل حل ساخته شده باشد تا بر روی آنالیتهای مورد سنجش تأثیری نگذارد. اندازه ظرف باید با حجم ادراری که قرار است جمعآوری گردد، متناسب باشد. الزامات دیگری هم ممکن است برحسب نوع آنالیت ضرورت پیدا کند؛ مثلاً برای سنجش پورفرینها و اوروبیلینوژن که نسبت به نور حساس هستند باید از ظرف کهربایی رنگ استفاده شود (8، 10).
نمونه اولیه جهت اجتناب از آلودگی باید دو قسمت شود و از نظر میکروبیولوژیک، مرفولوژیک و آنالیتهای شیمیایی بررسی گردد. ظرف ثانویه باید این خصوصیت را داشته باشد که بتوان بهراحتی نمونه را از ظرف اولیه به آن منتقل نمود، بیآنکه موجب آلودگی محیط و ترشح به بیرون گردد. لولههای انتقال بهتر است تهگرد باشند تا بهراحتی بتوان رسوب ادرار را پس از سانتریفیوژ در آن مجدداً به حال سوسپانسیون درآورد (10).
برای کاهش خطا و آلودگی، سیستمهای خلأ تجاری وجود دارند که امکان انتقال مستقیم نمونه را از ظرف اول به دوم فراهم میکنند.
سیستمهای انتقال خلأ برای سنجش شیمیایی کاربرد دارند و برای آزمایش پارتیکلها توصیه نمیشوند. در هنگام آسپیراسیون با سیستمهای خلأ کستهای شکننده بهواسطه اختلاف فشار خرد میشوند. سیستمهای خلأ در مقایسه با روش معمول استفاده از لوله آزمایش موجب کاهش شدید کستهای هیالین و کستهای سلولی (58% و 51%) میشوند (4).
کاهش کستها به میزان خلأ در هنگام انتقال بستگی دارد (19). در هنگام انتقال با سیستمهای خلأ، کستهای سلولی (که محتویات سلولی آنها بهطور ضعیف بهوسیله پروتئین تام هورسفال به هم متصل شدهاند) خرد میشوند و سلولها آزاد میگردند و لذا مقدار گلبولهای قرمز و سفید در نمونه افزایش مییابد. مقدار گلبولهای قرمز در انتقال بهوسیله سیستمهای خلأ تا حدود 25% بیشتر از روش متداول است (4). در این شرایط تنها با بررسی پارتیکلها میتوان به ماهیت کستها پی برد. با اندازهگیری پروتئین تام- هورسفال میتوان اطلاعاتی در خصوص فرایند تشکیل کستها بدست آورد، اما ماهیت کست را نمیتوان شناسایی کرد. اثر سیستمهای خلأ بر روی سایر اجزای ادرار محدود است. در مورد نمونههایی که اسمولالیتی آنها طبیعی است تفاوتی در تعداد گلبولهای قرمز و درصد گلبولهای لیزنشده به روش فلوسایتومتری در بین سیستمهای خلأ و روش متعارف دیده نمیشود. ولی در نمونههایی که اسمولالیتی پایین است در روش خلأ تعداد گلبولهای قرمز و گلبولهای قرمز لیزنشده کاهش نشان میدهد. واکنش نوار ادرار که مبتنی بر پراکسیداز است در هر دو گروه مشابه است. به لحاظ شناخت روزافزون از اهمیت میکروآلبومین ادرار در بیماریهای کلیه، توجه زیادی به خطاهای پرهآنالیتیک مربوط به آن معطوف شده است. در صورتی که مقدار آلبومین ادرار کم باشد، جذب شدن آن به دیوارۀ ظرف میتواند موجب کاهش نسبی آن گردد (20).
چسبندگی آلبومین ادرار به دیوارۀ ظرفهای هیدروفیلیک کمتر از 1mg/L و به دیوارۀ ظرفهای غیرهیدروفیلیک کمتر از 2mg/L است. اتصال به دیواره ظرف ممکن است سبب دناتوراسیون پروتئین نیز گردد. افزودن دترجنتهای غیریونی یا استفاده از سطوح هیدروفیلیک به کاهش جذب و دناتوراسیون پروتئین کمک میکند. وقتی که مخلوط کردن شدید نمونه ایجاد کف میکند پایداری آلبومین نسبتاً برقرار میماند. نگهداری در دمای بالای 80-درجه سانتیگراد (بهویژه در دمای 20-درجه سانتیگراد) موجب تغییرات متعدد در مولکول آلبومین میگردد (21).
انتقال و نگهداری
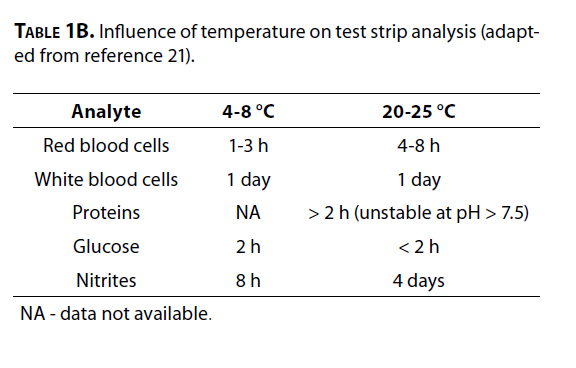
افزایش زمان بین جمعآوری نمونه تا انجام آزمایش، عدم کنترل دما و اضافه نکردن مواد نگهدارنده (در صورتی که آزمایش ظرف دو ساعت انجام نشود) موجب افت کیفیت نتایج خواهد شد. جدول 1A و 1Bپایداری پارتیکلهای مختلف و پاسخ پارامترهای نوار ادرار را نشان میدهند (22).
افزودن مواد نگهدارنده معمولاً مانع تغییرات متابولیک در آنالیتهای ادرار شده و از تکثیر باکتریها جلوگیری میکند. در یک مطالعه اخیر ارزش ظروف انتقال نمونه (حاوی موادنگهدارنده) در ارزیابی نیمهکمی و کیفی کشت ادرار مجدداً مشخص گردید بهویژه اگر زمان انتقال نمونه بیش از دو ساعت باشد (23)؛ اما مواد نگهدارنده ممکن است خواص شیمیایی آنالیتها و ظاهر پارتیکلها را تغییر دهند. باید در ظروفی که مواد نگهدارنده دارند برچسبی نصب شود که خطرات آنها را یادآوری کند و چگونگی رفتار با آنها را توضیح دهد (10، 13، 22). اگر از نگهدارندههای مایع استفاده میشود باید به اثر رقیقکننده آنها بر روی نمونه توجه داشت.
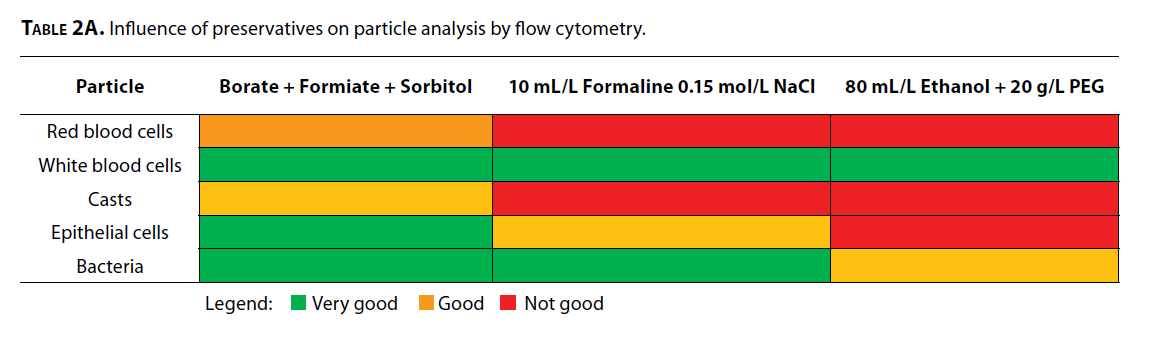
نسبت صحیح نگهدارنده به نمونه در نگهداری و انتقال نمونه باید مدنظر باشد (8). حجم مناسب نمونه معمولاً با یک خط علامتگذاریشده بر روی ظرف مشخص میشود. اگر نمونه بیش از حد مجاز به ظرف اضافه شود غلظت مادهنگهدارنده بهطور نسبی کاهش مییابد و لذا خاصیت نگهدارندگی آن کم میشود، برعکس افزایش ماده نگهدارنده میتواند رشد باکتریها را مهار کند. بهطور معمول اتانول (50%) برای پایداری اجزای سلولی استفاده میشود که تنها جلوی لیز بخشی از گلبولهای سفید و قرمز را میگیرد. افزودن اتیلن گلیکول (20g/L) به اتانول کیفیت نگهدارندگی را افزایش میدهد (10، 25). از مواد نگهدارنده تجاری که بهصورت لیوفیلیزه تهیه شدهاند هم میتوان استفاده کرد که در این صورت ریسک رقیق شدن نمونه با نگهدارنده وجود ندارد، همچنین ظروفی با محتوای اسیدبوریک بهتنهایی یا به همراه اسیدفرمیک و سایر نگهدارندهها هم مورد استفاده واقع میشوند (10،26). جدول 2A اثر نگهدارندههای متداول را بر روی آزمایش پارتیکلها به روش فلوسیتومتری نشان میدهد.
برخلاف کستها، سلولهای اپیتلیال و لکوسیتها، پایدار کردن گلبولهای قرمز بینهایت مشکل است، شاید علت آن چروکیدگی و پاره شدن گلبول قرمز بدنبال افزودن محلول فرمالدئید باشد (25).
آزمایشگاهها باید بر روی کیفیت متمرکز گردند، هر چه پیشنیازهای پرهآنالیتیکال سختگیرانهتر باشد نتایج قابلاعتمادتر هستند. پروتئینهای خاص متعددی در ادرار هستند که ناپایدارند ولی میتوان با افزودن برخی نگهدارندهها از تخریب آنها جلوگیری کرد. جمعآوری ادرار 24 ساعته جهت ارزیابی کمی آنالیتهای شیمیایی روش مرجع است، اما آلودگی، جمعآوری غلط، نگهداری نادرست و نیز محاسبه اشتباه حجم ادرار همگی میتوانند موجب خطاهای پرهآنالیتیکال گردند. نسبت آلبومین به کراتینین (یا پروتئین به کراتینین) در نمونه ادرار راندم که تحت تأثیر مصرف آب و سرعت دیورز نیست بهعنوان آلترناتیو جمعآوری 24 ساعته توصیه میگردد (27). همخوانی بین نسبت پروتئین به کراتینین و پروتئین ادرار 24 ساعته در صورتی که مقدار پروتئینوری بیش از یک گرم در لیتر باشد، صحیح نخواهد بود. برای پایش پروتئینوری استفاده از نسبت پروتئین به کراتینن هنوز به اثبات نرسیده است (9، 22).
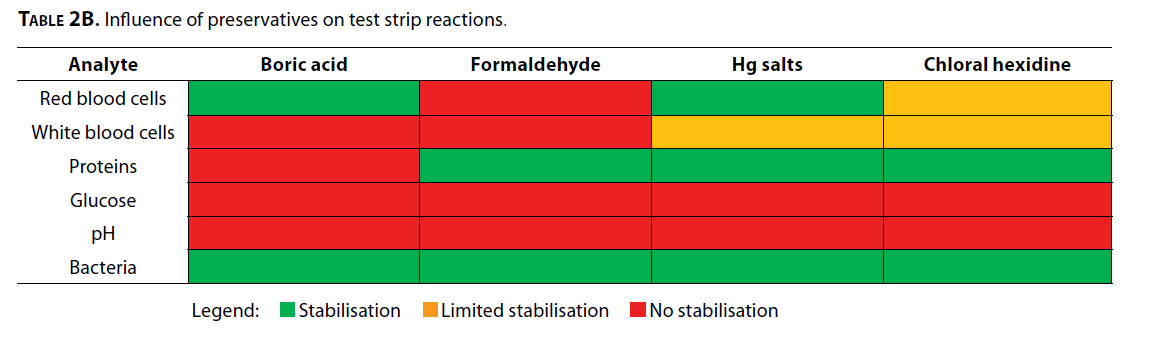
آزمایش ادرار بهوسیله نوار در صورتیکه نمونه در یخچال نگهداری شود تا 24 ساعت قابل انجام است و نیاز به نگهدارنده ندارد (10). به این منظور نمیتوان بهجای نگهداری در یخچال نمونه را فریز کرد. انتخاب ماده نگهدارنده تا حدودی بستگی به آنالیت مورد سنجش دارد، چرا که بعضی واکنشهای آنزیمی تحت تأثیر مواد نگهدارنده قرار میگیرند (جدول 2B) (10، 26، 27). استفاده از اسیدبوریک تعدادی از واکنشهای نواری را مختل میکند، به همین جهت ترکیب آزمایش با نوار ادرار و کشت ادرار جهت بدستآوردن نتیجه بهینه زیر سؤال میرود. اسیدبوریک پ هاش ادرار را زیر 7 نگه میدارد و در نتیجه از تجزیه سلولهای چرکی جلوگیری میکند (29) و موجب جواب منفی کاذب نوار ادرار (در مواردی چون پروتئین، گلبول سفید و کتون) میشود. مطالعه در چند مرکز نشان داده که استفاده از برخی ظروف تجاری خاص که حاوی نگهدارندههای ویژه هستند بیشتر واکنشهای نوار ادرا را با ثبات نگه میدارد (28). در بعضی آزمایشگاهها Dip slide را در همان ظرفی قرار میدهند که باید بقیه آنالیتهای ادرار هم از آن آزمایش شود و این روش توصیه نمیگردد. گزارشهای متعددی در دست است که نشان میدهد اجزای نوار ادرار همچون گلیسین (2)، ید (30)، کافئین (31) و سایر اجزا موجب آلودگی نمونه ادرار میشوند که به دنبال آن باید بررسیهای غیرضروری بیشتری انجام شود. برای اجتناب از این اشکالات بهجای قرار دادن نوار ادرار در لوله آزمایش باید نمونه ادرار را بر روی نوار ریخت، تنها در صورتی میتوان نوار را در لوله ادرار قرار داد که از آن نمونه تنها به همین منظور استفاده شود و نمونه دیگری برای انجام سایر آزمایشها موجود باشد.
بر اساس توصیههای کتب معتبر و نیز آزمایشگاههای معتبر (همچون آزمایشگاههای کلینیک مایو) جدولی در خصوص نگهداری صحیح نمونه ادرار 24 ساعته توسط NCCLS و CLIS به چاپ رسیده است. وقتی که قرار است چند آزمایش بر روی نمونه ادرار 24 ساعته انجام شود، الزامات متضادی ممکن است ضرورت یابد. برای حل این مشکل توصیههای گوناگونی بعمل آمده، از جمله اینکه چند بار نمونه 24 ساعته جمعآوری گردد و یا از ظرفهای مخصوص 2 یا 3 قسمتی استفاده شود. اگر حجم نمونه ادرار 24 ساعته فراتر از یک ظرف باشد باید مجموع نمونه دو ظرف قبل از آزمایش بهخوبی مخلوط گردند.
توصیه میشود که الزامات مربوط به آزمایشگاههای مرجع بهطور مستمر بازبینی شود چرا که امکان تغییر در آنها وجود دارد (10، 13، 32، 33).
اثرات تداخلی اجزای مختلف ادرار بر روی آزمایش بهوسیله نوار
به جهت حضور داروهای قلیایی در ادرار و یا کهنه شدن نمونه، ادرار قلیایی (PH9) میتواند منجر به نتیجه مثبت کاذب پروتئینوری در نوار گردد. در صورت ماندن بیش از حد نوار در ادرار، استفاده از ترکیبات آمونیوم نوع چهارم جهت تمیز کردن ظرف ادرار، درمان بیمار با Polyvinylpyrroledione یا phenazopyridine، تمیز کردن پوست با مواد حاوی کلرهگزیدین گلوکونات، وجود خون، ترشحات واژینال، چرک، منی یا موکوس زیاد در ادرار هم امکان مثبت شدن پروتئین نوار بهطور کاذب وجود دارد. در صورت رقیق بودن ادرار و یا وجود اندکی از پروتئینهای غیر از آلبومین (گلوبولین، ایمونوگلوبولین، زنجیرههای سبک) امکان واکنش منفی کاذب جهت پروتئین ادرار بهوسیله نوار هست (10، 24).
در حال حاضر هیچیک از اجزای ادرار موجب واکنش مثبت کاذب گلوکز در واکنش گلوکز اکسیداز نمیگردد، اما آلوده شدن نمونه با مواد پاککننده که عامل پراکسید دارند و یا با اسیدکلریدریک واکنش مثبت کاذب جهت گلوکز نوار ایجاد میکند. در برخی روشهای اتوماتیک خواندن نوار ادرار، بالا بودن اوروبیلینوژن هم میتواند گلوکز را بهطور کاذب مثبت نماید (34). علاوه بر این دمای محیط هم با تأثیر بر واکنش آنزیمی میتواند بر حساسیت تست گلوکز مؤثر باشد. قلیایی بودن پ هاش، عفونت ادراری، بالا بودن وزن مخصوص ادرار و بالا بودن غلظت آسکوربات در ادرار میتوانند حساسیت تست گلوکز اکسیداز را کاهش دهند (10، 35)، لذا آزمایش باید حداقل یک روز پس از ترک مصرف ویتامین c تکرار شود. در برخی نوارهای ادرار بالا بودن غلظت کتون هم میتواند موجب جواب منفی کاذب گلوکز گردد (36).
واکنش مثبت کاذب جهت کتون در موارد ذیل دیده میشود:
الف- نمونه ادرار که PH آن پایین و وزن مخصوص بالا باشد.
ب- نمونه حاوی مقادیر زیاد متابولیتهای متیل دوپا
ج- در حضور ترکیباتی که گروه سولفهیدریل دارند.
د- نمونهای که شدیداً پیگمانته باشد (34).
نگهداری ناصحیح منجر به نتیجه منفی کاذب شده و بتاهیدروکسی بوتیرات شناسایی نمیشود (10، 34).
تست غربالگری جهت خون مخفی در ادرار در موارد ذیل بهطور کاذب مثبت میشود:
الف- برخی مواد آلودهکننده اکسیدکننده (تمیز کردن ظرف ادرار با هیپوکلریت یا وجود پراکسیدازهای باکتریایی) (37، 38)
ب- آلودگی با povidone-iodine (39)
ج- خون قاعدگی
د- منی
و- میوگلوبینوری (34، 40)
از آنجا که نوارهای ادراری به گلبول قرمز سالم و هموگلوبین آزاد شدیداً حساس هستند، لذا هماتوری گذرا یک یافته معمول در آزمایش ادرار است. در صورتی که تست نواری جهت خون مثبت باشد ولی در آزمایش میکروسکوپی چیزی دیده نشود برای رد تشخیص هماتوری گذرا باید آزمایش ادرار را در نوبتهای مکرر انجام داد. اگر بهطور مستمر خون ادرار مثبت بود باید در آزمایش میکروسکوپی رسوب ادرار به دنبال گلبول قرمز گشت. اگر علیرغم مثبت بودن خون ادرار با نوار در بررسی میکروسکوپی، گلبول قرمز دیده نشود، ممکن است گلبولها بهواسطه رقیق بودن ادرار لیز شده و هموگلوبین را آزاد کرده باشند، در این حالت رنگ ادرار طبیعی است، اما اگر رنگ ادرار هم قرمز بود و علیرغم مثبت شدن نوار در رسوب، گلبول قرمز مشاهده نشد احتمال لیز داخل عروقی و یا رابدمیولیز وجود دارد (40). چنانچه نتیجه نوار به همراه یک کامنت در خصوص عوامل مداخلهگر همراه گردد میتواند به پزشک معالج در جهت تشخیص کمک کند. در صورت تأخیر در انجام آزمایش، خوب مخلوط نکردن نمونه قبل از آزمایش و یا استفاده از نگهدارنده فرمالین ممکن است نتیجه خون با نوار بهطور کاذب منفی گردد. پس از مصرف مقادیر زیاد اسید اسکوربیک، مصرف کاپتوپریل، بالا بودن غلطت پروتئین یا نیتریت ادرار و بالا بودن وزن مخصوص، حساسیت نوار برای تشخیص خون کاهش مییابد (10، 34).
بعد از منقضی شدن تاریخ نوار، تست بیلیروبین آن قابل اعتماد نخواهد بود. وجود indican و متابولیتهای etodolac، مصرف فنازوپیریدین یا دوز بالای کلرپرومازین یا فنازوپیریدین هم موجب واکنش مثبت کاذب بیلیروبین میگردد. پس از مصرف مقادیر زیاد اسید اسکوربیک، غلظت بالای نیترات و قرار گرفتن در معرض نور، حساسیت تست بیلیروبین کاهش مییابد (10، 34).
مواد مداخلهگری همچون پاراآمینوبنزوئیک اسید، فنازوپیریدین، پارا-آمینو سالیسیلیک اسید، سولفونامیدها و پارا- دی متیل آمینوبنزآلدئید، موجب واکنشهای غیرمعمول در پد اوروبیلینوژن نوار میگردند.
همچنین ادرار رنگی و پورفوبیلینوژن موجب مثبت کاذب میشوند. نگهداری نامناسب نمونه (مجاورت با نور)، وجود فرمالدئید و یا نیترات میتواند موجب پاسخ منفی کاذب برای اوروبیلینوژن باشد (34).
در صورتی که نمونه ادرار برای مدت طولانی در دمای اتاق بماند و یا زمانی که رنگ ادرار قرمز باشد احتمال ایجاد واکنش مثبت کاذب برای تست نیترات وجود دارد. افزایش غلظت اسیدآسکوربیک، بالا بودن وزن مخصوص، کاهش پ هاش به زیر 6 و غلظت بالای اوروبیلینوژن از حساسیت تست میکاهد (34).
وجود مواد اکسیدان قوی، فرمالدئید و سدیم آزاید منجر به واکنش مثبت کاذب در تست لکوسیت استراز میگردند، همچنین ادرار رنگی (بیلیروبین، مصرف چغندر) میتواند منجر به واکنش مثبت کاذب گردد. آلودگی نمونه ادرار با ترشحات واژن و مخاط یا مصرف برخی داروها (همچون نیترو فورانتوئین، کلاولانیک اسید، مروپنم و ایمیپنم) میتواند موجب اختلال در تفسیر نتیجه گردد. مصرف ویتامین c، پروتئینوری بیش از 5 گرم در لیتر، گلوکوزوری بیش از 20 گرم در لیتر، اسیدبوریک 1%، مهارکننده تریپسین، نمکهای اگزالات یا جیوه همگی میتوانند حساسیت تست را کاهش دهند (10، 34، 41).
در خصوص تشخیص باکتریها توسط نوارهای ادراری مختلف این محدودیتها وجود دارند:
ادرار رنگی و ماندن ادرار و رشد باکتری در شرایط invivo منجر به واکنش مثبت کاذب میگردد، زمان توقف کوتاه در مثانه، وجود باکتری گرم مثبت، مصرف ویتامین c و عدم مصرف سبزیجات میتوانند باعث واکنش منفی کاذب گردند (10).
درصورتیکه مقدار پروئینوری بیش از 1 گرم در لیتر باشد و نیز در حضور کتواسیدها وزن مخصوص ادرار افزایش مییابد. ادرار قلیایی، گلوکز و اوره حساسیت سنجش وزن مخصوص را کاهش میدهند (10).
در نهایت فرمالدئید باعث کاهش پ هاش میشود، هموگلوبین، میوگلوبین و EDTA بر سنجش کراتینین اثر میگذارند و اسید اسکوربیک نیز در حضور مواد احیاکننده بهطور کاذب مثبت میگردد (10).
آزمایش پارتیکلها
دستورالعمل اروپایی آزمایش ادرار (10) توصیه میکند که آزمایش پارتیکلها چنانچه نمونه در دمای اتاق نگهداری شده یک ساعت پس از جمعآوری و در دمای یخچال تا 4 ساعت پس از جمعآوری انجام شود.
نگهداری نمونه در یخچال باعث رسوب فسفاتها و اوراتها میشود که این مسئله در سنجش این مواد تداخل میکند، لذا اگر بررسی بلورهای ادراری اهمیت دارند باید یک قسمت از نمونه را در خارج از یخچال نگهداری نمود. اگر نمونه بیش از 4 ساعت بماند آزمایش لکوسیتها با ابهام مواجه میگردد، گرچه بدون افزودن ماده نگهدارنده، حتی تا 72 ساعت پس از نمونهگیری و بهشرط نگهداری در دمای اتاق لکوسیتها نسبتاً خوب باقی میمانند. البته این نتایج باید بااحتیاط تفسیر شوند چرا که فقط در مورد نمونه بزرگسالان مورد ارزیابی قرار گرفتهاند (28). در نمونه کودکان چنانچه در دمای اتاق نگهداری شوند کاهش سریع گلبولهای قرمز مشاهده میشود (42). لیز سلولها با افزایش پ هاش و کاهش وزن مخصوص افزایش مییابد (10، 25، 43، 44).
افزایش کاذب شمارش گلبولهای قرمز با روش فلوسایتومتری ممکن است در نتیجه حل نشدن پودر موجود در ظرف ادرار باشد که سیگنال نویز ایجاد میکنند. (28)
بررسی مرفولوژیک گلبولهای قرمز در رسوب ادرار خود یک مسئله جداگانه است. بیماریهای مجاری ادراری و کلیه میتوانند منجر به هماتوری گردند، ضمناً یک اختلال خونریزیدهنده و یا حتی ورزش شدید یا خون قاعدگی نیز ممکن است سبب مشاهده خون در ادرار شوند، بررسی مرفولوژی میتواند منشأ گلبول قرمز را مشخص کند؛ گلبولهای قرمز دیسمورفیک (گلبولهایی که شکل و اندازه غیرطبیعی دارند)، بهویژه آکانتوسیتها یا سلولهای G1 (یک جسم حلقوی با زائدههای تاولی) نشاندهنده بیماری کلیوی هستند. در صورتی که مرفولوژی گلبول قرمز طبیعی باشد معمولاً از قسمتهای پایین دستگاه ادراری نشأت گرفته است (16).
استفاده وسیعتر از این تست بهواسطه فقدان تعریف ویژگیهای گلبول دیسمورفیک و نیاز به میکروسکوپ فازکنتراست محدود شده است (45). به جهت آنکه مرفولوژی گلبول به pH و اسمولالیتی بستگی دارد، لذا برای این آزمایش نمونه صبحگاهی توصیه میگردد (46). راه دیگر برای افتراق منشأ خونریزی استفاده از نسبت IgG/Alb و alpha-2-microglobulin/Alb در ادرار است (47).
روشهای دستی
روشهای متعددی برای آزمایش عناصر ادراری ایجاد شدهاند. در روش کلاسیک دستی عناصر مختلف ادراری همچون گلبولهای قرمز و سفید، سلولهای اپیتلیال، کستها، اسپرماتوزآ، باکتریها، مخمرها، آرتیفکتهای مختلف، موکوس، چربیها و کریستالها با مشاهده میکروسکوپی بررسی میشود (4، 10، 48، 49). اگر حجم رسوب ادرار و کارایی سانتریفوژ در محاسبه لحاظ شوند و کار بهصورت استاندارد انجام شود بازهم ضریب تغییرات intra-assay جهت آزمایش روتین رسوب ادرار تا 100% هم میتواند برسد (4، 6، 48، 50)، لذا بررسی رسوب ادرار را نمیتوان بهعنوان یک روش رفرانس شمارش پارتیکلهای ادرار در نظر گرفت (10).
گرچه پس از سانتریفوژ کردن لازم است که مایع رویی دور ریخته شود اما همین کار خود منشأ خطاهای عمدهای میتواند باشد. شمارش پارتیکلها در ادرار سانتریفوژنشده جلوی این خطاها را میگیرد اما حساسیت آنالیز را کاهش میدهد. در مقایسه با کشت ادرار، حساسیت شناسایی باکتری در تعداد پایین، بهوسیله مشاهده میکروسکوپی کم است.
شناسایی باکتریوری به مهارت آزمایشکننده، شکل باکتری (کوکی یا باسیل) و تداخل دبریس (خردهریزها) بستگی دارد. سانتریفوژ کردن تعداد گلبولهای سفید و قرمز را کاهش میدهد، لذا شمارش آنها نمیتواند دقیق باشد. کاهش نسبی گلبولها پس از سانتریفوژ کردن بین 20 تا 80 درصد متغیر است (10).
آزمایش میکروسکوپی برای تخمین نسبی عناصر جامد و شکلدار استفاده میشود. بعد از سانتریفوژ میتوان آزمایش را بر روی لام ساده یا لام مدرج انجام داد. مزیت استفاده از لام مدرج این است که حجم بیشتری از نمونه را میتوان بررسی کرد و لذا نتایج دقیقتری بدست آورد، ولی در لام ساده که حجم کمتری از نمونه بین لام و لامل قرار میگیرد امکان افتراق عناصر بیشتر است، در ضمن استفاده از لام مدرج وقتگیر است. افتراق ساده عناصر بدون استفاده از رنگآمیزی یا میکروسکوپ فاز کنتراست برای عناصر کلیوی کفایت نمیکند. بدیهی است که اخذ نتایج دقیق کار بیشتری میطلبد.
استاندارسازی آزمایش رسوب ادرار شامل حجم ادرار، سرعت و مدت سانتریفوژ کردن، غلظت ادرار یا حجم رسوب، مقداری از رسوب که مورد آزمایش قرار میگیرد و گزارش نتایج است. چنانچه ادرار طی 30 دقیقه بعد از نمونهگیری در دمای اتاق یا 4 ساعت در دمای یخچال آزمایش نمیشود باید به آن نگهدارنده افزود. جهت بررسی عناصر شکلدار ادراری در بزرگسالان استفاده از 12 میلیلیتر ادرار توصیه شده است، اما حجم بین 5 تا 12 میلیلیتر هم قابل قبول است. پذیرش حجم کمتر و پروتکل انجام آزمایش توسط هر آزمایشگاه بهطور جداگانه تعیین میگردد.
در گزارش آزمایشگاه باید یادداشتی در خصوص انحراف استاندارد ضمیمه گردد. 5 دقیقه سانتریفوژ با دور 400g و ترجیحاً در دمای 4°c برای تهیه بهینه رسوب ضرورت دارد. نباید سانتریفوژ را با استفاده از ترمز بهطور ناگهانی متوقف کرد چرا که باعث بههم خوردن رسوب میشود. پس از سانتریفوژ کردن 12 میلیلیتر ادرار باید 11 میلیلیتر آن را دور ریخت و رسوب را در 1 میلیلیتر ادرار باقیمانده بهآرامی معلق کرد. از میکروسکوپ زمینه روشن، فازکنتراست یا پولاریزه با بزرگنمایی پایین و بالا میتوان استفاده نمود. برای انجام آزمایش باید دستورالعمل مکتوب با فرمت و ترمینولوژی (بعضی عناصر بهصورت کیفی توصیف میشوند و برخی شمارش میگردند)، محدوده مرجع و بزرگنمایی مربوط بهطور ثابت و یکنواخت تهیه گردد تا بتوان آن را یک گزارش استاندارد فرض کرد. در نهایت مهم است که یک برنامه کنترل کیفی خارجی هم مورد استفاده واقع شود (10، 51).
روشهای اتوماتیک
استفاده از آزمایش میکروسکوپی و نوار ادرار بهطور همزمان اطمینان به حساسیت و ویژگی آزمایش ادرار را افزایش میدهد (4، 45، 50). آنالیز تصویری ادرار سانتریفوژنشده یک تحول تکنولوژیک بود که آزمایش تعداد زیادی از پارتیکلها را ممکن میساخت و لذا کیفیت نتایج بهتر میشد، اما برای تشخیص این تصاویر تبحر زیادی لازم بود و لذا به پرسنل بیشتری نیاز داشت (45، 50، 52).
بهکارگیری فلوسایتومتری در آزمایش روتین ادرار پیشرفت عظیمی در این آزمایش بهحساب میآمد. در یک مدت کوتاه با استفاده از حجم اندکی از ادرار سانتریفوژنشده، تعداد بسیار زیادی گلبول قرمز، لکوسیت و سلول اپیتلیال مورد ارزیابی واقع میشود (4). در روش دستی بهواسطه سانتریفوژ کردن، دکانته کردن و تعلیق مجدد رسوب تعداد متغیری از عناصر فرمدار از بین میروند، علاوه بر این اتوماسیون امکان استانداردسازی بهتر آزمایش پارتیکلها را فراهم میکند (4، 49). در روش فلوسایتومتری برخلاف روش دستی ضریب تغییرات آنالیزکستها در حد قابل قبولی (17%) است (19).
همخوانی بین روش دستی و فلوسایتومتری بهجز در مورد کستها و مخمرها خوب است که در دو مورد اخیر روش دستی نتایج بهتری دارد. مقایسه within run cv برای شمارش پارتیکلها بین روش دستی، میکروسکوپی اتومات (Iris IQ200) و فلوسایتومتری (sysmex UF-100) نشان میدهد که در مورد اریتروسیتها، CV فلوسایتومتری بهتر است، اما در مورد گلبولهای سفید CV میکروسکوپی اتومات برتری دارد (53). در مقایسه با روش دستی تکرارپذیری آزمایش رسوب ادرار با دستگاه بهتر است (54).
آزمایش پروتئینهای آسیب حاد کلیوی
Neutrophil Gelatinase Associated Lipocalin (NGAL) یک بیومارکر جدید در تشخیص آسیب حاد کلیوی است، اما عفونت ادراری و تعداد نوتروفیلهای موجود در ادرار ارزش این بیومارکر را تحت تأثیر قرار میدهند. بین تعداد نوتروفیل و باکتریهای ادرار با NGAL ارتباط وجود دارد. در موارد لکوسیتوری یا انهدام توبولی (مثل بیماران بخش مراقبتهای ویژه) یک فرمول ریاضی برای اصلاح مقدار NLGL در صورت پیوری شدید پیشنهاد شده است (55).
اهمیت مرحله پرهآنالیتیکال در بخش سمشناسی ادرار
از آنجایی که بیشتر داروها از طریق ادرار دفع میشوند، لذا برای تشخیص سوءمصرف داروها نمونه ادرار ترجیح دارد چرا که ارزان، غیرتهاجمی و سریع است (56). مؤسس استاندارهای بالینی و آزمایشگاهی (CLSI) دستورالعملهایی در خصوص الزامات خاص فنی انجام آزمایشهای دارویی ادرار تدوین کرده است (57). انجمنهای مختلف علمی در کشورهای مختلف جهت اعتباربخشی آزمایش ادرار با توجه به پارامتریهایی همچون غلظت کراتینین ادرار، وزن مخصوص، نیتریت، pH و حضور مواد اگزوژن و اندوژن پیشنهاداتی ارائه کردهاند. پس از کنترل کامل بودن نمونه، تستهای مثبت غربالگری را باید با روشهای تأییدی مورد آزمایش قرار داد (63).
باید تأکید کرد که جهت اجتناب از موارد مثبت کاذب، منفی کاذب و نتایج مبهم جمعآوری، انتقال و انجام صحیح آزمایش ضرورت دارد (56). راههای مختلفی توسط افراد معتاد جهت تقلب در نتیجه آزمایش بهکار میرود، بهعنوان مثال مایع دیگری بهجای ادرار میریزند و یا یک ماده خارجی به آن اضافه میکنند و یا اینکه آن را با آب رقیق میسازند. برای پیشگیری از اینگونه تقلبها میتوان از تمهیدات مختلفی استفاده کرد:
الف- در کاسه توالت فرنگی رنگ آبی ریخت.
ب- کارت شناسایی عکسدار مطالبه نمود.
ج- کت، پالتو، بارانی و … در بیرون از توالت نگهداری شود.
د- قبل از نمونهگیری دستها شسته و خشک شوند.
ه- به هنگام جمعآوری نمونه نظارت انجام شود.
و- درجه حرارت نمونه ظرف 4 دقیقه پس از نمونهگیری اندازهگیری گردد (57).
در اثر عواملی همچون خطای اپراتور، تمیز کردن پوست با ایزوپروپیل الکل، آلودگی تجهیزات، جابهجا شدن نمونهها و خطا به هنگام انجام آزمایش امکان ایجاد پاسخ مثبت کاذب وجود دارد (57). برای کاهش خطاهای پرهآنالتیک تمهیدات متعددی باید اتخاذ گردد. باید یک سیستم تعیین هویت و اطلاعات آزمایشگاهی مستقر گردد، ظروف نمونه از نظر سالم بودن و فقدان نشت مورد بررسی قرار گیرد، اطلاعات روی برگ درخواست نمونه و فرم تحویل بهطور دقیق مورد مطالعه قرار گیرد (57).
نمونه توکسیکولوژی ادرار را میتوان در 8-2 درجه سانتیگراد تا 5 روز نگهداری نمود. چنانچه انجام آزمایش بیش از 5 روز به تعویق میافتد توصیه میشود که نمونه در کمتر از منهای 5 درجه نگهداری شود. برای نمونههای پزشکی قانونی علاوه بر الزامات نمونههای پزشکی، الزامات دیگری نیز توصیه میشود:
الف- نگهداری نمونه در همان ظرف اولیه
ب- کاهش تعداد انجماد- ذوب برای جلوگیری از تخریب نمونه
ج- اتخاذ تدابیر کنترلی جهت اطمینان از تمامیت و یکپارچگی نمونه
د- ثبت رویدادها و حفظ برگههای تحویل داخلی و خارجی
در پایان داروهای بدون نسخه، داروهای با نسخه و برخی مواد غذایی که از نظر شیمیایی به مواد مخدر نزدیک هستند میتوانند در آزمایش دارویی ادرار شناسایی شوند (56). داروهای بدون نسخه مرتبط با آمفتامین (افدرین، سودوافدرین و فنیل پروپانولآمین) در روش ایمنواسی سنجش آمفتامین واکنش متقاطع دارند (64).
بعد از مصرف خشخاش احتمال مثبت شدن تست تریاک وجود دارد (65). برای کاهش واکنش متقاطع و افزایش ویژگی دارو، بسیاری از روشهای روتین آزمایش دارو تغییر داده شدهاند (56).
مدیریت کیفیت بهینه ادرار در آزمایشگاه روتین
بهمنظور ارتقاء مدیریت کیفیت آزمایش ادرار در آزمایشگاه روتین CLSI دستورالعملی را تدوین و منتشر ساخته است (13). علاوه براین استاندارد 15189:2007 ایزو نیز الزامات خاص کیفیت و صلاحیت را ارائه نموده است (70). آخرین توصیه CLSI به استفاده از لوله آزمایش مناسب (پلاستیکی با ته مخروطی) و ظرف جمعآوری بدون نشت جهت داشتن نمونه باکیفیت ادرار تأکید نموده است. علاوه بر این پیپت باکیفیت و لام میکروسکوپ استاندارد با حجم کالیبره شده برای بررسی رسوب ادرار ضروری است. نکته پرهآنالیتیک مهم دیگر مصرف یا عدم مصرف مواد نگهدارنده است چرا که در نمونه بدون ماده نگهدارنده تکثیر باکتریها اتفاق میافتد.
پس از بیرون آوردن نمونه از یخچال باید اجازه دهیم تا به دمای اتاق برسد و خوب آن را مخلوط نموده آنگاه اقدام به انجام آزمایش نماییم. داروهای مختلفی میتوانند در نتایج روتین آزمایش ادرار ایجاد اختلال نمایند برای داشتن نمونه بدون دارو میتوان مدت کوتاهی در مصرف آن دارو وقفه ایجاد کرد. کدورت و رنگ ادرار و نیز تعدادی از مواد دیگر برحسب نوع نوار ادرار میتوانند با برخی تستهای آن ایجاد تداخل نمایند. برای سنجش آنالیتهای شیمیایی نمونه جمعآوریشده در طی یک زمان بخصوص به نمونه راندوم ترجیح دارد، اما در معرض خطاهای پرهآنالیتیک بیشتری هم هست. کشت میکروبی و آنتیبیوگرام با وجود آلودگیهای باکتریایی یعنی حضور 10/000 CFU/ML از دو یا بیش از دو نوع ارگانیسم تحت تأثیر قرار میگیرد. ادرار راندوم در مقایسه با ادرار میانی در معرض آلودگی بیشتری است. تأخیر در انتقال نمونه نیز میتواند موجب جواب مثبت کاذب گردد. درمان دارویی قبل از انجام آزمایش احتمال جواب منفی کاذب را افزایش میدهد.
خلاصه
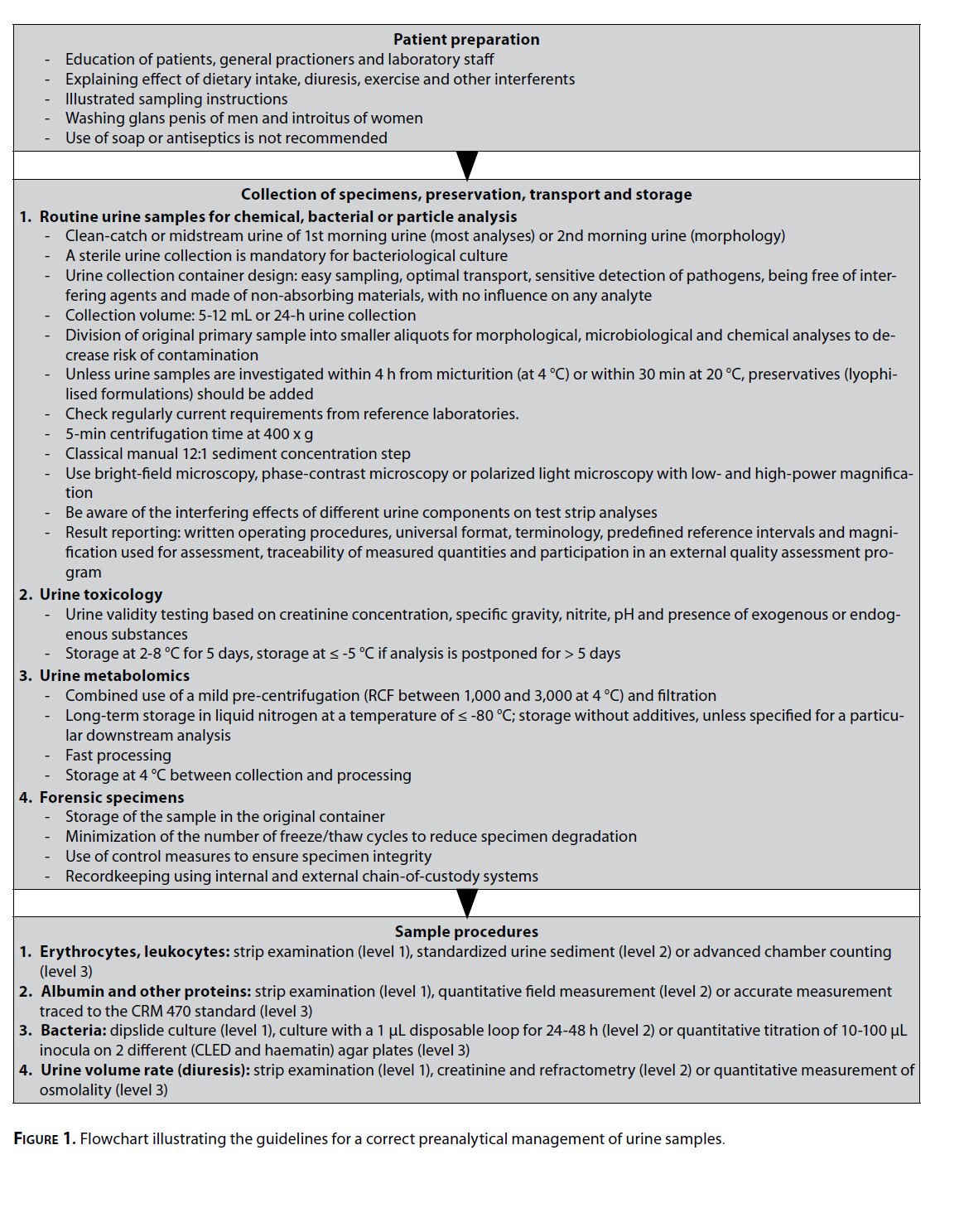
آزمایش تجزیه ادرار نقش مهمی در تشخیص افتراقی بسیاری از بیماریهای کلیوی و اورولوژی ایفا میکند. مرحله پرهآنالیتیک که شامل جمعآوری، تعیین هویت، نگهداری و حملونقل، آماده کردن نمونه جهت آزمایش (سانتریفوژ کردن، انجماد، ذوب و…) میشود، نقش مهمی در کیفیت آزمایش دارد و بههمین دلیل ما دستورالعملی تنظیم کردیم که در آن مدیریت صحیح نمونه ادرار را در مرحله پرهآنالیتیک بهطور شماتیک نشان دادیم (شکل 1).
ازآنجاکه نمونه ادرار معمولاً توسط خود بیمار تهیه میشود، لذا در معرض خطاهای پرهآنالیتیک بسیاری است، علاوه بر این جهت اطمینان از نمونهگیری صحیح، آزمایشگاه باید حملونقل و نگهداری نمونه را بهینه سازد. بعد از جمعآوری نمونه در ظرف اولیه تقسیم آن در ظرفهای متعدد برای آزمایشهای مرفولوژی، میکروبشناسی و شیمیایی خطر آلودگی را کاهش میدهد.
بهکارگیری سیستمهای خلأ انتقال سریع نمونه را میسر ساخته و خطر آلودگی و خطا را کاهش میدهد. نیروی مخرب خلأ بر عناصر فرمدار (مثل کستها) عموماً کمتر از حد واقعی تخمین زده میشود و بهطور کامل بررسی نشده است. در سیستمهای جدید آزمایش تجزیه ادرار (فلوسایتومتری، میکروسکوپی اتوماتیک) CV آزمایش کاهش یافته و لذا جنبههای پرهآنالیتیک اهمیت بیشتری مییابند. توجه خاصی باید نسبت به کستها بعمل آید چرا که در سیستم اتوماسیون شکنندگی و انهدام بیشتری متوجه آنها است. بررسی گلبولهای قرمز دیسمورفیک در تشخیص اختلالات گلومرولی اهمیت خاصی دارد. هنوز در قرن بیست و یکم نمیتوان از آزمایش رسوب ادرار صرفنظر کرد.
فاصله زمانی بین دفع ادرار تا انجام آزمایش در ارزش تشخیص آزمایش نقش تعیینکننده دارد. اگر نمونه در یخچال نگهداری شود و ظرف 24 ساعته آزمایش انجام گردد برای بیشتر آنالیتهای شیمیایی نیاز به افزودن ماده نگهدارنده وجود ندارد. اگر تأخیر در انجام آزمایش اجتنابناپذیر است میتوان به ظرف جمعآوری ادرار ماده نگهدارنده (اسیدبوریک بهتنهایی یا همراه با فورمات یا سایر نگهدارندهها) افزود. ازآنجاکه بهطور روتین معمولاً آزمایشگاهها با چند ساعت تأخیر نسبت به انجام آزمایش اقدام میکنند، ما توصیه میکنیم که بهجای استفاده از ماده نگهدارنده نمونه را در یخچال قرار دهند. این توصیه در دستورالعمل NCCLS هم آمده است (13). اگر از نگهدارندههای تجاری استفاده میکنیم باید متوجه تأثیر آنها بر آنالیتهای شیمیایی و پارتیکلهای ادرار باشیم. بهطور ایدهآل نگهدارندهها بهصورت لیوفیلیزه عرضه میشوند. تداخل مواد نگهدارنده با آزمایشهای مواد شیمیایی ادرار مشخص شده است. در بیشتر موارد استفاده از نگهدارندهها بهمنظور جلوگیری از رشد میکروبها است و برای آزمایشهای شیمیایی یا شمارش پارتیکلها استفاده نمیشوند. بهمنظور استفاده بهینه از منابع قبل از انجام کشت توصیه شده که بهطور همزمان آزمایش با نوار ادرار و آزمایش پارتیکلها (دستی یا اتوماتیک) انجام شود (4).
چون در حال حاضر هیچ ماده نگهدارندهای وجود ندارد که بتواند به همه مواد شیمیایی و پارتیکلهای ادرار ثبات ببخشد، لذا تحقیقات جدید در این خصوص ضرورت دارد. تا زمان دست یافتن به اینچنین نگهدارندهای آزمایشگاهها باید دو نمونه جداگانه از ادرار تهیه کنند. نگهدارندهای که بتواند هم جلوی رشد باکتریها را بگیرد و هم پارتیکلهای ادرار را حفظ کند خواهد توانست جایگزین نگهداری ادرار در یخچال گردد. از آنجایی که متابولومیکهای ادرار تبدیل به یک موضوع داغ شدهاند، لذا توصیههایی توسط گروههای صلاحیتدار جهت روشهای بیوبانکینگ تدوین شده است. (67).
منبع:
Preanalytical requirements of urinalysis
Biochemia Medica 2014;24(1):89–104
References:
- Coppens A, Speeckaert M, Delanghe J. The pre-analytical
challenges of routine urinalysis. Acta Clin Belg
2010;65:182-9.
- Carlson DA, Statland BE. Automated urinalysis. Clin Lab
Med 1988;8:449-61.
- Fogazzi GB, Cameron JS, Ritz E, Ponticelli C. The history of
urinary microscopy to the end of the 19th century. Am J Nephrol
1994;14:452-7. http://dx.doi.org/10.1159/000168764.
- Langlois MR, Delanghe JR, Steyaert RS, Everaert KC, De
Buyzere ML. Automated flow cytometry compared with
an automated dipstick reader for urinalysis. Clin Chem
1999;45:118-22.
- Caleffi A, Manoni F, Alessio MG, Ottomano C, Lippi G. Quality
in extra-analytical phases of urinanalysis. Biochemia
Medica 2010;20:179-83. http://dx.doi.org/10.11613/
BM.2010.022.
- Howanitz PJ, Howanitz JH. Quality control for the clinical
laboratory. Clin Lab Med 1983;3:541-51.
- Lippi G, Becan-McBride K, Behulova D, Bowen RA, Church S,
Delanghe J, et al. Preanalytical quality improvement: in quality
we trust. Clin Chem Lab Med 2013;51:229-41. http://
dx.doi.org/10.1515/cclm-2012-0597.
- Stankovic AK, DiLauri E. Quality improvements in the preanalytical
phase: focus on urine specimen workflow. Clin
Lab Med 2008;28:339-50. http://dx.doi.org/10.1016/j.
cll.2007.12.011.
- Delanghe JR. New screening diagnostic techniques in urinalysis.
Acta Clin Belg 2007;62:155-61.
- European Confederation of Laboratory Medicine. European
urinalysis guidelines. Scand J Clin Lab Investig 2000;60:1-
96.
- Miler M, Šimundić AM. Low level of adherence to instructions
for 24-hour urine collection among hospital outpatients.
Biochem Med 2013;23:316-20. http://dx.doi.
org/10.11613/BM.2013.038.
- Cotten SW, Duncan DL, Burch EA, Seashore CJ, Hammett-
Stabler CA. Unexpected interference of baby wash products
with a cannabinoid (THC) immunoassay. Clin Biochem
2012;45:605-9. http://dx.doi.org/10.1016/j.clinbiochem.
2012.02.029.
- Clinical and Laboratory Standards Institute. Urinalysis and
Collection, Transportation, and Preservation of Urine Specimens;
Approved Guideline-Third Edition. NCCLS document
GP16-A3. Available at: http://www.clsi.org/. Assessed
November 11th 2013.
- Norden CW, Kass EH. Bacteriuria of pregnancy – a critical
appraisal. Ann Rev Med 1968;19:431-70. http://dx.doi.
org/10.1146/annurev.me.19.020168.002243.
- Roberts AP, Robinson IE, Beard RW. Some factors affecting
bacterial colony counts in urinary infection. Br Med J
1967;I:400-3. http://dx.doi.org/10.1136/bmj.1.5537.400.
- Dinda AK, Saxena S, Guleria S, Tiwari SC, Dash SC, Srivastava
RN, et al. Diagnosis of glomerular haematuria: role
of dysmorphic red cell, G1 cell and bright-field microscopy.
Scand J Clin Lab Invest 1997;57:203-8. http://dx.doi.
org/10.3109/00365519709060028.
- Manoni F, Gessoni G, Alessio, MG, Caleffi A, Saccani G, Silvestri
MG, et al. Mid-stream vs. first-voided urine collection
by using automated analyzers for particle examination
in healthy subjects: an Italian multicenter study. Clin
Chem Lab Med 2012;50:679-84. http://dx.doi.org/10.1515/
cclm.2011.823.
- Kouri TT, Gant VA, Fogazzi GB, Hofmann W, Hallander HO,
Guder WG. Towards European urinalysis guidelines. Introduction
of a project under European Confederation of Laboratory
Medicine. Clin Chim Acta 2000;297:305-11. http://
dx.doi.org/10.1016/S0009-8981(00)00256-4.
- Delanghe J, Langlois M. Pre-analytical effects of vacuum
aspiration on urinalysis. Proceedings of the 5th Symposium:
preanalytical phase in patient care and hospital management.
Pratolino 1999.
- Hara F, Shiba K. Nonspecific binding of urinary albumin on
preservation tube. Jpn J Clin Chem 2003;32:28-9.
- Miller WG, Bruns DE, Hortin GL, Sandberg S, Aakre KM,
McQueen MJ, et al. Current issues in measurement and reporting
of urinary albumin excretion. Clin Chem 2009;55:24-
- http://dx.doi.org/10.1373/clinchem.2008.106567.
- Fogazzi GB, Verdesca S, Garigali G. Urinalysis: core curriculum
- Am J Kidney Dis 2008;51:1052-67. http://dx.doi.
org/10.1053/j.ajkd.2007.11.039.
- Eisinger SW, Schwartz M, Dam L, Riedel S. Evaluation of the
BD Vacutainer Plus Urine C&S Preservative Tubes Compared
With Nonpreservative Urine Samples Stored at 4{degrees}C
and Room Temperature. Am J Clin Pathol 2013;140:306-13.
http://dx.doi.org/10.1309/AJCP5ON9JHXVNQOD.
- Nickander KK, Shanholtzer CJ, Peterson LR. Urine culture
transport tubes: effect of sample volume on bacterial toxicity
of the preservative. J Clin Microbiol 1982;15:593-5.
- Kouri TT, Vuotari L, Pohjavaara S, Laippala P. Preservation
of urine for flow cytometric and visual microscopic testing.
Clin Chem 2002;48:900-5.
- Gillespie T, Fewster J, Masterton RG. The effect of specimen
processing delay on borate urine preservation. J Clin Pathol
1999;52:95-8. http://dx.doi.org/10.1136/jcp.52.2.95.
- Guy M, Borzomato JK, Newall RG, Kalra PA, Price CP. Protein
and albumin-to creatinine ratios in random urines accurately
predict 24 h protein and albumin loss in patients with
kidney disease. Ann Clin Biochem 2009;46:468-76. http://
dx.doi.org/10.1258/acb.2009.009001.
- Kouri T, Malminiemi O, Penders J, Pelkonen V, Vuotari
L, Delanghe J. Limits of preservation of samples for urine
strip tests and particle counting. Clin Chem Lab Med
2008;46:703-13. http://dx.doi.org/10.1515/CCLM.2008.122.
- Porter IA, Brodie J. Boric acid preservation of urine samples.
Brit Med J 1969;2:353-5. http://dx.doi.org/10.1136/
bmj.2.5653.353.
- Chanoine JP, Bourdoux P, Vo Thi NB, Ermans AM. Iodine
contamination of urine samples by test strips. Clin Chem
1987;33:1935.
- Van Acker JT, Verstraete AG, Van Hamme MA, Delanghe J.
Falsely increased urinary caffeine attributable to contamination
by urine test strips. Clin Chem 1999;45:1315-7.
- Burtis CA, Ashwood ER, eds. Textbook of Clinical Chemistry.
2nd ed. Philadelphia: WB Saunders, 1994.
- Henry JB. Clinical Diagnosis and Management by Laboratory
Methods, 19th ed. Philadelphia: WB Saunders, 1996.
- Mundt L, Shanahan K, eds. Graff’s Textbook of Urinalysis
and Body Fluids. 2nd ed. Philadelphia: Wolters Kluwer,
2010.
- Brandt R, Guyer KE, Banks WL Jr. Urinary glucose and vitamin
- Am J Clin Pathol 1977;68:592-4.
- Court JM, Davies HE, Ferguson R. Diastix and ketodiastix: a
new semiquantitative test for glucose in urine. Med J Aust
1972;1:525-8.
- Smith BC, Peake MJ, Fraser CG. Urinalysis by use of multi-
test reagent strips: two dipsticks compared. Clin Chem
1977;23:2337-40.
- Wilson DM. Urinalysis and other tests of renal function.
Minn Med 1975;58:9-17.
- Rasoulpour M, McLean RH, Raye J, Shah BL. Pseudohematuria
in neonates. J Pediatr 1978;92:852-3. http://dx.doi.
org/10.1016/S0022-3476(78)80179-6.
- Patel HP. The abnormal urinalysis. Pediatr Clin N Am
2006;53:325-37. http://dx.doi.org/10.1016/j.pcl.2006. 02.004.
- Beer JH, Vogt A, Neftel K, Cottagnoud P. False positive results
for leucocytes in urine dipstick test with common
antibiotics. BMJ 1996;313:25. http://dx.doi.org/10.1136/
bmj.313.7048.25.
- Kierkegaard H, Feldt-Rasmussen U, Horder M, Andersen HJ,
Jorgensen PJ. Falsely negative urinary leukocyte counts due
to delayed examination. Scand J Clin Lab Invest 1980;40:259-
- http://dx.doi.org/10.3109/00365518009095576
- Mobley HL, Warren JW. Urease-positive bacteriuria and
obstruction of long-term urinary catheters. J Clin Microbiol
1987;25:2216-7.
- Griffith DP, Musher DM, Itin C. Urease. The primary cause
of infection- induced urinary stones. Investig Urol
1976;13:346-50.
- Fassett RG, Horgan BA, Mathew TH. Detection of glomerular
bleeding by phase-contrast microscopy. Lancet
1982;i:1432-4. http://dx.doi.org/10.1016/S0140-6736-
(82)92451-5.
- Kitamoto Y, Tomita M, Akamine M, Inoue T, Itoh J, Takamori
H, et al. Differentiation of hematuria using a uniquely
shaped red cell. Nephron 1993;64:32-6. http://dx.doi.
org/10.1159/000187274.
- Guder WG, Ivandic M, Hofmann W. Physiopathology of
proteinuria and laboratory diagnostic strategy based on
single protein analysis. Clin Chem Lab Med 1998;36:935-9.
http://dx.doi.org/10.1515/CCLM.1998.162.
- Hanneman-Pohl K, Kampf SC. Automation of Urine Sediment
Examination: a comparison of the Sysmex UF-100
Automated Flow Cytometer with Routine Manual Diagnosis.
Clin Chem Lab Med 1999;37:753-64. http://dx.doi.
org/10.1515/CCLM.1999.116.
- Ben-Ezra J, Bork L, McPherson RA. Evaluation of the Sysmex
UF-100 automated urinalysis analyzer. Clin Chem
1998;44:92-5.
- Mayo S, Acevedo D, Quinones-Torrelo C, Canos I, Sancho
- Clinical laboratory automated urinalysis: comparison
among automated microscopy, flow cytometry, two test
strips analyzers, and manual microscopic examination of
the urine sediments. J Clin Lab Anal 2008;22:262-70. http://
dx.doi.org/10.1002/jcla.20257.
- Brunzel NA, ed. Fundamentals of Urine and Body Fluid
Analysis. 3rd ed. St. Louis, MO: Elsevier, Saunders, 2013.
- Linko S, Kouri TT, Toivonen E, Ranta PH, Chapoulaud E, Lalla
- Analytical performance of the Iris iQ200 automated urine
microscopy analyzer. Clin Chim Acta 2006;372:54-64.
http://dx.doi.org/10.1016/j.cca.2006.03.015.
- Chien TI, Kao JT, Liu HL, Lin PC, Hong JS, Hsieh HP, et al.
Urine sediment examination: A comparison of automated
urinalysis systems and manual microscopy. Clin
Chim Acta 2007;384:28-34. http://dx.doi.org/10.1016/j.
cca.2007.05.012.
- Yuksel H, Kilic E, Ekinci A, Evliyaoğlu O. Comparison of fully
automated urine sediment analyzers H800-FUS100 and
labumat-urised with manual microscopy. J Clin Lab Anal
2013;27:312-6. http://dx.doi.org/10.1002/jcla.21604.
- Decavele AS, Dhondt L, De Buyzere ML, Delanghe JR. Increased
urinary neutrophil gelatinase associated lipocalin
in urinary tract infections and leukocyturia. Clin Chem
Lab Med 2011 49:999-1003. http://dx.doi.org/10.1515/
CCLM.2011.156.
- Kandall SR, ed. Improving Treatment for Drug-Exposed
Infants Treatment Improvement Protocol (TIP) Series 5.
- Available at: http://www.ncbi.nlm.nih.gov/books/
NBK64750/. Assessed November 10th 2013.
- Clinical and Laboratory Standards Institute. Urine drug testing
in the clinical laboratory; Approved guideline. NCCLS/
CLSI T/DM8-A. 1999. Available at: http://www.clsi.org/.
Assessed November 11th 2013.
- European Workplace Drug Testing Society (EWDTS). European
Laboratory Guidelines for Legally Defensible Workplace
Drug Testing, 2003. Available at: http://www.ewdts.
org/. Assessed November 10th 2013.
- Department of Health and Human Services – Substance
Abuse and Mental Health Services Administration. Proposed
revisions to mandatory guidelines for federal workplace
drug testing programs, 2004. Federal Register p. 19673-
- Available at: http://www.gpo.gov/fdsys/pkg/FR-2004
-04-13/pdf/04-7984.pdf/. Assessed November 10th 2013.
- Swiss Working Group for Drugs of Abuse Testing Guidelines
(AGSA) Drugs of Abuse Testing Guidelines, 2003. Available
at: http://faculty.ksu.edu.sa/18856/454/AGSA%20
%20Drugs%20of%20Abuse%20Testing%20Guidelines.pdf.
Assessed November 10th 2013.
- Joint Technical Committee CH-036 Analysis of Body Fluids
and Wastes. Australian/New Zealand Standard TM: Procedures
for the collection, detection and quantitation of drugs
of abuse in urine, 2001. Available at: http://www.saiglobal.
com/pdftemp/previews/osh/as/as4000/4300/4308.
pdf/. Assessed November 11th 2013.
- Steering Group UK. United Kingdom laboratory guidelines
for legally defensible workplace drug testing: urine drug testing.
2001;1-38.
- Penders J, Verstraete A. Laboratory guidelines and standards
in clinical and forensic toxicology. Accred Qual Assur 2006;
11:284-90. http://dx.doi.org/10.1007/s00769-006-0131-y.
- Stout PR, Klette KL, Horn CK. Evaluation of ephedrine, pseudoephedrine
and phenylpropanolamine concentrations
in human urine samples and a comparison of the specificity
of DRI amphetamines and Abuscreen online (KIMS)
amphetamines screening immunoassays. J Forensic Sci
2004;49:160-4. http://dx.doi.org/10.1520/JFS2003233.
- Lachenmeier DW, Sproll C, Musshoff F. Poppy seed foods
and opiate drug testing–where are we today? Ther
Drug Monit 2010;32:11-8. http://dx.doi.org/10.1097/
FTD.0b013e3181c0eee0.
- Bernini P, Bertini I, Luchinat C, Nincheri P, Staderini S, Turano
- Standard operating procedures for pre-analytical
handling of blood and urine for metabolomic studies and
biobanks. J Biomol NMR 2011;49:231-43. http://dx.doi.
org/10.1007/s10858-011-9489-1.
- Yuille M, Illig T, Hveem K, Schmitz G, Hansen J, Neumaier M,
et al. Laboratory management of samples in biobanks: European
consensus expert group report. Biopreserv Biobank
2010;8:65-9. http://dx.doi.org/10.1089/bio.2010.8102.
- Beckonert O, Keun HC, Ebbels TM, Bundy J, Holmes E, Lindon
JC, et al. Metabolic profiling, metabolomic and metabonomic
procedures for NMR spectroscopy of urine, plasma,
serum and tissue extracts. Nat Protoc 2007;2:2692-
- http://dx.doi.org/10.1038/nprot.2007.376.
- Saude EJ, Sykes BD. Urine stability for metabolomic studies:
effects of preparation and storage. Metabolomics
2007;3:19-27. http://dx.doi.org/10.1007/s11306-006-
0042-2.
- Medical laboratories — Particular requirements for quality
and competence. ISO document 15189, International Organization
for Standardization, Geneva, 2007. Available
at: http://www.iso-15189.com/. Assessed November 11th
2013
مفاهيم و روشهاي مختلف اندازهگيري كيفي و كمي پروتئين ادرار
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام