نقش التهاب در آترواسکلروزیس
دکتر شاهرخ مستور تهرانی
پیشزمینه: در بررسیهای مختلفی، التهاب به آترواسکلروزیس و عوارض آن ارتباط داده شده است. مطالعات حیوانی بر دخالت واسطههای التهابی متعددی در بروز و عوارض آترواسکلروزیس دلالت داشتهاند. مطالعات متعددی در انسانها، ارتباط بین بیومارکرهای التهابی با رخدادهای قلبی عروقی ناشی از آترومها را نشان دادهاند. وضعیت التهابی که با بررسی بیومارکر پروتئین واکنشگر C تعیین میشود، میتواند راهنمایی باشد برای درمان با استاتین برای جلوگیری از اولین رخداد نامطلوب قلبی عروقی در افرادی که هنوز غلظت لیپوپروتئين با چگالی کم (LDL) در آنها افزایش نیافته است.
محتوا: تا مدتی پیش، شواهد مستقیمی مبنی بر اینکه مداخلات محدودکننده التهاب بتوانند وضعیت بیماران مبتلا به آترواسکلروزیس را بهبود ببخشند، وجود نداشت. در یک مطالعه اخیر، بر اساس چند دهه تحقیقات پیشبالینی، بیمارانی که دچار انفارکتوس میوکارد شده و میزان LDL آنها با استاتین به خوبی کنترل شده بود، با آنتیبادیای که اینترلوکین ۱ بتا را خنثی میکرد، درمان شدند. این کارآزمایی بر روی بیش ۱۰،۰۰۰ نفر انجام شد و کاهش در بروز رخدادهای قلبی نامطلوب مهم را به دنبال داشت که این مسئله برای اولین بار اثربخشی بالینی مداخله ضدالتهابی را در آترواسکلروزیس به اثبات رساند. سپس دو مطالعه بزرگ دیگر، نشان دادند که درمان با کلشیسین میتواند از بروز رخدادهای راجعه در بیمارانی که در حال بهبود یافتن از سندرم حاد کرونری یا در فاز پایدار بیماری سرخرگ کرونری هستند، جلوگیری کند. این کارآزماییهای بالینی، نقش التهاب در آترواسکلروزیس را از حالت تئوری خارج کرده و در عمل آن را اثبات کردهاند.
خلاصه: کارهای بسیاری باقی مانده است که باید برای بهینه ساختن مداخلات ضد التهابی، کاهش پیامدهای ناخواسته و تصحیح انتخاب بیمار انجام شود. این مسیر طولانی از کشف در آزمایشگاه تا کارآزمایی بالینی موفق، یک پیروزی در علوم پزشکی به شمار میآید و راه جدیدی را برای کاهش خطراتی که علیرغم درمانهای فعلی برای آترواسکلروزیس باقی میمانند، میگشاید.
مفهوم التهاب در آترواسکلروزیس درست همانند ستاره دنبالهدار هالی، بهصورت دورهای ظاهر میشود؛ اما بهجای اینکه هر بار یک ظهور یکسان و یکنواخت داشته باشد، هر ظهور تئوری التهاب در آترواسکلروزیس، روشنتر و شفافتر از پیش است. ما وارد دورهای شدیم که در آن انبوه پژوهشهای تجربی و دادههای بیومارکری در حال رشد، به عرصه بالینی راه یافتهاند. دخالت التهاب در آترواسکلروزیس، دیگر یک تئوری نیست، بلکه رشد یافته و به اثبات رسیده است.
رنگسازی و ایده هوشمندانه
صنعت شیمی آلمان در قرن نوزدهم بهطور عمده بر تولید رنگ برای صنعت نساجی متمرکز بود. یکی از محصولات جانبی این فعالیت صنعتی، امکان رنگآمیزی و رنگآمیزی متضاد (counter-staining) نمونههای بافتی را فراهم میآورد که این امر موجب ارتقا و پیشرفت پاتولوژی سلولی شد. مشاهده دقیق و گاهی استدلال قیاسی درخشان باعث به وجود آمدن تئوریهای بسیاری در رابطه با پاتوژنز بیماریها شد. Rudolf Virchow، سرآمد پاتولوژیستهای آن دوره، ادعا کرد که التهاب در آترواسکلروزیس نقش دارد. او بر اساس مشاهده دقیق هم در سطح ماکروسکوپی و هم در سطح میکروسکوپی به چنین نتایجی دست یافت. توصیفات او از آترواسکلروزیس در میانه قرن نوزدهم به چاپ رسید و اتفاقاً بهطور قابلتوجهی با بسیاری از دانستههای فعلی ما از این بیماری همخوانی دارد. او تکثیر سلولها و مرگ آنها را نتیجهگیری کرده بود. او به فرایندهای التهابی دخیل در پاتوژنز این بیماری نیز اشاره کرده بـــــــــــود. اگرچه او درگیر مناقشهای جدی با رقیبش یعنی von Rokitansky بود، اما امروزه ما میدانیم که نتیجهگیری Virchow در مورد تغییر رفتار سلولهای دیواره آرتریول و نظر von Rokitansky مبنی بر وجود ترومبوس، هر دو در شکلگیری آترومای پیشرفته دخالت دارند. در واقع وجود ترومبوس به دنبال تخریب پلاک، احتمالاً در بهبود و تکامل پلاکهای بسیاری نقش دارد.
پاتولوژی عملی و بیوشیمی لیپیدها در ارتباط با افزایش کلسترول ۱۹۷۰-۱۹۰۰
دانش پاتولوژی عملی در طول قرن نوزدهم در اروپا شکوفا شد. Claude Bernard شالوده بنیادین فیزیولوژی عملی را بنا نهاد. مهارتهای عملی Pasteur، علم پزشکی را بهطور برگشتناپذیر تغییر داد. بهکارگیری این ابزارهای قدرتمند برای آترواسکلروزیس تا زمان کارهای Anistchkow و همکارانش در اوایل قرن بیستم در سنت پترزبوزگ به طول انجامید. آزمایشهای تغذیهای آنها در خرگوشها، بر اهمیت زرده تخممرغ و ترکیبات آن در شکلگیری ضایعات چربی در سرخرگهای خرگوشها متمرکز بود. آنها دخالت «کلسترین» در این فرایند را دریافتند. طراحیهای زیبای آنها از مشاهدات مورفولوژیکشان، سلولهای ماکروفاژ کفآلود را به وضوح نشان میداد. با این حال، دیدگاه غالب آن زمان که بیشتر شیمیایی بود تا اینکه سلولی باشد، باعث شد تا حدود نیم قرن تمرکز بر روی لیپیدها باشد. Adolf Windaus یک شیمیدان آلمانی، کلسترول را در پلاکهای آترواسکلروتیک انسانی، شناسایی کرد. بیوشیمی لیپیدها توسعه یافت و با شناخت مسیرهای بیوشیمیایی دخیل در سنتز کلسترول توسط Konrad Bloch به اوج رسید.
ابداع اولتراسانتریفیوژ منجر به شناسایی لیپوپروتئینها شد؛ مجموعه مولکولهایی که تریگلیسیریدهای نامحلول در آب و کلسترول را در فاز آبی خون انتقال میدهند. پیشرفتهای تکنیکی متوالی در بیوشیمی لیپیدها و بیوشیمی پروتئینها، منجر به جداسازی و تعیین مشخصات شیمیایی دستههای متفاوت لیپوپروتئینها و در نهایت بخش آپولیپوپروتئین آنها شد. لیپوپروتئین با چگالی کم (LDL) حاوی آپولیپوپروتئين B است، در حالی که آپولیپوپروتئین A-I، آپولیپوپروتئین اصلی در لیپوپروتئين با چگالی بالا (HDL) است. این ذرات بر اساس مشخصات اولتراسانتریفیوژی خود نیز نامگذاری میشوند.
اپیدمی انفارکتوس میوکارد پس از جنگ جهانی دوم که عمدتاً مردان سفیدپوست- جمعیتی که همانند سولون[1]های آن روزگار بودند- را مورد حمله قرار میداد، منجر به سرمایهگذاری دولتی قاطع و بسیار ضروری در حوزه پژوهشهای قلب و عروق شد. در واقع مؤسسه ملی سلامت ایالات متحده و مؤسسه ملی قلب (که هسته اولیه مؤسسه ملی قلب، ریه و خون (NHLBI) امروزی است)، حوزه در حال رشد بیوشیمی لیپیدها را تقویت کرده و پرورش داد. شکلگیری Framingham Study منجر به شناسایی ریسک فاکتورهای آترواسکلروزیس شد که اولین بار در اوایل دهه ۱۹۶۰ به چاپ رسید. این مطالعه کوهورت اولیه مشاهدهای اپیدمیولوژیک، همبستگی قوی بین کلسترول- و سرانجام لیپوپروتئین با چگالی کم- و انفارکتوس میوکارد را نشان داد و یافتههای آن بهطور گسترده در سراسر جهان تکرار شد.
داستان مشخص شدن مسیر کاتابولیک LDL، شناسایی رسپتور LDL و تنظـــــــــیم آن، از کارهای Michael Brown و Joseph Goldstein سرچشمه گرفت که نقش بسزایی در بیوشیمی لیپوپروتئینها در NHLBI داشتند. من با وضوح زمانی را به یاد میآورم که یک استاد برجسته بیوشیمی در دانشکده پزشکی هاروارد، هنگام معرفی سمیناری از Joseph Goldstein جوان در دهه ۱۹۷۰، با کمی اکراه تصدیق کرد که کار Goldstein و Brown به واقع وی را به این فکر واداشته است که چنین حوزهای در زیستشناسی سلولی میتواند وجود داشته باشد. Goldstein صحبتهای خود را که حاوی انبوهی از اطلاعات و دادهها بود، با شتاب، طی زمانی که به وی اختصاص داده شد بود به پایان رساند. Brown و Goldstein، مشاهداتی را نشان دادند که از فیبروبلاستهای کشت داده شده بیماران مبتلا به هایپرکلسترولمیای خانوادگی، استفاده شده بود.
در همین زمان، افرادی مانند Russell Ross بر روی روشهایی برای کشت سلولهای عضلات صاف واسکولار انسانی در آزمایشگاه کار میکردند. Ross از این عقیده که رشد بیش از حد سلولهای ماهیچه صاف یک عامل کلیدی در شکلگیری ضایعات آترواسکلروتیک هستند، حمایت میکرد. او معتقد بود که فاکتور رشد مشتق از پلاکت به عنوان یک محرک تکثیر ماهیچه صاف، قطعاً در شکلگیری پلاک نقش دارد. او مطالعات مورفولوژیک دقیقی را بر روی پریماتهایی غیر از انسان و خرگوشها انجام داد که باعث شد ماکروفاژها بر اساس ظاهر فراساختاری خود به عنوان یکی از عوامل دخیل در فرایند آترواسکلروتیک شناخته شوند. اگرچه ویژگی فرمولهای اولیه Ross برای نظریه «پاسخ به آسیب» در آتروژنز، تجمع تدریجی سلولهای ماهیچه صاف بود، اما نظرات بعدی وی شامل ماکروفاژها و از این رو التهاب به عنوان بخشی از ساختار بیولوژیکی آتروم میباشد. من به یاد میآورم که Ross در حال ارائه یک سمینار در بخش آسیبشناسی بیمارستان Brigham and Women’s بود که از آخرین بازبینی فرضیه پاسخ به آسیب سخن گفت که در آن به نقش سلولهای التهابی اشاره شده است. یک استاد ارشد مورد احترام پاتولوژی در پاسخ به Ross که طی سمینار خود نظر وی را جویا شده بود، گفت:«ادامه دهید Ross، بالاخره به پاسخ درست دست خواهید یافت».
در همین حال، Michael Gimbrone، با همکاری Ramzi Cotran و Judah Folkman، روشهایی را برای کشت سلولهای اندوتلیال ابداع کردند که اجازه رشد بیش از حد سلولهای مزانشیمی آلودهکننده را نمیداد. این پیشرفت، امکان مطالعه آزمایشگاهی رفتار سلولهای اندوتلیال را فراهم کرد. Jaffe و Nachman همچنین بهطور همزمان در کشت سلولهای اندوتلیال موفق شدند. متأسفانه، در ابتدا تکثیر سلولهای اندوتلیال در کشت دشوار بود. افزودن فاکتورهای رشد که بر اساس میل ترکیبی آنها به هپارین، خالصسازی و تعیین مشخصات شده باشند، کشت سلولهای اندوتلیال را در شرایط آزمایشگاهی ممکن ساخت و امکان انجام گروهی از مطالعات مکانیکی را فراهم آورد که آغازگر دوره جدیدی از مطالعه آزمایشگاهی نقش التهاب در آترواسکلروزیس شدند.
فهم Gimbrone از «مولکول چسبندگی لکوسیت اندوتلیال مرتبط با آترواسکلروزیس» یا Athero-ELAM، به دنبال تعیین خصوصیات E- سلکتین شکل گرفت. شناسایی مولکول چسبندگی سلول عروقی -1 (VCAM-1) اساس فراخوانی لکوسیتها به مناطق التهاب را نشان داد. یافتههای Cybulsky و Gimbrone مبنی بر بیان بیش از حد VCAM-1 در سلولهای اندوتلیال پوشاننده پلاکهای آترواسکلروتیک، موجب درک مکانیکی فراخوانی لکوسیتها که در طراحیهای Anitschkow حضور داشتند و در میکروگرافهای الکترونی Faggiotto و Ross، قابل مشاهده بودند، شد. مطالعات دیگر، بیان VCAM-1 قبل از فراخوانی لکوسیتها را نشان میدهد و از عقیده دخالت این مولکول چسبندگی در فراخوانی لکوسیتها حمایت میکند. روشن شدن ساختار و عملکرد مجموعهای از مولکولهای جاذب شیمیایی به نام کموکاینها، چرایی ورود لکوسیتهای متصل به مولکولهای چسبندگی به انتیمای سرخرگ را که باعث ایجاد پلاک آترواسکلروتیک و تقویت شکلگیری آن میشود، را توضیح داد. این یافته که سایتوکاینهای پیشالتهابی مانند اینترلوکین-۱ و فاکتور نکروز تومور میتوانند موجب بیان مولکولهای چسبندگی و کموکاینها شوند، التهابی بودن اساس این بیماری را بیش از پیش تأیید میکند. این که دیوارههای عروقی میتوانند در صورت مواجهه با محرکهای پیشالتهابی، این سایتوکاینها را تولید کنند، موجب درک چگونگی آغاز و گسترش فرایند فراخوانی و تجمع لکوسیتها در ضایعات نوظهور و در حال رشد شد.
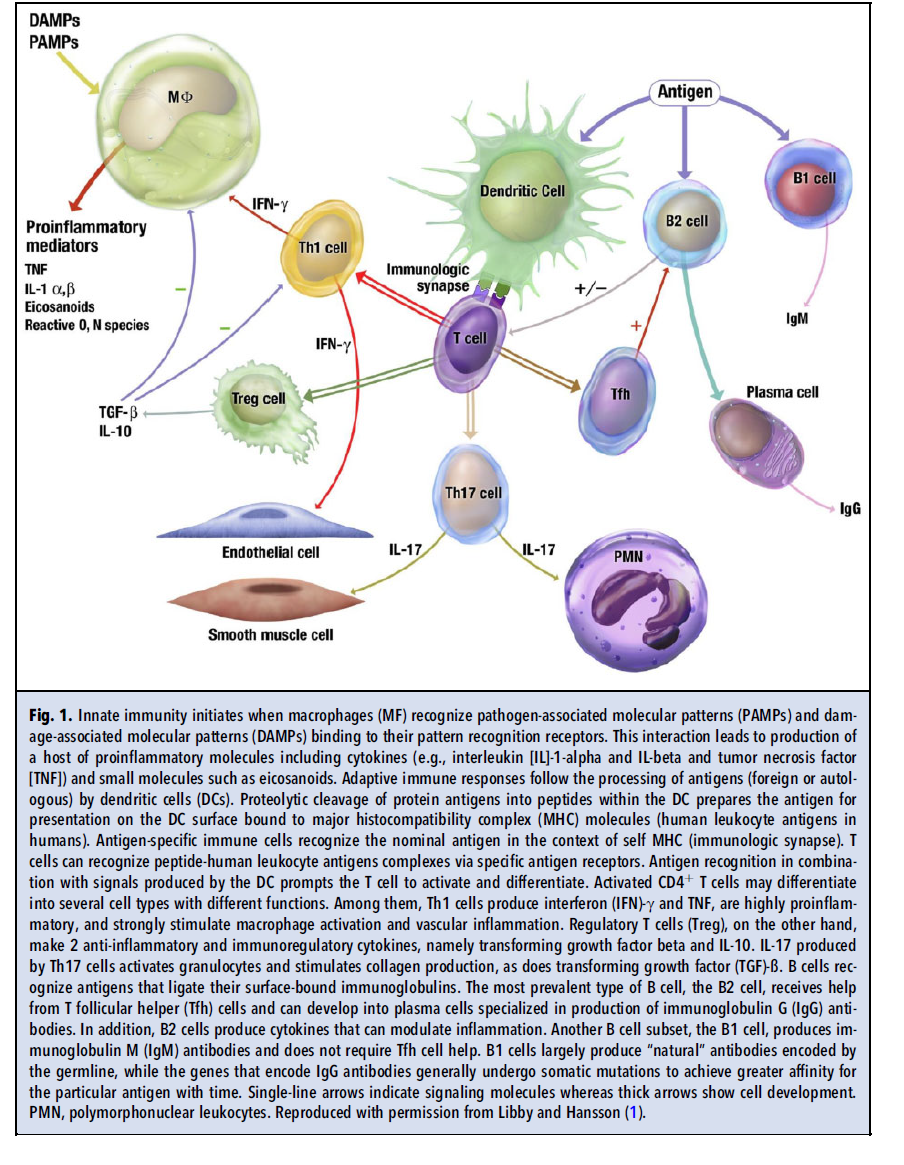
پیشرفت تکنولوژیکی دیگر، ظهور آنتیبادیهای مونوکلونال بود که تعریف دقیق انواع سلولی مختلف دخیل در آتروژنز را ممکن ساخت. این نوآوری قرن بیستمی که فراتر از فناوری رنگ قرن نوزدهم است، ساختارهای سطح سلولی و سیتوپلاسمیای را شناسایی کرد که انواع مختلف لکوسیتها را در محل ضایعات، لوکالیزه میکند. سلول اصلی ایمنی ذاتی؛ ماکروفاژ، بخش غالب جمعیت لکوسیتی در پلاکها است. با این وجود به نظر میرسد جمعیت كوچكتر لنفوسیتهای T سیگنالهای مهمی را برای تنظیم پاسخ التهابی حاصل از تعداد زیاد فاگوسیتهای تکهستهای در ضایعات را فراهم میكنند. در نهایت، تکنیکهای ایمونوهیستوشیمی و ایمونوفلورسنت و بهکارگیری مرتبسازی سلولی فعالشده با فلورسنت، هر کلاس از لکوسیتها را به عنوان اجزای پلاکهای آترواسکلروتیک یا احاطهکننده لایههای medial یا adventitial عروقی در مراحل مختلف پلاکهای آترواسکلروتیک انسانی و تجربی شناسایی کرده است. جامعه ایمونولوژی، دورهای را برای تقسیم دقیقتر سلولهای ایمنی ذاتی و تطبیقی آغاز کرد که برای متخصصان غیر ایمونولوژی گیجکننده بود اما این تقسیمبندی، مفاهیم و ابزارهایی را فراهم آورد که چشمانداز جدیدی را به روی بخشهای پیدا و پنهان مسیرهای التهابی در آترواسکلروزیس بازمیگشاید (شکل ۱).
هتروژنسیتی سلولهای ایمنی ذاتی در آترواسکلروزیس
استفاده از جعبه ابزار ایمونولوژیستها برای آترواسکلروزیس، شناسایی انواع مختلف فاگوسیتهای تکهستهای را که در آترواسکلروزیس دخالت دارند، امکانپذیر ساخت. ظهور موشهای مستعد آترواسکلروزیس که برای به دست آوردن یا از دست دادن عملکرد مدیاتورهای مختلف مهندسی شده بودند، آزمایش فرضیههای مکانیکی در مورد مشارکت سلولها و مدیاتورهای مختلف در این بیماری را ممکن ساخت. به نظر میرسد زیرگروه مونوسیتهای پیشالتهابی (که در موشها با سطح بالای مارکر سطح سلولی Ly6c مشخص میشوند) در پلاکهای آترواسکلروتیک تجمع مییابند. آنها میتوانند بالغ شده و به ماکروفاژها تبدیل شوند؛ این ماکروفاژها به دلیل بیان گیرندههای رفتگر (scavenger) که خود توسط مدیاتورهای پیشالتهابی تنظیم میشوند، میتوانند لیپید اضافی را جذب کرده و به سلولهای کفآلود تبدیل شوند. ماکروفاژها نیز از خود قطبیت نشان میدهند. دودستگی ماکروفاژها بهصورت ماکروفاژهای پیش التهابی M1 و ماکروفاژهای جبرانکننده یا کمتر التهابی M2، در موشها نسبت به انسان تمایز دقیقتری دارد و مجموعه زیرگروههای عملکردی ماکروفاژها را بیش از حد ساده میکند. در حقیقت، استفاده از بیان ژن یک سلول منفرد (single cell gene expression) و بیان پروتئین مبتنی بر طیفسنجی جرمی، رنگینکمان واقعی از انواع سلولهای ایمنی ذاتی را در آترواسکلروز آزمایشگاهی و انسانی نشان داده است. مشاهدات تجربی در آترواسکلروزیس موشی که نشاندهنده تکثیر فاگوسیتهای تکهستهای بودند از یافتههای فراساختاری پاتولوژیستهایی مانند Herbert Stary مبنی بر همانندسازی ماکروفاژ در پلاکها، پشتیبانی میکرد، همچنین این نتیجهگیری از مشاهدات آترواسکلروزیس در خرگوشها نیز مطرح شده است.
عملکردهای سلولهای ایمنی تطبیقی در آترواسکلروزیس
همانگونه که مونوسیتها و ماکروفاژها از لحاظ مارکرها و عملکردها، هتروژنسیتی نشان میدهند؛ سلولهای سیستم ایمنی تطبیقی نیز دارای هتروژنسیتی هستند (شکل ۱، سمت راست). زیرگروه Th1 از سلولهای T کمکی که سایتوکاین شاخص آنها اینترفرون گاما (IFN-g) است، طی آترواسکلروزیس فعالیت دارد و عملکرد آن با بیان آنتیژنهای سازگاری بافتی اصلی کلاس II که توسط سایتوکاین IFN-g تنظیم میشود، آشکار میگردد. دادههای تجربی مختلفی بر نقش IFN-g و بنابراین سلولهای Th1 در آتروژنز صحه میگذارند. سلولهای T کمکی Th2 که با ترشح اینترلوکین ۱۰ (IL-10) و IL-4 مشخص میشوند، ممکن است آتروژنز را کاهش دهند. سلولهای T تنظیمی که بیانکننده فاکتور رشد ترانسفورم کننده بتا (TGF-β) هستند نیز تمایل به فرونشاندن التهاب دارند. عملکرد سلولهای Th17 در آترواسکلروزیس هنوز مورد بحث است و باید بیشتر مورد بررسی قرار گرفته و روشن شود.
ایمنی همورال و سلولهای B نیز در آترواسکلروزیس نقش دارند. لنفوسیتهای B1 میتوانند آنتیبادیهای طبیعی کد شده توسط Germline را تولید کنند که ظاهراً نقش محافظتکننده در مقابل آترواسکلروزیس دارند. در مقابل، لنفوسیتهای B2 میتوانند این فرایند را تشدید کنند. در حال حاضر نقش پیچیده زیرگروههای سلول B و مدیاتورهای مختلف سلول B، یک موضوع داغ پژوهشی در حیطه آترواسکلروزیس به شمار میرود.
کاهش فاصله بین کشف بیومارکرها و بهکارگیری آنها در بالین
پیشرفتهای فنی متوالی در بیوشیمی، بیولوژی سلولی و مهندسی ژنتیک، باعث شکلگیری انبوهی از پژوهشها در خصوص آترواسکلروزیس تجربی شد که حاصل آنها هزاران مقاله تجربی بود که ابعاد مختلف نقش التهاب در تنظیم این بیماری را روشن میساختند. با این وجود همچنان یک شکاف عمیق بین این حجم عظیم دادههای تجربی و بالین وجود داشت. بهکارگیری بیومارکرهایی که نشاندهنده آغاز التهاب بودند، این شکاف را کمتر کرد.
بهطور خاص، پروتئین واکنشگر C (CRP) که گزارشگر پاسخ فاز حاد است، به عنوان یک مارکر مورد اعتماد و ماندگار برای التهاب، به اثبات رسیده است. توسعه یک سنجش بسیار حساس (hsCRP)، اندازهگیری قابلاطمینان غلظتهایی که در بازه نرمال قرار داشتند را امکانپذیر ساخت. Berk و Alexander ارتباط بین التهاب و انفارکتوس میوکارد را شناسایی کردند. مشاهدات اولیه توسط گروه Rome افزایش CRP را در سندرم حاد کرونری نشان دادند. یک پژوهش جامع تحت هدایت Paul Ridker به نتیجهای منتهی شد که در ابتدا بحثبرانگیز بود اما در حال حاضر قطعی و مسلم است؛ اینکه CRP خون طیف مختلفی از پیامدهای قلبی- عروقی را پیشبینی میکند. از زمان شکلگیری تحقیقات اولیه در مورد نقش CRP در بیماری قلبی عروقی، شواهد بهدستآمده از صدها مطالعه، نشاندهنده ارتباط بهشدت قوی بین التهاب که معیار وجود آن CRP است و انواع مختلف پیامدهای قلبی عروقی است. شمار زیادی از بیومارکرهای التهاب و استرس اکسیداتیو در حال بررسی و تحقیق هستند، اما تکرارپذیری و کارایی عملی هیچیک به اندازه CRP اندازهگیری شده با سنجش بسیار حساس، نبوده است.
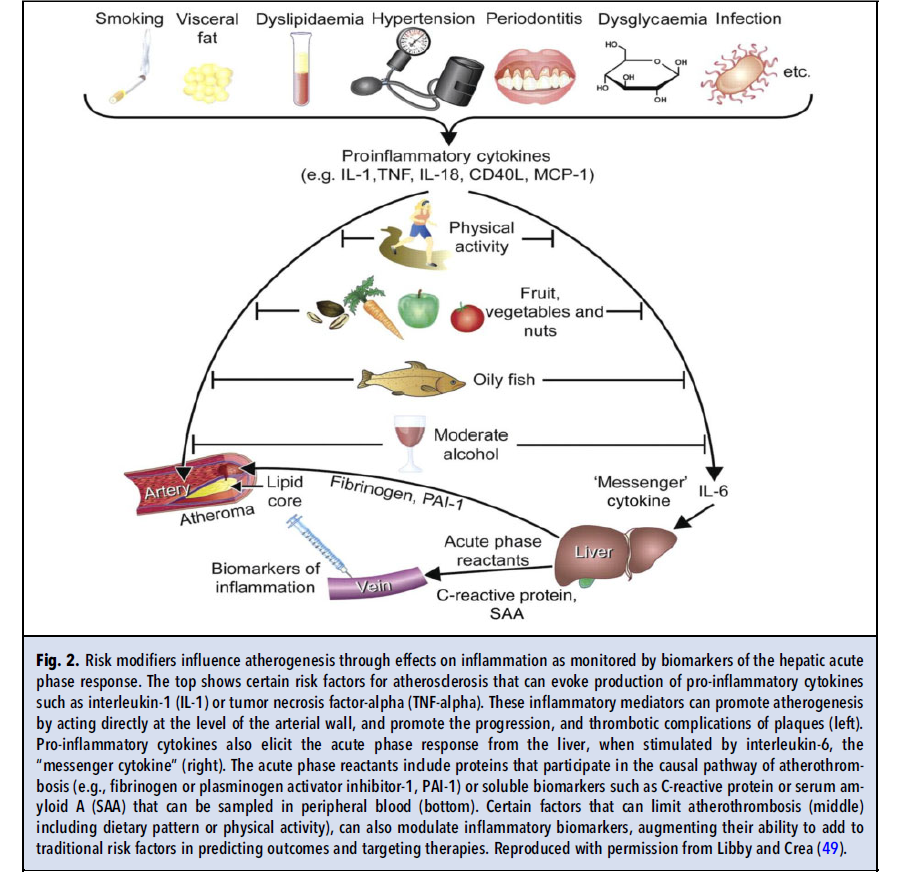
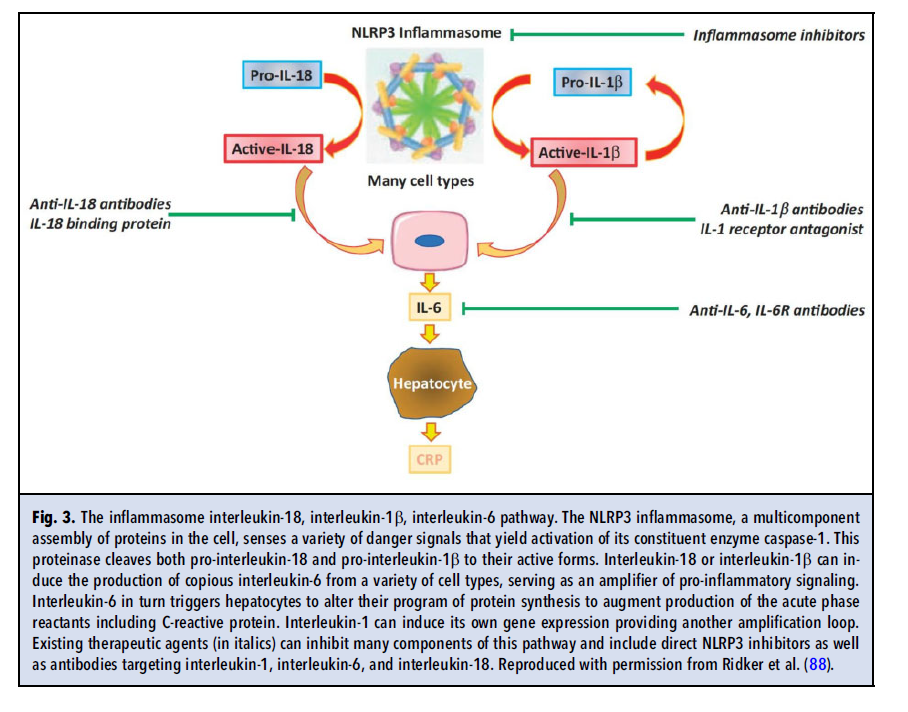
CRP سیگنالهای التهابی را که از منابع مختلفی سرچشمه میگیرند، یکپارچه میسازد. بسیاری از ریسک فاکتورهای مرسوم و نوظهور میتوانند موجب بیان سایتوکاینهای التهابی از جمله IL-1 شوند (شکل ۲). اینفلامازوم که یک اجتماع مولتیمریک داخلسلولی است، شماری از سیگنالهای مرتبط با آترواسکلروزیس از جمله کریستالهای کلسترول را دریافت میکند (شکل ۳ و ۴). اینفلامازوم از نوع NLRP3، پیشسازهای غیرفعال IL-1 بتا و IL-18 که سایتوکاینهای پیشالتهابی مرتبطی هستند را پردازش میکند و اشکال فعال آنها را تولید میکند. IL-1 به نوبه خود، IL-6 را از طریق چرخهای که سیگنال خطر را چندین برابر تقویت میکند، القا میکند. IL-6 القاکننده اصلی پاسخ فاز حاد در هپاتوسیتها است. سلولهای کبد در پاسخ به IL-6، تولید پروتئینهای دخیل در دفاع میزبان و بهبود زخم را افزایش میدهند (شکل ۲ و ۳). واکنشگرهای فاز حاد شامل فیبرینوژن و مهارکننده فعالکننده پلاسمینوژن-۱، در ترومبوز دخالت دارند اما استفاده از این دو پروتئين به عنوان بیومارکر، با چالشهای آنالیتیکال روبرو است. CRP اگرچه در مسیر معمول ترومبوز دخالت ندارد (همانگونه که در مطالعات تصادفیشده مندلی نشان داده شده است)، اما ویژگیهای مطلوبی به عنوان یک بیومارکر دارد. سنجش حساس، دقیق و مقرون به صرفهای برای CRP وجود دارد. CRP تغییرات شبانهروزی ندارد و حساسیت قابلتوجهی به تغذیه نیز ندارد. یک آنالیت پایدار است، نمونههای خون را میتوان برای سنجش CRP به نقاط دیگر ارسال کرد و بهصورت off-site سنجش را انجام داد. به علاوه چندین مطالعه از ارزش پروگنوستیک hsCRP در ارزیابی خطر قلبی عروقی حمایت کردهاند.
بیومارکرهای التهابی درمان هدفمند را ممکن میسازند
یک آنالیز post-hoc تحت هدایت Dr. Ridker بر روی مطالعه اولیه با موضوع استاتینها در پیشگیری ابتدایی که تحت عنوان مطالعه پیشگیری آترواسکلروزیس کرونری تگزاس/ نیروی هوایی شناخته میشود، مشخص ساخت که درمان با استاتین در افرادی با غلظتهای کمتر از متوسط LDL اما دارای غلظتهای بالاتر از متوسط CRP به همان اندازه مفید است که برای افرادی با کلسترول بالاتر از متوسط سودمند است. مطالعه آنالیز کلسترول و رویدادهای راجعه (CARE) نشان داد که پرواستاتین میتواند CRP را کاهش دهد، این نتیجه بهطور گسترده در افرادی با غلظتهای LDL «نرمال» اما CRP بالاتر از میانگین جمعیت (تقریباً 2 mg/L) از لحاظ بالینی با همه استاتینهای تست شده، تکرار شد. در مطالعات PROVE-IT TIMI-22 و Aggrastat-to-Zocor، شرکتکنندگانی که میزان LDL و CRP آنها پایینتر از پاسخ متوسط بود، بهترین پیامدها را داشتند. این نتایج پیشنهاد میکنند که استاتینها میتوانند مارکر التهابی را بهصورت مستقل از کاهش LDL، کاهش دهند.
این مشاهدات، Ridker را به سمت طراحی یک مطالعه برای آزمودن این فرضیه که انجام استاتینتراپی برای پیشگیری مفید خواهد بود، هدایت کرد. در مطالعه «توجیه استفاده از استاتین برای پیشگیری: یک کارآزمایی مداخلهای با ارزیابی رزوواستاتین (JUPITER)» این فرضیه بر روی ۱۷ هزار نفر تست شد. این مطالعه در میانه راه با نظر کمیته نظارت بر امنیت دادهها به دلیل اثربخشی بسیار زیاد، متوقف شد. این نتیجه چشمگیر، نشان میدهد که وضعیت التهابی قابلیت این را دارد که درمان را به سمتی هدایت کند که وقایع قلبی عروقی را کاهش دهد. با وجود این، مطالعه JUPITER نتوانست بهطور مستقیم تئوری التهاب در آترواسکلروزیس را بیازماید. اگرچه به نظر میرسد رزوواستاتین بخشی از اثربخشی خود را از طریق اثر ضدالتهابی مستقیم اعمال میکند، اما به دلیل اثر همزمان آن در کاهش LDL، تعیین دقیق اینکه عملکرد ضدالتهابی آن تا چه اندازه در سودمندی بالینی آن، مستقل از کاهش LDL، نقش دارد؛ ممکن نیست.
درمانهای ضدالتهابی مستقیم میتوانند رویدادهای آترواسکلروتیک را کاهش دهند- از تئوری تا عمل
گام منطقی بعدی در آزمودن فرضیه التهاب در آترواسکلروزیس در انسانها نیازمند یک کارآزمایی با مداخلهای است که التهاب را کاهش دهد اما بر لیپوپروتئینها آتروژنیک اثر نگذارد. کارهای تحقیقی منسجم انجامشده در طول دهههای گذشته، به نقش سایتوکاین پیشالتهابی اینترلوکین ۱ بتا، (IL-1β) در پاتوژنز آترواسکلروزیس اشاره دارند. داروی کمکاربرد (orphan drug) کاناکینومب که یک آنتیبادی منوکلونال اختصاصی برای خنثی کردن IL-1β است، فرصت آزمودن این فرضیه را در اختیار پژوهشگران قرار داده است. در یک مطالعه فاز ۲ در
افراد دیابتیک، کاناکینومب یک کاهش وابسته به دوز در CRP، فیبرینوژن (پیشساز لخته) و IL-6، سایتوکاینی که توسط IL-1β القا میشود و بنا به شواهد قوی ژنتیک انسانی، میتواند از عوامل آتروترومبوز باشد؛ ایجاد کرد.
ما با استفاده از دادههای مطالعه فاز ۲، یک کارآزمایی پیامدهای بالینی در مقیاس بزرگ بر روی ۱۰ هزار نفر که از انفارکتوس میوکارد بهبود یافته بودند و مجموعه کامل داروهای استاندارد الزام شده توسط گایدلاینها از جمله استاتینتراپی با شدت بالا را دریافت میکردند، انجام دادیم. این بیماران در فاز پایدار پس از کنترل سندرم کرونری حاد قرار داشتند و حداقل ۳۰ روز از رویداد انفارکتوس میگذشت. تنــــــها افرادی با hsCRP بالای 2.0 mg/L وارد مطالعه شدند، بنابراین این افراد شواهد بیومارکری التهاب خاموش را علیرغم
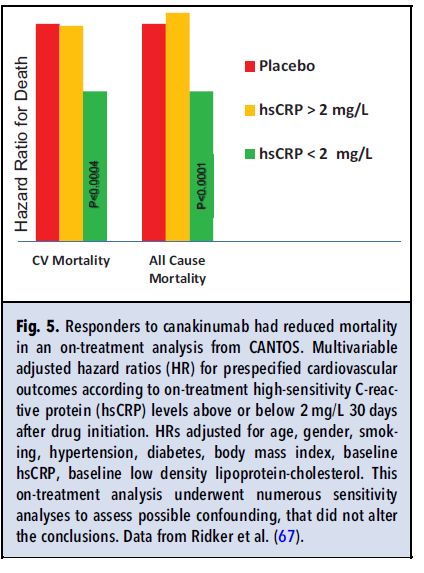
استاتینتراپی بسیار مؤثر نشان میدادند. CANTOS (مطالعه پیامدهای ضدالتهابی ترومبوزی کاناکینومب) به نقطه پایانی اولیه خود دست یافت، کاهش در انفارکتوس میوکارد، سکته یا مرگ با دوز متوسط تست شد. در افرادی پاسخ به عامل دارویی، کاهش بیشتر از حد متوسط در hsCRP بود، در یک آنالیز حین درمان، ۳۰ درصد کاهش در مرگ و میر کلی و ناشی از رویدادهای قلبی عروقی مشاهده شد(شکل ۵). درمان با کاناکینومب، لیپوپروتئینهای آتروژنیک را کاهش نداد. این نتیجه برای اولین بار توانایی درمانهای ضدالتهابی را در کاهش رویدادهای قلبی عروقی نشان داد. تاکنون در مطالعه CANTOS علیرغم اثرات سودمند بسیار، افزایش کم ولی به لحاظ آماری معناداری در ابتلا به عفونت از جمله عفونتهای کشنده وجود داشته است. کاهش در بروز سرطان و مورتالیتی ناشی از آن، در یک آنالیز exploratory نشان داده شده است که با ریسک عفونت به توازن و تعادل میرسد؛ بنابراین اگرچه نبرد درمان ضدالتهابی آترواسکلروزیس آغاز شده است، اما هنوز کارهای زیادی باید انجام شود.
کارآزمایی کاهش مداخله قلبی عروقی (CIRT) این فرضیه را مورد آزمایش قرار داد که آیا دوز پایین هفتگی متوترکسات، دارویی که انقلابی در مدیریت آرتریت روماتوئید پدید آورد، میتواند در کاهش وقایع قلبی عروقی نیز سودمند باشد؟ در جمعیت مورد بررسی، کاهشی در وقایع قلبی عروقی مشاهده نشد. درمان با متوترکسات بیومارکرهای التهاب از جمله hs-CRP و IL-6 را کاهش نداد که نشان میدهد در دوز استفاده شده در این مطالعه و شرکتکنندگان آن، متوترکسات اثر ضدالتهابی ایجاد نمیکند. شماری از دیگر درمانهای ضدالتهابی مشهور از جمله مهارکنندههای مختلف فسفولیپازها و مهارکنندههای p38 MAP کیناز، نیز در بهبود پیامدهای قلبی عروقی با شکست روبرو شدهاند.
تقویت توانایی ضدالتهابی داروها برای محدود ساختن وقایع آترواسکلروتیک، از حمایت قاطع حجم زیادی از مطالعات اخیر بر روی کلشیسین، برخوردار شده است. این محصول طبیعی، التهاب را کاهش میدهد، مانع عملکردهای گرانولوسیتها میشود و دهها سال در نقرس و وضعیتهای التهابی مانند تب خانوادگی مدیترانهای استفاده شده است که پیشگام آن تیم تحت هدایت Sheldon M. Wolff بود که اعضای آن
Dr. Charles Dinarello و Dr. Anthony Fauci بودند. درمان با کلشیسین در طب قلب و عروق به عنوان درمانی برای پریکاردیت کاربرد دارد که از عودهای معمولی که افراد مبتلا به این بیماری غالباً در هنگام کاهش گلوکوکورتیکوئیدها تجربه میکنند، جلوگیری میکنند.
مطالعه کلشیسین با دوز پایین (LoDoCo) بر روی ۵۰۰ فرد که دوز 0/5 میلیگرمی کلشیسین در روز دریافت میکردند، انجام شد. این مطالعه open lable کاهش چشمگیری در عود وقایع قلبی عروقی را نشان داد. COLCOT (کارآزمایی پیامدهای قلبی عروقی کلشیسین) این فرضیه را در یک کارآزمایی بزرگ، با طراحی دقیق دوسوکور و کنترلشده با دارونما، مورد آزمایش قرار داد که نتیجه مثبت واضحی را با ۲۶ درصد کاهش در نقطه پایانی اولیه نشان داد که عمدتاً ناشی از revascularization فوری بود. اندکی پس از COLCOT، کارآزمایی LoDoCo2 افرادی را مورد مطالعه قرار داد که در فاز پایدار بیماری شریان کرونری قرار داشتند و رژیم کلشیسین مشابهی دریافت میکردند؛ این مطالعه کاهش ۲۶ درصدی در نقطه پایانی اولیه را نشان داد که عمدتاً ناشی از انفارکتوس میوکارد راجعه بود. به نظر میرسد در COLCOT و LoDoCo2، کلشیسین به خوبی تحمل (well tolerated) شده بود. LoDoCo2 در افراد فاز ثابت انجام شده بود و این افراد قادر بودند که فاز run-in را کامل کنند که منجر به حذف تقریباً ۱۰ درصد داوطلبین به دلیل اثرات ناخواسته غیرقابل تحمل شد.
اگرچه COLCOT افزایش کمی در پنومونی نشان داد، اما LoDoCo2 با افزایش عفونت همراهی نداشت. ما به بررسیهای بیشتر در مورد تفاوتهای جغرافیایی و سیگنال مورتالیتی مشاهده شده در برخی از این مطالعات نیاز داریم. اصولاً کلشیسین ارزان است و از دهههای گذشته توسط سازمانهای نظارتی برای شرایط التهابی تأیید شده است. استفاده آن در افراد مبتلا به بیماری مزمن کلیوی پیشرفته محدود است. تداخلات دارویی مورد توجه شامل آنتیبیوتیکهای ماکرولید مانند کلاریترومایسین و اریترومایسین و یک داروی قلبی عروقی متداول، یعنی وراپامیل است. سیکلوسپورین که همچنان در گیرندگان پیوند استفاده میشود، میتواند با کلشیسین میانکنش داشته باشد، مانند سایر مهارکنندههای گلیکوپروتئین P.
ترکیب CANTOS با کارآزماییهای اخیر کلشیسین، فرضیه التهاب در آترواسکلروزیس را از تئوری به یک واقعیت بالینی تبدیل میکند.
آینده درمان ضدالتهابی در آترواسکلروزیس چگونه خواهد بود؟
بهجز IL-1، تعدیل سایر سایتوکینها به عنوان درمانی برای آتروترومبوز شایسته توجه است. IL-6، در پاییندست IL-1 و IL-18، یک سایتوکین پیشالتهابی مرتبط با IL-1، ممکن است التهاب را با اختلال کمتری در دفاع میزبان نسبت به مسدود ساختن IL-1 بتا، فرو نشاند. در بالادست، اینفلامازوم NLRP3 نیز به عنوان یک هدف درمانی در آترواسکلروز، جالب توجه است، زیرا فرمهای فعالIL-1 بتا و IL-18 را ایجاد میکند (شکل 3 و 4). درگیری ایمنی همورال در کاهش آترواسکلروزیس منجر به تحقیقاتی در مورد رویکرد واکسیناسیون برای درمان آترواسکلروزیس شده است. این رویکرد، اگرچه توسط مطالعات تجربی متعددی پشتیبانی میشود، اما کاربرد بالینی آن با تأخیر روبرو بوده است. تقویت سلولهای T تنظیمی با مصرف IL-2 با دوز پایین در حال ارزیابی است. یک چالش کلیدی همچنان هدفگذاری دقیق درمانهایی است که اثرات ناخواسته احتمالی بهصورت تداخل در دفاع میزبان هستند. اگرچه ممکن است مولکولهای اختصاصیشده pro-resolving آترواسکلروزیس را بدون تداخل در دفاع میزبان کاهش دهند، اما این روش هنوز بازده بالینی به همراه نداشته است.
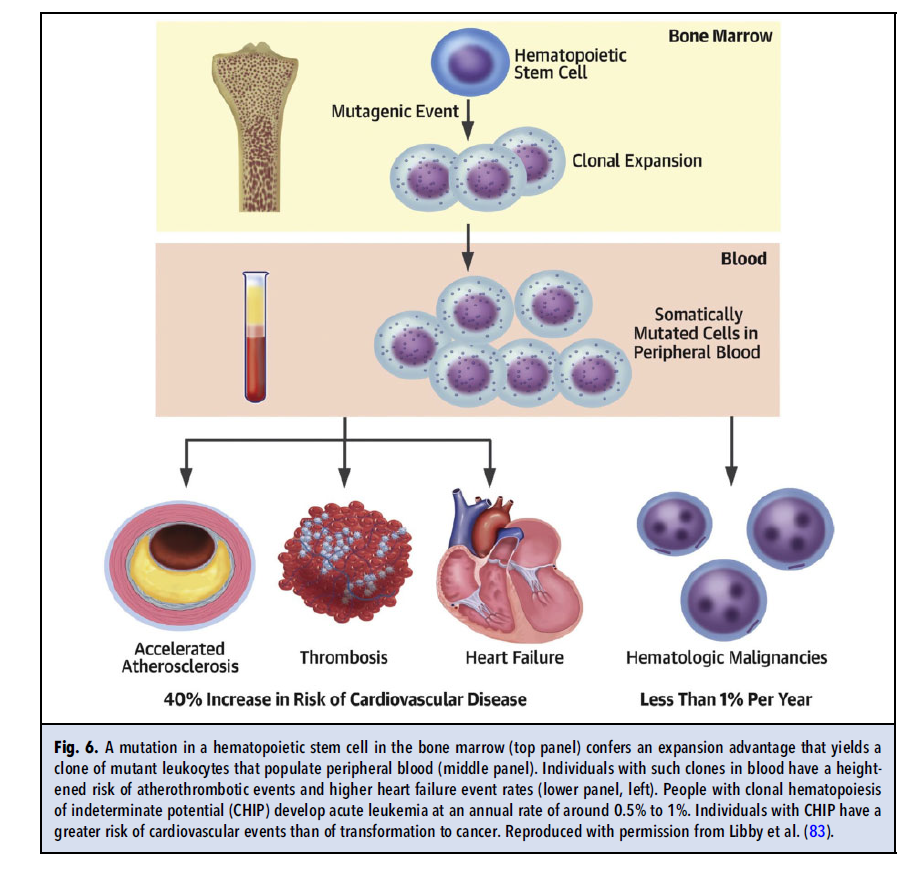
مشاهده اینکه افراد با هماتوپوئز کلونال با پتانسیل نامشخص (CHIP) ریسک قلبی عروقی افزایشیافته دارند که به نظر میرسد حداقل تا حدی از فعالسازی مسیرهای پیش التهابی ناشی میشود؛ یک مسیر بالقوه برای تخصیص دقیق درمانهای ضد التهابی را فراهم میکند. CHIP از جهشهای سوماتیک در سلولهای بنیادی مغز استخوان منشأ میگیرد که باعث ایجاد کلون سلولهای جهشیافته در خون محیطی میشود (شکل 6). این جهشها در ژنهای driver شناختهشده لوسمی رخ میدهند. از آنجا که گذار این وضعیت به بدخیمی هماتولوژیک بهطور کلی نیاز به کسب سه جهش یا بیشتر در یک کلون لکوسیتی معین دارد، افراد مبتلا به CHIP، مبتلا به لوسمی نیستند. با این حال، آنها افزایش چشمگیری در وقایع قلبی عروقی، مستقل از ریسک فاکتورهای مرسوم دارند. کسب این کلونها، وابستگی سنی چشمگیری را نشان میدهد. تا 70 سالگی، حداقل 10 درصد افراد حامل یک کلون جهشیافته با جزء آللی واریانت ۲ درصد هستند که تعریف CHIP در مورد آن صدق میکند.
شواهد همزمان از چندین آزمایشگاه، از فعال شدن اینفلامازوم از مسیر IL-1b به IL-6 در CHIP پشتیبانی میکند. این یافتهها این احتمال را ایجاد میکنند که وضعیت CHIP ممکن است به هدایت درمانهای انتخابی که مسیر اینفلامازوم را هدف قرار میدهند در افراد دارای جهش در ژنهایی که بهطور معمول منجر به CHIP میشود یعنی DNMT3A و TET2، کمک کند. این طرح پیشنهادی، شایسته بررسی دقیق است.
نتیجهگیری
از استدلال قیاسی Virchow تا شکوفایی پاتولوژی تجربی، بیوشیمی لیپیدها و لیپوپروتئینها، زیستشناسی سلولی و حیوانات مهندسی شده ژنتیکی، مفهوم التهاب در آترواسکلروزیس بهطور دورهای در طول بیش از یک و نیم قرن، توجه را به خود معطوف میساخت. با کاوش در این مفهوم، هزاران مقاله علمی به دست آمده است. سه آزمایش کارآزمایی بالینی شاخص در سالهای اخیر، کارایی بالینی مورد انتظار این تحقیقات تجربی عظیم و بیومارکر انسانی و شواهد ژنتیکی را به ثمر نشانده است. این حماسه نمایانگر یک شاهکار علمی است که در طی چندین قرن باعث بحث و جدالهای زیادی بوده است. با این حال، ما در آستانه دورانی ایستادهایم که میتوانیم از مزایای این دوران طولانی تلاشهای تحقیقاتی برای بهبود سلامت و رفاه انسان بهرهمند شویم.
برگردان از:
Inflammation in Atherosclerosis—No Longer a Theory
Clinical Chemistry 67:1 (2021)
منابع:
[1] سولون، دولتمرد و قانونگذار آتنی که وی را پدر شهر آتن خواندهاند.
مروری مختصر بر پروتئینهای فاز حاد
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام