بررسی آئروسلهای قارچی آلودهکننده محیط آزمایشگاه جانورشناسی دانشگاه پرند
سحر فرزانه1*، الهه سرداری2، فرشته قاسمی سیمکانی3
1،2،3گروه زیستشناسی، واحد پرند، دانشگاه آزاد اسلامي، پرند، ايران.
*نویسنده مسئول:
دانشجوی دکترای تکوین دانشگاه آزاد اسلامی، پرند، ایران.
پست الکترونیکی: sahar.farzaneh@gmail.com
چکیده
سابقه و هدف: آزمایشگاههای مراکز آموزشی به علت رفتوآمد بسیار زیاد میتوانند مکانهای مهمی برای انتشار میکروبها بهویژه باکتریها و قارچها باشند، لذا مطالعه حاضر با بررسی آلودگیهای قارچی محیط آزمایشگاه جانورشناسی دانشگاه آزاد پرند به منظور تشخیص و کاهش و رفع آلودگیها انجام گردیده است.
مواد و روشها: در این مطالعه پس از ساخت محیط کشت ویژه رشد قارچها، 6 گروه مجزا ایجاد گردید. این گروهها شامل موارد ذیل هستند:
1- گروه کنترل
2- گروهی که محیط به مدت 10 دقیقه در معرض هوای آزمایشگاه قرار گرفته بود.
3- گروهی که محیط به مدت 20 دقیقه در معرض هوای آزمایشگاه قرار گرفته بود.
4- گروهی که محیط به مدت 30 دقیقه در معرض هوای آزمایشگاه قرار گرفته بود.
5- گروهی که با سواب، نمونه از روی سطوح گرفته شده بود.
6- نمونه حاصل از برخورد دست دانشجویان و سطح محیط آزمایشگاه.
پس از شستشوی آزمایشگاه با آب ژاول مجدداً از محیط نمونهبرداری شد و نمونهها پس از نگهداری در دمای 28 درجه انکوباتور، از نظر رشد قارچی مورد بررسی قرار گرفتند.
یافتهها: از 30 نمونه کشتشده، تمام نمونهها از نظر رشد قارچ مثبت بودهاند. شایعترین گونههای قارچی جداشده شامل پنیسیلیوم و آسپرژیلوس بوده و گونههای رایزوپوس و کاندیدا نیز از فضای آزمایشگاه جدا شدند، همچنین پس از شستشوی آزمایشگاه با دترجنتهای رایج همچون آب ژاول، میزان آلودگیها بهطور قابلتوجهی کاهش نشان داد.
نتیجهگیری: بر اساس یافتههاي بدستآمده، با توجه به وجود آلودگیهاي قارچی ساپروفیتی و درماتوفیتی در آزمایشگاه، بهکارگیری فرآیندهاي پیشگیري و بهداشتی در این محیطها از جمله شستوشوي منظم و اصولی و برطرف کردن کلنیهاي قارچی در این محیطها میتواند در کاهش آلودگی و انتقال این بیماريها مفید باشد.
واژههای کلیدی: قارچ، آلودگی، آزمایشگاه، دانشگاه
مقدمه
قارچها (Fungi) یوکاریوتهای غیرمتحرک و غالباً بیهوازیاند که میتوانند بهصورت انگل یا آزاد وجود داشته باشند. قارچها دارای دیواره سلولی سختی از جنس گلوکان و کیتیناند و غشای سلولی آنها محتوی ارگوسترول (مشابه غشاهای سلولی انسانی) است که مورد هدف قارچکشها قرار میگیرند (1،2). قارچها به شکلهای گوناگونی وجود دارند، اما فقط سه فرم آنها برای انسان بیماریزا هستند:
1) مخمرها (Yeasts) که بهصورت تکسلولیهای گرد یا بیضوی شکلند و از طریق جوانه زدن تولیدمثل میکنند.
2) کپکها (Molds) که بهصورت کلنیهای طویل، نرم و کرکدار وجود دارند. کپکها را میتوان بهصورت ساختارهای توبولار میکروسکوپی به نام هیفی (hyphae) مشاهده نمود که در انتهای آن ساختمان ایجادکننده اسپور یعنی کونیدیا (conidia) را ایجاد میکنند.
3) قارچهای دو شکلی (Dimorphic) که به لحاظ پزشکی اهمیت دارند و میتوانند از حالت مخمر به کپک بازگردند. در محیط کپکها و در انسان مخمرها قارچهای غالب محسوب میشوند (3).
بیماريهاي قارچی از جمله عفونتهایی هستند که در محیطهای مختلف با توزیع الگوهای متغیر که بستگی به عوامل مختلف دارند، پیدا میشوند و همواره موجب ابتلاي انسان به انواع بیماریهای ناشی از قارچها میگردند که در مواردي حیات ما را نیز به خطر میاندازند (4). در میان انواع عفونتهای ناشی از میکروبها، عفونتهاي قارچی سطحی به خاطر وجود عوامل ایجادکننده آن که در اکثر موارد فلور نرمال هستند از اهمیت ویژهاي برخوردارند (5)، همچنین قارچهای ساپروفیت از شایعترین عوامل بیولوژیک (بیوآئروسل) آلودهکننده هوا هستند. کونيديهاي آنها به ميزان زيادي در هوا وجود داشته و باعث آلودگي محيط زيست میشوند. اين قارچها جهت رشد و تکثير نیاز به رطوبت و ماده اوليه آلي بهعنوان منبع تغذيه دارند و بهراحتی قادر هستند در دمای محیط و بر روي هرگونه ماده آلي زندگی نموده و تکثیر يابند (6). معمولترین قارچهای ساپروفیت کپکها هستند مانند کپک سبز (Penicilium)، کپک سیاه (Aspergillus) و رایزوپوس (Rhizopus) که با وجود مقدار کمی از رطوبت میتوانند روی هر مادهای رشد کنند (7). از دیگر انواع قارچها میتوان به قارچهای سطحی عامل ایجاد عفونتهای درماتوفیت اشاره نمود که از عفونتهاي معمول انسانی بوده و شیوع آن در حال افزایش است (8) مانند مايکوزيسها (Mycosis) و کاندیداها Candida) (9)). کاندیداها انواعی از قارچهای مخمری هستند که در سطح مخاط دهان و واژن بهصورت یک لایه پلاک سفید رنگ یافت میشوند (12-10). یکی از علائم وجود کاندیدا این است که اگر سطح پلاک از بین برود، موجب درد و قرمز شدن و گاهی خونریزی میشود. کاندیدا غالباً در نوزادان مشاهده میشود (15-13)، اما در بزرگسالان به دلیل مصرف استروئیدها و آنتیبیوتیکها و برهم خوردن تعادل میکروبها نیز تشکیل میشود و حتی رشد بیش از حد آنها میتواند منجر به سرطان شود (18-16).
محیطهای سرپوشیده همچون آزمایشگاهها به دلیل ارتباط مستقیم و مداوم گروههای مختلف همچون نمونههای میکروبی، انگلی، جانوران و انسان میتواند همانند یک منبع بالقوه انتشار آلودگیهای بیولوژیکی عمل نموده و عامل انتقال و شیوع بیماریهای مختلف بهویژه قارچی باشند (19). بسياري از قارچهای موجود در آزمایشگاهها به علت اینکه رفتوآمد افراد در آنها زیاد است، توانايي بالقوهای در توليد تركيباتي موسوم به تركيبات آلي فرار (Volatile organic compounds) و مايكوتوكسين دارند. تماس با اين تركيبات ميتواند منجر به عوارض خفيف نظير آسيبهاي غشاهاي مخاطي، اختلال در توجه، سردرد، عدم توانايي در تمركز و گيجي تا عوارض مزمني نظير سرطان در افراد در معرض شود و بهعنوان يكي از آتروآلرژنهاي شايع در افراد حساس، میتوانند شروعکننده واکنشهای آلرژيك با طيف متنوعي از علامتهاي ساده نظير آبريزش بيني، اشكريزش، سرفه و عطسه تا ناراحتيهاي شديد نظير آسم و سينوزيت باشند (20،21). آسپرژيلوسها و قارچهای سياه از جمله شایعترین عوامل ایجادکننده سینوزیتهای قارچي هستند (22). تحقیقات نشان داده پنیسیلیومها، آسپرژیلوسها و فوزاریومها توکسینزا بوده و سموم خطرناکی مثل تریکوتسنها را تولید میکنند که میتواند منجر به پنومونی شود (23). تاکنون مطالعات کمی و کیفی متعددی در رابطه با آلایندههای بیولوژیکی منتقلشده در بخشهای مختلف آزمایشگاهها، دانشگاهها و بیمارستانها صورت گرفته است؛ اما در رابطه با بررسی انواع آنها در هوا و مقاومت قارچها نسبت به دترجنتهای رایج جهت شستشوی آزمایشگاهها اطلاعات کمی در دسترس است، لذا با توجه به اهمیت شناسایی این قارچها و پیشگیری از مضرات آنها برای سلامت دانشجویان و نیز کنترل آلودگی محیط آزمایشگاهها، این مطالعه با هدف بررسی انواع آلودگیهای قارچی در فضای آزمایشگاهها انجام گردید.
مواد و روشها
در این مطالعه قارچهای موجود در هوا، سطوح آزمایشگاه و دست دانشجویان پس از تماس با سطوح آزمایشگاه جانورشناسی دانشگاه آزاد واحد پرند طی بهار 1398 در حین تشریح ماهی مورد ارزیابی قرار گرفت. پس از ساخت محیط کشت ویژه رشد قارچها {سابور و دکستروآگار حاوی آنتیبیوتیک کلرامفنیکل (Chloramphenicol)} 6 گروه مجزا (بهصورت هر گروه 3 تکرار) ایجاد گردید؛ شامل:
1- گروه کنترل (گروهی که در آن باز نشده بود).
2- گروهی که محیط به مدت 10 دقیقه در معرض هوای آزمایشگاه قرار گرفته بود.
3- گروهی که محیط به مدت 20 دقیقه در معرض هوای آزمایشگاه قرار گرفته بود.
4- گروهی که محیط به مدت 30 دقیقه در معرض هوای آزمایشگاه قرار گرفته بود.
5- گروهی که با سواب، نمونه از روی سطوح گرفته شده بود.
6- و در آخر گروه حاصل از برخورد دست دانشجویان و سطح محیط آزمایشگاه کشت شد.
همچنین ساعاتی پس از شستشوی آزمایشگاه با دترجنت آب ژاول، مجدداً همان نمونهها از سطوح گرفته شد و پس از نگهداری در دمای 28 درجه انکوباتور، نمونهها از نظر رشد قارچی مورد بررسی قرار گرفتند. پس از یک هفته پلیتها از انکوباتور خارج شده و از انواع کلنیها توسط فیلدوپلاتین نمونهبرداری گردید و سپس بهوسیله لاکتوفنل کاتن بلو رنگآمیزی شدند. پس از آن توسط میکروسکوپ با بزرگنماییهای 4، 10 و 100 مورد بررسی قرار گرفتند. همچنین تعداد کلنیهای هرگونه شمارش شد و درصد آنها توسط نرمافزار Excel 2013 محاسبه و بررسی گردید.
یافتهها
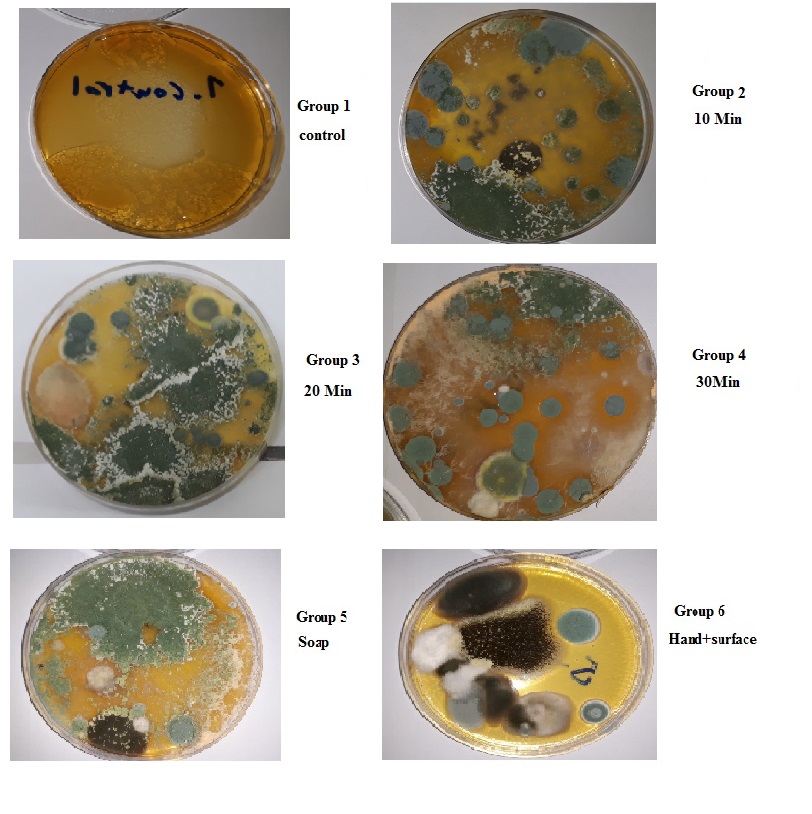
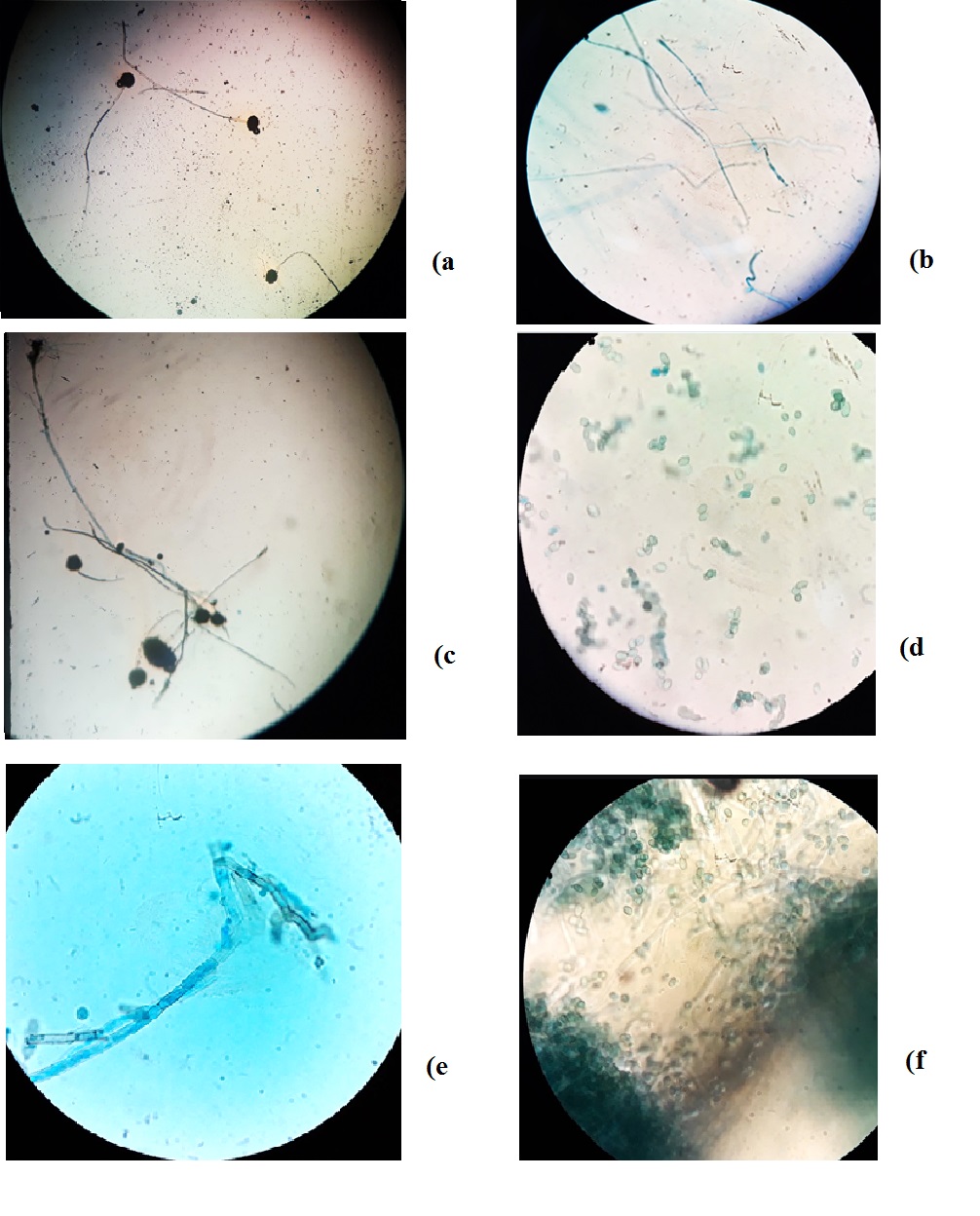
از 30 نمونه کشتشده، تمام نمونهها از نظر رشد قارچ مثبت بودهاند. شایعترین کلنیهای قارچی جداشده شامل پنیسیلیوم و آسپرژیلوس بوده و گونههای رایزوپوس و کاندیدا نیز از فضای آزمایشگاه جدا شدند (شکل 1)، همچنین پس از رنگآمیزی با لاکتوفنل کاتن بلو و بررسی میکروسکوپی لامها و مشخص شدن شکل هایفی و کونیدیاها، جنسها قابل شناسایی گردیدند (شکل 2).
شکل 1. نمونههای کشتشده قارچهای موجود در هوا و سطوح محیط آزمایشگاه
گروه 1) گروه کنترل (در بسته)؛
گروه 2) گروهی که محیط به مدت 10 دقیقه در معرض هوای آزمایشگاه بود؛ گروه 3) گروهی که محیط به مدت 20 دقیقه در معرض هوای آزمایشگاه بود؛ گروه 4) گروهی که محیط به مدت 30 دقیقه در معرض هوای آزمایشگاه قرار گرفته بود؛
گروه 5) گروهی که با سواب نمونه از روی سطوح گرفته شده بود؛
گروه 6) گروه حاصل از برخورد دست دانشجویان و سطح محیط آزمایشگاه. کپکهای سبز رنگ غالباً کلنیهای پنیسیلیوم و سیاه رنگ آسپرژیلوس را نشان میدهند، همچنین تراکم قارچها در پلیتها بهوضوح نشان داده شده است.
شکل 2. رنگآمیزی با لاکتوفنل کاتن بلو و بررسی میکروسکوپی کلنیها
(a) رشتهها (هایفیها)، کونیدیاها (اسپورانژیوم) آسپرژیلوس نایجر؛
(b) کپک (کونوسیتیک) (هایفیهای بدون سپتا)؛
(c) رایزوپوس (رشتههای ریشه مانند به نام ریزوئید در بالا و اسپورانژیومها به شکل دایرههای توپر قابل مشاهدهاند)؛
(d) آسکوپورها؛
(e) رشتهها (میکروکونیدیاها) و نقاط توپر (میکروکونیدیاها)؛
(f) سلولهای مخمر و سودوهایفیها
پس از شستشوی آزمایشگاه با دترجنتهای رایج همچون آب ژاول میزان آلودگیها بهطور قابلتوجهی کاهش نشان داد اما بهطور کامل حذف نشدند.
ارتباط میان مدت زمان و غلظت آئروسلهای قارچی
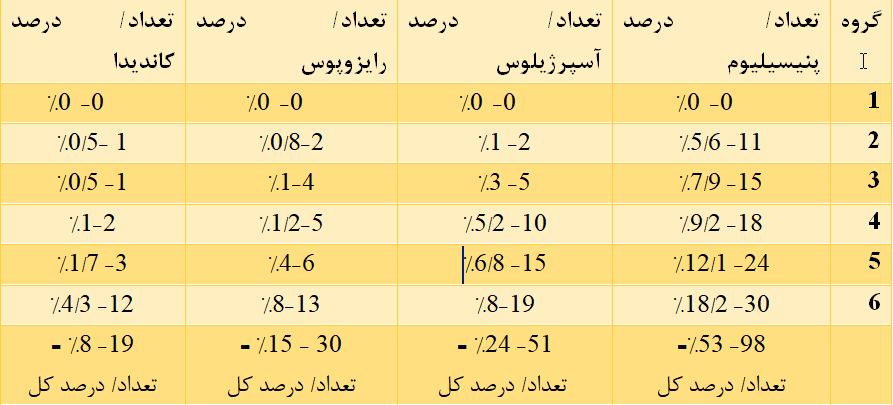
مشاهدات نشان میدهند که در گروه کنترل (گروهی که در آن باز نشده بود) هیچ قارچی رشد نکرده. در باقی گروهها (یعنی گروههای 2، 3، 4، 5 و 6)، کلنیهای پنیسیلیوم (سبز رنگ) و آسپرژیلوس نایجر (سیاه رنگ) بهوضوح قابل مشاهدهاند. همانطور که در شکل مشخص است، تعداد و تراکم کلنی قارچها در گروهی که مدت زمان بیشتری در معرض هوای محیط آزمایشگاه قرار داشتند (گروه 4) نسبت به گروه کنترل و گروه 3 و 2 مشاهده میشود، همچنین کلنیهای سفید رنگ کاندیدی نیز در گروه 5 مشاهده میشود. در جدول 1 تعداد و درصد کلنیها در هر گروه نشان داده است.
جدول 1. درصد توزیع قارچها با توجه به تعداد کلنی در هر پلیت
بحث
در مطالعه حاضر، در مجموع 4 جنس قارچ و 198 کلنی بهدست آمد. پنیسیلیوم با تعداد 98 کلنی (حدوداً 53%)، آسپرژیلوس نایجر با 51 کلنی (حدوداً 24%) و رایزوپوس و کاندیدیا به ترتیب شایعترین قارچهای جداشده بودند و تراکم قارچها در محیطهای کشت هرچه طولانیتر در معرض هوا قرار داشتند، بیشتر شد. نتایج مطالعه حاضر تفاوتها و شباهتهایی را با مطالعات انجامشده قبلی نشان میدهد. در مطالعهای که در سال 1387 در دانشگاه علوم پزشکی مازندران صورت گرفت، مشخص گردید که بیشترین قارچهای محیطی پنیسیلومها هستند که میتوانند با توجه به رطوبت محیط (استان مازندران) در مکانهایی همچون کتابخانهها نیز رشد کنند (24). از آنجایی که قارچها به دلیل اندازه بزرگ خود (50 الی 100 برابر باکتریها) منجر به فعال شدن پاسخهای ایمنی و در نتیجه تولید محصولات جانبی مانند توکسینها و متعاقب آن ایجاد عفونت در بدن میگردند (25،26)، اما به دلیل فعالیت اجزای کمپلمان (C3 و C4) سیستم ایمنی در مواجهه با عوامل پاتوژن قارچی همچون کاندیداها غالباً این آئروسلها در بدو ورود به بدن مهار میشوند (27)، بنابراین علت اینکه هیچکدام از دانشجویان مبتلا به عفونت جدی قارچی نبودند عملکرد سیستم ایمنی آنها است، همچنین در این مطالعه پس از شستشوی محیط با آب ژاول رقیقشده مجدداً از محیط نمونهبرداری گردید، اما تک کلنیهای بسیار کمتری نیز روی محیط رشد نمود. ماده اصلي و مؤثر در آب ژاول، هيپوکلريت سديم (NaOCl) است که از آن، بهعنوان سفیدکننده استفاده ميشود. هیپوکلریت سدیم یک ترکیب شیمیایی شامل یک کاتیون سدیم +NA و یک آنیون هایپوکلریت OCl است که بهعنوان نمک سدیم اسید هایپوکلروس نیز مشاهده میشود. سدیم هایپوکلریت که اغلب بهصورت محلول است، جهت ضدعفونی نمودن محیط بهکار میرود. فعالیت ضد میکروبی کلرین بر اساس میزان کلرین آزاد آن یعنی بخش غیرفعال گونههای کلرین جهت اکسیداسیون است. تمام گونههای کلرین دارای فعالیت ضدباکتریایی و ضدقارچی قوی هستند، اما شواهد نشان دادهاند که HOCL و Cl2 توانایی بیشتری نسبت به هیپوکلریت آنیونی ناشی از نفوذ به غشای میکروبها دارند. مکانیسمی که طی آن کلرین سبب مرگ میکروبها میشود به دلیل اختلال در متابولیسم گلوکز و توقف رونویسی DNA نسبت به فعالیت پروتئین (بهعنوان مثال Crosslinking به دلیل اکسیداسیون سولفیدریل) و غشای لیپیدی از طریق جایگزین نمودن کلرین به اسید چرب غیراشباع غشا فسفولیپدی است؛ بنابراین میزان رقت این ماده جهت کاربرد ضدعفونی میتواند یکی از عوامل بازدارنده رشد میکروبها مانند قارچها باشد (28) که در این مطالعه به دلیل رقیق نمودن زیاد آن سبب رشد باقیمانده قارچها گردید. مورد دیگری که در اینجا میتوان به آن پرداخت، علت تراکم بالای قارچها در پلیتها است. همانطور که در شکل 1 مشخص است تمامی پلیتها دارای تراکم بسیاری هستند و دلیل آن را وجود رطوبت بالا در روز نمونهگیری میتوان عنوان نمود. تحقیقات نشان داده در محیطهای با رطوبت بالا مانند استخرها با وجود استفاده از مواد ضد میکروبی همچون کلر همچنان میزان بالایی از قارچها به دلیل شرایط مساعد امکان رشد دارند (29). مطالعه موسوی و همکارانش در سال 84 نیز نشان داد که شایعترین گونههای قارچی در استخرهای آب گرم گونههای آسپرژیلوس و پنیسیلیوم هستند (30). Hoshyar و همکارانش نیز دریافتند که پنیسیلیومها فراوانترین قارچهای محیطی هستند که امکان آسیب و تخریب بیولوژیک دارند و به لزوم آموزش پرسنل شاغل در محیطهایی که امکان رشد این آلودگیها در آن بالاست را امری ضروری دانستند (6). بررسیهای دیگر افراد مانند Marc Sautour و همکارانش در سال 2009 که آلایندههای قارچی هوا و سطوح را در آزمایشگاه قارچشناسی بیمارستان Dijon شمال کشور فرانسه به مدت یک سال مورد مطالعه و پژوهش قرار داده بودند نیز نشان داد که استفاده از دستگاههای تصفیه هوا در آزمایشگاهها میتواند میزان آلودگیهای قارچی را بهطور قابلتوجهی کاهش دهد (31). همچنین Ogorek و همکارانش در سال 2011 با بررسی اتاق خوابگاههای دانشجویان دانشگاه Wroclaw نتایجی مشابه بررسی ما بهدست آوردند. آنها دریافتند که بیشترین قارچهای آلودهکننده محیط خوابگاه دانشجویان، آسپرژیلوس نایجر، کلادوسپوریوم و کاندیدا آلبیکنز بوده اما میزان آنها از مقدار استاندارد برای اتاقهای عمومی بالاتر نبود (32). با این وجود قارچهای فرصتطلب در محیطهای سربسته همچون استخرها، کتابخانهها و آزمایشگاهها جزء جداییناپذیر میکروبهای محیطی هستند که جهت کنترل و ممانعت از بیماریزایی آنها توصیه میشود که از میزان مواد استاندارد جهت برطرف نمودنشان استفاده گردد.
نتیجهگیری
مطالعههای ما نشان داد که وجود قارچهای فرصتطلب و پاتوژن در آزمایشگاه احتمالاً به میزان دترجنتها جهت شستشوی محیط بستگی دارد و لزوم توجه به روشهای شستشو میتواند راهکاری پیشگیرانه در جهت کاهش بروز این آلودگیها و برطرف نمودن انتقال آنها باشد. در انتها پیشنهاد میگردد بهمنظور مطالعات دقیقتر جهت شناسایی قارچها از محیطهای دیگر، روزهای متفاوت و روشهای بیوشیمیایی و مولکولی جهت شناسایی گونهها استفاده گردد.
تشكر و قدرداني
اين پژوهش در قالب ارائه درس آزمایشگاه زیست عمومی 2 در آزمایشگاه جانورشناسی دانشگاه آزاد اسلامی واحد پرند انجام شده است. بدینوسیله از دانشجویان و تمام كساني كه به هر نحوي در انجام اين مقاله ما را ياري نمودند قدرداني ميشود.
منابع:
- Semel JD, Goldin H. Association of athlete’s foot with cellulitis of the lower extremities: Diagnostic value of bacterial cultures of ipsilateral interdigital space samples. Clin Infect Dis. 1996; 23:1162–4.
- Elewski BE. Tinea capitis: A current perspective. J Am Acad Dermatol. 2000;42:1–20.
- Jain A, Jain S, Rawat S. Emerging fungal infections among children: A review on its clinical manifestations, diagnosis, and prevention. J Pharm Bioallied Sci. 2010;2(4):314–320.
- Lamps LW, Lai KK, Milner DA Jr. Fungal infections of the gastrointestinal tract in the immunocompromised host: an update. Adv Anat Pathol. 2014; 21(4):217–227.
- Jain A, Jain S, Rawat S. Emerging fungal infections among children: A review on its clinical manifestations, diagnosis, and prevention. J Pharm Bioallied Sci. 2010; 2(4):314-20.
- Hoshyar F, Kabiri N, Taghipoor S, et al. Study of fungal infection frequency in libraries affiliated with Shahrekord University of Medical Sciences in J Shahrekord Univ Med Sci. 2014; 16(4):39-45 (Persian).
- Peppier, H. J.: “Yeast Properties Adversely Affecting Food Fermentations,” Food Technology, 1977; 31 (2) 62–65.
- Abd Elmegeed AS, Ouf SA, Moussa TA, et al. Dermatophytes and other associated fungi in patients attending to some hospitals in Egypt. Braz J Microbiol. 2015; 46(3):799–805.
- Ghasemi Z, Hashemi S J, Rezaei S, et al. Molecular Analysis of Candida species with Emphasis on Predisposing Factors in Cutaneous Candidiasis Patients, Jundishapur J Microbiol. 2017; 10(2):e41030.
- Regúlez P, García Fernández JF, Moragues MD, et al. Detection of anti-Candida albicans IgE antibodies in vaginal washes from patients with acute vulvovaginal candidiasis. Gynecol Obstet Invest. 1994; 37:110–4.
- Woolley PD, Higgins SP. Comparison of clotrimazole, fluconazole and itraconazole in vaginal candidiasis. Br J Clin Pract. 1995;49: 65–6.
- Vazquez JA. Options for the management of mucosal candidiasis in patients with AIDS and HIV infection. Pharmacotherapy. 1999; 19:76–87.
- Powderly WG, Mayer KH, Perfect JR. Diagnosis and treatment of oropharyngeal Candidiasis in patients infected with HIV: A critical reassessment. AIDS Res Hum Retroviruses. 1999; 15: 1405–12.
- Hoepelman IM, Dupont B. Oral candidiasis: The clinical challenge of resistance and management. Int J Antimicrob Agents. 1996; 6:155–9.
- Diz Dios P, Ocampo A, Miralles C, et al. Frequency of oropharyngeal candidiasis in IV-infected patients on protease inhibitor therapy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999; 87:437–41.
- Rios-Fabra A, Moreno AR, Istúriz RE. Fungal infection in Latin American countries. Infect Dis Clin North Am. 1994; 8(1):129-54.
- Epstein JB. Antifungal therapy in oropharyngeal mycotic infections. Oral Surg Oral Med Oral Pathol. 1990; 69(1):32-41.
- Akansha Jain, Shubham Jain, Swati Rawat. Merging fungal infections among children: A review on its clinical manifestations, diagnosis, and prevention. J Pharm Bioallied Sci. 2010 Oct-Dec; 2(4): 314–320.
- Baron EJ, Miller JM. Bacterial and fungal infections among diagnostic laboratory workers: evaluating the risks. Diagn Microbiol Infect Dis. 2008; 60(3):241-6.
- Schleibinger H, Laussmann D, Bornehag CG, et al. Microbial volatile organiccompounds in the air of moldy and mold-free indoor Indoor Air. 2008; 18(2): 113-24.
- Simon-Nobbe B, Denk U, Poll V, et al. The spectrum of fungal allergy. Int Arch Allergy Immunol. 2008; 145(1): 58-86.
- Zyska B. Fungi isolated from library materials: a review of the literature. Int Biodeterior Biodegrad. 1997; 40(1): 43-51.
- Terr AI. Stachybotrys: relevance to human disease. Ann Allergy Asthma Immunol. 2001; 87(6 Suppl 3):57-63.
- Hedayati M, Shokohi T, Mayahi S, et al. A survey on myco-flora of air, book and cabinet of Mazandaran University of Medical Sciences Libraries. J Mazandaran Univ Med Sci. 2008; 18 (67): 107-110.
- Bronson DM, Desai DR, Barsky S, et al. An epidemic of infection with Trichophyton tonsurans revealed in a 20-year survey of fungal infections in Chicago. J Am Acad Dermatol. 1983; 8(3):322-30.
- Hay RJ, Clayton YM, De Silva N, et al. Tinea capitis in south-east London–a new pattern of infection with public health implications. Br J Dermatol. 1996; 135(6):955-8.
- Moghim H, Ghavami nejad A. Detection of CH50 and role of C3, C4 complement in patients with Candidiasis. J Shahrekord Univ Med Sci. 2000; 2 (1): 61-65.
- Mangum LC, Garcia GR, Niece KL, et al. A Rapid, High-Throughput Iodometric Titration Method for the Determination of Active Chlorine Content of Topical Antiseptic Solutions. J Antimicrob Agents. 2017; 3: 152.
- Nanbakhsh H, Diba K, Hazrati Tapeh K. Evaluation of some physico-chemical parameters and fungal contamination of indoor public swimming pools in Urmia in 2001. SJKU. 2005; 10 (2) :26-35.
- Seyedmousavi SM, Fataei E, Hashemi SJ, et al. Survey of mycological flora in tourist hot pools Sarein. Journal of Ardabil University of Medical Sciences. 2005; 146-154.
- Sautour M, Dalle F, Olivieri C, L’ollivier C, et al. A prospective survey of air and surface fungal contamination in a medical mycology laboratory at a tertiary care university hospital. Am J Infect Control. 2009; 37(3): 189-94.
- Ogórek R, Plaskowska E, et al.The analysis of mycological air pollution in selected rooms of student hostels. Mikologia Lekarska. 2011, 18 (4): 201-210.
Investigation of Fungi aerosols Pollutant in the environment of Zoology Lab at University of Parand
Sahar Farzaneh1*, Elaheh Sardari2, Fereshteh Ghasemi simkani3
Department of Biology, University of Parand, Parand, Iran
Background and Objective: Educational center’s laboratories can be important places for the spread of microbes, especially bacteria and fungi, due to high commuting. Therefore, the present study has been conducted to investigate and reduce the Fungi contamination by diagnostic the environmental pollution in the Zoology Laboratory at Azad University of Parand.
Materials and Methods: In this study, after made the culture medium for growth of fungi, we have been making 6 separate groups. Includes: 1- Control group; 2- The group exposed to the laboratory air for 10 minutes; 3- The group exposed to the laboratory air for 20 minutes; 4- The group exposed to the laboratory atmosphere for 30 minutes. 5- The group which taken sample by swabs from the surfaces, and the group which was collect from the hands of the students. Also, after washing the laboratory with Bleach, the samples were collect again for investigate the fungi pollution and plate were store at 28 ° C incubator.
Results: All 30 cultirated samples were positive for fungal growth. The most common isolated fungal species was Penicillium and Aspergillus, the Rhizospus and Candida species also were isolated from laboratory environment. In Addition, after washing the laboratory with the common detergents such as Javel water, the amount of contamination decreased significantly.
Conclusion: According to our findings, considering the presence of saprophytic and dermatophytic fungal contaminations of the laboratory, the use of preventive and sanitary processes in these environments, including principle washing and elimination of fungal colonies in this environment can be useful in reducing infections and transmitting diseases.
Keywords: Fung, Pollution, Laboratory, University
Corresponded Author: Sahar Farzaneh, PHD Candidate at University of Parand, Parand, Iran
Email: Sahar.Farzaneh@gmail.com
Tell: +989126802949
اهمیت ارزیابی D-β-Glucan-3-1 در تشخیص عفونتهای مهاجم قارچی
پاسخ سیستم ایمنی در برابر قارچها (1)
عفونتهای قارچی منتشره از راه خون (1)
پاسخ سیستم ایمنی در برابر قارچها (3)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام