نکات مهم کاربردی در میکروبشناسی بالینی
قسمت هفتم
دکتر مریم متوسل دکتری تخصصی باکتریشناسی
استادیار دانشکده پیراپزشکی، دانشگاه علوم پزشکی شیراز
دستگاه تناسلی (Genital tract)
منشأ عفونت دستگاه تناسلی به دو نوع داخلی (Endogenous) و خارجی (Exogenous) طبقهبندی میشود. ارگانیسمهای عامل عفونت در دسته اول عمدتاً از نوع فلور نرمال دستگاه تناسلی و در نوع دوم از عوامل بیماریزای جنسی هستند.
موضوع مهم در نمونهبرداری صحیح از دستگاه تناسلی، استفاده از سوآب (Swab) استریل از جنس داکرون و عدم استعمال داروی موضعی یا مصرف خوراکی آنتیبیوتیک، چند روز قبل از نمونهگیری است. نمونه در خانمها مستقیماً از گردن رحم تهیه میشود، اما در آقایان از مجرای ادرار به این نحو گرفته میشود که چرک خارج شده را با گاز استریل پاک نموده، سپس از چرک تازه خارج شده، نمونه تهیه میشود. در صورتی که ترشحات، مشهود نباشد، سوآب را به اندازه 3-2 سانتیمتر در مجرا فرو برده، بعد از مکث چند ثانیهای و چرخاندن، نمونهگیری انجام میشود.
به طور کلی اگر ضایعه زخمی در آلت تناسلی ظاهر شده باشد، از اگزودا و بستر زخم جهت کشت، تهیه اسمیر و رنگآمیزی استفاده میگردد. محیط کشتهای مورد لزوم شامل بلاد آگار، شکلات آگار و در مورد سوزاک، تایرمارتین (Thayer- Martine) هستند. ابتدا سوآب آغشته به نمونه بر روی محیط کشتهای مناسب، کشت داده میشود و در صورتی که امکان کشت سریع وجود نداشته باشد، درون محیطهای کشت انتقالی (Transport)، به آزمایشگاه منتقل میگردد. مناسبترین محیطهای انتقالی در این موارد، محیط استوارت است. پس از کشت، باقیمانده نمونه را بر روی لام تمیز کشیده، رنگآمیزی (Gram stain) مینمایند.
حداقل سه سوآب جهت نمونهگیری لازم است؛ یکی برای کشت و رنگآمیزی گرم، دیگری جهت تشخیص کاندیدا و تریکوموناس و سومی جهت تهیه اسمیر و تشخیص گاردنرلا واژینالیس (Gardenerella vaginalis) مورد استفاده قرار میگیرند.
گاردنرلا واژینالیس (Gardenerella vaginalis)
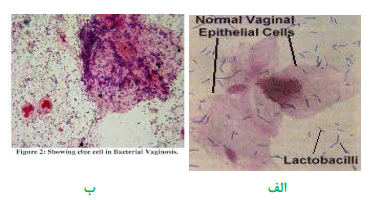
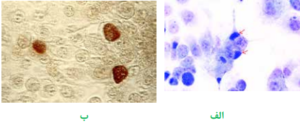
گاردنرلا واژینالیس عامل ایجاد واژینیت غیر اختصاصی در بانوان خصوصاً خانمهای باردار است و سبب بروز ترشحات خاکستری چسبناک و کشدار میگردد. نحوه تهیه اسمیر به این ترتیب است که ابتدا یک لام تمیز انتخاب مینمایند؛ سپس سوآب آغشته به ترشحات واژن را از یک سمت لام به سمت دیگر میغلتانند. به منظور گسترش سلولهای اپیتلیال و جلوگیری از مچاله شدن سلولها، حرکت سوآب در یک جهت انجام میگیرد و مجاز به حرکت رفت و برگشت نیستند. گاردنرلا واژینالیس معمولاً روی محیطهای کشت روتین رشد نمینماید، به همین جهت سوآب آغشته به نمونه را در محلول پتاس 10% قرار میدهند که در صورت وجود گاردنرلا واژینالیس بوی ماهی گندیده به مشام میرسد. همچنین اسمیر تهیهشده را با روش گرم، رنگآمیزی نموده، به کمک لنز روغنی (عدسی 100) مطالعه مینمایند. واژینوز گاردنرلایی با مشاهده سلولهای اپیتلیال که فاقد حاشیه و مرز مشخص هستند و منظره برجسته و پوشیده از باسیل و کوکوباسیلهای گرم مثبت دارند، مشخص میشود. این سلولها بنام سلولهای کلو (Clue cells) خوانده میشوند.
تصویر 1– الف: سلولهای طبیعی اپیتلیال واژن،
ب: سلولهای آلوده واژن به گاردنرلا واژینالیس روی کلو سل
تریکوموناس واژینالیس و کاندیدا آلبیکنس
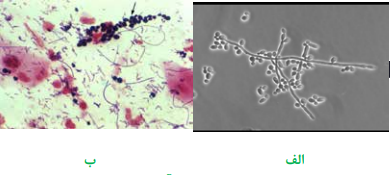
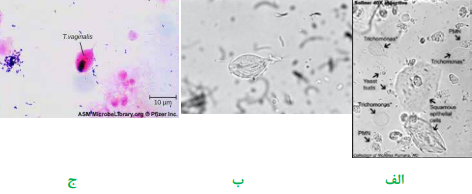
جهت بررسی تریکوموناس واژینالیس (Trichomonas vaginalis) و کاندیدا آلبیکنس، یک سوآب آغشته به نمونه را در لوله حاوی سرم فیزیولوژی استریل قرار داده، در دمای 37 درجه سانتیگراد به مدت نیم ساعت انکوبه نموده، سپس یک قطره آن را بین لام و لامل قرار داده، با لنز 40 (HPF) میکروسکوپ، مطالعه مینمایند. تریکوموناس واژینالیس، تکیاخته تاژکدار گلابی شکل و واجد 5-4 تاژک است که متحرک است و در تمام جهات حرکت مینماید. در صورت انجام رنگآمیزی، چنانکه در شکل مشاهده میشود، یک غشاء مواج در پیکره ارگانیسم وجود دارد که در تشخیص نهایی بسیار کمککننده است. کاندیدا آلبیکنس نیز بهصورت اجسام تخممرغی شکل گرم مثبت، واجد جوانه و میسلیوم کوتاه مشاهده میگردد.
تصویر 2– کاندیدا آلبیکنس،
الف: در حال جوانه زدن (Budding) به همراه میسلیوم در نمونه مرطوب (عدسی 40)،
ب: اشکال گرم مثبت – نمونه رنگآمیزی شده با عدسی 100
تصویر 3– الف: تریکوموناس واژینالیس در نمونه ترشحات واژن،
ب: تریکوموناس واژینالیس در ادرار، ج: تریکوموناس واژینالیس در رنگآمیزی گرم
نایسریا گونورهآ (Neisseria gonorrehoa)
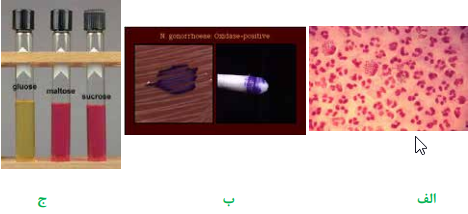
سوزاک یک بیماری مقاربتی است که عامل مولد آن نایسریا گونورهآ یا گنوکوک (Gonococcus) است. گنوکوک دیپلوکوک گرم منفی، لوبیایی شکل و هوازی است که در رنگآمیزی گرم بهصورت داخل و خارج سلولهای PMN مشاهده میگردد. انگل اجباری انسان است و تنها مخزن آن انسان آلوده است. پس از نمونهگیری از بیمار، مستقیماً بر روی محیط تایر مارتین کشت داده میشود و در اتمسفر کمتر از 3% دیاکسید کربن (Co2 jar یا Candle jar) و دمای 37 درجه سانتیگراد گرماگذاری میشود. تایرمارتین نوعی شکلات آگار تغییریافته است که توسط آنتیبیوتیکهایی موسوم به VCN، انتخابی میشود. VCN مخفف اسامی سه آنتیبیوتیک وانکومایسین (Vancomycin)، کلیستین (Colistin) و نیستاتین (Nystatin) است و در محیط کشت به منظور جلوگیری از رشد باکتریهای گرم مثبت، باکتریهای گرم منفی و قارچ استفاده میگردند. به منظور جلوگیری از رشد پروتئوس، تریمتوپریم نیز علاوه بر VCN به محیط کشت اضافه میگردد. محیط کشت اخیر به نام محیط تایر مارتین تغییریافته (Modified Thayer – martin) شناخته میشود. کلنی 48 ساعته گنوکوک، شفاف و به اندازه 2-1 میلیمتر است. اکسیداز مثبت است. قند گلوکز را تخمیر مینماید و قادر به تخمیر مالتوز، لاکتوز و سوکروز نیستند.
تصویر 4– الف: تستهای تشخیص نایسریا گونورهآ– اسمیر مستقیم از ترشحات چرکی دستگاه تناسلی، دیپلوکوکهای لوبیایی شکل خارج و داخل سلولهای پلیمورفو نوکلئر،
ب: اکسیداز مثبت، ج: تست تخمیر قندها- گلوکز مثبت، مالتوز و سوکروز منفی
عوامل باکتریایی مسبب اورتریتهای غیر گونوکوکی
شایعترین عوامل اورتریت غیر گونوکوکی شامل هموفیلوس دوکرهای (Heamophilus ducreyi)، کلامیدیا (Chlamidia)، مایکوپلاسما (Mycoplasma) و اورهآپلاسما اورهآلیتیکوم (Ureaplasma urealyticum) است.
هموفیلوس دوکرهای (Heamophtlus ducreyi)
یک نوع بیماری مقاربتی بنام شانکروئید (Chancroid) یا شانکر نرم وجود دارد که توسط باسیل کوتاه گرم منفی موسوم به هموفیلوس دوکرهای ایجاد میگردد. این باکتری انگل اجباری انسان است و از طریق تماس مستقیم انتقال مییابد. چند روز پس از ورود میکروب به بدن، ضایعات تاولی که روی دستگاه تناسلی خارجی ایجاد شده، تبدیل به زخم مرطوب با حاشیه نامنظم میگردد که قاعده زخم بر خلاف شانکر سیفلیسی، سفت نیست. همچنین ممکن است غدد لنفاوی کشاله ران به چرک بنشیند (Bubonic lymphadenitis) که به خیارک معروف است و نمونه چرک خارج شده از آن جهت کشت و رنگآمیزی مناسب است.
از آنجا که ممکن است زخم شانکروئید دچار آلودگی ثانویه با سایر میکروبها گردد، توصیه میشود سطح زخم را قبل از نمونهگیری، با سرم فیزیولوژی استریل شستشو داده، سپس از بستر زخم، نمونه گرفته شود. در رنگآمیزی گرم، باسیل گرم منفی دوتایی و زنجیره کوتاه مشاهده میشود. اگر نمونه با متیلن بلو رنگآمیزی گردد، دو طرف باکتری رنگپذیری بیشتری دارد و گفته میشود رنگپذیری دوقطبی (Bipolar) دارد. هموفیلوس دوکرهای، هوازی و بیهوازی اختیاری است و در محیطهای معمولی رشد نمینماید، به همین جهت برای بدست آوردن کلنیهای اولیه، بهتر است نمونه روی یک محیط بلاد آگار گوسفندی شامل فاکتور X کشت داده شود و در دمای 35 درجه و در حضور 10-5% گاز کربنیک، انکوبه گردد.
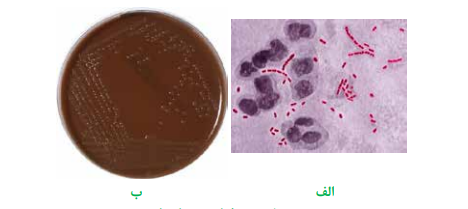
تصویر 5 – هموفیلوس دوکرهای
الف: اسمیر مستقیم با رنگآمیزی گرم، ب: کلنیهای رشد کرده بر محیط شکلات آگار همراه با ایزوویتالکس
کلامیدیا (Chlamidia)
کلامیدیا در خارج از سلول زنده قادر به رشد و تکثیر نیست و تکثیر اجباری داخل سلولی با سیکل تکاملی پیچیده دارد که منجر به تولید جسم ابتدائی (Elementary body) و جسم رتیکوله (Inclusion body) میگردد. جسم ابتدائی، شکل خارج سلولی و آلودهکننده باکتری است. جسم رتیکوله، شکل داخل سلولی و تکثیرشونده باکتری است که قادر به رشد و تکثیر در کیسه زرده جنین جوجه و سیتوپلاسم سلولهای هلا (Hela) و مککوی (McCoy)، در مدت 7-4 روز است، همچنین در هیچ محیط کشت ساختگی (Synthetic media) رشد نمیکند. از لحاظ دیواره سلولی شبیه باکتریهای گرم منفی است اما با رنگآمیزی گرم، رنگ نمیپذیرد. جسم رتیکوله در سیتوپلاسم سلول آلوده، به نام اجسام انکلوزیونی (Inclusion bodies) نامیده میشود که با رنگآمیزی گیمسا (Giemsa stain) و ماکیاولو (Macchiavello stain) قابل رؤیت میگردد. جسم رتیکوله بالغ میتواند حاوی 500-100 جسم ابتدائی باشد.
کلامیدیا تراکوماتیس (Chlamidia trachomatis) انگل اجباری انسان است و مستقیماً از فرد آلوده به فرد سالم منتقل میگردد. این باکتری علاوه بر تراخم، قادراست بیماری مقاربتی لنفوگرانولوم آمیزشی (Lymphogranuloma venereum) یا LGV را نیز ایجاد نماید. در بیماریLGV، نمونهبرداری از غدد لنفاوی متورم و چرکی ناحیه کشاله ران صورت میگیرد.
تصویر 6 – کلامیدیا
الف: انکلوژن بادی (فلش) رشد کرده بر محیط مککوی با رنگآمیزی گیمسا،
ب: انکلوژن بادی با رنگآمیزی ماکیاولو
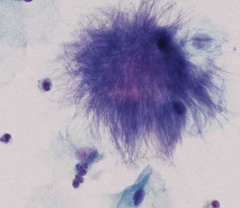
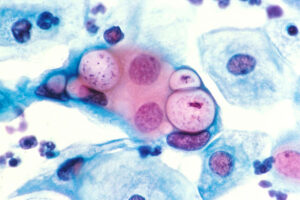
تصویر7 – شکل موی پریشان
وجود اکتینومایست که بهصورت کلاف پنبهای در پاپ اسمیر قابل مشاهده بوده و از علائم عفونت در خانمهای دارای IUD است
تصویر 8– انکلوزیونهای تارگت شکل در پاپ اسمیر خانمهایی که عفونت گردن رحم با کلامیدیا دارند
وجود آنتیبادی 4-2 هفته پس از شروع بیماری، مثبت میشود که با عیار بیش از 1/64 در یک نمونه سرم یا ازدیاد عیار آنتیبادی در دو نمونه سرم به فاصله 7 روز قابل پیگیری است.
تکنیک ایمنوفلورسنس مستقـــــــــــیم (Direct Immunofluorescence) نیز در تشخیص عفونت کلامیدیایی کمککننده است. بیشترین کاربرد تستهای سرولوژیک، مطالعات اپیدمیولوژی (Sero-epidepidemiologic studies) است.
امروزه روشهای مولکولی شناسایی عفونت لنفوگرانولومای آمیزشی، اهمیت تشخیصی پیدا کردهاند؛ به عنوان مثال میتوان به تعیین توالی ژن omp1 و استفاده از تکنیک RT-PCR (Real Time Polymerase Chain Reaction) اشاره نمود.
مایکوپلاسما (Mycoplasma)
میکوپلاسماها کوچکترین میکروارگانیسمی هستند که قادرند در محیطهای کشت مصنوعی و بدون سلول رشد و تکثیر نمایند. فاقد دیواره سلولی هستند و با یک غشاء سه لایهای حاوی استرول احاطه شدهاند، لذا به تغییرات محیط بسیار حساسند و چون دیواره سلولی ندارند به اشکال مختلف درمیآیند. این باکتریها در واقع شکل L باکتریها نیستند و از سایر باکتریها بوجود نیامدهاند؛ همچنین بر خلاف اشکال اسفروپلاست و پروتوپلاست، در شرایط مساعد به فرم واجد دیواره سلولی تبدیل نمیشوند. در واقع این موضوع یکی از مطمئنترین وجوه تشخیصی، میان مایکوپلاسماها و باکتریهای L فرم است.
نمونه بیمار مشکوک به مایکوپلاسما را بر روی محیط کشت جامد حاوی سرم و مایع آسیت انتقال داده، سپس با میله شیشهای استریل (Sterile glass rod) پخش و در شرایط هوازی و دمای 37-35 درجه سانتیگراد به مدت 7 تا 8 روز گرماگذاری مینمایند. پس از این زمان، کلنی کوچک شبیه تخممرغ نیمرویی رشد میکند که در آگار فرو رفته است. برای کشت مجدد (Subculture) باکتری، ورقه نازک آگار حاوی کلنی را به کمک اسکالپل استریل برش داده، بر محیط جدید میمالند و گرماگذاری مینمایند. جهت جلوگیری از ترک خوردن محیط کشت، پلیت را با سلوفان نفوذپذیر به هوا میبندند.
مایکوپلاسما در محیط کشت مایع عصاره قلب و مغز (Brain Heart Infusion Broth) حاوی 30% آسیت و سرم اسب یا خرگوش نیز رشد میکند و کمی آن را کدر مینماید. اگر لوله حاوی محیط کشت مایع آلوده به مایکوپلاسما را سانتریفیوژ نموده و رسوب آن را با گیمسا رنگآمیزی کنند، اشکال چندشکلی (Pleomorphic) کوکوئید، باسیل، حلقه، رشته مارپیچ و رشته با انتهای برآمده مشاهده میشود.
در صورتی که بخواهند کلنی تخممرغ نیمرویی باکتری را از روی محیط جامد، رنگآمیزی نمایند، یک ورقه نازک چهارگوش از محیط آگار حاوی کلنی را برش داده، بین لام و لامل قرار میدهند. سپس یک قطره رنگ گیمسا یا داین (Diene’s stain) را در میان لام و لامل میچکانند. رنگآمیزی داین، اختصاصی کلامیدیاست و رنگ اصلی آن متیلن بلو است.
مایکوپلاسما بسیار حساس به شرایط محیطی است، لذا کشت سریع نمونه مشکوک به مایکوپلاسما بسیار حائز اهمیت است. در غیر این صورت نمونه را در یخچال 4 درجه به مدت 24 ساعت و یا در فریزر 70- درجه قرار میدهند. هنگام کشت لازم است نمونه فریزشده را در حمام آب (Water bath) 37 درجه ذوب نموده، سپس کشت دهند.
در شرایط دور بودن محل نمونهگیری از آزمایشگاه، میتوان نمونه را در محیط کشت انتقالی وارد کرده، به آزمایشگاه منتقل نمود. محیط انتقالی مناسب، محیط تریپتیکیز سوی براث (Tripticase soybroth) و سرم آلبومین گاوی به میزان 5/0 درصد است. به دلیل آلودگی نمونه با فلور نرمال ناحیه تناسلی، محیطهای کشت را با عوامل ضد باکتری مانند پنیسیلین و ضد قارچ مانند پلیمیکسین B و آمفوترسین B انتخابی مینمایند.
مایکوپلاسما هومینیس (Mycoplasma hominis)، مایکوپلاسما جنیتالیوم (Mycoplasma genitalium) و اورهآپلاسما اورهآلیتیکوم (Ureaplasma urealyticum) از باکتریهای بدون دیواره و عوامل مسبب بیماریهای مقاربتی هستند. از میان باکتریهای فوقالذکر، فقط اورهآپلاسما اورهآلیتیکوم قادر به هیدرولیز اوره به آمونیاک است. برای تشخیص باکتری کافی است کلنیهای آن را در معرض معرف کلرید منگنز (MnCl2) و اوره (MnCl2- urea reagent) قرار داده، با میکروسکوپ تشریح (Dissecting microscope) مطالعه نمود. کلنیهای اورهآپلاسما اورهآلیتیکوم قهوهای تیره میشود و کلنی مایکوپلاسماها تغییر رنگ نمیدهند.
تصویر 9 – میکروسکوپ تشریح یا استریو میکروسکوپ
(Dissecting microscope یا Stereo microscope)
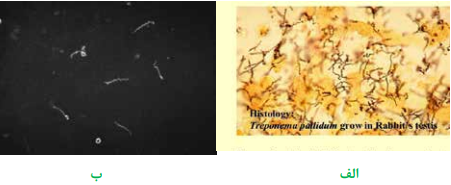
ترپونما پالیدوم (Treponema pallidum)
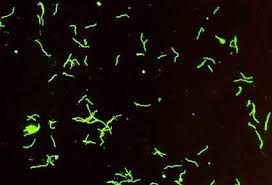
سیفلیس (Syphilis) یک نوع بیماری مقاربتی است که توسط ترپونما پالیدوم ایجاد میگردد. سیفلیس در صورت عدم درمان، یک بیماری مزمن و پیشرونده است و به سه دوره اول (Primary syphilis)، دوم (Secondary syphilis) و سوم (Tertiary syphilis or late- stage) تقسیم میگردد. دوره اول که معروف به دوره شانکر (chancre) است، پس از ورود باکتری و سپری شدن دوره کمون (10 روز تا 3 هفته)، آغاز میگردد. در محل ورود باکتری یک پاپول قرمز رنگ ایجاد میشود که بهتدریج به زخم با قاعده سفت بنام شانکر سخت (Hard chancre) تبدیل میگردد. زخم شانکر، به شکل گرد یا بیضی با حاشیه دردناک است و ترشحات حاشیه و بستر آن، حاوی مقدار زیادی اسپیروکت ترپونما است. بیماری در این دوره بشدت قابل سرایت است و 3 تا 6 هفته بعد در صورت عدم درمان، وارد مرحله دوم میگردد که نیمی از این بیماران واجد علامت میشوند و نیم دیگر وارد فاز مخفی (latent phase) میگردند. در مرحله دوم بیماری، ترپونما پالیدوم در جریان انتشار خونی قرار میگیرد و بیمار علائم پوستی مانند بثورات قرمز جلدی (Roseole)، پلاکهای مخاطی (Mucous patches) و تاول (Vesicle) را نشان میدهد. دوره دوم نیز مانند دوره اول بشدت قابل سرایت است و ضایعات، حاوی باکتری هستند. در صورتی که بیماری درمان نشود، چند سال بعد وارد مرحله سوم میگردد و ضایعات گرانولوماتوز موسوم به گوما (Gumma) در دستگاه قلبی عروقی، عصبی، استخوانی و مفصلی ایجاد میگردد. گوما ضایعهای تومورمانند و سفت است که بهتدریج تخلیه و نرم میشود و دارای تعداد کمی باکتری است. ترپونما پالیدوم در محیط کشتهای آزمایشگاهی رشد نمیکند و فقط قادر به رشد و تکثیر در بیضه خرگوش است. رنگ گرم نمیگیرد، اما با ترکیبات محتوی نیترات نقره موسوم به رنگآمیزی فونتانا (Funtana stain) بهصورت اسپیروکتهای قهوهای تیره رنگ در زمینه روشن مشاهده میشود. اگر نمونه تازه گرفتهشده با میکروسکوپ زمینه تاریک (Dark field microscopy) مطالعه شود، اسپیروکتهای متحرک با حرکتی مته مانند، قابل مشاهده هستند. پر واضح است در این شرایط فقط باکتریهای زنده و متحرک قابل تشخیص هستند و سایر اسپیروکتهای موجود ممکن است از نوع ساپروفیت باشند. مطالعه میکروسکوپی با رنگآمیزی فلورسنت آنتیبادی مستقیم یا DFA (Direct fluorescent antibody staining) کمک قابلتوجهی به شناسایی باکتری مینماید.
تصویر 10 – ترپونما پالیدوم، الف: با رنگآمیزی فونتانا، ب: با میکروسکوپ زمینه تاریک
مناسبترین تستهای آزمایشگاهی جهت شناسایی ترپونما پالیدوم، تستهای سرولوژی هستند که بر دو نوع. تستهای سرولوژی ترپونمی (Treponemal tests) و غیرترپونمی (nonTreponemal tests) طبقهبندی میگردند. تستهای ترپونمی شامل FTA-ABS (Fluorescent Treponemal Antibody – Absorption) ، MHA-TP (Microhemagglutination test for Treponema pallidum) و TP- EI (Treponema pallidum– Enzyme Immunoassay) و تستهای غیرترپونمی شامل VDRL (Veneral Disease Research Laboratory) و RPR (Rapid Plasma Reagin) هستند.
اساس تستهای VDRL و RPR، فلوکولاسیون است و طی آن آنتیژنهای غیراختصاصی ترپونمی مانند آنتیژن کاردیولیپین و لستین، جستجو میگردند. رآژین از IgM و IgG تشکیل شده است و علاوه بر بیماری سیفلیس در سایر بیماریها نیز ایجاد میشود. رآژین حدود 2 تا 3 هفته پس از ظهور شانکر بوجود میآید. مقداری از رآژین IgG از راه جفت به جنین میرسد. اگر نوزاد به سیفلیس مبتلا نشده باشد، این رآژین پس از 8 تا 12 هفته از بین میرود ولی اگر سیفلیس نوزادی رخ داده باشد، این آزمایش پس از سه ماهگی هم مثبت میشود و آزمایش FTA-ABS، تشخیص را قطعی مینماید. آزمایش FTA-ABS بسیار حساس و اختصاصی است آنتیبادیهای آن یک هفته پس از بروز شانکر بوجود آمده، تیتر آن بهخوبی بالا میرود. مثبت شدن FTA-ABS و IgM نشانه ابتلا به بیماری سیفلیس است.
تصویر 11– مطالعه میکروسکوپی ترپونما پالیدوم با تست FTA
آزمایش MHA-TP معروف به TPHA، بر اساس آگلوتیناسیون گلبولهای قرمز گوسفندی حاوی آنتیژن ترپونم در حضور آنتیبادیهای اختصاصی سرم بیمار است و در مطالعات اپیدمیولوژیک کاربرد فراوان دارد.
مراجع:
– Connie R. Mahon I Donald C. Lehman. 2019. DIAGNOSTIC MICROBIOLOGY. SiXTH EDITION.
– Chlamydia, From Wikipedia, the free encyclopedia.
– Jawetz, Melnick & Adelberg’s. 2010. MEDICAL MICROBIOLOGY. 25th Edition. McGraw- Hill Companies.
– M Alfa. The laboratory diagnosisof Haemophilus ducrei. 2005. Can J Infect Dis Med Microbiol.16(1): 31- 34.
– Tille, P. (2015). Bailey & Scott’s Diagnostic Microbiology-E-Book. Elsevier Health Sciences.
– Wayne, P. A. (2007). Clinical and laboratory standards institute. Performance standards for antimicrobial susceptibility testing.
– Wikler, M. A. (2017). Methods for Dilution Antimicrobial Susceptibility Test for Bacteria That Grow Aerobically. Approved Standard M7-A7, 26 (2).
– Winn, W. C. (2006). Koneman’s color atlas and textbook of diagnostic microbiology. Lippincott williams & wilkins.
– جداول میکروارگانیسمهای بیماریزای اولویتدار و آنتیبیوتیکهای تعیین شده برای آزمایش تعیین حساسیت ضد میکربی در برنامه مهار مقاومت میکروبشناسی. سال 1398. تهیه شده توسط کمیته تخصصی میکروبشناسی آزمایشگاه مرجع سلامت. وزارت بهداشت، درمان وآموزش پزشکی جمهوری اسلامی ایران. آزمایشگاه مرجع سلامت. ویرایش چهارم. بر اساس CLSI M 100 29th ed., 2019.
– میکربشناسی پزشکی. دکتر پرویز ادیبفر سال 1368.
https://medlabnews.ir/%da%a9%d9%84%d8%a7%d9%85%db%8c%d8%af%db%8c%d8%a7-%d8%aa%d8%b1%d8%a7%da%a9%d9%88%d9%85%d8%a7%d8%aa%db%8c%d8%b3/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام