پروتئینهای شوک حرارتی (Heat Shock Proteins) HSPs
مرجان مجابی – کارشناس ارشد میکروبیولوژی
تاریخچه:
پروتئینهای شوک حرارتی اولین بار توسط ران لاسکی (Ron Laskey) و همکارانش مطرح شد. آنها این واژه را برای یک نوع پروتئین که برای تجمع هیستونها و DNA لازم بود به کار بردند. پس از آن در سال 1962 Ritossa واکنش سلول نسبت به شوک حرارتی را در کروموزومهای غده بزاقی مگس سرکه مشاهده کرد که در دمای بالاتر از حد طبیعی، کروموزوم درازوفیلا پف میکند. وی سپس متوجه شد که این کروموزومهای پف کرده پروتئینهایی را کد میکنند که آنها را پروتئینهای شوک حرارتی یا HSPs مینامند.
HSPها از محافظت شدهترین خانوادههای پروتئینی در طی تکامل هستند و در اکثر بخشهای سلول نظیر هسته، سیتوپلاسم و میتوکندری وجود داشته و همه جا حضور دارند؛ در باکتری، گیاهان، جانوران و …
نقش HSPها:
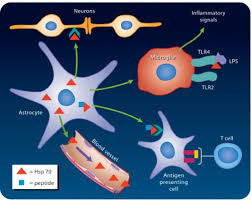
پروتئینهای شوک حرارتی به مجموع پروتئینهایی گفته میشود که در شرایط استرس در سلول بیان میگردند. نقش آنها جلوگیری از تغییر ساختار پروتئینها تحت عوامل استرسی میباشد و عملکرد آنها نقش مهمی در کنترل ساختار یا رشد سلولها دارد. عامل حرارت به طور مستقیم یا غیر مستقیم تغییراتی در پروتئینهای سلول القاء میکند که منجر به تجمع و نهایت تخریب عملکرد اجزای سلول میشود. یک عکسالعمل مشترک همه پروکاریوتها و یوکاریوتها، غلبه بر دمای القای این پروتئینها است که حتی در شرایط غیر تنش مثلاً رشد طبیعی سلول لازم میباشد. این پروتئینها به دستهای از پروتئینها به نام چاپرونها تعلق دارند.
- این چاپرونهای مولکولی از پروتئینهایی که توسط حرارت دناتوره شدند محافظت میکنند.
- به جایگاه هیدروفوب روی پلیپپتیدها متصل شده و سبب بروز تغییرات ساختاری میگردند.
- سبب جلوگیری از ایجاد پروتئینهایی با تاخوردگی یا فولدینگ اشتباه میشوند.
- كمك به انتقال مولكولها در عرض غشاء
گروههای HSP:
خانواده HSP 20، خانوادهHSP 25/27 ، خانوادهHSP 60 و خانوادهHSP 70-90-100
- اساس دسته بندی این گروهها بر مبناي وزن مولکولی است؛ به عنوان مثال در الکتروفورز پروتئینهای باکتری بروسلا آبورتوس شوک ندیده، باندها در محدوده 20/30KD تشکیل میشود ولی در وضعیت شوک دیده مقدار تولیدHSP افزایش چشمگیر داشته و باندهای پروتئینی در محدوده 60 KD تشکیل میشود.
- همچنین میتوان آنها را بر حسب محل داخل سلولی به زیرگروههای دیگری تقسیم کرد، مثلاً پروتئینهای مرتبط با گلوکز زیرگروهی هستند که مقیم شبکه اندوپلاسمیک میباشند.
- معمولترین پروتئینها HSP 70 –HSP 90 هستند و باقی پروتئینها شباهت نزدیکی به این دو دارند.
مکانیسم عمل:
ژنهای کد کننده توسط یک مهار کننده، خاموش هستند که با واسطه سیگنال ایجاد شده در اثر شوک از مهار کننده آزاد شده و آنزیم RNA پلیمراز رونویسی آنها را شروع میکند.
این پروتئینها در اثر شوک فوراً عمل کرده و HSP در حالت اتصال به ATP فرم باز به خود گرفته و به نواحی هیدروفوب پروتئین تا نخورده متصل شده و از اجتماع ناصحیح آنها جلوگیری میکند. هیدرولیز ATP متصل باعث میشود HSP به فرم بسته خود درآید و از پروتئین هدف جدا شود.
موجودات زنده در شوک حرارتی با سرعت بالا HSP را القاء میکنند. این پاسخ توسط فاکتوری به نام فاکتور شوک حرارتی HSF تنظیم میشود. HSF در پاسخ به سیگنال شوک حرارتی به DNA متصل میشود و از ژن هدف رونویسی میکند، در اصل یک تعامل فیزیکی بین این دو وجود دارد.
در سلول طبیعی بدون تنش HSF به صورت یک مونومرغیر فعال در سیتوپلاسم است.
موارد استفاده:
- به منظور تولید داروی ضد تومور از HSP 90 استفاده میشود.
- HSP 27 در انقباض ماهیچه صاف نقش داشته و به نگهداری کلسیم در عضلات کمک میکند. تحقیقات اخیر نشان میدهد با افزایش HSP در فیبرهای عضلانی بیماران مبتلا به دیستروفی دوشن میتوان آنها را تا حد زیادی درمان کرد.
- این پروتئینها در حفاظت از مخاط روده نقش دارند.
- تولید واکسن بر مبنای HSP بر علیه بیماریهای عفونی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام