پرسش و پاسخهای آزمایشگاهی و کاربردی در طب انتقال خون
قسمت دوم
دکتر حبیباله گلافشان1، پریسا تندل2
1: هیئت علمی دانشگاه علوم پزشکی شیراز
2: کارشناسی ارشد خونشناسی و بانک خون دانشکده پیراپزشکی
مقدمه
سمینارهای طب انتقال خون و هموویژولانس بهطور مکرر در بیمارستانهای استان برای پرسنل علوم آزمایشگاهی، پرستاران و پزشکان برگزار میگردد. توفیق الهی نصیب اینجانب در برگزاری سمینارها در طی سالیان متمادی گردید و موفق به جمعآوری پرسشهای کلیدی و کاربردی از طرف عزیزان علوم آزمایشگاهی گردیدم که در حد بضاعت علمی با توجه به رفرانسهای مرجع و معتبر که در بخش آخر خواهد آمد، پاسخ داده شده است. این پرسش و پاسخ در پنج قسمت تقدیم شما عزیزان میگردد؛ به این امید که گره مشکلات آزمایشگاهی در رابطه با تزریق خون و فراوردههای آن گشوده گردد.
پرسش 11) گروه خون مادر و نوزادی هر دو منفی است، آیا نیاز به آزمایش دیگر هست؟
پاسخ: در این حالت چنانچه گروه خون پدر ارهاش منفی باشد، نیاز به آزمایش دیگر نیست ولی چنانچه پدر از نظر ارهاش مثبت باشد، ممکن است که فرزند ارهاش مثبت را به ارث برده باشد ولی به علت تداخل ژنی با ژن آنتیژن C از مادر، دارای فتوتایپ Du باشد. از این رو بایستی آزمایش Du نوزاد را انجام داد که در صورت مثبت بودن بایستی به مادر آمپول روگام جهت جلوگیری از تحریک Rh تزریق گردد.
پرسش 12) شایعترین تناقضهای گروهبندی در سلتایپ و بکتایپ چیست؟ آیا میتوان خون O را در صورت تناقض گروهبندی به بیمار تزریق کرد؟
پاسخ: شایعترین علل تناقض در گروهبندی سیستم ABO موارد زیر است:
- گروه خون A2
- گروه خون A2B
- واکنشهای رولکس و آگلوتیناسیون سرد
- تزریق IVIg به بیمار
- تزریق فراوردههای ناسازگار مانند پلاکت با پلاسمای ناسازگار به بیمار
- کمخونی آتوایمیون
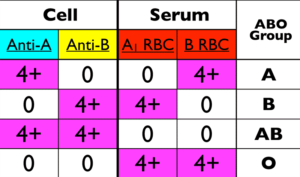
برای هر شخص یا بیمار بالای 6 ماه بایستی هم سلتایپ و هم بکتایپ انجام شود و جواب این دو باید یکدیگر را تأیید کنند؛ برای مثال بنا به قانون لاندشتاینر اگر فردی گروه خون O داشته باشد بایستی بهطور طبیعی در سرم دارای آنتی A و آنتی B باشد یا اگر گروه AB دارد فاقد آنتی A و آنتی B باشد. افراد با گروه A دارای آنتی B و افراد با گروه B دارای آنتی A هستند. عیار آنتیبادیهای گروه خونی از 4 تا 6 ماهگی بالا رفته و در سن 5 تا 10 سالگی به اوج میرسد. مصرف غذاهای پروبیوتیک موجب افزایش بسیار بالای عیار آنتیکرهای گروه خونی گشته، بهطوریکه تزریق گلبول قرمز فشرده با گروه O به گروههایA و B خطرناک میگردد. توجه داشته باشید که هر کیسه خون فشرده دارای 50-30 سیسی پلاسماست. گروه خون A دارای 2 تایپ اصلی A1 و A2 است. 80% افراد A دارای گروه A1 و حدود 19% دارای گروه A2 هستند. حدود 1 تا 8% افراد A2 دارای آنتی A1 هستند و از این رو گروه A2 این افراد در سلتایپ بهصورت A و در بکتایپ بهصورتO درمیآید. عصاره لکتین دولیشوس با گروه خون A2 واکنش نمیدهد درصورتی که با گروه A1 و A1B واکنش میدهد. حدود 22 تا 35% افراد A2B داری آنتی A1 هستند و از این رو گروه A2B در این دسته از افراد در سلتایپ بهصورتAB و در بکتایپ بهصورت گروه B درمیآید.
واکنش رولکس با تجمع غیر اختصاصی موجب اشتباه در گروهبندی میشود و با شستشوی خون با سالین و انجام مجدد گروهبندی از روی خون شستهشده، مشکل رفع میگردد. پدیــــــده رولکس در بیماران مالتیپل مایلوما، روماتیسمی و در حاملگی شایع است.
در هنگام حضور آنتیبادیهای سرد، خون را دو تا سه بار با سالین گرم 37 درجه شستشو داده و سپس گروهبندی انجام دهید. همیشه قبل از گروهبندی بر روی اسلاید دو تا سه قطره خون بیمار را ریخته و مطمئن باشید که گلبولها به هم نچسبیده و پخش هستند. به هم چسبیدن گلبولها در پدیده رولکس، آگلوتیناسیون سرد و آلوده شدن خون بند ناف با ژله وارتی رخ میدهد.
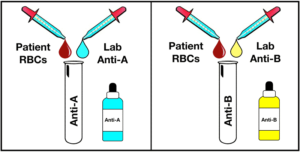
گروهبندی خون با استفاده از گلبولهای قرمز یا سلتایپ
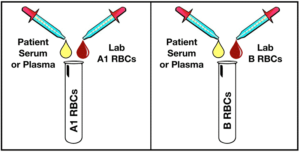
گروهبندی خون از روی سرم یا پلاسما یا بکتایپ
تفسیر گروهبندی با توجه به سلتایپ و بکتایپ
تناقضهای شایع در گروهبندی و راهحل آنها
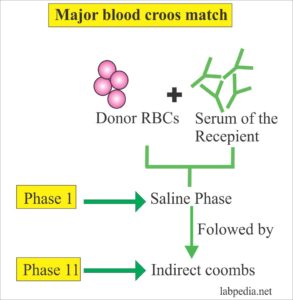
پرسش 13) کراس مچ شامل چه مراحلی است و هر مرحله گویای چیست؟ کدام فرآورده نیاز به کراس مچ دارد؟
پاسخ: در آزمایش کراس مچ، سرم بیمار با گلبولهای قرمز اهداکننده مجاور گشته و هدف آن اطمینان یافتن از نبود آنتیبادیهای آگلوتینهکننده و همولیزکننده و آغشتهکننده در سرم بیمار علیه گلبولهای قرمز اهداکننده است. برای دستیابی به اهداف فوق از فاز حرارتی RT (درجه حرارت اتاق) برای آنتیبادیهای آگلوتینهکننده و فاز 37 درجه و کومبز برای شناسایی آنتیبادیهای همولیز و آغشتهکننده استفاده میشود. هر فراوردهای که حاوی بیش از 2 سیسی گلبول قرمز اهداکننده باشد نیاز به کراس مچ با سرم بیمار دارد. فراوردههای گلبول قرمز و لکوسیتها نیاز به کراس مچ گلبولهای قرمز با سرم بیمار دارند.
واکنش آگلوتیناسیون در حرارت اتاق بیانگر اشتباه در گروهبندیABO و یا حضور آنتیبادیهای سرد علیه گلبولهای قرمز اهداکننده از گروه LIPMAN به مفهوم سیستمهای گروه خونی لوئیس، P، I، M و N است. با توجه به اینکه ناسازگاری ABO با واکنش حاد همولیتیک همراه است و بیشتر اشتباهات گروهبندی ABO در این فاز شناخته میشود، از این رو دارای اهمیت است. در این فاز مخلوط سرم بیمار و گلبول قرمز اهداکننده، فوری سانترفیوژ شده و برای آگلوتیناسیون بررسی میشود. گفتنی است که اشتباه در گروهبندی ارهاش در هیچ فازی از مراحل کراس مچ مشخص نمیشود، مگر اینکه به بیمار ارهاش منفی از قبل خون ارهاش مثبت تزریق شده باشد و شخص آنتی D ساخته باشد. چنانچه در بیماری با گروه A و یا AB ناسازگاری در حرارت اتاق مشاهده شود به گروههای A2 و A2B با آنتی A1 شک کنید و در این حالت کراس مچ بایستی با گروههای A2 و یا O برای بیمار A2 و برای بیمارA2B با خون A2B و یاO کراس مچ شود. مثبت بودن کراس مچ در فاز 37 درجه و یا فاز کومبز بیانگر حضور آنتیبادیهای گرم است. در این موارد چنانچه آزمایش کومبز مستقیم بیمار مثبت بود میتوان در حالت اورژانس، خون با کمترین درجه ناسازگاری برای بیمار ارسال نمود و چنانچه کومبز مستقیم منفی باشد بایستی با استفاده از پانل سلولی هویت آنتیبادی را شناسایی و خون آنتیژن منفی از نظر حضور آنتیبادی دریافت شود.
در آزمایش کراس مچ، سرم بیمار با گلبولهای قرمز اهداکننده مجاور گشته و هدف آن اطمینان یافتن از نبود آنتیبادیهای آگلوتینهکننده و همولیزکننده و آغشتهکننده در سرم بیمار علیه گلبولهای قرمز اهداکننده است
پرسش 14) برای بیماری خون اشعهدیده تقاضا شده، علت آن چیست؟ تا چه زمان خون اشعهدیده قابل مصرف است؟ آیا میتوان در صورت مصرف نشدن، آن را برای بیمار دیگر که نیازی به خون اشعهدیده ندارد مصرف کرد؟
پاسخ: لنفوسیتهای کیسه خون چنانچه به گردش خون یک شخص که از نظر ایمنی مشکلی ندارند وارد شوند بهعنوان غریبه شناخته شده و ظرف 48 ساعت نابود میگردند، ولی چنانچه بیمار مشکل سیستم ایمنی داشته باشد و نتواند لنفوسیتها را نابود کند، لنفوسیتها در بدن بیمار تکثیر شده و با حمله به ارگانهایی مانند کبد و پوست و گوارش و مغز استخوان منجر به مرگ بیمار میشوند. هپاتیت، درماتیت، گاستروانتریت و نارسایی مغز استخوان نتیجه حمله لنفوسیتها است که به آن سندرم گرافت گفته میشود. اشعه دادن کیسه خون یا پلاکت با 2500 راد اشعه گاما یا اشعه X این ضمانت را میدهد که لنفوسیت زنده در کیسه وجود ندارد و قابلیت تهاجم ندارند. بیماران با کاهش ایمنی سلولار، لنفوم هوچکین، بیمار مبتلا به کمخونی آپلاستیک که داروی ATG میگیرد، شیمی درمانی با آنالوگهای پورین و نوزادان کموزن از مهمترین گروهها برای دریافت خون اشعهدیده هستند. لنفوسیتها در مقابل اشعه بسیار حساس هستند ولی بقیه سلولهای خون دارای مقاومت نسبی هستند. کیسه خون را در هر زمان از نگهداری میتوان اشعه داد و چنانچه در روز اول نگهداری در نگهدارنده CPD-A1 اشعه داده شود، به مدت 28 روز بهجای 35 روز قابل نگهداری در یخچال 4 درجه است ولی چنانچه در روز 20 از نگهداری اشعه داده شود فقط تا 8 روز دیگر قابل استفاده است. با توجه به اینکه اشعه موجب نشت پتاسیم از گلبولهای قرمز به داخل کیسه میشود از این رو برای جلوگیری از هایپرکالمی، سفارش میشود که زودتر به بیمار تزریق گردد و چنانچه چند روز بگذرد ممکن است نیاز به شستن آن برای خارج کردن پتاسیم باشد. از خون اشعهدیده میتوان در صورت مصرف نشدن برای بیماران دیگری که نیاز به خون اشعهدیده نداشتهاند کراس مچ کرد. کیسه خون و پلاکت که برای اشعه دادن در نظر گرفته شده دارای نشانه قرمز رنگ بوده (Lable) که بعد از دریافت 2500 راد اشعه گاما به رنگ سیاه درمیآید. دریافت خون از برادر و خواهر و اقوام درجه اول حتی در صورت نبود مشکل ایمنی بایستی اشعه داده شود زیرا در این حالت تشابه HLA موجب بقای لنفوسیتها و تکثیر آنها در بدن بیمار شده که سندرم گرافت را به دنبال دارد.
پرسش 15) آمادهسازی خون به روش تایپ و اسکرین یعنی چه؟ در چه مواردی کاربرد دارد؟ ضریب اطمینان آن چقدر است؟
پاسخ: در روش تایپ و اسکرین، سرم بیمار با سلولهای معرف اسکرین که در 2 تا 3 ویال و از گروههای O است در فازهای حرارتی اتاق و 37 درجه و فاز کومبز مجاور میگردد. گلبول اسکرین حاوی مجموعه آنتیژنهای مهم بالینی هستند که در 2 تا 3 ویال جمع شدهاند.
آنتیژنهای خانواده RH (e ,c ,E ,C ,D)، کل (K ,k) ، لوتران (Lua ,Lub)، MNSs، کیـــــــــــــــد (JKa ,JKb)، دافی (Fya ,Fyb)، P1و لوئیس (Lea ,Leb) بر روی گلبولهای معرف اسکرین وجود دارند. چنانچه مجاورت سرم با گلبولهای اسکرین در فازهای مختلف حرارتی واکنش منفی بدهد، بدین مفهوم است که بیمار دارای آنتیبادیهای غیرمنتظره و حائز اهمیت بالینی نیست و با اطمینان بیشتر از 99% میتوان خون همگروه ABO و RH را برای بیمار ارسال کرد و از ذخیرهسازی خون جلوگیری نمود. روش تایپ و اسکرین برای بیماری که سابقه مکرر تزریق خون دارد و یا اینکه در سه ماه گذشته حامله بوده و یا در برههای از زمان در سرم دارای آنتیبادی غیرمنتظره بوده، استفاده نمیشود و به کراس مچ کامل نیاز دارد. البته همراه کردن کراس مچ با تست اسکرین آنتیبادی میتواند در تهیه خون راه گشا باشد؛ برای مثال اگر کراس مچ منفی و اسکرین آنتیبادی مثبت باشد، ممکن است سلولهای اسکرین دارای آنتیژنهای هموزیگوت باشد که آنتیبادی با اثر دوزاژ با آنها واکنش میدهد. آنتیبادیهای ارهاش به غیر از آنتی D و آنتیبادیهای سیستم کید و دافی و M و N وS با آنتیژنهای قوی و بیان هموزیگوت واکنش میدهند که به آن اثر دوزاژ گفته میشود. برای مثال آنتی M اگر با گلبولهای +M+N واکنش 2+ بدهد با گلبولهای –M+N واکنش 4+ میدهد، چون در این حالت آنتیژن M بهصورت هموزیگوت بیان شده است.
پرسش 16) برخی از پزشکان وقتی که خون سازگار برای بیماری یافت نمیشود تقاضای خون K–(Kell negative) میکنند. علت آن چیست؟
پاسخ: در میان آنتیژنهای گروه خونی، آنتیژن K بعد از ABO و RH از بالاترین قدرت تحریک ایمنی (Immunogenicity) برخوردار است و چنانچه آنتیژن K به فرد K منفی تزریق شود 10% شانس تولید آنتی K دارد، در حالی که شانس تولید آنتی D با تزریق RH مثبت به ارهاش منفی 70% است. بقیه آنتیژنهای گروه خونی معمولاً شانس تحریک کمتر از 2 تا 4% دارند. شیوع آنتیژن K منفی در جامعه حدود 90% و شیوع +K در جامعه حدود 10% است؛ از این رو فردی که ترانسفیوژن مکرر یا قبلی داشته است و خون همگروه ABO و RH را دریافت کرده، شانس تولید آنتی K دارد و بنابراین خون K منفی ممکن است در کراس مچ سازگار درآید. در برخی از مراکز به خانم باردار که –K است خون همگروه با سیستمهای ABO و RH و Kell تزریق میشود؛ برای مثال خون +O–K به خانم +O–K داده میشود، زیرا ساخته شدن آنتی K و عبور آن از جفت موجب کمخونی همولیتیک و ترومبوسایتوپنی جنین- نوزادی میشود. البته خون –K به شرطی که پدر +K باشد به خانم باردار تزریق میشود. یادآوری میشود که خون –K ممکن است مشکل ناسازگاری را حل کند. چنانچه ناسازگاری با –K ادامه داشت بایستی با استفاده از سلولهای پانل، هویت آنتیبادی را مشخص و خون آنتیژن منفی را برای بیمار کراس مچ نمود.
پرسش 17) برای بیماری تقاضای خون LR-RBC شده است؛ چرا؟ هدف از تزریق خون کم لکوسیت چیست؟ آیا میتوان در کنار تخت بیمار خون را فیلتر کرد؟
پاسخ: خون کم لکوسیت به کیسه خونی گفته میشود که با فیلترهای مخصوص لکوتراپ، 99/9% از گلبولهای سفید آن برداشته شده است. هدف از برداشتن گلبولهای سفید کیسه کاهش سرایت CMV، کاهش واکنشهای تریم (Trim)، کاهش واکنشهای تب و لرز و کاهش رفراکتوری به تزریق پلاکت از طریق جلوگیری از ساخته شدن آنتیبادی علیه آنتیژنهای HLA است. خون کم لکوسیت یا LR-RBC فراورده مناسبی برای افراد با کمبود ایمنی، برای نوزادی که مادر از نظر ویروسCMV سرونگاتیو است، دریافتکننده پیوند اعضا از اهداکننده سرونگاتیو و خانم باردار سرونگاتیو است. سرونگاتیو یعنی اینکه با ویروس CMV برخورد نداشته و آنتیبادی علیه آن ندارد. گلبولهای سفید مخزن ویروس CMV است و برداشت 99/9% از گلبولهای سفید شانس ابتلا در افراد مستعد را از 30% به 1/5% میرساند و از این رو خون LR-RBC تقریباً معادل سرونگاتیو در نظر گرفته میشود. واکنش Trim به مفهوم دستکاری در سیستم ایمنی است. حرف T به مفهوم Transfusion و حرف R به مفهوم Related و IM به مفهوم Immunomodulation است. تزریق خون کم لکوسیت مانع از عدم تعادل TH1 و TH2 میگردد و از این رو تزریق این فراورده موجب کاهش عود تومور و عفونتهای جراحی میشود. گفتنی است که تزریق خون لکوسیتدار، شانس برگشت تومور و عفونتهای زخمهای جراحی را زیاد میکند و این به علت کاهش ترشح IL2 و کاهش دادن تعداد سلولهای TH1 است که در ایمنی سلولار نقش دارند. برداشت گلبولهای سفید از کیسه حدود 90-75% از واکنشهای تب و لرز را کاهش میدهد زیرا تجمع سایتوکاینهای گلبولهای سفید علت بیشترین موارد تب و لرز است. با برداشت گلبولهای سفید شانس ساخته شدن آنتیبادی علیه آنتیژنهای لکوسیتی کاهش یافته و از این رو شانس بیپاسخی یا رفراکتوری به تزریق پلاکتها کاهش مییابد. فیلتر با لکوتراپ در کنار تخت بیمار اثربخشی کمتری دارد و ممکن است با سندرم چشم قرمز و افت فشارخون همراه شود.
با فیلترهای مخصوص لکوتراپ، 99/9% از گلبولهای سفید کیسه خون برداشته شده است. هدف از برداشتن گلبولهای سفید کیسه، کاهش سرایت CMV و کاهش واکنشهای تریم (Trim) است
پرسش 18) آیا عمر نگهداری خون شستهشده مانند عمر نگهداری در کیسههای عادی است؟ چند بار و با چه محلولی خون شستشو داده میشود؟
پاسخ: شستشوی گلبولهای قرمز با سرم فیزیولوژی 4 درجه انجام میشود و هدف آن خارج شدن پروتئینها و چربیها از خون است. برای هر بار شستن، سرم فیزیولوژی به کیسه خون اضافه شده و مخلوط گردیده و سانترفیوژ میگردد، سپس سرم فیزیولوژی آلوده به پروتئین خارج میشود. این پروسه معمولاً 3 بار تکرار و هر کیسه خون تقریباً با 1/5 لیتر سالین شسته میگردد؛ بهطوریکه پروتئین نهایی کل کیسه کمتر از 5 /0 گرم میگردد. چنانچه برای شستشو، ورودی کیسه باز شود، از این زمان تا 24 ساعت خون شسته شده در یخچال 4 درجه قابل نگهداری است و ربطی به نوع ضد انعقاد کیسه ندارد. از خون شسته شده برای بیمارانی که سابقه آلرژی با تزریق خون یا پلاسما دارند، استفاده میشود زیرا تزریق خون عادی موجب خارش و کهیر در این بیماران میگردد. گاهی آلرژی موجب اختلال تنفسی و خسخس ریه میگردد که با خون شسته شده میتوان از این واکنش جلوگیری کرد. بیماران با کمبود IgA، کمبود هاپتوگلوبین و کمبود اجزای کمپلمان در خطر شوک آنافیلاکسی با تزریق فراوردههای پلاسمایی و آلوده به پلاسما هستند و از این رو سفارش میشود که گلبولهای تزریقی برای این افراد 5 بار شستشو شود. قبلاً برای بیماران مبتلا به کمخونی PNH (هموگلوبینوری حملهای شبانه) از خون شسته شده استفاده میشد ولی امروزه استانداردها، تزریق خون عادی را بلامانع میدانند.
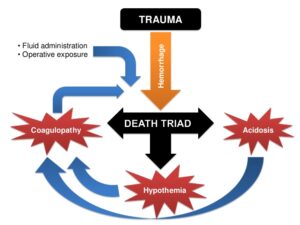
پرسش 19) چرا برای بیماران ترومایی که خون زیادی از دست دادهاند، فراوردههای خون به نسبت 1:1:1 تقاضا میشود؟
پاسخ: بیماران ترومایی که مقدار زیادی خون از دست دادهاند در خطر اختلال انعقادی، اسیدوز و هایپوترمی هستند که به این سه مورد، سهتایی مرگ گفته میشود. با از دست دادن خون نهتنها حجم خون کم میشود بلکه پلاکتها و فاکتورهای انعقادی هم خارج میگردند. چنانچه به بیمار کیسههای خون همراه با سرم فیزیولوژی تزریق شود، جبران پلاکتها و فاکتورهای انعقادی از دست رفته نمیگردد و مرگومیر افزایش مییابد، از این رو بایستی ترکیبی شبیه به خون کامل به بیمار ترومایی داده شود؛ برای مثال 5 کیسه خون فشرده، 5 کیسه FFP (پلاسمای تازه) و 5 واحد پلاکت راندوم که شبیه خون کامل میشود. هر بسته ارسالی از بانک خون برای بیمار ترومایی به نسبت 1:1:1 دارای گلبول قرمز فشرده، پلاسما و پلاکت است. با این روش تزریقی، کاهش مرگومیر بیماران ترومایی مشاهده شده است.
سهتایی مرگ در بیماران ترومایی
پرسش 20) بیماری پس از تزریق خون دچار تب و لرز شده است، وظیفه آزمایشگاه در این موارد چیست؟ چگونه علتیابی میشود؟
پاسخ: تب و لرز حین تزریق خون یا حتی تا 24 ساعت از تزریق خون ممکن است بیانگر واکنش حاد همولیتیک باشد. در این حالت گروهبندی و کراس مچ مجدد با نمونه جدید بایستی انجام شود ولی آزمایشهای کومبز مستقیم، آزمایش هموگلوبینوری و مشاهده رنگ پلاسمای بیمار برای همولیز در گروه آزمایشهای اورژانس هستند که در صورت مثبت شدن، بیانگر واکنش حاد همولیتیک است و هر چه سریعتر درمان بایستی شروع شود و عواقبی مانند انعقاد داخل عروقی منتشره، شوک و نارسایی کلیه را به دنبال دارد.
واکنش آسیــــــب حـــــــاد ریوی یا تـــــــــــــرالی (Trali) نیز با تنگی نفس و تب همراه اســت و اندازهگـــــــــیری
BNP)Brain Natriuretic Peptide) و شمارش WBC و اندازهگیری فشار اکسیژن شریانی در تشخیص و افتراق آن از واکنش ازدیاد حجم خون یا واکنش تاکو کمککننده است.
عفونت کیسه خون بهویژه عفونی شدن کیسه پلاکت یکی دیگر از موارد تب و لرز است که در این حالت رنگآمیزی گرم روی خون و کشت کیسه سفارش میشود. یادآوری میشود که در هنگام تحویل کیسه خون به بخش جهت تزریق بایستی کیسه خون را از جهت رنگ غیرطبیعی، همولیز، جمع شدن گاز در کیسه و حضور اجسام ذرهای چک کرد، زیرا موارد فوق ممکن است نشانهای از عفونت کیسه باشد. میکروب یرسینیا (Yersinia)، سودوموناس و سیتروباکتر از ارگانیزمهای شایع در عفونت کیسههای خون هستند. با توجه به اینکه کیسه پلاکت در حرارت اتاق نگهداری میشود، امکان رشد میکروبی بیشتر در صورت آلودگی دارد و میکروبهای گرم مثبت و منفی توانایی رشد در کیسه پلاکت را دارند. تزریق کیسه عفونی به بیمار با شوک گرم، کلاپس عروقی، تب و لرز و مرگ همراهی دارد.
پرسش و پاسخهای آزمایشگاهی و کاربردی در طب انتقال خون (1)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام