دکتر شاهین اسعدی
(دکتری تخصصی ژنتیک پزشکی)
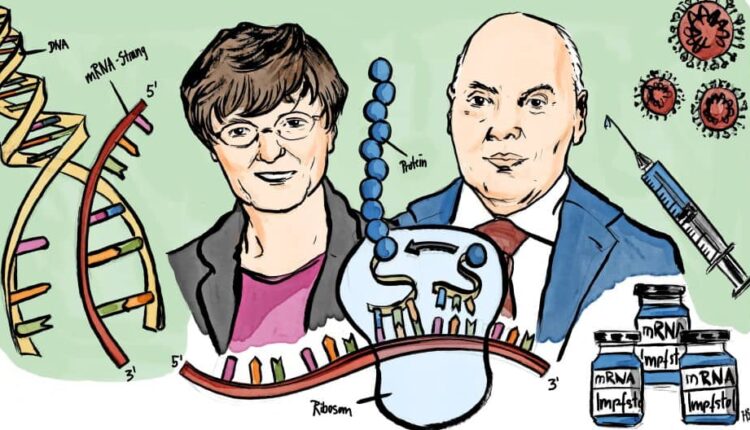
جایزه نوبل 2023 در فیزیولوژی یا پزشکی به طور مشترک به محققانی به نامهای خانم کاتالین کاریکو و آقای درو وایسمن برای اکتشافات در مورد تغییرات باز نوکلئوزیدی که امکان ساخت واکسنهای mRNA مؤثر علیه COVID-19 را فراهم کرد، تعلق گرفت.
اکتشافات دو برنده جایزه نوبل برای توسعه واکسنهای mRNA مؤثر علیه کووید-19 در طول همهگیری که در اوایل سال 2020 آغاز شد، حیاتی بود. برندگان جایزه نوبل پزشکی از طریق یافتههای پیشگامانه خودشان که اساساً درک ما را از نحوه تعامل mRNA با سیستم ایمنی ما تغییر داده است، به نرخ بیسابقه توسعه واکسن در یکی از بزرگترین تهدیدات سلامت انسان در دوران مُدرن کمک کردند.
واکسنها قبل از همهگیری
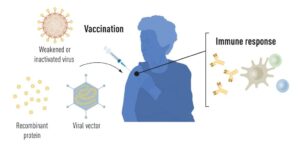
واکسیناسیون باعث تحریک تشکیل یک پاسخ ایمنی به یک پاتوژن خاص میشود. این امر به بدن در مبارزه با بیماری در صورت قرار گرفتن در معرض بعدی کمک میکند. واکسنهای مبتنی بر ویروسهای کُشته یا ضعیف شده از دیرباز در دسترس بودهاند که نمونهای از آن واکسنهای ضد فلج اطفال، سرخک و تب زرد است. در سال 1951، دانشمندی به نام مکس تیلر جایزه نوبل فیزیولوژی یا پزشکی را برای ساخت واکسن تب زرد دریافت کرد.
به لطف پیشرفت در زیست شناسی مولکولی در دهههای اخیر، واکسنهایی بر اساس اجزای ویروسی منفرد، بهجای ویروسهای کامل ساخته شدهاند. بخشهایی از کُد ژنتیکی ویروسی که معمولاً پروتئینهای موجود در سطح ویروس را کُد میکنند، برای ساختن پروتئینهایی استفاده میشوند که تشکیل آنتیبادیهای مسدودکننده ویروس را تحریک میکنند. به عنوان مثال میتوان به واکسنهای ضد ویروس هپاتیت B و ویروس پاپیلومای انسانی اشاره کرد. از طرف دیگر، بخشهایی از کُد ژنتیکی ویروسی را میتوان به یک ویروس ناقل بیضرر، به عنوان یک “حامل” منتقل کرد. این روش در واکسنهای ضد ویروس اِبولا استفاده میشود. هنگامی که واکسنهای ناقل تزریق میشوند، پروتئین ویروسی انتخاب شده در سلولهای ما تولید میشود و پاسخ ایمنی را در برابر ویروس هدف تحریک میکند.
تولید واکسنهای کامل مبتنی بر ویروس، پروتئین و ناقل نیاز به کِشت سلولی در مقیاس بزرگ دارد. این فرآیند فشرده منابع، امکان تولید سریع واکسن را در پاسخ به شیوع و همهگیری محدود میکند؛ بنابراین، محققان مدتها تلاش کردهاند که فناوریهای واکسن را مستقل از کِشت سلولی توسعه دهند، اما این امر چالشبرانگیز بود.
شکل 1: شماتیکی از روشهای تولید واکسن قبل از همهگیری COVID-19
واکسنهای mRNA: یک ایده امیدوارکننده
در سلولهای ما، اطلاعات ژنتیکی رمزگذاری شده در DNA به RNA پیامرسان (mRNA) منتقل میشود که به عنوان الگویی برای تولید پروتئین استفاده میگردد. در طول دهه 1980، روشهای کارآمد برای تولید mRNA بدون کِشت سلولی به نام رونویسی در شرایط آزمایشگاهی معرفی شد. این گام تعیینکننده توسعه کاربردهای زیست شناسی مولکولی را در چندین زمینه تسریع کرد. ایدههای استفاده از فناوری mRNA برای اهداف واکسن و درمان نیز مطرح شد، اما موانعی در راه بود. mRNA رونویسی شده در شرایط آزمایشگاهی ناپایدار و چالشبرانگیز در نظر گرفته شد که به توسعه سیستمهای لیپیدی حامل mRNA کپسوله شده نیاز دارد. علاوه بر این، mRNA تولید شده در شرایط آزمایشگاهی منجر به واکنشهای التهابی شد؛ بنابراین، اشتیاق برای توسعه فناوری mRNA برای اهداف بالینی در ابتدا محدود بود.
اما این موانع، کاتالین کاریکو، بیوشیمیدان مجارستانی را که به توسعه روشهایی برای استفاده از mRNA برای درمان مشغول بود، دلسرد نکرد. در اوایل دهه 1990، زمانی که او استادیار دانشگاه پنسیلوانیا بود، علیرغم اینکه با مشکلاتی در متقاعد کردن سرمایهگذاران تحقیقاتی در مورد اهمیت پروژهاش مواجه شد، به دیدگاه خود مبنی بر تحقق mRNA به عنوان یک روش درمانی وفادار ماند. یکی از همکاران جدید Karikó در دانشگاه او، ایمونولوژیستی به نام Drew Weissman بود. او به سلولهای دندریتیک علاقهمند بود که عملکردهای مهمی در نظارت بر سیستم ایمنی و فعالسازی پاسخهای ایمنی ناشی از واکسن دارند. با تحریک ایدههای جدید، همکاری مثمر ثمری بین این دو دانشمند با تمرکز بر نحوه تعامل انواع مختلف RNA با سیستم ایمنی، آغاز شد.
دستیابی به موفقیت
Karikó و Weissman متوجه شدند که سلولهای دندریتیک، mRNA رونویسی شده در شرایط آزمایشگاهی را به عنوان یک ماده خارجی تشخیص میدهند که منجر به فعال شدن آنها و آزاد شدن مولکولهای سیگنالدهنده التهابی میشود. آنها تعجب کردند که چرا mRNA رونویسی شده در شرایط آزمایشگاهی به عنوان عامل خارجی شناخته میشود در حالی که mRNA از سلولهای پستانداران منجر به واکنش مشابهی نمیشود. Karikó و Weissman دریافتند که برخی از خصوصیات حیاتی باید انواع مختلف mRNA را متمایز کند.
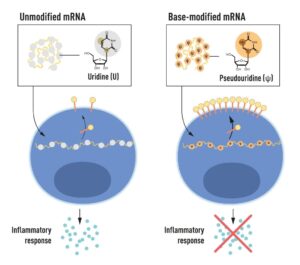
RNA شامل چهار باز به نامهای اختصاری A، U، G و C است که مربوط به A، T، G و C در DNA، الفبای کُد ژنتیکی است. Karikó و Weissman میدانستند که بازهای نوکلئوزیدی موجود در RNA سلولهای پستانداران اغلب از نظر شیمیایی اصلاح میشوند، در حالی که mRNA رونویسی شده در شرایط آزمایشگاهی چنین نیست. آنها تعجب کردند که آیا عدم وجود بازهای نوکلئوزیدی تغییر یافته در RNA رونویسی شده در شرایط آزمایشگاهی میتواند واکنش التهابی ناخواسته را توضیح دهد یا خیر. برای بررسی این موضوع، آنها انواع مختلفی از mRNA را تولید کردند که هر کدام دارای تغییرات شیمیایی منحصربهفردی در بازهای نوکلئوزیدی خود بودند که آنها را به سلولهای دندریتی تحویل دادند.
نتایج قابل توجه بود: هنگامی که تغییرات باز نوکلئوزید در mRNA گنجانده شد، پاسخ التهابی تقریباً از بین رفت. این یک تغییر پارادایم در درک ما از نحوه تشخیص و واکنش سلولها به اشکال مختلف mRNA بود. Karikó و Weissman بلافاصله دریافتند که کشف آنها اهمیت عمیقی برای استفاده از mRNA به عنوان درمان دارد. این نتایج اولیه در سال 2005، پانزده سال قبل از همهگیری COVID-19 منتشر شد.
شکل 2: شماتیکی از mRNA که حاوی چهار باز نوکلئوزید مختلف است که به اختصار A، U، G و C نامیده میشوند. برندگان جایزه نوبل کشف کردند که mRNA اصلاح شده با باز نوکلئوزیدی میتواند برای جلوگیری از فعال شدن واکنشهای التهابی (ترشح مولکولهای سیگنالینگ) و افزایش تولید پروتئین در زمانی که mRNA است استفاده شود و به سلولهای هدف تحویل داده شود
در مطالعات پیشتر منتشر شده در سال 2008 و 2010، Karikó و Weissman نشان دادند که تحویل mRNA تولید شده با تغییرات باز نوکلئوزیدی به طور قابلتوجهی تولید پروتئین را در مقایسه با mRNA اصلاح نشده افزایش میدهد. این اثر به دلیل کاهش فعال شدن آنزیمی بود که تولید پروتئین را تنظیم میکند. Karikó و Weissman از طریق اکتشافات خود مبنی بر کاهش پاسخهای التهابی و افزایش تولید پروتئین، موانع حیاتی را بر سر راه کاربردهای بالینی mRNA حذف کردند.
واکسنهای mRNA به پتانسیل خود پی بردند
علاقه به فناوری mRNA شروع شد و در سال 2010، چندین شرکت در حال کار بر روی توسعه این روش بودند. واکسنها علیه ویروس زیکا و MERS-CoV دنبال شدند. مورد دوم ارتباط نزدیکی با SARS-CoV-2 دارد. پس از شیوع همهگیری COVID-19، دو واکسن mRNA اصلاحشده با باز نوکلئوزیدی که پروتئین سطحی SARS-CoV-2 را کُد میکنند، با سرعت بیسابقه ساخته شدند. اثرات محافظتی حدود 95 درصد گزارش شده است و هر دو واکسن در دسامبر 2020 تأیید شدند.
انعطافپذیری و سرعت قابلتوجهی که واکسنهای mRNA را میتوان توسعه داد، راه را برای استفاده از پلتفرم جدید برای واکسنها علیه سایر بیماریهای عفونی هموار میکند. در آینده، این فناوری ممکن است برای ارائه پروتئینهای درمانی و درمان برخی از انواع سرطان نیز مورد استفاده قرار گیرد. چندین واکسن دیگر علیه SARS-CoV-2، بر اساس روشهای مختلف، نیز به سرعت معرفی شدند و در مجموع، بیش از 13 میلیارد دوز واکسن کووید-19 در سراسر جهان تزریق شده است. واکسنها جان میلیونها نفر را نجات داده و از بیماریهای شدید در بسیاری دیگر جلوگیری کردهاند و به جوامع اجازه میدهند ایمن بمانند و به شرایط عادی زندگی بازگردند. برندگان جایزه نوبل امسال از طریق اکتشافات اساسی خود در مورد اهمیت تغییرات باز نوکلئوزیدی در mRNA، نقش مهمی در این تحول دگرگون کننده طی یکی از بزرگترین بحرانهای بهداشتی زمان ما داشتند.
Reference:
the 2023 Nobel Prize in Physiology or Medicine.
ورود / ثبت نام