پیشرفت پژوهشها بر روی کاربردهای بالینی هورمون آنتیمولرین و توسعه ایمونواسی
دکتر شاهرخ مستور تهرانی
چکیده
هورمون آنتیمولرین (AMH) از اعضای ابرخانواده فاکتور رشد ترانسفورمکننده بتا (TGF-β) است و بهعنوان ماده مهارکننده مولرین نیز شناخته میشود، زیرا وظیفه آن از بین بردن مجاری مولرین است. در سالهای اخیر AMH به دلیل امکان استفاده از آن بهعنوان یک مارکر بیولوژیک ایدهآل و شکلگیری تکنولوژيهایی برای آنالیز آن، به موضوعی تبدیل شده است که پژوهشهای بسیاری بر روی آن انجام گرفته است. هدف این مقاله مروری آن است که ابتدا خلاصهای از کاربردهای بالینی بالقوه AMH ارائه دهد و سپس در مورد توسعه ایمونواسی برای AMH بحث کند.
مقدمه
هورمون آنتیمولرین (AMH) دایمری از دو زیرواحد گلیکوپروتئینی یکسان به جرم مولکولی KDa ۱۴۰ است که توسط یک پیوند دیسولفیدی به یکدیگر متصل شدهاند. این هورمون به ابرخانواده فاکتور رشد ترانسفورمکننده بتا (TGF-β) تعلق دارد که نقش مهمی را در رشد و تکثیر سلول و میانکنش مزانشیمال- اپیتلیال ایفا میکنند. AMH تنها توسط سلولهای گرانولوزا در تخمدانها و نیز توسط سلولهای سرتولی در بیضهها تولید میشود. AMH نقش مهمی در تمایز جنسی برعهده دارد و در تنظیم رشد فولیکولار شرکت میکند. در زنان، AMH سرم در مقایسه با مردان در سطوح نسبتاً پایینی حفظ میشود. در چند دهه اخیر، پژوهشهای متعددی در ارتباط با کاربردهای بالینی AMH در زمینههای مختلف پزشکی مانند یائسگی، اندوکرینولوژی ژنیکولوژیک و انکولوژی منتشر شده است. در این مقاله مروری خواهیم داشت بر روی پیشرفتهای تحقیقاتی در زمینه AMH و بر روی کاربردهای بالینی بالقوه آن. از جمله به کاربرد در زمینه کارسینوما و اندوکرینولوژی تمرکز خواهیم کرد و به توسعه ایمونواسی برای AMH نیز خواهیم پرداخت.
کاربردهای بالینی بالقوه
کاربردهای بالینی در زمینه اندوکرینولوژی تولیدمثل
سندرم تخمدان پلیکیستیک
سندرم تخمدان پلیکیستیک (PCOS) بیماری پیچیده هورمونهای تولیدمثلی و متابولیک رایجی در زنان است که به عدم تخمکگذاری مزمن و هایپرآندروژنیسم منجر میشود. این بیماری در اثر اختلال در عملکرد تخمدانی بهویژه در زنان جوان و زنان در سن باروری ایجاد میشود.
در سال ۲۰۰۳، Rotterdam Consensus، PCOS را تعریف و استفاده از اولتراسوند برای شمارش فولکیولهای آنترال بهعنوان یکی از معیارهای تشخیصی را مطرح نمود. AMH موجود در سرم بهوسیله فولیکولهای آنترال کوچک تولید میشود که همان فولیکولهایی هستند که در اولتراسوند مشاهده میشوند. AMH در تمام فرایند فولیکولوژنز در مقادیر مختلف بیان میشود. Weene و همکاران، بیشترین میزان AMH در زنان مبتلا به PCOS را در فولیکولهای پری- آنترال و فولیکولهای آنترال کوچک، یعنی جایی که بخش اعظم AMH سنتز میشود، مشاهده کردند. این یافته با دیگر پژوهشها که میزان AMH در زنان مبتلا به PCOS را با زنان گروه کنترل مقایسه میکردند، سازگاری داشت، بهعلاوه سطوح AMH سرم نیز در بیماران مبتلا به PCOS هنگام عدم تخمکگذاری و هایپرآندروژنیسم بالاتر است. به دلیل اینکه AMH توسط اکثر سلولهای گرانولوزای موجود در فولیکولهایی با قطر ۲ تا ۹ میلیمتر تولید میشود، چندین مطالعه نشان دادهاند که همبستگی قوی بین سطوح AMH سرم و یافتههای اولتراسونوگرافی از تعداد فولیکولهای آنترال (AFC) وجود دارد. با وجود اینکه اندازهگیری AMH سرم نسبت به اولتراسوند برتریهایی دارد، اما میتواند نشاندهنده فولیکولهای پری- آنترال و آنترال کوچک هم باشد که مشاهده این فولیکولها بهوسیله اولتراسوند دشوار است؛ بنابراین AMH سرم نسبت به تعداد فولیکولهای آنترال دقیقتر است و استفاده از آن در تشخیص بالینی PCOS بهطور فزایندهای در حال گسترش است.
ارزیابی ذخیره تخمدانی و تکنولوژی کمک باروری (assisted reproductive technology, ART)
ذخیره تخمدانی یک فاکتور مهم نشاندهنده عملکرد تخمدان و باروری است که به تعداد فولیکولهای پریموردیال موجود در قشر تخمدان که در زمان تولد شکل گرفتهاند، بستگی دارد. عملکرد فیزیولوژیکی برای تولید فولیکولهای پریموردیال وجود ندارد و تعداد فولیکولهای پریموردیال، دیگر پس از تولد افزایش پیدا نمیکند. تعداد فولیکولهای پریموردیال بهتدریج در طول دوره تولیدمثلی زنان کاهش مییابد زیرا رشد برخی از فولیکولها بهطور مداوم آغاز میشود و متعاقباً بیشتر این فولیکولها دچار آپوپتوز میشوند و این روند تا زمانی که فرد به یائسگی برسد ادامه دارد. AMH از سلولهای گرانولوزای موجود در فولیکولهای تخمدانی ترشح میشود و ثابت شده است که با تعداد فولیکولهای در حال رشد، مرتبط است. این نتایج پیشنهاد میکنند که میزان آغاز رشد فولیکولی بهشدت به مخزن فولیکولی اولیه بستگی دارد؛ بنابراین ما پیشنهاد میکنیم که سطوح AMH میتواند بهصورت غیرمستقیم نشاندهنده ذخیره تخمدانی باشد. اندازهگیری AMH سرم در مقایسه با مارکرهای مرسوم ذخیره تخمدانی (FSH و E2)، مزایای آشکاری دارد، برای مثال اینکه سطوح AMH سرم در طول دوره قاعدگی، بدون تغییرات چشمگیری ثابت است و در هر زمان قابل اندازهگیری است در حالی که FSH و E2 تنها در پنج روز اول دوره قاعدگی قابل تشخیص و اندازهگیری هستند، بهعلاوه از AMH میتوان برای ارزیابی تأثیرات پزشکزاد درمانهای مختلف بر روی عملکرد ذخیره تخمدانی برای مثال طی درمان سرطان یا جراحی استفاده کرد و استفاده از AMH به پزشک این امکان را میدهد که بهترین رژیم درمانی را برای محافظت از عملکرد تخمدانی بیمار تحت درمان انتخاب کند.
بهخوبی میدانیم که زنان ۴۰ ساله و بیشتر، به دلیل اندک بودن تعداد فولیکولهای بالغی که آزاد میشوند، از ناباروری رنج میبرند. اگرچه محققان نشان دادهاند که نتایج بارداری پس از درمان با تکنولوژی کمک باروری (ART) در میان زنان ۴۰ ساله یا بیشتر در بیمارانی که پاسخ مناسب به تحریک کنترلشده تخمدان (controlled ovarian stimulation, COS) دارند، بهتر است. تحریک کنترلشده تخمدان یکی از مهمترین تکنولوژیهای کمکباروری است و بسیار مهم است که تحریک کنترلشده تخمدان بیماران را بر اساس ارزیابی ذخیره تخمدانی و پیشبینی واکنش تخمدان به القای تخمکگذاری، انجام دهیم. پیشتر پژوهشی به این نکته اشاره کرد که AMH یک مارکر ایدهآل از ذخیره تخمدانی برای کاربردهای بالینی است و از آن در تکنولوژی کمکباروری میتوان برای ارائه درمانهای شخصیسازیشده استفاده کرد و از این طریق میزان موفقیت این تکنولوژیها را افزایش داد.
پیشبینی سن یائسگی
در زنان، AMH فقط در سلولهای گرانولوزای فولیکولهای تخمدانی تولید میشود. پژوهشها اثبات کردهاند که AMH در تنظیم تکامل فولیکولها دخالت دارند. Weenen و همکاران گزارش کردند که بیان AMH در فولیکولهای پریموردیال مشاهده نمیشود، اما عمدتاً در سلولهای گرانولوزای فولیکولهای ثانویه، پریآنترال و آنترال کوچک با قطر کمتر از ۴ میلیمتر وجود دارد. در فولیکولهای آنترال بزرگ (۸-۴ میلیمتر)، بیان AMH بهتدریج ناپدید میشود که نشان میدهد AMH نقش مهمی در فولیکولوژنز ایفا میکند. سطوح AMH با میزان مخزن فولیکولهای پریموردیال همبستگی دارد و یک مخزن فولیکولی تهیشده نشاندهنده فرا رسیدن یائسگی است، بهعلاوه تعدادی از محققان گزارش کردهاند که AMH ارتباط نزدیکی با سن دارد. Lie و همکاران سطوح AMH سرم را در ۸۰۴ زن سالم در بازه سنی کودکی تا پایان دوره باروری اندازهگیری کردند و سن دارای همبستگی مثبت با AMH بود، همبستگی از کودکی تا 15/8سالگی که مقدار AMH سرم به بیشترین مقدار خود میرسد، وجود دارد. سپس سطوح AMH سرم تا ۲۵ سالگی ثابت میماند و پس از آن تا زمان یائسگی که AMH غیرقابل اندازهگیری میشود، AMH و سن همبستگی منفی دارند. Rosen و همکاران نیز ثابت کردند که میزان AMH کاهش پیشرونده چشمگیری را در ارتباط با سن نشان میدهد، بهعلاوه Seifer و همکاران اشاره کردند که گروههای سنی مختلف میزان کاهشهای مختلفی را در سطوح AMH نشان میدهند، اگرچه سطوح AMH بهطور مداوم با افزایش سن از ۲۴ تا ۵۰ سالگی کاهش مییابد. میزان کاهش در AMH سرم، در سن ۲۴ تا ۳۵ سالگی ng/mL/year 0/2 و از ۳۵ سالگی به بعد به میزان ng/mL/year 0/1 است. چنین دادههایی ممکن است برای پزشکان و بیماران آنها که در حال رسیدن به یائسگی هستند یا امکانهای باروری را در نظر دارند، ارزشمند باشد. گروهی از پژوهشهای پیگیری (follow-up) امکان استفاده از سطوح AMH برای پیشبینی سن یائسگی را بررسی کردهاند و نتایج همه این پژوهشها، تأئید فرضیه اولیه بود که بیان میکند بازه سنی که یائسگی در آن رخ خواهد داد میتواند در افراد مختلف با توجه به سن و AMH محاسبه شود.
با توجه به همبستگی قوی بین سطوح AMH و سن و همچنین ذخیره تخمدانی، AMH میتواند بهعنوان یک پیشبینیکننده بالقوه برای سنی که در آن زنان به یائسگی میرسند، در نظر گرفته شود و این امر مدیریت پیشگیری فردی زودهنگام با تمرکز بر دیگر بیماریهای وابسته به سن مثل پوکی استخوان، بیماریهای قلبی عروقی و بیماریهای نورولوژیک را امکانپذیر میسازد. با این حال پژوهشهای بیشتری برای ساخت یک مدل چندمتغیره شامل عواملی مانند سن، سطوح AMH، سیگار کشیدن و BMI برای پیشبینی سن یائسگی بهصورت دقیقتر لازم است، زیرا BMI و مصرف دخانیات نیز در کنار سطوح AMH در پیشبینی سن یائسگی دخالت دارند.
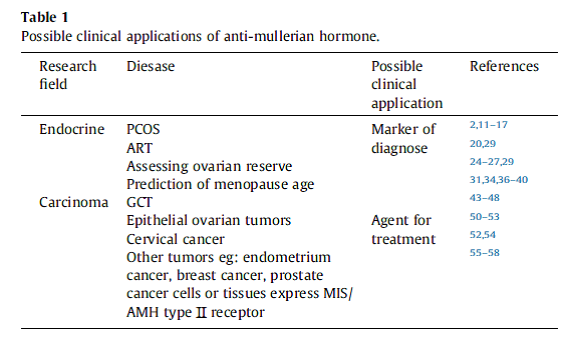
کاربردهای بالینی در زمینه کارسینوما
تومور سلولهای گرانولوزای تخمدان (GCT)
علیرغم اینکه دانستهها و کاربردهای اولیه AMH، عمدتاً در زمینه ژنیکولوژی و اندوکرینولوژی تولیدمثل بوده است، در سالهای اخیر تحقیقات روزافزونی بر روی ارتباط بین AMH و تومورهای ژنیکولوژیکال تمرکز کردهاند.
تومور سلولهای گرانولوزای تخمدان (GCT) نوعی از تومورهای غیرمعمول استرومال طناب جنسی (sex cord-stromal tumors) است. (GCT) بر اساس بافتشناسی پاتولوژیکی به دو زیرگروه مجزا تقسیم میشوند: تومور سلول گرانولوزای جوانان که نادر است و تومور سلول گرانولوزای بالغین که معمولتر است. به دلیل اینکه بیان AMH به سلولهای گرانولوزای تخمدان محدود میشود، این فرضیه شکل گرفته است که از AMH میتوان بهعنوان مارکر تومورهای سلول گرانولوزا استفاده کرد.
برای معتبر ساختن کارایی بالینی AMH سرم، Farkkil و همکارانش یک مطالعه کوهورت نسبتاً آیندهنگر شامل ۱۲۳ بیمار مبتلا به تومور سلولهای گرانولوزا نوع بالغین، در سنین قبل و بعد از یائسگی انجام دادند که این افراد به مدت 10/5 سال تحت پیگیری و بررسی قرار گرفتند. نویسندگان این مقاله مشاهده کردند که سطوح AMH سرم در بیمارانی با تومور سلولهای گرانولوزا نوع بالغین اولیه یا عودکننده، بهطور چشمگیری افزایش یافته است که این مورد با تحقیقات پیشین مطابقت دارد، بهعلاوه مطالعات دیگر ثابت کردهاند که همبستگی معنیداری بین AMH و GCT وجود دارد و واکنش ایمنی (immunoreactivity) AMH در تومورهای اکستراگونادال مشاهده نشد و تفاوت معنیداری در استروژن یا پروژستین در گروه مبتلا به GCT در مقایسه با گروه کنترل وجود نداشت. بهعلاوه سطوح افزایشیافته AMH در حدود ۶۹% بیماران پیش از عود بالینی بیماری رخ میدهد. همچنین حساسیت و اختصاصیت به ترتیب به ۹۲% و ۸۱% رسید. با این وجود یک مطالعه دیگر که سطوح AMH در زنان سالخورده مبتلا به GCT با میانگین سنی 76/9 را بررسی میکرد، نشان داد که مقادیر AMH سرم در زنان یائسه بالای ۶۵ سال، قابل چشمپوشی است.
در نتیجه اندازهگیری AMH میتواند بهعنوان یک مارکر تشخیصی اولیه برای GCT و بهعنوان مارکری برای عود تومور GCT، به کار گرفته شود. اگرچه تشخیص مقادیر غیرقابل ردیابی AMH سرم در زنان سالخورده، مستلزم تحقیقات بیشتر در زمینه استفاده از AMH بهعنوان مارکر برای GCT است.
تومورهای اپیتلیال تخمدان
اخیراً مطالعهای بر اساس دادههای اپیدمیولوژیک و زیستشناسی مولکولی و مشاهدات هیستوپاتولوژیک از نمونههای جراحی، پیشنهاد کرده است با اینکه اکثر سرطانهای تخمدان از انتهای حاشیهدار (fimbriated) لوله فالوپ منشأ میگیرند، اما برخی از سرطانها نیز از اجزای سیستم مولرین ثانویه ناشی میشوند. به دلیل اینکه AMH، تحلیل رفتن مجاری مولرین را القا میکند، چند محقق پیشنهاد دادهاند که AMH میتواند در درمان تومورهای اپیتلیال تخمدان استفاده شود. پیشتر در مطالعهای، اثربخشی AMH انسانی نوترکیب خالصشده (rhAMH) علیه رده سلولی OVCAR 8 و IGROV 1 در سرطان تخمدان در موشهای ماده SCID آزمایش شده است. محققان مشاهده کردند که میانگین نسبت اندازه پیوند در ایمپلنتهای تومور OVCAR 8 در موشهایی که به مدت دو یا سه هفته بهصورت پارنترال تحت درمان با AMH بودند، در مقایسه با موشهای کنترل کوچکتر است. محققان در مورد ایمپلنتهای تومور IGROV 1 نیز نتایج مشابهی را مشاهده کردند، بهعلاوه شواهد نشان میدهد که MIS از طریق مکانیسم وابسته به گیرنده MIS، مهار رشد سلولهای سرطانی اپیتلیال تخمدان را القا میکند. نتایج ذکرشده به یک استدلال متقاعدکننده مبنی بر اینکه AMH انسانی میتواند باعث مهار ردههای سلولی سرطان تخمدان در in vivo و in vitro شود، میانجامد که این امر قویاً از استفاده از AMH بهعنوان یک عامل پارنترال برای درمان سرطان تخمدان حمایت میکند.
سرطان گردن رحم
سرطان گردن رحم یکی از شایعترین تومورهای بدخیم در زنان است و میتواند بهشدت به سلامت و حیات زنان آسیب بزند. بخش اعظم سرطانهای گردن رحم بهوسیله عفونت HPV ایجاد میشوند. با توجه به اینکه اپیتلیوم گردن رحم و تخمدان، هر دو از مجرای مولرین منشأ میگیرند، تصور میشود که AMH میتواند علیه سلولهای سرطان گردن رحم نیز استفاده شود. برخی از سلولهای سرطان گردن رحم، گیرنده MIS (MISR II) را بیان میکنند که میتواند به AMH پاسخ دهد و منجر به مهار رشد شود. AMH میتواند تکثیر سلولهای سرطان گردن رحم مرتبط به HPV از جمله CaSki و SiHa و سلولهای سرطانی غیرمرتبط به HPV مانند C33A را سرکوب کرده و آپوپتوز را در آنها القا نماید، بهعلاوه Hwang و همکاران گزارش کردند که با ترسیم نقشه ژنتیکی بهوسیله سیستم طبقهبندی PANTHER (PANTHER Classification System) مشخص شد ۵۲ ژن از ۱۶۹۰ ژن تنظیمشده بهوسیله AMH، در مسیر سرطان و ۱۳ ژن در آپوپتوز نقش دارند، همچنین درمان بهوسیله MIS، بیان p16 و p17 را که مرتبط با توقف چرخه سلولی در سلولهای CaSki است، افزایش میدهد. اگرچه دادههایی که مکانیسم سرکوب سلولهای سرطان گردن رحم مرتبط با HPV را بررسی میکنند، محدود است اما این دادهها پیشنهاد میکنند که MIS ممکن است یک هدف درمانی مناسب برای سرطان گردن رحم ناشی از HPV16 باشد.
بهطور کلی، توضیحات بیشتری در مورد مکانیسم مولکولی موردنیاز است تا بتوان به آگاهی کامل در مورد تأثیر AMH بر روی سلولهای توموری دست یافت و مهم است که پژوهشهای تجربی بالینی را در کاربردهای بالینی به کار ببندیم.
دیگر تومورها
مطالعات پیشین نشان دادهاند که سلولها یا بافتهای سرطان اندومتریال، سرطان سینه و سرطان پروستات، گیرنده MIS/AMH نوع II را بیان میکنند و اتصال گیرنده نوع II به لیگاند خود یعنی AMH، منجر به مهار رشد سلولهای سرطانی میشود. Dogan و همکاران، سطوح AMH سرم را در بیماران مبتلا به کارسینوم اندومتریال (EC) که یکی از شایعترین انواع بدخیمی در سیستم تولیدمثلی زنان است و گروه کنترل ارزیابی کردند. نتایج نشان داد که سطوح AMH در بیماران مبتلا به کارسینوم اندومتریال با درگیری خارج رحمی، افزایش یافته است ولی تفاوت معنیدار دیگری در سطوح AMH و مرحله تومور، نوع بافتشناسی، تهاجم عمقی به میومتر، تهاجم به فضای لنفوواسکولار یا درگیری گرههای لنفی وجود نداشت، بهعلاوه رنگآمیزی مثبت علیه AMHR II در گروه بدخیم نسبت به گروه خوشخیم، بیشتر بود و میزان رنگآمیزی IHC علیه AMHR II با بدتر شدن وضعیت ضایعات، کاهش یافت. بیان گیرنده AMH نوع II در این سلولها یا بافتهای سرطانی و نقش AMH در مهار تکثیر سلولهای توموری ممکن است حمایتی از این نظریه باشد که AMH میتواند عامل مفیدی در درمان سرطانهای منشأ گرفته از مجرای مولرین با بیان گیرنده AMH باشد.
در پایان میتوان گفت AMH میتواند بهعنوان یک مارکر تشخیصی و همچنین یک عامل درمانی نویدبخش در درمان برخی سرطانها باشد (جدول ۱). پژوهشهای علمی بیشتر باید بر روی تشخیص بالینی و بهبود بخشیدن میزان موفقیت درمانها تمرکز کنند.
توسعه ایمونواسی
AMH دایمری است از دو زیرواحد مونومری یکسان با وزن مولکولی KDa ۱۷۰. هر زیرواحد مونومر دارای یک دومین انتهای C (که ناحیه بالغ نیز نامیده میشود) و یک دومین انتهای N (که ناحیه پرو نیز نامیده میشود) است. طی عبور و مرور سیتوپلاسمی، AMH در یک جایگاه مشخص شکسته میشود تا دو پلیپپتید ۵۸ کیلودالتونی (ناحیه پرو) و دو پلیپپتید ۱۲ کیلودالتونی ایجاد شود. گزارش شده است که AMH برای تحریک فعالیت دومین انتهای C، به دومین انتهای N نیاز دارد تا بتواند به فعالیت زیستی کامل خود دست یابد و توالی آمینواسیدی ناحیه بالغ، مسئول همولوژی AMH بین گونهها است. اندازهگیری سطوح AMH با استفاده از سنجش (الایزا) (Enzyme- linked Immunosorbent Assay, ELISA) برای اولین بار در سال ۱۹۹۰ گزارش شد و ارزیابی AMH تاکنون نیز در حال گسترش بوده است.
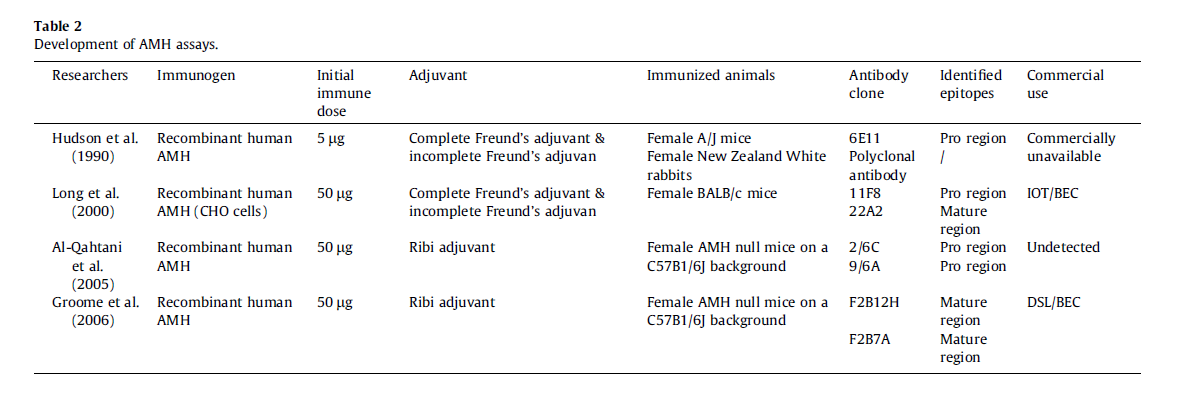
Cate و همکاران در سال ۱۹۸۶ ژن AMH انسانی را استخراج کرده و AMH انسانی نوترکیب را در سلولهای تخمدان همستر چینی (CHO) تولید کردند. Hudson و همکاران از پروتئین خالص AMH بهعنوان یک ایمونوژن استفاده کردند و به یک آنتیبادی منوکلونال به نام 6E11 بهدست آمده از موش ماده A/J که ناحیه pro در AMH را شناسایی میکرد و یک آنتیبادی پلیکلونال بهدستآمده از موشهای سفید نیوزیلند دست یافتند. این محققان از آنتیبادی منوکلونال 6E11 بهعنوان اولین آنتیبادی در سنجش الیزا استفاده کردند و مشاهده کردند که این آنتیبادی با تشخیص حداقل ng/mL 0/5، برای MIS موجود در سرم انسان اختصاصی و حساس است و نمیتواند فاکتور رشد ترانسفورمکننده β-1 یا β-2، LH یا FSH را تشخیص دهد، بهعلاوه Lee و همکاران از سنجش الیزای معرفیشده توسط Hudson و همکاران برای ارزیابی سطوح AMH در مردان و زنان استفاده کردند و یافتهها اثبات کردند که آنتیبادی استفادهشده در روش Hudson، ناحیه بالغ AMH را شناسایی نمیکند و اختصاصیت بالایی برای AMH انسانی پردازشنشده و کامل دارد. اگرچه این سنجش توسط Hudson و گروه تحقیقاتی او توسعه یافت اما هرگز گسترش تجاری پیدا نکرد.
به دلیل پایین بودن چشمگیر سطوح AMH در سرم زنان، نیاز جدی به ایجاد سنجش دقیقتری برای AMH وجود داشت. در سال ۲۰۰۰، Long و همکاران یک سنجش الایزای بسیار حساس را برای AMH سرم معرفی کردند. دو آنتیبادی منوکلونال استفادهشده در این سنجش، 11F8 و 22A2 بودند که با ایمنسازی موشهای ماده BALB/c علیه rhAMH تولیدشده در سلولهای تخمدان همستر چینی بهدست آمده بودند. آنتیبادیهای 11F8 و 22A2 به ترتیب قادر به شناسایی ناحیه pro و بالغ AMH انسانی هستند. این پژوهش از دو آنتیبادی منوکلونال استفاده کرد؛ یعنی: یک سنجش الایزای بسیار حساس با سیگنالهای پسزمینه (background signal) کمتر و حساسیت بالاتر برابر حداقل ng/mL 0/1 (pmol/L0/7) در سرم انسان و دیگری سنجش معمول که بهوسیله Hudson شکل گرفته بود و شامل یک آنتیبادی منوکلونال و یک آنتیبادی پلیکلونال با حساسیت pmol/L 3/6 میشد. این سنجش که بهعنوان سنجش IOT شناخته میشود، بهصورت تجاری از طریق Immunotech- Beckman Coulter در دسترس قرار گرفت.
پس از این خیلی زود، Groome و همکاران نیز یک جفت آنتیبادی منوکلونال، F2B12H و F2B7A را معرفی کردند که هر دو ناحیه بالغ را شناسایی میکردند. اندازهگیری با این روش، بهوسیله پروتئولیز AMH در نمونه تحت تأثیر قرار نمیگیرد و میتواند برای نمونههای زیستی مختلف مانند انسان، موش، رت و اسب، استفاده شود. در سنجش بسیار اختصاصی، آنتیبادی اول یعنی F2B12H بهعنوان آنتیبادی پذیرنده (capture) و آنتیبادی دوم، F2B7A بهعنوان آنتیبادی شناساییکننده مورد استفاده قرار گرفتند. این سنجش توسط Dignostic System Lab (DSL) بیشتر توسعه یافت. با گرفتـــــــــــــن حق مالکیت DSL توسط Immunotech- Beckman Coulter، یک سنجش جدید به نام سنجش Gen II Beckman Coulter شکل گرفت که برای IOT AMH ELISA کالیبره شده بود. با استفاده از همان آنتیبادیهای بهکاررفته در Gen II Beckman Coulter، دو سنجش کاملاً خودکار جدید به نامهای Elecsys AMH (Roche) و
Access AMH (Beckman Coulter) شکل گرفتند.
سنجش دیگری که در پژوهشهای مرتبط با AMH مورد استفاده قرار گرفت، از دو آنتیبادی منوکلونال تحت عنوان 2/6A و 9/6C بهره میبرد که هر دو ناحیه pro در AMH را با حد شناسایی ng/mL 0/078 شناسایی میکردند. با این وجود استانداردسازی بینالمللی برای سنجش AMH بهشدت موردنیاز است تا گزارش مقادیر AMH و به دنبال آن تفسیر بالینی آن، یکپارچه شود.
نتیجهگیری
AMH بهعنوان یک هورمون مرتبط به سیستم تولیدمثلی، همبستگی قوی با ارزیابی ذخیره تخمدانی، باروری تسهیل شده، PCOS و برخی از تومورهای ژنیکولوژیکال را نشان میدهد. از AMH میتوان نهتنها بهعنوان یک مارکر حساس بلکه بهعنوان یک عامل درمانی بالقوه علیه سلولهای سرطانی که گیرنده AMH را بیان میکنند، استفاده کرد. در حال حاضر بخش گستردهای از پژوهشها بر روی مکانیسم مولکولی نقش AMH تمرکز دارند و تلاشهای زیادی برای تبدیل این پژوهشها به ابزارهای تشخیصی یا درمانهای نوین برای بیماریها صورت گرفته است، بهعلاوه کیتهای شناسایی AMH بهصورت تجاری در دسترس میباشند و میتوانند بهطور مداوم نیاز به تعیین سطوح AMH را سریع و با حساسیت بالا برطرف سازند، اگرچه مطالعات بیشتری برای ایجاد یک استاندارد شناسایی یکپارچه و تعیین مقادیر مرجع AMH لازم است تا بتوان یک مرجع دقیق برای درمان و تشخیص بالینی فراهم آورد. ما باور داریم که با افزایش تحقیقات بنیادین بر روی کاربردهای بالینی AMH، شواهد بسیاری برای تقویت ارزش بالینی AMH بهدست خواهد آمد.
برگردان از:
Research progress on anti-mullerian hormone clinical applications and immunoassay development
Frontiers in Laboratory Medicine 2 (2018) 14–18:
سرطان تخمدان(در تب جدید مرورگر باز می شود )
سلولهای بنیادی تخمکساز تخمدان(در تب جدید مرورگر باز می شود )
غربالگری سرطان تخمدان(در تب جدید مرورگر باز می شود )
ورود / ثبت نام