نکات مهم کاربردی در میکروبشناسی بالینی
دکتر مریم متوسل دکتری تخصصی باکتریشناسی
استادیار دانشکده پیراپزشکی، دانشگاه علوم پزشکی شیراز
قسمت پنجم
دستگاه گوارش (Gastrointestinal Tract)
دستگاه گوارش زیستگاه طبیعی عده زیــــــــادی از باکتــــــــــــــریها شامل باسیلهای گرم منفی بیهوازی اختیاری (Enterobacteriaceae)، کوکسیهای گرم مثبت هوازی مانند انتروکوک و بـــــــــــــیهوازی مانند پپتواسترپتوکوک (Peptostreptococcus)، باسیلهای گرم منفی بیهوازی مانند گونههای باکتروئیدس (Bacteroides spp)، معدودی کلستریدیوم مانند کلستریدیوم دیفیسیله (Clostridium difficile) و قارچ (Candida albicans) است. هدف از کشت مدفوع، جداسازی باکتریهای پاتوژن است. باکتریهای بیماریزای دستگاه گوارش شامل شیگلا (Shigella)، سالمونلا (Salmonella)، یرسینیا انتروکولیتیکا (Yersinia enterocolitica)، ویبریو کلرا (Vibrio cholera)، ائروموناس هیدروفیلیا (Aeromonas hyrophilia)، پلزیوموناس شیگلوئیدس (Pelsiomonas shigelloides)، هلیکوباکتر پیلوری (Helicobacter pylori) و کمپیلوباکتر ژژونی (Campylobacter jejuni) هستند. سویههای انتروپاتوژن E. coli شامل ETEC، EPEC و DEAC اغلب سبب اسهال محدودشونده میشوند و بدون ایجاد مشکل جدی خاتمه مییابند، اما سویههای EHEC (Enteroheamorrhagic E. coli) و EIEC (Enteroinvasive E. coli) ابتدا با اسهال خونی تظاهر میکنند، اما پس از زمانی کوتاه خصوصاً در کودکان و افراد با بیماری زمینهای ممکن است در اثر آلودگی با E. coli O157: H7، سندرم اورمی همولیتیک (HUS) ایجاد شود. باکتریهای نامبرده، بیهوازی اختیاری هستند و در شرایط هوازی رشد میکنند، با این استثناء که هلیکوباکتر و کمپیلوباکتر میکروائروفیل هستند و برای رشد نیاز به اتمسفر میکروائروفیل دارند که این شرایط با استفاده از گاز پک میکروائروفیل (Microaerophilic Gas pack) در ظرف دربسته (Microaerophilic jar) فراهم میشود.
شناسایی باکتریهای بیماریزا در دستگاه گوارش بر اساس انجام تست اکسیداز و واکنشهای بیوشیمیایی بر محیط کشتهای تشخیصی است. بهطور استثناء، افراد بستری در بیمارستان که مکرراً آنتیبیوتیک دریافت نمودهاند، مبتلا به کولیت با غشای کاذب (Pseudomembranous colitis) میگردند که توسط کلستریدیوم دیفیسیله عارض میشود. تشخیص بیماری به کمک یافتههای پاتولوژیک صورت میگیرد و قطع مصرف آنتیبیوتیک باعث از بین رفتن علائم مذکور میگردد.
کشت مدفوع (Stool Culture)
زمان مناسب نمونهگیری و کشت مدفوع در زمان شروع گاستروانتریت و بروز اسهال و استفراغ است. نمونه در ظروف نفوذناپذیر جمعآوری و به آزمایشگاه منتقل میگردد. نمونه مورد آزمایش میتواند به فرم قوامدار، اسهال، سوآب مدفوع و رکتال سوآب باشد. سواب مدفوع در مواقعی تهیه میشود که مکان نمونهگیری از آزمایشگاه فاصله داشته باشد و رکتال سوآب عمدتاً برای انتقال اسهال مشکوک به شیگلا انجام میگردد. لازم است ظروف نمونهگیری از جنس پلاستیک، تمیز، خشک و یکبار مصرف باشند. برچسب نام بیمار و تاریخ نمونهگیری از ملزومات کنترل کیفی قبل از آزمایش (Pre-analytic Quality Control) است.
معیارهای رد نمونه
در شرایط زیر، نمونههای ارسالی به آزمایشگاه مردود اعلام شده و از انجام کشت جلوگیری به عمل میآید.
- نمونه مخلوط شده با ادرار، صابون یا مواد ضدعفونیکننده
- نمونه فیکس شده در فرمالین
- نمونه خشکشده
- نمونه منتقله در ظرف نشت کننده
نکته:
- انتقال نمونه از نقاط دوردست به آزمایشگاه باید در جعبه سرد دوجداره (Cold box) صورت گیرد. جداره اول نفوذناپذیر و جداره دوم به نحوی باشد که از شکستن لولهها جلوگیری نماید.
- گرچه کشت مدفوع در موارد مشکوک به حصبه و شبه حصبه ضروریست، اما انجام 3 کشت خون طی 48 ساعت توصیه میگردد و در این موارد باید دقت شود که خونگیری در زمان اوج تب و لرز انجام شود.
- شایعترین عوامل حصبه و شبه حصبه، سالمونلا تایفی ( thypi)، سالمونلا کلراسوئیس
(S. choleraesuis) و سالمونلا انترایتیدیس (S. enteritidis) هستند. کشت مدفوع از زمان بروز علائم بالینی و کشت خون از هفته دوم بیماری مثبت میشود.
محیطهای مورد لزوم برای کشت مدفوع
در صورتی که انتقال نمونه مدفوع به آزمایشگاه نیاز به صرف زمان داشته باشد، از محیط کشت انتقالی (Transport medium) استفاده میگردد. رایجترین محیطهای کشت انتقالی، کاری بلر (Cary Blair)، ایمیس (Amies) و استوارت (Stuart) هستند. محیط کاری بلر جهت نگهداری و انتقال کلیه باکتریهای رودهای خصوصاً ویبریو کلرا و محیط ایمیس عمدتاً جهت انتقال شیگلا بکارمیروند. محیط استوارت نیز کاربرد عمومی دارد و در مرتبه آخر قرار دارد. جداسازی باکتریهای پاتوژن از مدفوع طی دو مرحله صورت میگیرد؛ مرحله اول شامل کشت روی محیطهای انتخابی افتراقی EMB آگار و XLD آگار است که پس از 24 ساعت انکوباسیون در 37 درجه سانتیگراد، کلنیهای غیر تخمیرکننده لاکتوز (N.L.F) قابل شناسایی هستند. در مرحله دوم که همزمان با مرحله اول انجام میشود یک گرم مدفوع (به اندازه دانه فندق) در محیطهای کشت غنیکننده (Enrichment medium) مانند آبگوشت جی ان(GN broth) و آبگوشت سلنیت اف (Selenite F broth) کشت داده شده و به مدت 12-6 ساعت در 37 درجه سانتیگراد گرماگذاری مینمایند. پس از گذشت این زمان، بخش فوقانی آبگوشت را به کمک لوپ یا پیپت پاستور استریل برداشت نموده و مجدداً روی محیطهای EMB آگار و XLD آگار کشت و انکوبه مینمایند. کشت اخیر صرفاً جهت غنیسازی نمونه و به منظور صحت و دقت در جداسازی سالمونلا و شیگلا انجام میشود و در واقع نقش حمایتی دارد.
در مواقع اپیدمیهای سالمونلایی توصیه میشود کشت مدفوع روی محیطهای بیسموت سولفیت آگار (Bismuth Sulfite Agar) و هکتون انتریک آگار (Hektoen Enteric Agar) نیز انجام گردد. انواع سروتایپهای سالمونلا بهجز سالمونلا پاراتیفی A، تولید سولفید هیدروژن (H2S) مینمایند و روی محیط کشتهای ایکس ال دی آگار و هکتون انتریک آگار دارای مرکز سیاه هستند.
آمادهسازی و کشت مدفوع (Stool culture preparation)
اولین قدم در انجام آزمایش کشت مدفوع، جمعآوری نمونه به طرز صحیح است، لذا الزامی است مدفوع بهصورت تازه تهیه شده و در ظروف غیر قابل نفوذ جمعآوری گردد. در صورتی که نمونه مدفوع، قوامدار باشد مقدار مورد لزوم جهت کشت بر روی هر کدام از محیطهای کشت، یک گرم بوده و از نواحی خونی و بلغمی برداشت میگردد. چنانچه نمونه به صورت اسهالی و مایع باشد حجم 5 میلیلیتر کفایت مینماید. در مواقعی که محل نمونهگیری از آزمایشگاه فاصله داشته باشد، بهتر است به کمک سواب استریل از نواحی خونی، بلغمی و موکوئیدی مدفوع، نمونه گرفته شده و در محیط انتقالی به آزمایشگاه ارسال گردد. این نمونهگیری به سوآب مدفوع معروف است. گاهی اوقات به دلیل دوری مسافت و جلوگیری از خشکی نمونه و کشته شدن عوامل بیماریزا، توصیه میشود محیط انتقالی را پس از کشت، در جعبههای سرد (Cold box) قرار داده سپس اقدام به ارسال نمونه نمایند. در شرایطی مانند دشواری دفع نمونه توسط بیمار یا مشکوک بودن به عفونت شیگلایی، نمونهگیری به روش رکتال سواب توصیه میگردد. برای این منظور ابتدا سوآب را در سرم فیزیولوژی استریل مرطوب نموده، سپس از ناحیه 4/5-3/5 سانتیمتری اسفنکتر بیمار، با حرکت چرخشی، نمونهبرداری شده، به محیط ترانسپورت مناسب تلقیح و به آزمایشگاه ارسال میگردد.
تذکر:
چنانچه ذکر شد، جهت کشت مدفوع ابتدا مقدار مشخص نمونه را به محیطهای کشت غنیکننده GN broth یا SF broth منتقل نموده، GN broth را به مدت 6 ساعت و SF broth را به مدت 12-8 ساعت در 37 درجه سانتیگراد انکوبه مینمایند. به موازات غنیسازی نمونه، مقدار مورد لزوم مدفوع را بر روی محیـــــطهای EMB آگار و XLD آگار منتقل نموده، بهصورت چند مرحلهای (Streaking) کشت مینمایند و به مدت 24 ساعت گرماگذاری میکنند. جهت اطمینان از جداسازی عوامل پاتوژن، لازم است از محیطهای کشت غنیکننده، کشت مجدد (Subculture) به عمل آید. برای این منظور، پس از سپری شدن دوره انکوباسیون محیطهای مذکور، سطح رویی آبگوشت کشتشده را با کمک لوپ استریل، جمعآوری نموده، بهطور جداگانه روی محیطهایEMB آگار وXLD آگار بهصورت چند مرحلهای کشت مینمایند. اهمیت محیطهای کشت غنیکننده در جلوگیری از رشد باکتریهای فلور نرمال و مهیا نمودن شرایط مناسب برای رشد سالمونلا و شیگلا است. پس از گذشت زمان 12-6 ساعت از انکوباسیون، اثر ممانعت کنندگی محیطهای غنیکننده از بین رفته و مجدداً فلور نرمال رشد مینماید، لذا رعایت زمان انکوباسیون در کارآمدی محیطهای کشت غنیکننده برای کشت مجدد (Subculture)، بسیار حائز اهمیت است.
تخمیر لاکتوز توسط باکتریها
باکتریهای غیر تخمیرکننده لاکتوز یا N.L.F (Non- Lactose Fermenter) عمدتاً پاتوژنهای واقعی دستگاه گوارش محسوب میشوند. سالمونلا، شیگلا، یرسینیا انتروکولیتیکا، ائروموناس و پلزیوموناس مثالهای این دسته از باکتریها هستند. پاتوتایپهایE. coli مانند EHEC (Enterohemorrhagic E. coli) و EIEC (Enteroinvasive E. coli) لاکتوز را بهطور تأخیری تخمیر (Late lactose fermenter) مینمایند، اسهال (معمولاً خونی) و استفراغ ایجاد میکنند که پس از یک یا دو روز برطرف میشوند، اما پس از آن، درگیری گیرندههای GM1 دستگاه ادراری پیش میآید و نهایتاً منجر به سندروم اورمی همولیتیک (H.U.S) میگردد.
لازم به ذکر است باکتریهای فلور نرمال عمدتاً تخمیرکننده لاکتوز هستند و نشان داده شده است در مواردی هم که از گاستروانتریت جداسازی شوند، ارتباط معناداری با بیماری ندارند.
تشخیص اولیه باکتریهای غیر تخمیرکننده لاکتوز (N.L.F)، مشاهده رشد کلنیهای بیرنگ (Colorless) بر روی محیطهای قندی EMB آگار، XLD آگار (Xylose Lysine Deoxycholate Agar) و هکتون انتریک آگار (Hekton Enteric Agar) است. در نمونه مدفوع، رشد تنها یک کلنی باکتری N.L.F، میتواند نشانه عفونت دستگاه گوارش باشد.
تذکر:
- محیط کشت EMB آگار قابلیت شناسایی باکتریهای L.F از L.F را بهخوبی داراست.
- محیط کشت XLD آگار و هکتون انتریک آگار علاوه بر تشخیص باکتریهای تخمیرکننده لاکتوز (F) از غیر تخمیرکننده لاکتوز (N.L.F)، میتوانند باکتریهای مولد H2S را نیز با کمک معرفهای تیوسولفات سدیم (Sodium thiosulfate) و سولفات فرو (Ferrous sulfate) موجود در محیط، شناسایی نمایند.
- فنل رد (Phenol red) در محیط کشت XLD آگار و سبز درخشان (Brilliant green) و فوشین بازی (Basic fuchsin) در هکتون انتریک آگار، به عنوان معرف PH عمل مینمایند.
باکتریهای N.L.F، در تمام محیطهای قندی، کلنیهای بیرنگ ایجاد مینمایند. خواه معرف، فنل رد باشد که با صورتی کمرنگ مشخص میشود، خواه ائوزین باشد (مانند EMB آگار) که با رنگ بنفش بسیار کمرنگ مشاهده میشود و خواه برلیان گرین و فوشین بازی باشد که با رنگ سبز کمرنگ مشخص میشوند.
الف
ب
ج
تصویر 1- مقایسه کلنیهای غیر تخمیرکننده بر روی محیطهای قندی
الف: هکتون انتریک آگار، ب: XLD آگار، ج: EMB آگار
الف ب ج
د و
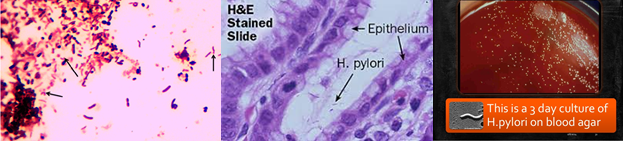
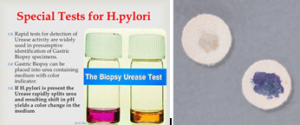
تصویر 2- تستهای شناسایی هلیکوباکتر پیلوری
الف: مورفولوژی میکروسکوپی در رنگآمیزی گرم، ب: مورفولوژی میکروسکوپی در رنگآمیزی هماتوکسیلین، ج: کلنی رشد کرده در شرایط میکروائروفیلیک، د: تست اورهآز سریع و: اکسیداز مثبت
ویبریو کلرا عامل دیگر گاستروانتریت است و ایجاد اسهال آب برنجی (rice water) مینماید. نمونه مشکوک توسط در محیط کاری بلر انتقال داده میشود. برای غنیسازی ویبریو کلرا از محیط قلیایی آب پپتونه استفاده میگردد. به منظور جداسازی ویبریو کلرا از محیط کشت اختصاصی تیوسولفات سیترات بایل سالت سوکروز آگار (TCBS) استفاده میشود. باکتری مذکور، تخمیرکننده سوکروز است و سبب تغییر رنگ معرف برم تیمول بلو موجود در محیط کشت به رنگ زرد شده و کلنیهای زرد رنگ بوجود میآورد.
الف ب
ج د
تصویر 3– تستهای شناسایی ویبریو کلرا، الف: باسیلهای خمیده گرم منفی، ب: کلنیهای واجد همولیزبتا، ج: کلنیهای زرد رنگ ویبریو کلرا بر محیط
TCBS (Thiosulfate citrate bile salt sucrose agar)،
د: اکسیداز مثبت
نکات مهم کاربردی در میکروبشناسی بالینی (1)
نکات مهم در دستورالعمل نمونه گیری و حمل نمونه گازهای خونی (بلاد گاز) ABG
اصول و روشهای نشان دادن قارچها در نمونههای کلینیکی (8)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام