پایش آزمایشگاهی مقاومت دارویی به داروهای رایج ضدلختگی
در بیماران قلبی و عروقی
قسمت اول
دکتر حبیبالله گلافشان عضو هیئت علمی دانشگاه علوم پزشکی شیراز
داروهای ضدلختگی در جلوگیری از بروز حوادث حاد قلبی عروقی و جلوگیری از ترومبوز استنت نقش عمده دارند؛ از آنجایی که مقاومت دارویی با این گروه از داروهای حیاتی با عود مکرر و حوادث مرگآور قلبی همراه هستند، ازاینرو پایش آزمایشگاهی مقاومت دارویی و پیگیری سطح دارویی در این گروه از بیماران بسیار حائز اهمیت است.
آسپرین:
آسپرین با بیش از یک قرن سابقه بهعنوان داروی ضد عملکرد پلاکتی و ضدالتهاب هنوز دارای کاربردی وسیع برای بیمارهای قلبی و عروقی و پیشگیری از بروز حوادث قلبی و عروقی است.
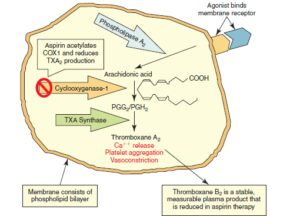
آسپرین بهطور نسبتاً انتخابی آنزیم سیکلواکسیژناز شماره یک (COX1) که بهطور غالب در پلاکتها وجود دارد را بهطور غیرقابل بازگشت استیله کرده و آن را ناکارآمد میکند. فرایند ناکارآمد شدن COX1 با توقف تولید ترومبوکسان A2 و اختلال در تولید پروستاگلاندینها است. ترومبوکسان A2 متابولیتی قوی جهت انقباض عروقی و فعال کردن پلاکتها است. ترومبوکسان A2 با فعال کردن گیرنده IIb/IIIa در سطح پلاکتها منجر به چسبیدن پلاکتها به یکدیگر میشود.
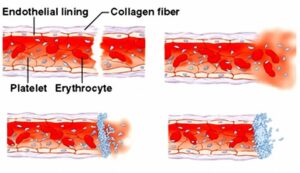
پلاکتها در روند طبیعی انعقاد با چسبیدن به رشتههای کلاژن از طریق گلیکوپروتئین Ib/IX و چسبیدن به یکدیگر از طریق گلیکوپروتئین IIb/IIIa خونریزی را متوقف میکنند. تداخل دارویی در عملکرد پلاکتها موجب جلوگیری از تشکیل ترومبوس پلاکتی در افراد مستعد به لختگی خون میگردد
دوزاژ کم آسپرین روی آنزیم COX-2 که در بافتهای بدن در پاسخ به پروسههای التهابی بیان میشود دارای اثرات ناچیز است و ازاینرو میتوان با دوزاژ کم آسپرین (81 میلیگرم در روز) آثار ضدپلاکتی آن را ظاهر ساخت، در حالی که برای فروکش کردن پروسههای التهابی به دوزاژ بالاتر برای بازدارندگی آنزیمCOX-2 نیاز است.
آسپرین با استیله کردن آنزیم سیکلواکسیژناز شماره یک از تولید ترومبوکسان A2 که یک محرک قوی برای فعالیت پلاکت است جلوگیری میکند. ترومبوکسان A2 با افزایش کلسیم سیتوپلاسمی موجب انقباض عروقی شده و با فعال کردن گلیکوپروتئین IIb/IIIa موجب بههم چسبیدن پلاکتها میگــردد. ترومبوکسان A2 در فرایند متابولیسم به ترومبوکسان B2 (11 dehydrothromboxane B2) تبدیل میگردد که از ادرار دفع میشود. انتظار میرود که مصرف آسپرین با کاهش سطح ادراری ماده فوق همراه باشد، در غیراینصورت امکان مقاومت به آسپرین وجود دارد.
آسپرین از قسمت فوقانی دستگاه گوارش بهسرعت جذب و اوج غلظت پلاسمایی آن در 20-15 دقیقه مشاهده گردیده و در 40 تا 60 دقیقه پلاکتها را برای تمام طول عمر خود ناکارآمد میکند.
علیرغم پاکسازی سریع آسپرین از پلاسما (نیمهعمر 20 دقیقه) ناکارآمد شدن پلاکت برای تمام طول عمر پلاکت (2±7 روز) به علت استیله شدن غیرقابلبرگشت COX1 ادامه دارد.
با توجه به اینکه 10 درصد از پلاکتهای در گردش خون هر 24 ساعت توسط مغز استخوان جایگزین میگردند، ازاینرو فعالیت پلاکتی برای هموستاز اولیه کافی بوده و پس از 6-5 روز از آخرین دوزاژ مصرفی آسپرین هموستاز اولیه به بیش از 50 درصد فعالیت میرسد.
آسپرین در پیشگیری از حوادث قلبی و عروقی و نیز جلوگیری از عود مجدد حوادث قلبی نقش مهمی دارد. رویهمرفته کاهش 30 درصدی در سکته غیرکشنده قلبی و مغزی و کاهش 25 درصدی عوارض عروقی از مزایای آسپرین است، علیرغم اینکه میل به خونریزی گوارش که در پارهای از موارد به تزریق خون نیاز میشود، از عوارض آن است. آنالیز دادهها نشان داده است که دوزاژ روزانه 75 تا 150 میلیگرم آسپرین در روز بیشترین کاهش حوادث عروقی (32%) را نسبت به دوزاژهای دیگر دارد.
درمان با 325 میلیگرم آسپرین قبل از پروسیجرهای PCI (آنژیوگرافی، بالون، کاشت استنت) و 81 تا 325 میلیگرم روزانه بعد از PCI بسیاری از عوارض نامطلوب فعال شدن پلاکتی از قبیل ایجاد ترومبوآمبولی و انتشار آتروآمبولی را کاهش داده است. برای بیمارانی که تحمل آسپرین ندارند،600 میلیگرم پلاویکس بهصورت اولیه و سپس 75 میلیگرم روزانه سفارش شده است.
پاسخ به آسپرین:
پاسخ به آسپرین در جلوگیری از تجمع پلاکتی در افراد یکسان نبوده و مطالعات، گسترهی 5 تا 60 درصدی مقاومت به آسپرین با توجه به روشهای مختلف آزمایش در جمعیت را نشان داده است. گفتنی است که مقاومت اکتسابی به آسپرین در تجویز همزمان ایبوپروفن (Ibuprofen) و در بیماریهای حاد مشاهده شده است. قانعکنندهترین موضوع در رابطه با مقاومت به آسپرین پلیمرفیسمهای ژن ITGB3 است که گلیکوپروتئین IIIa یا آنتیژن PLA را روی سطح پلاکتها رمزدهی میکند. گلیکوپروتئین IIIa نقش مهمی در چسبیدن پلاکتها به یکدیگر و اتصال آنها به فاکتور فونویلبراند دارد. وراثت آنتیژن پلاکتی PLA2 با افزایش مقاومت به آسپرین و افزایش خطر سکته و حوادث عروقی و مغزی و ترومبوز شریان و سیاهرگ نسبت به وراثت آنتیژن پلاکتی PLA1 همراه است. تعیین مقاومت به آسپرین با آزمایشهای گوناگون نتایج یکسانی را نشان نداده است.
گفتنی است که با فعال شدن گلیکوپروتئین IIb/IIIa در سطح پلاکت، مولکول فیبرینوژن مانند پلی، گیرندههای IIb/IIIa را بهم وصل کرده و عمل تجمعی پلاکتها صورت میگیرد. پلیمرفیسم گلیکوپروتئین IIIa تولید آنتیژنهای A1 و A2 را در سطح پلاکتها میکند. ژنوتیپهای A1/A1 حساس به آسپرین و ژنوتیپهای A1/A2 و A2/A2 به ترتیب مقاوم و مقاومتر میباشند.
ژنوتیپهای هموزیگوت A2 (A2/A2) با ترومبوز استنت در عروق کرونر همراه بوده است. در یک مطالعه برای تعیین مقاومت به آسپرین از 201 بیمار قلبی که تنگی عروق کرونر با تست ورزش و آنژیوگرافی تأیید و حداقل برای یک ماه روزانه 81mg آسپرین تجویز شده بود، نمونهگیری از خون و ادرار برای تعیــــــــین مقاومـــت یا حســــــــاسیت به آسپرین انجام شد. (European heart journal 2007, 28, 1702-1708)
در گروه مطالعه، بیمارانی که از داروهای بازدارنده پلاکتی دیگر از قبیل پلاویکس، تیکلوپیدین و دایپیرادامول مصرف میکردند و یا اینکه روی درمان وارفارین یا داروی ضدالتهاب غیراستروئیدی بودند، کنار گذاشته شدند. طیف شمارش پلاکت در گروه مطالعه بین 100 تا 450 هزار در میلیمترمکعب بوده است.
برای تعیین حساسیت یا مقاومت به آسپرین 6 تست زیر انتخاب گردید:
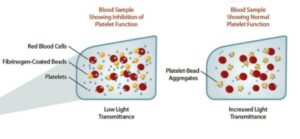
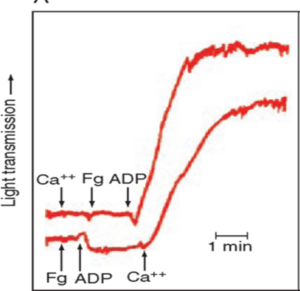
1- آزمایش تجمع پلاکتی (Light Transmission aggregometry) با محرک آراشیدونیک اسید
در این روش پلاسمای سرشار از پلاکت بیــــــــــمار با شمارش پلاکت (109/lit×250-450) با 1.6Mm (0.5mg/ml) از اسید آراشیدونیک (AA)در دستگاه تجمعسنج پلاکتی مورد مطالعه قرار گرفت و افرادی که علیرغم مصرف آسپرین بهطور روزانه دارای بقایای پلاکتی با تجمع 20≤ درصد بودند بهعنوان مقاوم به آسپرین درنظر گرفته شدند.
آزمایش تجمع پلاکتی با آراشیدونیک اسید، استاندارد طلایی برای تعیین مقاومت به آسپرین است. آزمایش تجمعی پلاکت با محرک ADP در غلظتهای 5 و 10 و 20 میکرومول نیز انجام گرفت و بیمارانی که دارای بقایای پلاکتی با تجمع 70≤ درصد بودند نیز بهعنوان مقاوم به آسپرین قلمداد گردیدند. میزان تجمع پلاکتی با سنجش ترانسمیتانس انجام میگیرد.
2- آزمایش تجمع پلاکتی در خون کامل (whole blood aggrgometry)
در این آزمایش محرک آراشیدونیک اسید در غلظت 1.6Mm به خون کامل که در آن بین دو الکترود جریان برقرار است اضافه میشود؛ تجمع پلاکت بر روی الکترودها موجب افزایش مقاومت بین جریان دو الکترود میگردد. برخی از مطالعات افزایش مقاومت Ω0 < را بهعنوان مقاومت به آسپرین در نظر گرفتهاند ولی در این مطالعه آستانه بیشتر از Ω3 در نظر گرفته شده است.
3- آنالیز کارآیی پلاکت با آنالیزور PFA-100
در این روش خون بیمار با فشار از یک سوراخ میکروسکوپی که اطراف آن با کلاژن و اپینفرین آغشته شده است، عبور داده شده و زمان لازم جهت بسته شدن سوراخ (closure time) که مربوط به تجمع پلاکتی در اطراف سوراخ است اندازهگیری میشود. چنانچه زمان انسداد نرمال باشد (کمتر از 193 ثانیه) بهعنوان مقاومت به آسپرین در نظر گرفته میشود.
آنالیزور PFA100 عملکرد پلاکت را شبیه به آزمایش زمان سیلان ارزیابی میکند. عبور جریان خون از سوراخ کوچک آغشته به محرکهای پلاکتی مانند کلاژن و اپینفرین موجب چسبندگی و تجمع پلاکتها و انسداد سوراخ میگردد که بهصورت زمان انسداد گزارش میشود
4- Verify Now Aspirin
در این روش خون بیمار به ظرف مخصوص که حاوی مهرههای آغشته به فیبرینوژن و محرک آراشیدونیک اسید است اضافه میشود. با تجمع پلاکت روی مهرهها میزان کدورت با سنـــــجش ترانسمیتانس در واحد (Aspirin reaction unit)ARU گزارش میگردد. نتایج 550ARU≤ که همراه با عوارض قلبی و عروقی علیرغم مصرف آسپرین است، بهعنوان مقاومت به آسپرین درنظر گرفته میشود.
در سنجش verify now aspirin تجمع پلاکتها بر روی مهرههای شیشهای آغشته به فیبرینوژن در حضور محرک آراشیدونیک اسید گزارش میشود. تجمع پلاکتها موجب صاف شدن سوسپانسیون پلاکتی و افزایش ترانسمیتانس میگردد. در سنجش verify now p2Y12 که برای سنجش مقاومت به داروی پلاویکس صورت میگیرد میزان تجمع پلاکتها بر روی مهرههای شیشهای آغشته به فیبرینوژن در حضور محرک ADP ارزیابی میشود که با واحد PRU گزارش میگردد
5- سنجش میزان (dTxB2)11-dehydro-thromboxane B2 در ادرار
آسپرین با استیله کردن آنزیم COX1 از تولید ترومبوکسان A2 (TXA2) جلوگیری میکند، یکی از متابولیتهای ترومبوکسان A2، یازده دیهیدرو ترومبوکسان B2است که انتظار کاهش سطح ادراری آن در افراد حساس به آسپرین است. برای اندازهگیری این متابولیت ادراری از کیت dTxB2 EIA استفاده میشود و بر اساس ng/mmol creatinine گزارش میگردد. سطح ادراری ng/mmol67/9 ≤ بهعنوان مقاومت به آسپرین در نظر گرفته میشود.
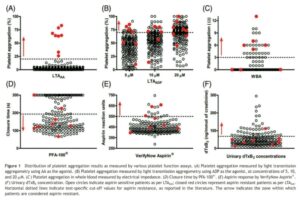
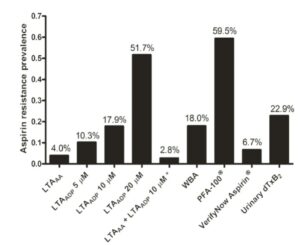
درپایش فوق از 6 آزمایش برای شناسایی مقاومت به آسپیرین در بیمارانی که درمان پایدار با آسپرین داشتهاند، استفاده شده است. گراف A آزمایش تجمع پلاکتی با محرک آراشیدونیک اسید (AA) که استاندارد طلایی جهت تعیین مقاومت به آسپرین است را نشان میدهد. آستانه تجمع پلاکتی بیشتر از 20 درصد بهعنوان مقاومت در نظر گرفته شده است و دایرههای قرمز بیانگر بیمارانی است که با این آزمایش به آسپیرین مقاومند (حدود 4 درصد)
گراف B آزمایش تجمع پلاکتی با محرک ADP در سه غلظت 5 و 10 و 20 میکرومول را نشان میدهد. تجمع پلاکتی بیشتر از 70 درصد آستانه مقاومت به آسپرین در نظر گرفته شده است که به ترتیب 10 و 17 و 51 درصد از بیماران مقاوم بودهاند. دایرههای مشکی و قرمز افراد مطالعه را نشان میدهد و جالب اینکه برخی از بیماران که با آزمایش تجمعی با محرک آراشیدونیک اسید مقاوم به آسپرین بودهاند (دایرههای قرمز) با محرک ADP برخی مقاوم و برخی حساس بودهاند.
گراف C آزمایش تجمعی پلاکت با نمونه خون کامل به روش تجمع سنجی امپدانس بین دو الکترود را نشان میدهد. تجمع پلاکت روی الکترودها از شدت جریان کاسته و آستانه بیش از سه اهم.(3Ω) بهعنوان مقاومت به آسپرین در نظر گرفته میشود. در این روش 18 درصد از افراد مقاوم. بودهاند.
گراف D مقاومت به آسپرین از طریق سنجش عملکرد پلاکت با آنالیزور PFA100 را نشان میدهد. در این آنالیزور خون سیتراته بیمار از سوراخ ریزی که به کلاژن و اپینفرین آغشته شده است، عبور داده شده و زمان انسداد بیش از 200 ثانیه بهعنوان مقاومت به آسپرین در نظر گرفته شده است که آمار حدود 59 درصدی دارد.
گراف E میزان مقاومت به آسپرین با روش verify now aspirin که با محرک آراشیدونیک اسید انجام شده است و با آستانه بیشتر از 550 واحد ARU حدود 6/7 درصد مقاومت به آسپرین را نشان داده است.
گراف F میزان مقاومت به آسپرین از طریق اندازهگیری متابولیت ادراری 11 دی هیدروترومبوکسان A2 انجام شده که آماری حدود22/9 درصد را نشان میدهد.
بررسی نتایج:
از 201 شرکتکننده در گروه مطالعه، 155 نفر مذکر در گروه سنی 10/4± 66/5 سال با مصرف حداقل 81 میلیگرم آسپرین بهصورت روزانه بودند. آزمایش تجمع پلاکتی با اسید آراشیدونیک که استاندارد طلایی برای تعیین حساسیت یا مقاومت به آسپرین است، 8 نفر (4 درصد) را مقاوم به آسپیرین نشان داده است، در حالی که میزان مقاومت به آسپرین با توجه به تستهای دیگر طبق هیستوگرام زیر متفاوت است، برای مثال با سنجش میزان ادراری dTXB2 حدود 22/9 درصد به آسپرین مقاوم بودهاند. گفتنی است که 8 بیمار (دایرههای قرمز) که با آزمایش LTAA (تست تجمعی با آراشیدونیک اسید) به آسپرین مقاوم بودند در آزمایشهای دیگر مقاوم یا حساس بودند.
با توجه به آزمایشهای فوق و آمار بیمارانی که در آزمایشهای مختلف، حساس یا مقاوم به آسپرین بودهاند نمیتوان به نتایج یکنواختی دست یافت. بهنظر میرسد که تست تجمعی پلاسمای سرشار از پلاکت با محرک آراشیدونیک اسید (AA) که مستقیماً آنزیم COX غیرفعال شده را با آسپرین هدف قرار میدهد و نیز آزمایش تجمع پلاکتها با دوزاژ کم ADP در تعیین افراد مقاوم به آسپرین از ارزش بیشتری برخوردار باشد.
آمار مقاومت به آسپرین با آزمایشهای مختلف
داروهای مسدودکننده گیرنده پلاکتی P2Y12 مانند پلاویکس
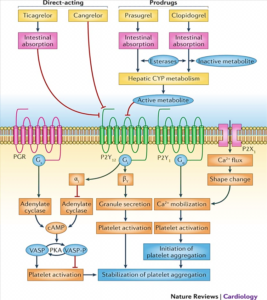
داروهای بازدارنده فعالیت پلاکت سنگبنای درمان برای بیمارانی است که عروق کرونر آنها با آنژیوگرافی بازگشایی (PCI) شده است. داروهای نسل اول و دوم خانواده Thienpyridine از قبیل تیکلوپیدین و پلاویکس (Clopidogrel) با مسدود کردن گیرنده P2Y12 (گیرنده پورینرژیک) در سطح پلاکت مانع از تجمع پلاکتی میگردند و نقش مهمی در پیشگیری از ترومبوز استنت (Stent thrombosis) و سکته قلبی دارند.
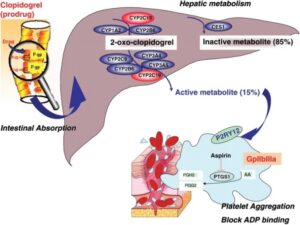
داروی پلاویکس یک پیشدارو است که توسط آنزیم سیتوکروم کبدی به فرم فعال تبدیل میشود. در یک دوز خوراکی پلاویکس 85 درصد آن غیرفعال و تنها 15 درصد آن به فرم فعال با خاصیت ضدپلاکتی تبدیل میشود
یکی از محرکهای قوی در فعالسازی گیرندههایIIb/IIIa برای چسبیدن پلاکتها به یکدیگر محرک آدنوزین دیفسفات (ADP) است که با اتصال به گیرنده P2Y12 نقش خود را ایفا میکند. پلاویکس با اتصال به گیرنده P2Y12 و با ایجاد تغییرات در Amp حلقوی (CAmp) و فسفریله کردن پروتئین VASP از فعال شدن گیرندههای IIb/IIIa جلوگیری میکند و در نتیجه تجمع پلاکتی صورت نمیگیرد. گفتنی است که پاسخ افراد به پلاویکس یکسان نبوده و ممکن است برخی از بیماران مقاوم به دارو باشند. شناسایی این دسته از بیماران و تجویز داروهای جایگزین نقش اساسی در پیشگیری از ترومبوز و عود سکته دارد. پلاویکس (Clopidogrel) و پراسوگرل (prasugrel) از خانواده تاینوپیریدین (Thienpyridine) و بازدارنده فعالیت پلاکتی میباشند. پلاویکس با اتصال به گیرنده پورینرژیک (P2Y12) از پیوند محرک ADP به این گیرنده جلوگیری میکند. پلاویکس یک پیشدارو (Pro drug) است که قسمتی از آن در کبد به فرم فعال با نیمعمر 2/3±7/7 ساعت تبدیل میگردد. برای دستیابی به بازدارندگی سریع پلاکتها در پروسه انعقاد میتوان به بیمار با تجویز 300mg≤ بهصورت (preload) و سپـس روزانه با دوزاژ mg 75 از دارو در مدت 3 تا 7 روز به میزان یکنواخت بازدارندگی رسید.
در بیماران مستعد به سکته قلبی یا سکته مغزی و بیماران عروقی که روی درمان با پلاویکس (75 میلیگرم روزانه) هستند، شانس سالانه ابتلا به سکته 5/32% در مقابل 5/83% با درمان آسپرین (325 میلیگرم در روز) میباشد. تقریباً حدود یک نفر از 1000 نفر که با پلاویکس درمان میشود مبتلا به نوتروپنی (کمتر از 1200 در میلیمتر مکعب) گردیده و 11 مورد در 3 میلیون احتمال ابتلا به TTP(ترومبوتیک ترومبوسیتوپنی) وجود دارد.
پلاویکس با مهار فعالیت پلاکتی برای جلوگیری از ترومبوز استنت (Stent thrombosis) و جلوگیری از عودهای مکرر حملات ایسکمیک کاربرد دارد. بسیاری بر این باورند پس از کاشت استنت (Stent) در عروق کرونر نیاز دائم به آسپرین و تجویز پلاویکس برای حداقل یک سال است.
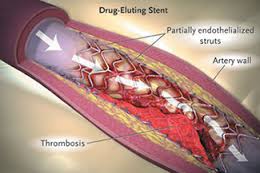
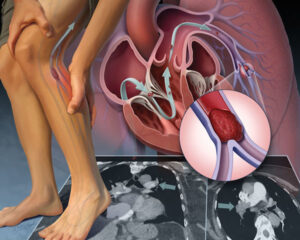
شکل فوق کاشت استنت در عروق مسدودشده کرونر و ترومبوز استنت را نشان میدهد
با توجه به اینکه در گروهی از بیماران مقاومت به پلاویکس مشاهده میگردد و ممکن است عوارض ناگواری از قبیل ترومبوز استنت به دنبال داشته باشد، ازاینرو منطقی است که شیوه پاسخ بیمار به پلاویکس موردمطالعه قرار گیرد.
گفتنی است که پلیمرفیسم ژن ABCB1 در جذب رودهای پلاویکس و پلیمرفیسمهای ژن سایتوکروم CYP450 در تبدیل پیشدارو به فرم فعال دخالت دارند.
تداخل دارویی بهویژه تجویز همزمان پلاویکس با داروهای بازدارنده پمپ پروتونی بهویژه امپرازول (Omeprazole)، استاتینها و مسدودکنندههای کانال کلسیم مانند وراپامیل که از طریق CYP2C19 و CYP 3A4 متابولیزه میگردند، موجب بیپاسخی یا کمپاسخی به درمان پلاویکس میشوند.
برای ارزیابی پاسخ یا بیپاسخی به درمان پلاویکس پایشهای آزمایشگاهی زیر ارائه شده است:
1- سنجش تجمع پلاکت به محرک ADP از طریق گیرندههای P2Y1 و P2Y12
با افزودن ADP با غلظتهای 5 و 10 و 20 میکرومول در لیتر به پلاسمای سرشار از پلاکت، انتظار کاهش تجمع پلاکتی با مصرف پلاویکس است. در دستگاههایی که با اندازهگیری ترانسمیتانس (T) تجمع پلاکتی مورد سنجش قرار میگیرد، اشلبندی آستانه برای تعریف افزایش فعالیت پلاکتی با تجویز پلاویکس، بازدارندگی کمتر از 20% یا تحریک تجمع بیشتر از 50% قرار داده میشود.
2- بررسی استحکام لخته فیبرینی– پلاکتی با روش ترومبوالاستوگرافی
(Thrombo elastography)
3- آزمایش Verify now P2Y12:
در این آزمایش تجمع پلاکتها بر روی مهرههای آغشته به فیبرینوژن در حضور محرک ADP در خون کامل بررسی میشود. آستانه کمتر از 240 واحد PRU (platelet reaction unit) بیانگر بروز عوارضی مانند سکته و ترومبوز استنت است.
4- آزمایش کارایی پلاکتها با آنالیزور PFA-100:
در این روش میزان چسبیدن و تجمع پلاکتها در اطراف یک سوراخ کوچک که با ADP و کلاژن آغشته شده است، بهصورت دینامیک ارزیابی میشود.
5- اندازهگیری درجه فسفریلاسیون VASP
(Vasodilator stimulated phosphoprotein) با فلوسیتومتری
پروتئین VASP یک مارکر اختصاصی برای ارزیابی فعال بودن یا غیرفعال شدن گیرنده P2Y12 است. هنگامی که پروتئین VASP فسفریله شود، توانایی فعال کردن گیرنده IIb/IIIa برای عمل تجمعی پلاکت را ندارد. پلاویکس با مسدود کردن گیرنده P2Y12 موجب فسفریله شدن VASP میگردد و افزایش میزان VASP بهصورت غیرفسفریله بیانگر بیپاسخی یا کمپاسخی به پلاویکس است.
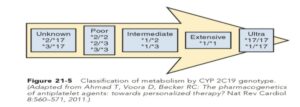
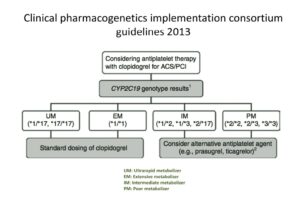
پلاویکس بهصورت غیرقابل برگشت گیرنده ADP را مسدود میکند و اثرات آن تا 7 روز یا برای تمام عمر پلاکت باقی است. به نظر میرسد که پلیمورفیسم ژنهای CYP2C19 نقش کلیدی در تولید شکل فعال دارو و پاسخ به پلاویکس را دارا باشد. حدود 25 پلیمورفیسم تکنوکلوئیدی (SNPS) در ژن CYP2C19 نهفته شده است که مهمترین آنها در رابطه با متابولیسم پلاویکس CYP2C19*2 و CYP2C19*3 و CYP2C19*17 است. دو پلیمورفیسم *3 و *2 شایعترین جهشهای متابولیزکننده ضعیف پلاویکس (Poor metabolism) در تبدیل دارو به فرم فعال و پلیمورفیسم *17 از جهشهای با افزایش فعالیت برای تولید فرم فعال دارو است. ژن اصلی (wild type) سایتوکروم در متابولیزم پلاویکس 1* است.
اثرات پلیمورفیسمهای ژن سایتوکروم در تبدیل پلاویکس به فرم فعال
شیوع ژنوتایپهای متابولیزهکننده ضعیف در طیف 20 تا 30% سفیدپوستان و 30 تا 45 درصد نژاد آفریقایی، آمریکایی و تا 50 تا 65% شرق آسیا گزارش شدهاند. به نظر میرسد که داروهای مسدودکننده جدید گیرنده P2Y12 مانند ticagrelor و prasugrelچندان تحتتأثیر پلیمرفیسمهای ژنتیکی آنزیم سیتوکروم CYP2C19 قرار نمیگیرند.
سازوکارهای داروهای مسدودکننده گیرندههای
پورینرژیک پلاکتی
گزارشها نشان از افزایش خطر 30% عوارض قلبی و خطر دو برابری برای ترومبوز استنت بهازای وراثت هر هاپلوتایپ ناکارآمد در متابولیزم پلاویکس میدهد. وراثت گونه CYP2C19*17 به علت افزایش کارایی در تولید فرم فعال دارو با خطر خونریزی همراه است. آلل CYP2C19*1 ژن اصلی (Wild type) برای متابولیسم و تولید شکل فعال پلاویکس در افراد عادی است. گفتنی است که پس از جذب خوراکی پلاویکس حدود 85% دارو تحتتأثیر واکنشهای استراز، غیرفعال گشته و تنها 15% آن تحتتأثیر آنزیم CYP2C19 به شکل فعال برای مسدود کردن گیرنده P2Y12 درمیآید.
راهنمای فارماکولوژیک 2013 تجویز پلاویکس با توجه به پلیمورفیسمهای ژن سیتوکروم
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام