مروری بر روشهای تشخیصی پیش از تولد تالاسمی
دکتر شعبان علیزاده، مریم سادات حسینی ، فاطمه روشن ضمیر
گروه هماتولوژی و انتقال خون، دانشکده پیراپزشکی، دانشگاه علوم پزشکی تهران alizadehs@sina.tums.ac.ir
خلاصه
تالاسمیها گروهی از اختلالات سنتز هموگلوبین با وراثت اتوزوم مغلوب هستند و به دو نوع عمده آلفا و بتا تقسیم میشوند. در حال حاضر بیماری تالاسمی به شایعترین بیماری تک ژنی در سراسر دنیا تبدیل شده است که نه تنها یک مشکل بهداشتی، بلکه یک مشکل اقتصادی- اجتماعی در بسیاری از کشورهاست. به منظور پیشگیری از موارد جدید تالاسمی استراتژیهای متفاوتی مطرح است که از این میان میتوان به غربالگری زوجین قبل از ازدواج و مشاوره ژنتیک اشاره کرد. یکی از مهمترین اقدامات در زمینه کنترل این بیماری، بکارگیری تکنیکهای تشخیصی پیش از تولد است. در این مقاله سعی بر این است که مروری بر روشهای تهاجمی و غیر تهاجمی نمونهبرداری از جنین و همچنین تکنیکهای مختلف جهت شناسایی جهشهای تالاسمی انجام گيرد. در آخر نیز به تشخیص پیش از لانه گزینی جنین در رحم که رویکرد جدیدی در زمینه کنترل بیماریهای ارثی است، اشاره شده است.
تالاسمی و تاریخچه آن
بیماری تالاسمی برای اولین بار در سال 1925 توسط دکتر Thomas Cooley با مشاهده این اختلال در تعدادی از بیماران با نژاد مدیترانهای، توصیف شد و cooley’s anemia نام گرفت. تا زمانی که تعدادی از پزشکان دانشگاه Rochester واژه تالاسمی را برای آن به کار بردند. واژه تالاسمی از واژه یونانی «تالاس» به معنی دریا گرفته شده است که به دلیل شیوع بالای بیماری در کشورهای حاشیه دریای مدیترانه است.(1)
اگرچه نام بیماری نشان دهنده شیوع بالای آن در نواحی مدیترانه است اما به این منطقه محدود نشده و در میان جمعیتهای مختلف در خاورمیانه و جنوب آسیا نیز گسترش یافته است؛ به طوری که تالاسمی به شایعترین بیماری تک ژنی در سراسر دنیا تبدیل شده است. شیوع انواع مختلف صفت تالاسمی تا 16% در جنوب اروپا، 10% در تایوان، 8-3% در هند، پاکستان و چین تخمین زده شده است.(2). بر اساس آمارهاي انجمن تالاسمی، درایران تعداد 18616 بیمار تالاسمی زندگی میکنند که استان مازندران با 2559 نفر داراي بیشترین و استان زنجان با 58 نفر داراي کمترین تعداد است. پیشبینی میشود حدود 3 میلیون ناقل تالاسمی در ایران زندگی میکنند.(3)
تالاسمیها گروهی از اختلالات سنتز هموگلوبین با وراثت اتوزوم مغلوب میباشند و به دو نوع عمده آلفا (α) و بتا (β) تقسیم میشوند. تالاسمیهای آلفا و بتا از نظر اپیدمیولوژی، نقصهای ژنتیکی، تظاهرات بالینی و نیز تشخیص و مدیریت قبل از تولد متفاوتاند. تالاسمیها براساس شدت بیماری به سه دسته مینور، متوسط و ماژور تقسیم بندی میشوند.(2)
بیماران تالاسمی ماژور به طورمرتب از خدمات بهداشتی و درمانی استفاده مینمایند. تالاسمی نه تنها یک مشکل بهداشتی بلکه یک مشکل اقتصادی –اجتماعی در بسیاری از کشورهاست، به منظور پیشگیری از موارد جدید تالاسمی استراتژیهای متفاوتی مطرح شده است که از آن میان میتوان به غربالگری تالاسمی زوجین قبل از ازدواج، مشاوره ژنتیک و افزایش آگاهی زوجین در معرض خطر اشاره کرد. تشخیص پیش از تولد ([1]PND) تالاسمی برای اولین بار از سال 1375 به عنوان یک روش مؤثر و کارآمد بر اساس نسبت زنجیرههای آلفا به بتا مطرح شد.(4)
در جدول زیر به خصوصيات اصلی تالاسمی آلفا و بتا اشاره شده است.(جدول 1)
| جدول 1: مقایسه تالاسمی آلفا و بتا | ||
| آلفا تالاسمی | بتا تالاسمی | |
| تعداد اللها | 4 | 2 |
| جایگاه ژنی | کروموزوم 16 | کروموزوم 11 |
| نقص ژنتیکی رایج | حذف | جهش نقطهای |
| اپیدمیولوژی | شایع در جنوب چین و آسیا | شایع در نواحی مدیترانه |
| غربالگری حاملین | MCH<27pg و MCV<81 fl | MCH<27pg و MCV<81 fl |
| تشخیص حاملین | حضور انکلوزیونهای Hb | افزایش HbA2 (3/5% یا بیشتر) و افزایش HbF |
تشخيص پيش از تولد (PND)
بیماریهای ارثی عامل 25-20 درصد مرگ و میر پیش از تولد هستند. تشخيصهاي پيش از تولد شامل تكنيكهاي متنوعي است كه سلامت و وضعيت جنين را قبل از تولد مشخص ميكند (5). با بکارگیری این روشها برای بارداریهای در معرض خطر میتوان از تولد جنین مبتلا جلوگیری کرد(6). از PND به ویژه در موارد زیر میتوان کمک گرفت:
- مديريت هفتههاي باقي مانده بارداري
- برنامهريزي براي عواقب ممكن مراحل تولد
- تعيين نتیجه بارداري
- مدیریت مشكلاتي كه ممكن است براي نوزاد تازه متولد پیش آید.
- تصميم گيري در رابطه با ادامه بارداري
- پيدا كردن موقعيتهايي كه ممكن است بارداريهاي بعدي را تحت تأثير قرار دهد.
تكنيكهاي تهاجمي و غير تهاجمي گوناگونی براي تشخيصهاي پيش از تولد وجود دارد؛ هر كدام از اين تكنيكها فقط در طول زمان خاصي در دوره بارداري قابل انجام هستند به طوری كه بتوانند بيشترين تأثير را داشته باشند. تكنيكهاي PND شامل موارد زير ميشود:
- اولتراسونوگرافي
- آمونيوسنتز
- نمونهگيري از پرزهاي جنيني
- سلولهاي خوني جنين موجود در خون مادر
- آلفافيتوپروتئين در سرم مادر
- β-HCG در سرم مادر
- استريول در سرم مادر
- DNA آزاد جنيني موجود در سرم مادر(5)
روشهای تهاجمی نمونه برداری از جنین
مهمترین منبع DNA جنینی از طریق تکنیکهای تهاجمی همچون آسپیراسیون شکمی از پرزهای جفتی و یا مایع آمونیوتیک به دست میآید که خطر سقط جنین یا آسیب به آن در این روشها هر چند کم (1%) است، اما وجود دارد. DNA جنین را میتوان از حدود 20 میلیگرم از پرزهای جفتی و یا 15 میلیلیتر از مایع آمونیوتیک جدا کرد(7). زمان نمونهگيري از پرزهاي جفتی بين هفتههاي 8 و 12 بارداري، آمونيوسنتز بين هفتههاي 14 و 20 بارداري و خونگيري از جنين (cordcentesis) بعد از هفته 18 بارداري ميباشد.(8) از آنجایی که این روشها نیاز به بستری شدن در بیمارستان و استفاده از نیروی متخصص دارند، پرهزینه هستند.(9)
تشخیصهای پیش از تولد غیر تهاجمی (NIPD)[2]
امروزه روشهاي غير تهاجمي در مراكز مختلف انجام ميشود و علیرغم اینکه کاملاً بیخطر هستند محدوديتهايي در استفاده از آنها وجود دارد، از جمله این روشها میتوان به غني سازي اريتروبلاستهاي جنيني به دست آمده از خون مادر اشاره کرد که انجام آن دشوار است. تعداد کم سلولهاي جنيني سالم در خون مادر و نیز حضور سلولهاي باقي مانده از بارداريهاي قبلي باعث ایجاد خطا و استفاده محدود از اين روشها شده است.(6) از سال 1960 تا سال 1990، روشهاي گوناگوني براي جدا كردن سلولهاي هستهدار جنين از پلاسماي مادر مورد مطالعه قرار گرفته است.(7)
حضور هر دو نوع DNA مادر و جنین در پلاسمای مادر، اخیراً طی آنالیزهای ملکولی ثابت شد. از زمان كشفDNA آزاد سلولي (cff-DNA)[3] در پلاسماي مادر توسط) Lo 10)، پيشرفت بزرگي در تشخيصهاي غير تهاجمي پيش از تولد حاصل شده است.(11) فراوانی DNA آزاد جنين در خون زنان باردار نسبت به سلولهاي جنين بیشتر است. اين DNA از سلولهاي تروفوبلاست منشأ میگیرد و بنظر میرسد در طی دوران بارداری کاملاً پایدار است، اگرچه خیلی سریع بعد از تولد از بین میرود. میزان DNA جنین در اوایل و اواخر بارداری به ترتیب 3 و 6 درصد کل DNA موجود در پلاسمای مادر است.(7) شناسایی جهشهای به ارث رسيده از پدر در پلاسماي مادري به دليل غالب بودن DNA مادر و همچنين تداخل آن در روند غني سازي DNA، در عمل چالش برانگيز است.(12) در روشهایی که از cff-DNA استفاده میشود، به دليل كم بودن ميزان DNA جنيني در پلاسماي مادر، میتوان با استفاده از آناليز ويژگيهاي به ارث رسيده از پدر در DNA، از منشأ سلولهاي به دست آمده مطمئن شد. در بیماریهای ژنتیکی غالب[4] و به ارث رسیده از پدر امکان استفاده از این روش وجود دارد.(13) با استفاده از روشهايي كه محدوده ژني حاوی ژن عامل بيماري را جدا کرده و مورد آناليز قرار ميدهد، میتوان هزينه و پيچيدگي روشهاي تشخيص قبل از تولد را كاهش داد.(14)
NIPD براي هموگلوبينوپاتيها
روشهاي NIPD كه بر اساس یافتن جهشهای جنيني به ارث رسیده از پدر در DNA موجود در پلاسماي مادر است، در مورد زوجهايي كه جهــــــشهاي يكساني را به اشتراك ميگذارند چندان كاربردي ندارد. در رابطه با هموگلوبينوپاتيها در هر قـــــوم و نژادي معمولاً جهشهاي محدودي وجود دارد، بنابراين روشهاي NIPD به حساسيت و اختصاصيـــت بالایی نياز دارند. روشهايي كه مبتني بر تكنيكهایMALDI[5] time-of-flight mass spectrometers میباشند، براي تشخيص قابل اعتماد اللهاي اختصاصي جنين در پلاسماي مادر مناسب هستند، اما به دليل نياز به تجهيزات گران قيمت و پيچيده محدود ميشوند.
روش ديگر مورد مطالعه، بررسی حضور جهشهای نقطهاي متعدد به ارث رسیده از پدر(SNPS)[6]در پلاسمای مادری است. اخیراً نشان داده شده است که علاوه بر یافتن جهشهای به ارث رسیده از پدر، با استفاده از روشهای مبتنی بر[7]RPM، میتوان اللهای جهش یافته به ارث رسیده از مادر را نیز تعیین کرد. روش فوق یک برنامه غنی سازی مولکولی است که غلظت DNA جنین را افزایش داده و به مشکل غلظت کم DNA جنین موجود در پلاسمای مادر غلبه میکند.
در رابطه با مادرانی که حامل کدون 41/42 یا جهش HbE هستند میتوان از Digital PCR براي تعيين ژنوتيپ جنين در سه ماهه دوم بارداري استفاده کرد، اگرچه اين روش هنوز به اصلاحاتي نياز دارد اما پيشرفت قابل ملاحظهای در زمینه NIPD محسوب میشود و امکان استفاده از تشخیصهای غیر تهاجمی را برای انواع بیماریهای تک ژنی فراهم میکند.(7)
روشهای رایج تشخیص پیش از تولد
اکثر جهشهای شناخته شده تالاسمی و واریانتهای غیر طبیعی Hb از طریق تکنیکهای مبتنی بر PCR شناسایی میشوند. این روشها برای تعیین ژنوتیپ حاملین و نیز DNA جنینی برای تشخیص پیش از تولد مناسب هستند. عمدتاً طیف جهشها در جمعیت هدف و امکانات موجود در آزمایشگاه تعیین کننده روشی است که انتخاب میشود.(7)
تعیین نقص مولکولی در والدین پیش نیاز تشخیص قبل از تولد بیماری است.(15)
روشهای شناسایی کننده جهش در زوجهای حامل به طور کلی به دو دسته مستقیم و غیرمستقیم تقسیم میشوند. در هر گروهی از جمعیت بعضی انواع جهشهای ژنهای گلوبین شایعترند. در صورتی که هدف بررسی حضور این جهشهای شناخته شده در والدین حامل باشد از روشهای مستقیم استفاده میشود. از این دسته روشها میتوان به تکنیکهای ASO[8] و ARMS[9] برای یافتن جهشهای نقطهای و gap-PCR برای تشخیص حذفهای خاص اشاره کرد.(7)
در صورتی که حاملین به روشهای فوق جواب ندهند، بررسیهای بیشتر توسط روشهای غیرمستقیم صورت میگیرد که حضور جهشهای ناشناخته را از طریق جستجوی کل ژن آشکار میسازند. (15)DGGE[10] و [11]dHPLC از جمله این روشها هستند. روشهای غیرمستقیم متعاقباً به روش دیگری نیاز دارند که تنوعهای نوکلئوتیدی پیدا شده را به طور دقیق مشخص کند.
تکنیکهای جدیدتر شامل MLPA[12] و [13]QMPSF برای یافتن حذفها و real-time PCR و HRMA[14] برای یافتن جهشهای نقطهای میباشند.(7)
روشهای رایج مستقیم
- Allele Specific Oligonucleotid hybridization
هیبریداسیون ASO یکی از اولین روشهای مبتنی بر PCR است که در قالب هیبریداسیون dot blot یا reverse dot blot انجام میگیرد. از این روش برای یافتن جهشهای نقطهای در ژنهای بتا استفاده میشود.(7) برای هر جهش دو پروب الیگونوکلئوتیدی نیاز است که یکی مکمل توالی نرمال و دیگری مکمل توالی جهش یافته میباشد.
هنگام هیبریداسیون، هر پروب فقط به ژنی که کاملاً مکملش است اتصال مییابد، بنابراین DNA هموزیگوت نرمال (N/N) فقط به پروب نرمال، DNA هموزیگوت β تالاسمیک (T/T) فقط به پروب تالاسمیک و DNA هتروزیگوت (N/T) به هر دو پروب (ولی با شدت کمتر برای هر کدام) اتصال مییابد. (17)
شکل 1: استفاده از پروبهای ASO برای تشخیص یک شکل رایج تالاسمیβ (دو پروب الیگونوکلئوتیدی فقط در موقعیت جهش تفاوت دارند. (برگرفته از کتاب Dacie and Lewis Practical Heamatology 2011)
- Amplification Refractory Mutation System
تکنیک ARMS بر اساس پرایمری است که به علت داشتن یک ناحیه عدم تطابق در انتهای ‘3 نمیتواند به الگو متصل شود. در این روش قطعه DNA هدف در دو واکنشPCR مجزا تقویت میشود. در هر واکنش از یک پرایمر معمول به همراه یکی از دو پرایمر زیر استفاده میشود: یکی مکمل با جهش (پرایمر بتا تالاسمی) و دیگری در همان موقعیت مکمل با DNA نرمال (پرایمر نرمال). DNA نرمال فقط با پرایمر نرمال، DNA هموزیگوت فقط با پرایمر β-تالاسمی وDNA هتروزیگوت به کمک هر دو پرایمر تقویت میشود.
روش ARMS بسیار ساده است به طوری که برای یافتن هر جهش فقط دو واکنش PCR و متعاقباً الکتروفورز ژل آگارز نیاز است. این روش در آنالیز DNA جنینی به ویژه برای یافتن جهشهایی که از قبل در والدین پیدا شدهاند مفید است.
با متعدد کردن پرایمرها برای بیش از یک جهش میتوان تکنیک ARMS را ارتقا داد. (15)
از معایب روش فوق این است که به استاندارد سازی و بهینه سازی دقیق شرایط واکنش برای هر مجموعه پرایمر نیاز دارد و در غیر این صورت احتمال نتیجه مثبت و منفی کاذب وجود دارد.(7)
- Gap-PCR
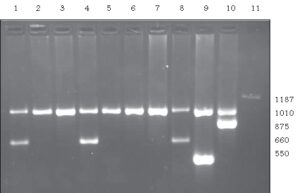
Gap-PCR برای یافتن حذفهای بزرگی که جایگاه شکست شناخته شده دارند به کار میرود. در این روش از پرایمرهایی مکمل با نواحی ‘3 و ‘5 نقاط شکست استفاده میشود. در یک کروموزوم طبیعی این پرایمرها در فاصلهای بسیار دور از هم به DNA متصل میشوند ولی در صورتی که حذف مورد نظر وجود داشته باشد محلهای اتصال پرایمرها نزدیک به هم خواهد بود، در نتیجه بسته به نوع حذف محصولات PCR با اندازههای متفاوت ایجاد خواهند شد. (18)
Gap-PCR به ویژه برای یافتن حذفهای عامل α0 تالاسمی به کار میرود.
شکل 2: شناسایی α0 تالاسمی توسط multiplex GAP-PCR. یک باند نرمال با bp 1010 در همه نمونهها ایجاد شده است (هرچند در نمونه 11 بسیار ضعیف است). در نمونههای 1، 4، 8 ،9 ، 10 و 11 یک باند اضافی با اندازههای متفاوت دیده میشود که هر کدام نماینده یک حذف خاص بوده و با پرایمرهای ویژه همان حذف شناسایی شدهاند. (نمونههای 1، 4 و 8 هتروزیگوت برای حذف – – SEA، نمونه 9 هتروزیگوت برای حذف – – FIL، نمونه 10 هتروزیگوت برای حذف – – MED و نمونه 11 هتروزیگوت برای حذف – α20.5 میباشند.)(18)
به دلیل تغییرات نوکلئوتیدی اسپورادیک که ممکن است در ناحیه پرایمر اتفاق بیفتد، نتایج به دست آمده باید با روش دیگری همچون MLPA یا QMPSF تأیید شوند.(7)
روشهای رایج غیرمستقیم
- Denaturing Gradient Gel Electrophoresis
این روش امکان جداسازی مولکولهای DNA با چند صد bp که به اندازه یک نوکلئوتید تفاوت دارند را فراهم میکند. جداسازی الکتروفورتیک بر پایه ویژگیهای ذوب مولکول DNA دو رشته است که تحت شرایط افزایش دما یا تحت تأثیر افزایش شیب ماده دناتوره کننده در ژل پلیآکریل آمید جدا میشوند.
اگرچه الگوهای الکتروفورتیک اغلب ویژه هر جهش هستند اما DGGE همیشه در ترکیب با یک روش دوم مثل توالی یابی مستقیم برای تأیید هویت تنوعهای نوکلئوتیدی بکار برده شده است.(7)
- Denaturing High-Performance Liquid Chromatography
اساس این روش یافتن مولکولهای هترودوپلکس از طریق کروماتوگرافی مایع فاز معکوس جفت یونی[15]، تحت شرایط دناتوراسیون نسبی است.
حساسیت و اختصاصیت تکنیک فوق بالغ بر 96% است. به دلیل حساسیت و کارایی بالا و نیز هزینه به صرفه، به طور گستردهای برای غربالگری جهشهای ژن بتاگلوبین بکار میرود. این روش نیز (همانند DGGE) بهتر است با روش دیگری تأیید شود، به ویژه زمانی که ممکن است الگوهای استخراج در اثر پلیمورفیسمها پیچیده شوند.(7)
- توالی یابی مستقیم
کوچک بودن نسبی ژنهای گلوبین این امکان را فراهم میکند که نسبتاً به آسانی توالی یابی شوند. ژنهای α1 و α2 هر کدام در دو قطعه و ژن β معمولاً در 4-3 قطعهی تقویت شده، توالی یابی میشوند.
بهترین کارایی توالی یابی زمانی حاصل میشود که از یک دستگاه توالی یاب خودکار با تکنولوژی فلورسنت برای آنالیز محصولات استفاده شود.(7)
روشهای نوین
- Multiplex Ligation-dependent Prob Amplification
در تکنیک MLPA، DNA ژنومی با مجموعهای از پروبها هیبرید میشود. هر پروب دارای دو نیمه است؛ یکی از نیمهها از یک توالی مکمل با DNA هدف (nt 20-30) در کنار توالی یک پرایمر عمومی تشکیل شده است، نیمه دیگر نیز یک توالی مکمل هدف در یک انتها (nt 25-43) و یک توالی پرایمر عمومی در انتهای دیگر دارد، با این تفاوت که یک قطعه با طول متـــغیر (nt 19-370) میان آن دو قرار داده شده است. این امر منجر به تفاوت در اندازه پروبها میشود که برای تفکیک الکتروفورتیک مورد نیاز است. دو نیمه پروب طوری طراحی شدهاند که توالیهای مکمل DNA هدف در مجاورت هم با DNA باند شوند، سپس توسط یک لیگاز به هم متصل میشوند، در نتیجه یک پروب پیوسته ایجاد خواهد شد که در دو انتهای آن جایگاه اتصال پرایمر وجود دارد و در مرحله بعد توسط PCR تقویت میشوند. (شکل 3)
شکل 3: (16)
میزان پروبهای پیوستهای که ایجاد میشود با تعداد کپیهای توالی هدف متناسب خواهد بود و بعد از مرحله PCR ارتفاع پیک مربوطه حذف یا مضاعف شدگی توالی هدف را نشان میدهد.
به دلیل کوتاه بودن طول ناحیه ویژه هدف در پروبهای MLPA (nt 20-30)، عدم تطابقهای نوکلئوتیدی در جایگاه اتصال پروب ممکن است از هیبریداسیون و در نتیجه مراحل بعدی جلوگیری کند، بنابراین تغییرات یک باز ممکن است به عنوان حذفهای اگزونی ظاهر شوند، به همین دلیل توصیه میشود همه حذفهای شناسایی شده با MLPA با روش دیگری تأیید شوند.(16)
- Quantitative Multiplex PCR of Short Fragments (QMPSF)
این تکنیک یک روش نیمه کمی است که بر پایه PCR متعدد حذفهای اگزونی کوتاه میباشد. تقویت قطعات اگزونی کوتاه (<bp 300) در تعداد سیکلهای محدود و همزمان، استفاده از پرایمرهای نشاندار شده با رنگ امکان اندازهگیری کمی DNA را فراهم میکند.(7)
- Real-time PCR
Real-time PCR یک روش یک مرحلهای است که اساس آن استفاده از پروبهای هیبریداسیون فلورسنت و به دنبال آن آنالیز منحنی ذوب میباشد. این روش امکان یافتن همزمان جهشهای متعدد را فراهم میکند. از Real-time PCR برای غربالگری والدین، تشخیص پیش از تولد و شناسایی آلودگی نمونه جنین با DNA مادر با موفقیت استفاده شده است. علیرغم این مزایا، استفاده از تکنیک با محدودیتهایی همچون نیاز به تجهیزات اختصاصی و نیز طراحی دقیق و مبتنی بر جهشهای موجود در جمعیت برای پروبها، روبرو است.(15)
- Hight Resolution Melting curve Analysis
این تكنيك سرعت و صحت بالايي داشته و بر اساس ویژگیهاي ذوب محصولات PCR ميباشد. مزيت روش فوق اين است كه به مراحل پيچيده بعد از PCR نياز ندارد و در مقایسه با Real-time PCR باعـــث صرفه جویی در هزینه و زمان میشود.(19)
در جدول زیر مزایا و معایب روشهای تشخیصی مورد استفاده در PND ذکر گردیده است. (جدول 2)
| جدول 2. مزایا و معایب روشهای تشخیصی تالاسمی (7 و 15) | ||
| نام روش | مزایا | معایب |
| Aso dot blot hybridisation | استفاده گسترده و مطمئن | استفاده از پروبهای نشاندار با رادیواکتیو
زمانبر عدم امکان غربالگری همزمان چندین جهش |
| Reverse dot blot hybridisation | غربالگری همزمان جهشهای متعدد
مقرون به صرفه استاندارد سازی سریع، ساده و قابل اطمینان |
دشواری استاندارد سازی داخلی
پرهزینه بودن کیتهای تجاری |
| ARMS -PCR | آسان، سریع و مقرون به صرفه | استاندارد سازی و بهینه سازی دقیق شرایط واکنش
ایجاد نتایج غیر اختصاصی در صورت تجزیه پرایمر در انتهای ˊ3 |
| توالی یابی مستقیم | شناسایی مستقیم جهشها
نسبتاً ارزان |
پرهزینه بودن تجهیزات
سختی تکنیک آماده سازی نمونه |
| PGGE | مناسب برای غربالگری در سطح وسیع
ایجاد الگوهای الکتروفورز ویژه هر جهش نسبتا ارزان |
نیاز به تفسیر دقیق به علت وجود پلیمورفیسمها
سختی آنالیز نواحی غنی از GC سختی بهینه سازی شرایط به طور کلی از نظر تکنیکی پیچیده است |
| DHPLC | مناسب برای غربالگری در سطح وسیع
حساسیت بسیار بالا نسبتاً ارزان |
پرهزینه بودن تجهیزات |
| Gap-PCR | آسان، سریع و مقرون به صرفه | نیاز به DNA کنترل
محدود به حذفهایی با توالیهای شکست شناخته شده به عنوان یک روش تنها برای PND توصیه نمیشود |
| MLPA | دسترس بودن کیتهای تجاری | نیاز به تجهیزات توالی یابی خودکار
امکان تأثیر داشتن کیفیت و غلظت DNA در نتایج |
| QMPSF |
آسان، سریع و مناسب جهت اتوماسیون
|
نیاز به تجهیزات توالی یابی خودکار |
| Real time PCR | امکان یافتن همزمان جهشهای متعدد | نیاز به تجهیزات اختصاصی
طراحی دقیق پروبها |
تشخيصهاي ژنتيكي پيش از لانه گزینی (PGD)[16]
در حدود 20 سال از اولين کاربردهای PGD در بالين ميگذرد، امروزه این روش به عنوان جايگزيني براي PND در تعدادي مراكز اختصاصي در سراسر جهان پيشنهاد شده است. PGD براي بيماريهاي تک ژنی و نیز اختلالات كروموزومی شناخته شده همچون جابجايي دوطرفه[17] استفاده شده است. تشخیصهای پیش از لانه گزینی براي هر نوع بيماري ژنتيكي كه اطلاعات كافي از تواليهاي آن موجود باشد و به راحتی بتوان براي آن پرايمر يا پروب طراحي كرد از نظر تئوری امکان پذیر است. PGD به همكاري نزديك بين متخصصين باروری[18]و ژنتيك نياز دارد. امروزه مراکز IVF طی روندی موسوم به transport PGD سلولهای نمونه رویان را برای تشخیص به مراکز ژنتیکی تخصصی ارسال کرده و بر اساس نتایج حاصل انتقال رویان انجام میگیرد.
PGD شامل مراحل زير ميشود:
- مشاوره و ارزيابي زوجين
- بيوپسي محتويات ژنتيكي هر رويان
- آناليز محتويات ژنتيكي هر رويان
- انتقال رويان
- در صورت لانه گزینی، دنبال کردن بارداری تا تولد نوزاد یا نوزادان
اخيراً در اغلب موارد PGD از بیوپسی بلاستومر استفاده ميشود. در همه موارد بيوپسي، ميزان نمونه مورد نياز حداقل بوده و در بيشتر موارد شامل بيش از يك سلول نميشود. روشهاي PGD، اغلب بر اساس PCR هستند. به دليل اينكه آناليزهاي PCR روي سلولهاي تك، نياز به چرخههای غني سازي دارد، احتمال آلودگی از نمونههای قبلی و اپراتور افزایش مییابد، در نتیجه بهتر است جهت به حداقل رساندن این آلودگیها کلیه مراحل PCR در شرایط دقیق انجام شود.
PGD براي هموگلوبينوپاتيها
اولين نمونههاي مربـــــــــــــــــوط به PGD با استفاده از روشهاي non-fluorescent- PCR و gel electrophoresis، برای یافتن جهشهاي عامل بيماري آنالیز شدند. بيشتر روشهاي PGD در ارتباط با هموگلوبينوپاتيها شامل minisequencing و real-time PCR میباشد.
Minisequencing امكان یافتن سريع و صحيح جهشها و نیز پلیمورفیسمهای نوکلئوتیدی آنها را فراهم میکند، همچنین میتوان از Real-time PCR به عنوان یک روش صحیح و سریع برای تعیین ژنوتیپ سلولهای متعدد در تشخیصهای پیش از لانه گزینی استفاده کرد. این روش به ویژه در تالاسمی β، به دلیل اندازه نسبتاً کوچک ژن مربوطه کاربرد دارد. به طور كلي بيشتر روشهای PGD در ارتباط با هموگلوبينوپاتيها به آناليز جایگا ههای متعدد ژنی نياز ندارد، به جز در مواردی که نیاز است علاوه بر انتخاب رویان سالم،HLA-typing انجام شود.
انتخاب برادر يا خواهر HLA سازگار برای تسهیل پيوند مغز استخوان بیشتر در رابطه با بیماران تالاسمی ماژور میتواند در نظر گرفته شود، اگرچه از نظر تئوری علاوه بر تشخیص هموگلوبینوپاتیها، استفاده از PGD برای HLA-typing امکان پذیر است، اما در نهایت تولد یک نوزاد سالم و HLA سازگار در عمل بسیار محدود است.(7)
منابع:
- Kremastinos DT, Farmakis D,Aessopos A et al. Thalassemia Cardiomyopathy History, Present Considerations, and Future Perspectives.Circ Heart Fail. 2010;(3):451-458.
- Leung TY, Lao TT. Thalassaemia in pregnancy. Best Practice & Research Clinical Obstetrics and Gynaecology2012 ;( 26) : 37–51.
3.Valizadeh F , Mousavi A , Hashemi-Soteh MB. Prevalence of hemoglobinopathies in premarriage individuals referred to Babolsar, Iran (2006-09). J GorganUni Med Sci. 2012;14(1): 106-12. [Full text in Persian]
4.MiriMoghadamA,NaruyiNejadM,Eshghi P et al. Molecular basis and prenatal diagnosis of thalassemia in South East Iran, In years 1381-83. Journal of Mazandaran University of MedicalSciences 2005;(48):105-111.[Full text in Persian]
- Kaimin C, Yama I, Leung K et al . Detection of paternal alleles in maternal plasma for non-invasive prenatal diagnosis of b-thalassemia: A feasibility study in southern Chinese . European Journal of Obstetrics & Gynecology and Reproductive Biology 2010 ; (150): 28–33.
- Harteveld CL,Kleanthous M,Traeger-Synodinos J et all. Prenatal diagnosis of hemoglobin disorders: Present and future strategies.Clinical Biochemistry 2009;(42):1767–1779.
- Hataichanok S, Fucharoen G, Sae-Ung N et al . Analysis of fetal blood using capillary electrophoresis system: a simple method for prenatal diagnosis of severe thalassemia diseases . European Journal of Haematology 2009 ; 57–65.
- Phylipsen M, Yamsri S , Treffers E et al . Non-invasive prenatal diagnosis of beta-thalassemia and sickle-cell disease using pyrophosphorolysis-activated polymerization and melting curve analysis .Prenatal Diagnosis 2012; (32): 578–587.
10.LeandrosL ,Hatzi E, Bouba J et al . Non-invasive first-trimester detection of paternal beta-globin gene mutations and polymorphisms as predictors of thalassemia risk at chorionic villous sampling, European Journal of Obstetrics & Gynecology and Reproductive Biology 2008; (140) :17–20.
- Sirichotiyakul S, Charoenkwan P and Sanguansermsri T . Prenatal diagnosis of homozygous alpha-thalassemia-1 by cell-free fetal DNA in maternal plasma . Prenatal Diagnosis 2011;( 32): 45–49.
12.Galbiati S , Foglieni B, Travi M et al. Peptide-nucleic acid-mediated enriched polymerase chain reaction as a key point for non-invasive prenatal diagnosis of b-thalassemia . haematologica 2008; 610-614.
- Bustamante-AragonésA , Rodríguez de Alba M, Perlado S , et al . Non-invasive prenatal diagnosis of single-gene disorders from maternal blood .gene 2012;144-149 .
- Kwan-Wood G. L, Jiang P, Liao G et al . Noninvasive Prenatal Diagnosis of Monogenic Diseases by Targeted Massively Parallel Sequencing of Maternal Plasma: Application to Thalassemia . Clinical Chemistry 2012;1467–1475 .
- Cristina Rosatelli M, Saba L. Prenatal Diagnosis of β-Thalassemias and hemoglobinopathies.Medit J Hemat Infect Dis 2009; 1(1).
- Sellner LN, Taylor GR. MLPA and MAPH: New Techniques for Detection of Gene Deletions.human mutation 2004; (23):413-419.
17.Bain BJ, Bates I,laffan MA et al. Dacie and Lewis Practical Haematology. 11thed China. Elsevier. 2011.144,149.
- Hoffman R. Benz EJ. Silberstein LE et al. HEMATOLOGY: Basic Principles and Practice. 6thedCanada. Elsevier. 2012.529.
- Holterman M, Oggenfuss M, Ernst Frey J et al . Evaluation of High-resolution Melting Curve Analysis as New Tool for Root-knot Nematode Diagnostics. J Phytopathol2012 ; 59–66 .
[1]Prenatal diagnosis
[2]Noninvasive prenatal diagnosis
[3]Cell free fetal DNA
[4]Dominant
[5]Matrix-assisted laser desorption ionization
[6]Single nucleotide polymorphism
[7]Digital relative mutation dosage
[8]Allele Specific Oligonucleotid hybridization
[9]Amplification Refractory Mutation System
[10]Denaturing Gradient Gel Electrophoresis
[11]denaturing High-Performance Liquid Chromatography
[12]Multiplex Ligation-dependent Prob Amplification
[13]Quantitative Multiplex PCR of Short Fragments
[14]HightResolution Melting curve Analysis
[15]ion-pair reverse-phase liquid chromatography
[16]Preimplantation genetic diagnosis
[17]Reciprocal translocation
[18]Assisted reproductive technique
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام