دكتر رضا ميرنژاد (استاد تمام دانشگاه)
مقدمه:
ظهور بيماري لژيونرها در سال 1976 صورت گرفت كه در آن بدون پیشآگهی، 221 مصدوم و 34 كشته در اعضاي لژيون ایالات متحده آمريكا كه در گردهمايي در هتل فيلادلفيا حضور يافته بودند، حاصل شد. دوربینها بيماراني را نشان میدMona_Javadi28@yahoo.comاد كه يكي بعد از ديگري بر روي تختهای چرخدار در انتظار سوار شدن به آمبولانس، از هتل خارج میشدند. بيماریي كه بنظر میرسید طاعون عصر مدرن باشد. عامل ناشناخته بيماري كه سبب پنوموني میشد، تأثیرش بر چند سيستم بدن بود. این بیماری بهخصوص در بيماراني كه مبتلا به بيماري قلبي، ديابت، يا سرطان هستند خطرناك است، بطوریکه میزان مرگومیر در این افراد 29 درصد است. در مقابل، ميزان كشندگي آن در افرادي كه قبلاً سلامتی خوبی داشتند، فقط 5 درصد است.
اپيدميولوژيستها در يك تلاش ملي براي شناسايي عامل مولد پنوموني مرگزا دست به كار شدند. بعد از چند ماه فردي به نام جو مكديد[1] توانست بعد از اولين تزريق مواد حاصل از نمونه كلينيكي به يك خوكچه هندي، باكتري را بر روي محيط غنیشده مولر هينتون آگار جدا نمايد. به دلیل جدا شدن باكتري از لژيونرها و به دلیل تمايل باكتري به ريه آن را لژيونلا پنوموفيلا[2] نام نهادند.
محققين بعدي نشان دادند كه موارد و اپیدمیهای قبلتری نيز از لژيونلا در 1947 وجود داشته كه در آن فردي به نام هاف تات لوك[3] باكتري شبه ريكتزيا را از بيمار مبتلا به پنوموني جدا كرده بود. اين عامل كه قبلاً عامل تاتلوك[4] نام گرفته بود، بعدها لژيونلا پنوموفيلا ناميده شد. يك اپيدمي در 1965 در واشنگتن رخ داد و 81 بيمار رواني را مبتلا و 15 نفر از آنها را كشت. این اپیدمی حادثه بعدي لژيونلا پنوموفيلا بود. در حقيقت آنچه امروزه بيماري لژيونرها[5] ناميده میشود، بيماري Odd Fellows نيز ناميده میشـــد زيــــــرا اپيدمي مشابهي در Odd Fellow كه در 1974 در همان هتل كه ميزبان باكتري و قربانیهای آن بود و در همايشي شركت كرده بودند، رخ داده بود. چون در آن زمان تنها 11 نفر مبتلا شدند، تا سالهای بعد عامل آن تشخيص داده نشد.
عفونتهاي انساني بيشتر زماني شروع ميشود كه آب گرم حاوي لژيونلا بهصورت آئروسل درآمده و تنفس ميگردد. اين مشكل بيشتر در مؤسسات بزرگ مثل بيمارستان و هتلها خصوصاً زماني كه حرارت آب مصرفي براي آب گرم پايينتر از 57 درجه سلسیوس (135 درجه فارنهايت) است، يا محلهای راكدي در سيستم آب گرم وجود دارد، يا هنگام استفاده از جكوزي و ايجاد بخار بهوجود میآید و يا زماني است كه دستگاههای تنفس مصنوعي يا تولیدکننده بخار با آبهای گرم آلوده پر میشوند.
استفاده از مالشدهندههاي سيليكوني در آب داغ سبب تداوم حضور لژيونلا ميشود و برجهاي افقي بخار هم كه قسمتي از سيستم گرمايش و سرمايش هستند، ميتوانند بهعنوان مخزن عفونت عمل كنند. با آلودگي 30 درصد از محلهای آب گرم يك مؤسسه با لژيونلا، خطر احتمال بروز اپيدمي بيماري لژيونرها بهطور چشمگيري افزايش مييابد
در لوئيزيانا يك اپيدمي بيماري لژيونرها توسط يك دستگاه بخار اولتراسونيك بهوجود آمد كه در يك سبزي فروشي قرار داشت و براي مرطوب نگاه داشتن سبزیها استفاده میشد. اين اپيدمي بسيار قابل ملاحظه بود، زيرا ماشيني كه سبب آن شده بود اساساً يك مرطوبکننده اولتراسونيك بود كه معمولاً در خانهها استفاده میشد.
امروزه لژيونلا عامل مهمي در پنوموني بيمارستاني است و کمکم به جایگاه سوم در عفونتهاي بيمارستاني در ایالات متحده آمريكا میرسد كه نهتنها عامل شكل حاد پنوموني است (كه بيماري لژيونرها نام دارد)، بلكه سبب بيماري شبهآنفلوانزای خودبهخود محدودشوندهاي به نام تب پونتياك ميگردد. از بيماران مبتلا به تب پونتياك لژيونلا جدا نميشود، اما نمونههای سرم آنها تیتر بالايي از آنتیبادی ضد لژيونلا را در دوران نقاهت نشان میدهد.
گونههاي لژيونلا
تاكنون بالغ بر 52 گونه و دهها سروتايپ براي لژيونلا شناسايي شده است. حدود 85 درصد از موارد بيماري لژيونر در اثر لژيونلا پنوموفيلا است كه 50 درصد موارد در اثر سروگروپ 1 و 10 درصد موارد در اثر سروگروپ 6 است. لژيونلا ميكددي[6] دومين گونه معمول عامل بيماري لژيونر است. ساير گونههای لژيونلا كه اغلب با جداسازي يا در نتيجه تستهاي سرولوژيك تشخيص داده ميشوند عبارتند از: لژيونلا بزماني[7]، لژيونلا داموفي[8] و لژيونلا لانگ بيچ[9].
لژيونلا پنوموفيلا (و بقيه لژيونلاها) هم در جامعه عادي و هم در بيماران دچار ضعف ايمني بستري در بيمارستان، ايجاد پنوموني مينمايد.
مورفولوژي و مشخصات
بيشتر اطلاعات ما درباره لژيونلا از مطالعه لژيونلا پنوموفيلا و لژيونلا ميكددي حاصل شده است. لژيونلا، باسيل گرم منفي، هوازي، باریک و رنگپذیری ضعیف، بدون اسپور و بدون كپسول است كه داراي ابعادي حدود 0/3 تا 0/9 ميكرومتر عرض و 2 تا 20 ميكرومتر طول است. اين باكتري، متحرک و واجد يك يا بيش از يك تاژه قطبي يا جانبي است. در برخي از محيطهاي كشت، اين ارگانيسم به اشكال رشتهاي نيز ديده ميشود. رشد لژيونلاها در محيطهاي گرم بهواسطه حضور اسلايم لاير و تشكيل بيوفيلم است.
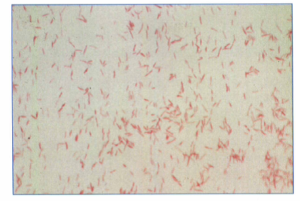
اين باكتري با رنگآميزي گرم در نمونههاي كلينيكي بهسختي قابل مشاهده است، چرا که در رنگآميزي به مقدار كمي رنگ گرفته و در نمونههاي رنگآميزيشده مشاهده نميشود (مگر از فوشين بازی يک درصد بهجای سافرانين در رنگآمیزی گرم استفاده شود) (شكل 1). رنگآميزي گيمنز جهت رنگآميزي لژيونلا بسيار کارآمدتر بوده و در مدت زماني معادل روش گرم، نتيجه قابل اطمينان بدست ميدهد. براي مشاهده لژيونلاها در نمونههاي بافتي فيكسشده با پارافين از روش رنگآميزي استاندارد هماتوكسلين –ائوزين (H & E) استفاده نشده بلکه از روشهاي مخصوصي مانند رنگآميزي اشباعي ديترل نقره (Dieterle s Silver) استفاده ميشود.
شكل 1: رنگآميزي گرم لژيونلا پنوموفيلا
در رنگآميزي گرم بجاي سافرانين، فوشين بازي استفاده شده است
در ميکروگرافهاي الکتروني برشهاي مقاطع سلولي باکتري، غشاء سيتوپلاسمي بهصورت سهلايهاي مشاهده شده و غشاء خارجي نيز به همين صورت واجد ساختاري سه لايه است. اين دو غشاء توسط فضاي پريپلاسميك از هم جدا ميشوند.
لژيونلاها كاتالاز و ژلاتیناز مثبت و اكسيداز متغير (لژيونلا پنوموفيلا اکسيداز مثبت است) هستند. بيشتر لژيونلاها به استثناء لژيونلا لنساينگسيس و لژيونلا ميكددي، ژلاتين را هيدروليز کرده ولي هيدروليز هيپورات منحصر به لژيونلا پنوموفيلا، لژيونلا اسپيريتنس و تعدادي از سويههاي لژيونلا فيلهاي است (جدول 1). لژيونلاها قابليت احياء نيترات به نيتريت را نداشته، فعاليت اورهآز ندارند و فاقد قدرت هيدروليز نشاستهاند؛ اما لژيونلا پنوموفيلا برخلاف ديگر اعضاي اين جنس، نشاسته را هيدروليز مينمايد. اين باکتريها توليد پروتئاز، فسفاتاز، ليپاز، RNase و DNase ميكنند. لژيونلا پنوموفيلا در تماس با نور ماوراء بنفش با طولموج بلند، فلورسانس آبي- سفيد و يا قرمز توليد کرده و در محیطهای حاوي تيروزين، مشابه با اغلب اعضاء خانواده، پيگمان قهوهاي بهوجود ميآورد. لژيونلاها اسيدهاي چرب 14 تا 17 كربنه خاصي توليد ميكنند كه داراي زنجيرههاي شاخهدار بوده و در شناسايي آنها كمككننده هستند.
لژيونلاها باکتریهای سختگیری هستند كه معمولاً در بافر چاركول ييست اكستركت آگار[10] CYE)) قابل كشت میباشند. اين باکتریها قادر به رشد در غياب L- سيستئين نيستند و براي رشد دلخواه به كتواسيد و آهن نيز احتياج دارند. لژيونلا پنوموفيلا سريعاً در بعضي محيطها به فرم تخفيف حدتيافته[11] در ميآيد؛ مثلاً در پاسخ به حضور مقادير زيادي NaCl در آگار.
محيطهاي مصرفي براي لژيونلا را بهواسطة استفاده از یک آنتیبیوتیک (سفامندول، پليميكسين B يا وانكومايسين)، يا يك مهاركننده (گليسين) براي توقف رشد باکتریهای موجود در نمونههاي تنفسي، اختصاصي ميكنند و براي رؤیت بهتر كلنيهاي لژيونلا مقداري رنگ نيز به محيط كشت اضافه ميشود. جداسازي لژيونلا از نمونة خلط، وقتي كه نمونه با اسيد مجاور شود (به دلیل حذف باکتریهای كومنسال تنفسي كه باعث آلودگي ميشوند)، بهتر صورت ميگيرد. لژيونلا پنوموفيلا در دماي 25 تا 42 درجه سلسیوس تكثير يافته و كلنيهايش از 3 تا 5 روز بر روي محيط انتخابي در دماي 35 تا 37 درجه سلسیوس قابل رؤیت ميگردند.
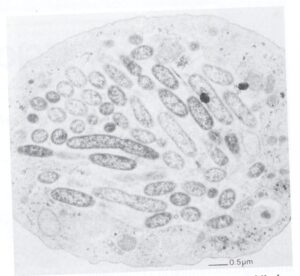
لژيونلاها نسبتاً مقاوم به كلر هستند و عموماً به تعداد كم در آب تازه و آب سيستم خنککننده ساختمانهاي بزرگ وجود دارند. معمولاً به ميزان زياد رشد نميكنند و براي سلامتي تا زماني كه ساير باکتریها و تکیاختگان براي فراهم كردن مواد غذايي در مجاورت آنها وجود نداشته باشند، مضر نيستند و بهصورت طبيعي به ميزان زياد در آب تازه وجود ندارند. بعضي از محققين گزارش کردهاند كه باکتریها و جلبكهاي سبز- آبي محصولاتي ترشح ميكنند كه به لژيونلا امكان رشد در محيطهايي كه قبلاً بهتنهایی نميتوانستند بر روي آنها رشد كنند، میدهند؛ اما مطالعات نشان داده كه لژيونلا بهسرعت ميتواند درون آميبهاي آزادزی (شكل 2)، مثل هارتمانلا[12] و نگلريا[13] و تتراهايمناي مژكدار[14] رشد كند.
شكل 2: فاگوسيتوز لژيونلا پنوموفيلا توسط يك آميب آزادزی
آميبي كه در اينجا نشان داده شده است (هارتمانلا ورمي فورميس) پر از لژيونلا پنوموفيلا شده است. بيشتر لژيونلاها در واكوئلهاي فاگوسيتيك زندگي كرده و در سيتوپلاسم آميب تكثير مییابند (برگرفته از کتاب میکروبشناسی پزشکی واکر)
جدول 1: ويژگيهاي مهم لژيونلاهاي بیماریزا در انسان
مكانيسم بیماریزایی:
لژيونلا در انسانها بهصورت باكتري درون سلولي اختياري رشد ميكند و خصوصيت كليدي بیماریزا بودن آنها توانايي زنده ماندن درون لكوسيتهاي پليمورفونوكلئر و منوسیتها و ماكروفاژهاي آلوئولري است.
(1) آنتيژنهاي و شاخصهاي بیماریزایی لژيونلا:
تعدادي از آنتیژنهای سطح سلولي و محصولات سلولي لژيونلا به بقاي باكتري درون فاگوسيتكنندهها كمك كرده و سبب اثرات سمي بر روي ميزبان ميشوند.
(الف) پيلي، پروتئینهای غشاء خارجي و ليپوپلي ساكاريد: لژيونلا پنوموفيلا داراي يك عدد فلاژل قطبي است و باكتري بهصورت تيپيك داراي پيلي است. پروتئين اصلي غشاء خارجي[15] مولكول پوريني با وزن مولکولی 24 تا 29 دالتون است كه درون ليپوپليساكاريد قلاب انداخته و ورود لژيونلا به سلول ميزبان را با اتصال به يك سابيونيت فعالشده جزء C3 كمپلمان، تسهيل ميكند.
پروتئيني با وزن مولکولی 24 دالتون به نام Mip[16] در غشاء خارجي وجود دارد و بهنظر میرسد براي بقاي لژيونلا در داخل ماكروفاژ، لازم است. پروتئين Mip يك پپتيديل پروليل سيس– ترانس ايزومراز[17] است و آنزيمي است كه در ايجاد فولدینگ[18] پروتئين دخالت دارد. پروتئين Mip سبب القاي بقاي داخل سلولي لژيونلا با يك مكانيسم ناشناخته میشود و فقدان Mip در موتانتها، توانايي لژيونلا براي بقا را تا 80 برابر كاهش میدهد.
يك پروتئين شوك حرارتي با وزن مولکولی 58 تا 60 دالتون در فضاي پريپلاسميك لژيونلا پنوموفيلا وجود دارد. عمل آن نامعلوم است اما بيماران در دورة نقاهت داراي تيتر بالاي مشخصي بر عليه آن هستند.
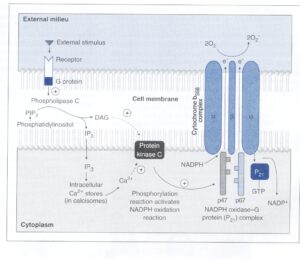
(ب) فسفاتاز: لژيونلا پنوموفيلا فسفاتازي ترشح ميكند كه توليد سوپراكسيداز را بهواسطة كاهش ميزان ديآسيل گليسرول (DAG) و ميو–اينوزيتول تریفسفات (IP3)، مهار ميكند. شكل 3 نشان میدهد كه توليد سوپراكسيداز توسط نوتروفيل طبيعتاً بهصــورت فرم احياء نيكوتيـــن آميد آدنين دينوكلئوتيد فسفات (NADPH Oxidase) است كه مستقيم يا غيرمستقيم يك پروتئين كيناز را فعال ميكند. اين پروتئين كيناز مستقيماً توسط DAG و غيرمستقيم توسط IP3 به دليل خالي شدن مخازن داخل سلولي كلسيم، فعال ميشود. فعال شدن فسفوليپاز C در پاسخ به چند محرك خارجي و توسط يك G پروتئين، سبب ايجاد IP3 از فسفاتيديل اينوزيتول ميشود.
شكل 3: انفجار تنفسي لكوسيتهاي پليمورفونوكلئر (PMN)
مکانیسمهای مختلفي بيان انفجار تنفسي PMN را از طريق اثرشان بر فعاليت فرم احياء نيكوتين آميد آدنين دي نوكلئوتيد فسفات (NADPH Oxidase)، كنترل میکنند. محرك خارجي به رسپتورهاي مرتبط با G متصل شده و پروتئين G، فسفوليپاز C را فعال میکند. فسفوليپاز، 5،4– بيفسفات (PIP2) را شكسته و توليـــــد sn-2،1- دي آسيل گليسرول (DAG) و ميو- اينوزيتول 5،4،1- تريفسفات (IP3) مینماید. DAG مستقيماً فعاليت پروتئين كيناز C (PKC) را تحريك میکند، در حالي كه IP3 بهطور غيرمستقيم و بهواسطه تخليه +Ca2 از ذخاير داخل سلولي، PKC را تحريك مینماید، سپسPKC فعاليت كمپلكس پروتئين G، گوانوزين تريفسفات (GTP) و NADPH Oxidase را تحريك میکند. اين مجموعه NADPH را به +NADP تبديل میکند و در اين حال به كمپلكس 558b فلاووسيتوكرومي كه به غشاء متصل است، دو الكترون میدهد، سپس سيتوكروم 558 b اين مراحل را با دادن دو الكترون به اكسيژن براي تبديل آن به سوپراكسيداز، تكميل مینماید (برگرفته از کتاب میکروبشناسی پزشکی واکر)
(ج) توكسين پپتيد: توكسين پپتيد توسط لژيونلاهاي فاگوسيتشده توليد ميشود و بهنظر میرسد با مراحل اوليه فعاليت نوتروفيل توسط توقف فعاليت فسفوليپاز C، تداخل ميكند. مطالعات نشان داده است كه توكسين پپتيد براي سلول ميزبان سمي است، فعاليت مسیر هگزوز منوفسفات، نوتروفيل را مختل و شديداً توانايي فاگوسيتكنندهها براي يددار شدن[19] و كشتن باکتریها را مهار ميكند.
(د) متالوپروتئازهاي روي: متالوپروتئاز با وزن مولکولی 38 دالتون بهعنوان اصليترين پروتئين ترشحي لژيونلا پنوموفيلا است و احتمالاً شاخص اصلی بیماریزایی این باکتری است. این پروتئاز سیتوتوكسيك بوده و توليد سوپراكسيداز و كموتاكسي و مهاجرت PMN و فعاليت سلولهای كشنده طبيعي را مهار ميكند. همچنین آن سبب غيرفعال شدن α آنتيتريپسين و تجزیه دو پيامآور التهابي كليدي (يعني اينترلوكين 2 و فاكتور نكروز بافتي) و تخریب آنتیژنهای CD4 لنفوسیتها میشود. مهمتر از همه اينكه، چندين گروه نشان دادهاند كه اگر متالوپروتئاز روي از طريق تنفس به كسي داده شود، سبب ايجاد ضایعات ريوي ميگردد كه از ضایعاتی كه در انسان مبتلا به بيماري لژيونر پيدا ميشود، قابل افتراق نيست. البته اختصاصيت متالوپروتئاز براي اين امر مشخص نيست، زيرا بعضي از لژيونلاها كه فاقد مقدار قابل جستجوي پروتئاز هستند نيز ميتوانند بيماري را در خوكچه هندي ايجاد كنند.
(ه) ساير توليدات سلول: ساير توليدات لژيونلا كه كمتر مطرحاند عبارتند از: فسفوليپاز C، يك پروتئاز شبهكموتريپسين[20]، يك پروتئين كيناز فسفريلهكننده توبولين[21]، هيستونها و فسفاتيديل اينوزتيول و همولیزیني كه لژيولیزین[22] نام دارد.
(2) مراحل بیماریزایی:
لژيونلا از طريق مجاري تنفسي، بدون آلوده كردن مخاط گلو، وارد ريه ميگردد. باكتري ابتدا توسط ماكروفاژهاي ريوي و سپس توسط PMN فاگوسيته ميشود. سويه فيلادلفيا 1، لژيونلا پنوموفيلا با روشي به نام فاگوسيتوز Coiling، فاگوسيته ميشود. اين پروسه غيرمعمول، باكتري را در واكوئل پيچيدهاي قرار میدهد كه با ريبوزوم پوشيده شده است و باكتري در آن تكثير كرده و واكوئل فاگوسيتي را بدون اينكه تحريك به دگرانولاسيون بكند، از باكتري پر ميكند. ورود به روش فاگوسيتوز Coiling اختصاصي سويه فيلادلفياي 1 است و ساير لژيونلاها منجمله سروتايپهاي ديگر لژيونلا پنوموفيلا از طريق فاگوسيتوز مرسوم وارد شده و فاگوزومهاي حاوي اين باکتریها بهطور طبيعي به گرانولوهاي ثانويه الحاق ميشوند.
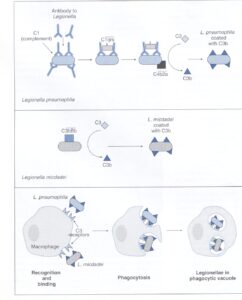
آنتیبادی و اجزاي كمپلمان نقش تعيينكنندهاي در ورود لژيونلا به سلول ميزبان دارند (شكل 4). لژيونلا پنوموفيلا فقط وقتي بهطور مؤثر وارد سلولهای فاگوسيتكننده ميشود كه جزء C3 كمپلمان توسط آنتیبادی ضد لژيونلا فعال شود و به MOMP و رسپتورهاي سلولي C3 باند شود. در عوض، لژيونلا ميكددي، كمپلمان را بهطور مؤثر از مسير آلترناتيو فعال ميكند و وقتي كه به C3 فعالشده در غياب آنتیبادی باند شود، ورودش تسهيل ميگردد.
در هر دو مورد آنتیبادی و كمپلمان لژيونلا را ليز نميكنند و مكانيسم كشتن را با ورود به فاگوسيتها فعال نمينمايند، در عوض بهبودی از لژيونلوزيس بستگي به ايجاد يك پاسخ ايمني سلولي قوي نسبت به باكتري دارد. حداقل يك آزمايشگاه گزارش كرده است كه رشد داخل سلولي باكتري توسط اينترفرون گاما محدود شده و سلولي كه با اينترفرون گاما فعال شده بود، باكتري را نكشت، اما با غيرقابل دسترس كردن آهن براي باكتري، سبب محدود شدن رشد آن گرديد. ديگران نشان دادهاند كه فاكتور نكروز تومور آلفا نيز فعاليت سينرژيكي با اينترفرون گاما دارد و سنتز نيتريك اكسايد را تحريك كرده و باعث محدوديتهاي بعدی جهت تكثير داخل سلولي لژيونلا ميشود.
مطالعات شرايط آزمايشگاهي و مدل حيواني نشان داده كه بيشتر لژيونلاهاي فاگوسيته شده، زنده نميمانند؛ اما آنهايي كه ميمانند، قادر به تكثير سریعاند كه سلول ميزبان را تخريب ميكنند. فاگوسيتكننده حاوي سويه فيلادلفيا 1 لژيونلا پنوموفيلا نميتواند دگرانوله شود، اما امروزه مشخص شده كه اين امر يكي از خصوصيات منحصر به فرد اين باكتري است. ساير سويهها ميتوانند با بلوكه نمودن انفجار تنفسي، درون ماكروفاژ و منوسیت زنده بمانند كه متعاقب آن سوپراكسيداز و ساير راديكالهاي آزاد سیتوتوكسيك تشكيل نميشوند. طي 30 دقيقه بعد از بلع لژيونلا توسط فاگوسيتكنندهها، توانايي آنها براي بلعيدن استافيلوكوكوس اورئوس و اشریشیا كلي از دست ميرود و ديگر با عوامل مختلفي كه معمولاً بهعنوان عوامل فعالكننده سلول فاگوسيتكننده بودند، نميتوانند فعال شوند، بنابراين بهمحض اينكه سلول فاگوسيتکنندهای لژيونلا را ببلعد، توانايي خود را براي دفاع از بدن از دست میدهد.
آميبها نيز در مراحل بیماریزایی لژيونلا نقش دارند. مطالعات شرايط آزمايشگاهي نشان داده است كه موشهایی كه همزمان با لژيونلا پنوموفيلا و آميب هارتمانلا ورميفورميس آلوده شدهاند، نسبت به موشهایی كه فقط با لژيونلا آلوده شده بودند، درجات بسيار شديدتري از ابتلاي به لژيونلوزيس ريوي را نشان دادهاند كه بهصورت بیماریهای شديد ريوي بوده است. البته موشها وقتي كه همزمان به لژيونلا و هارتمانلا آلوده شدهاند بهطور طبيعي به عفونت لژيونلا و ايجاد بيماري لژيونلوزيس ريوي مقاومت نشان دادهاند.
شكل 4: ورود لژيونلا به سلول ميزبان
لژيونلا پنوموفيلا كمپلمان را از مسير كلاسيك فعال میکند، در صورتی که لژيونلا ميكددي از مسير آلترناتيو ايجاد C3b مینماید. در هر مورد، C3b از طريق پروتئینهای اصلي غشاء خارجي (MOMP) به گيرندههاي C3 موجود در سطح ماكروفاژها متصل میشود و باكتري فاگوسيت میگردد. درون سلول ميزبان، باكتري پاسخ اكسيداتيو را بلوكه كرده و درون واكوئل فاگوسيتيك تكثير مییابد (برگرفته از کتاب میکروبشناسی پزشکی واکر)
بیماریهای حاصل از لژيونلا
گروهي از محققين حدس میزنند كه سالانه بين 20 تا 50 هزار مورد بيماري لژيونر در ایالات متحده آمريكا رخ میدهد، در حالي كه سايرين معتقدند كه تعداد واقعي حتي از اين ميزان نيز بيشتر است و بنظر میرسد كه در هر جايي لژيونلا عامل 1 تا 15 درصد از پنومونيهاي حاصل از جمعيت و 1 تا 40 درصد پنومونيهاي بيمارستاني باشد.
بيماري لژيونر عموماً در كساني كه زياد وضعيت ايمني خوبي ندارند، خصوصاً مبتلايان به نقص ايمني با مشكلات قلبي ريوي، افراد مسن، سيگاريها، افراد مبتلا به بيماري مزمن ريوي (COPD)[23]، افراد دارای سوندگذاري در ناي، مصرفکنندگان داروهاي سركوب ايمني يا كورتيكواستروئيد (مثلاً در پيوند كليه) و وجود لوسمي Hairy all (كه در آن عمل منوسیت سركوب میشود) بيشتر خطرزا است. افرادی که پيوند كليه داشتند بیشتر به لژيونلا ميكدي حساسند و در كمال تعجب، مبتلايان به ايدز و نوتروپني به بيماري لژيونرها حساس نيستند.
علائم باليني:
اگرچه عفونتهاي لژيونلا بهصورت عفونت بافت نرم، اندوكارديت يا پريكارديت نيز ظاهر ميشود، اما عمدتاً بهصورت بيماري لژيونرها و يا تب پونتياك بروز ميكند.
(الف) بيماري لژيونرها: بيماري لژيونرها پنوموني حاد چركي است كه از نظر باليني و راديولوژي از پنوموني پنوموككي غيرقابل تشخيص است. بيماري 2 تا 10 روز بعد از مواجهه بيمار با آب حاوي لژيونلا ظاهر ميشود كه در ايمني سرکوبشده، دوره كمون کوتاهتری دارد. در طي 24 تا 48 ساعت اول بيماري، تظاهرات شامل تب، بيحالي، درد عضلات، سردرد، ضعف و از دست دادن اشتها است، سپس بيماران بهشدت بدحال شده و از درد سينه پلورتيك يا غير پلورتيك رنج ميبرند و داراي تب بالا (اغلب بالاتر از 40/5 درجه سلسیوس يا 104/9 درجه فارنهايت) و سرفه خشك هستند. هموپتزي نادر است، اما معمولاً خلط چركي در چند روز آينده مشاهده میشود. در اكثر موارد راديوگرافي، سوراخ شدن جنب بهصورت لكه ديده شده كه بيشتر در نواحي تحتاني ريه بهصورت پنوموني یکطرفه درمیآیند. پنوموني چند روز پيشروي ميكند كه اين پيشروي حتي چند روز بعد از درمان آنتیبیوتیکي مناسب طول ميكشد.
اگرچه بيماري لژيونر يك بيماري است كه چند عضو را گرفتار ميكند، اما بروز علائم غیر ریوی بسيار بيشتر از پنوموني پنوموككي است. از اين علائم ميتوان به اسهال آبكي (در 25 تا 50 درصد موارد)، تهوع، استفراغ و درد شكم (10 تا 20 درصد) اشاره كرد. علائم عصبي شامل گيجي آنسفالوپاتي، نوروپاتي، آتاكسي مغزي و سردرد است. بيماري كليوي، سينوزيت و درگيري قلب بهصورت پريكارديت و اندوكارديت است. بعضي از بيماران دچار لرز شديد شده و يك پنجم بيماران دچار افت فشارخون ميگردند.
(ب) تب پونتياك: تب پونتياك معمولاً بعد از 24 تا 48 ساعت بهصورت اپيدمي در كساني كه با منبع محيطي لژيونلا روبرو شدهاند، ايجاد میگردد و بيماري در 90 درصد اين افراد پيشروي ميكند. تب پونتياك شبيه آنفلوانزاست و داراي تب بالا، سردرد، اسهال، بدحالي است ولي پنوموني وجود ندارد، گاهي بيمار دچار سرفه خشك يا علائم عصبي است و بيشتر بيماران در عرض 1 هفته بدون درمان خوب ميشوند.
تشخيص آزمايشگاهي
هرچند كه علائم كلينيكي غیراختصاصی است؛ اما موارد زير ميتواند در تشخيص پنوموني لژيونلايي کاربرد داشته باشد:
- تب بالا (بيشتر از 39 درجه سلسیوس يا 101/8درجه فارنهايت)
- بيمار دچار نقص ايمني يا دچار COPD است.
- ممكن است سطح سرمي آنزيم اسپارتات آمينوترانسفراز (ASAT) و γ– گلوتاميل ترانسفراز (GGT) در اين بيماران بالا برود.
- در رنگآميزي نمونههاي تنفسي، نوتروفيلها به تعداد زياد و باکتريها به تعداد کم مشاهده ميشوند.
- ميزان سديم خون كمتر از 130 ميلي اكيوالان در ميليليتر است.
- پنوموني به آنتيبيوتيكهاي بتالاكتام و آمينوگليكوزيدها جواب نميدهد.
- اكثر بيماران در سه روز اول عفونت، راديوگرافي قفسة سينة غيرطبيعي دارند.
به دليل اينكه بيماري ناشي از لژيونلا داراي علائم كلينيكي و راديولوژيكي اختصاصي نيست، بهناچار ميبايست از تستهاي آزمايشگاهي اختصاصي براي تشخيص عفونت استفاده نمود.
نمونهگیری:
نمونهگيري اکثراً از دستگاه تنفس تحتاني انجام ميشود. تكنيكهاي متعددي براي نمونهگيري وجود دارد كه از همه رايجتر، جمعآوري خلط بيماران است. تكنيكهاي پيچيدهتري مانند آسپيراسيون ترشحات برونش و ناي، لاواژ آلوئولها، بيوپسي بافت ريه و بيوپسي باز ريه در موارد لزوم، استفاده ميگردد. نمونه بيوپسي ريه و يا برونكوسكوپي، مفيدترين نمونههايي هستند كه براي تشخيص لژيونلا مورد استفاده قرار ميگيرند. نمونههاي ديگر شامل ادرار، خون، سرم و بافت ريه نيز جهت تشخيص استفاده ميگردند.
نکته مهم: تیمار خلط با یک اسید ضعیف (0/2مولار اسیدکلریدریک/ کلرید پتاسیم با pH 2/2) به مدت 4 دقیقه یا با حرارت (60 درجه سلسیوس) به مدت 2 دقیقه میتواند در کاهش آلودگی نمونه از سایر ارگانیسمها مؤثر واقع گردد، اما ممکن است تعداد لژیونلاها را نیز کاهش دهد.
برای تشخیص آزمایشگاهی لژیونلا پنوموفیلا از روشهای زیر استفاده میشود:
مشاهده مستقیم عامل بیماری در نمونههای کلینیکی
برای رنگآمیزی از روش اشباع نقره (Diettere Silver) استفاده میشود. از آزمایش ایمونوفلورسانس مستقیم {(DFA) Direct Fluorescent Antibody} نیز استفاده میگردد. این روش سریع و اختصاصی است و در مواردی که برداشت بهوسیله آسپیراسیون تراشه، نمونههای بیوپسی و نمونههای حاصل از شستشوی برنش بهعمل آید تا 70% موارد، بیماران مبتلا به لژیونلوز را مشخص میکند. لژيونلا ميكددي بهصورت باسيلهاي اسيدفست ضعيف در خلط ظاهر ميشود.
اگرچه بيماري لژيونر يك بيماري باكتريايي است، اما لژيونلا با رنگ گرم خوب رنگ نميگيرد و بيشتر لژيونلاها درون ماكروفاژها هستند. اين عوامل دليل خوب رنگ نشدن لژيونلا در PMN ترشحات است كه اغلب منجر به نتايج منفي ميشود.
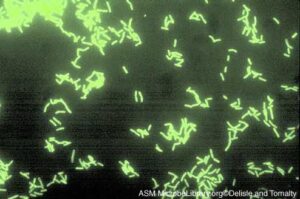
تكنيك DFA (Direct Fluorescent Antibody)
اولين روش مورد استفاده در يافتن لژيونلا در بافت ريه و ترشحات تنفسي، روش آنتيبادي فلورسنت مستقيم بود. لژيونلا حتي چندين روز پس از درمان ضد ميكروبي، با تکنيک DFA قابلتشخيص است (شكل 5). رنگآميزي DFA همچنين براي طبقهبندي سرولوژيك لژيونلاها مورد استفاده قرار ميگيرد. به دليل واكنش متقاطع سرولوژيک با باکتریهای ديگر، پيشنهاد ميشود كه آنتيسرمهاي پليكلونال غير لژيونلايي براي تستهاي معمول در نمونههاي باليني مورد استفاده قرار نگيرد. حساسيت روش DFA براي تشخيص لژيونلوز در ترشحات تنفسي از 25 تا 75 درصد و اختصاصيت آن بيش از 95 درصد گزارش شده است. امروزه به دلیل اینکه روشهای جدید شناسایی با حساسیت بالاتری ارائه شده است، معمولاً از این روش استفاده نمیکنند.
شكل 5: رنگآميزي لژيونلا پنوموفيلا با تكنيك DAF و مشاهده آنها زير ميكروسكوپ فلورسانت
کشت
لژيونلا پنوموفيلا، اولين بار با استفاده از محيط مولرهينتون آگار تقویتشده با هموگلوبين و ايزوويتالكس جداسازي شد. تركيب ضروري موجود در هموگلوبين براي لژيونلا پنوموفيلا، شكل محلول آهن و در ايزوويتالكس، ال-سيستئين است. اين محيط كشت به نام فيلي-گورمن ناميده شد. از آنجا که برخي اسيدهاي چرب موجود در محيط کشت براي باکتري سمي هستند، نشاسته و زغال، جهت سمزدايي محيط اضافه شدند، همچنین منابع آمینواسید با عصاره مخمر جايگزين گرديد و محيط كشت CYE (Charcoal Yeast Extract Agar) ابداع شد. اين محيط كشت، محيطي پايه براي رشد لژيونلا است. محيطهاي كشت مورد استفاده براي لژيونلا چندين بار تغيير كرد و نهايتاً محيط كشت BCYE (Buffered Charcoal Yeast Extract Agar) طراحي گرديد.
هرچند اكثر گونههاي لژيونلا روي محيط BCYE رشد ميكنند، ولي برخي گونهها براي رشد به آلبومين گاوي نيز نياز دارند. محيط كشت BCYE چندان انتخابي نيست، ولي با اضافه كردن آنتيبيوتيكهاي مختلف ميتوان محيط را براي رشد لژيونلاها انتخابي نمود؛ بهعنوان مثال، اگر به محيط سه آنتيبيوتيك سفامندول، پليميكسين B و آنيزومايسين بهعنوان ضد قارچ و مخمر اضافه گردد، محيط انتخابي BMPA (BCYE+Cefamandol+ Polymixin B+ Anisomysin) بهوجود ميآيد، همچنين اگر گليسين، وانكومايسين، پليميكسين B و آنيزومايسين را به محيط كشت BCYE اضافه كنيم، محيط انتخابي ديگري به نام MWY (Modified Wadowsky and Yee) ايجاد ميشود.
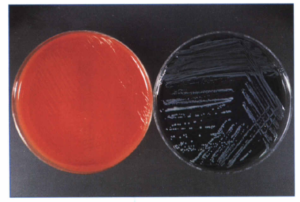
در صورتی که به محيط BCYE، وانكومايسين، پليميكسين B و آنيزومايسين و رنگهايي مثل بروموكروزول ارغواني و برومو تيمول آبي اضافه گردد، محيط PAV (PolymixinB+Anisomysin+Vanconmycin) بهوجود ميآيد. حضور اين رنگها باعث سهولت جداسازي لژيونلا پنوموفيلا از لژيونلاهاي ديگر ميگردد؛ زيرا در اين محيط، فقط كلنيهاي لژيونلا پنوموفيلا به رنگ سبز درمیآیند، ولي كلني ساير لژيونلاها آبي رنگ ميشوند. لازم به ذکر است كه اين باکتریها روي محيط بلاد آگار رشد نميكنند (شكل 6). برخی از لژیونلاها میتوانند روی شکلات آگار رشد نمایند.
لژيونلاها را ميتوان در محيطهاي پيچيدهي فوق در 6/9 = pH و دماي 35 درجه سلسیوس و رطوبت 90 درصد رشد داد. رشد لژيونلاها روي محيطهاي مصنوعي كند بوده و چند روز انکوباسيون (3 تا 5) براي ديدن كلنيها لازم است. کلنیها اغلب بهصورت رنگینکمانی (Irdesent) با حالت چسبندگی هستند. كشتهاي منفي را بايد تا 14 روز نگهداري كرد.
براي كشت لژيونلا، به محيطهاي انتخابي و غیرانتخابی (در بالا اشاره شد) نياز است كه اين محيطها با يا بدون استفاده از رنگهاي انديكاتور تهيه ميشوند. کلنيهاي لژيونلا، بهواسطه اين رنگها ظاهر ويژهاي پيدا ميکنند. اكثريت گونههاي لژيونلا روي محيط BCYE آگار رشد سريعي دارند ولي برخي براي افزايش رشد نياز به آلبومين گاوي دارند. کشت در دو پلیت، یکی بهصورت نقطهای و دیگری به شکل Steark method انجام میشود و در مورد کشت خون از محیط دیفازیک که فاز جامد آن CYE است، استفاده میگردد.
كشت در بيماراني كه از نظر سرولوژي مثبت هستند، يعني افزايش تيتر آنتيبادي در آنها چهار برابر است حساسيتي برابر 60 درصد و ويژگي در حدود 100 درصد دارد. از عوامل محدودکنندة ارزش كشت، ناتواني و عدم اطلاع کادر آزمايشگاهي از چگونگي كشت خالص لژيونلا است. باكتري در ترشحات تنفسي بهصورت ضعيف، زنده ميماند، بنابراين كشت سريع نمونهها بسيار ضروري است. جداسازي باکتري از ترشحات تنفسي توسط کشت از 20 تا 80 درصد حساسيت دارد. مطالعات مختلف نشان میدهد که کشت خلط، خصوصاً در ابتداي بيماري که بيمار سرفه چنداني ندارد ارزش كمتري دارد. بهتر است قبل از کشت از تيمار حرارتي يا اسيدي در مورد نمونهها استفاده شود.
شكل 6: رشد لژيونلا پنوموفيلا روي محيط BCYA بعد از 3 روز انكوباسيون (سمت راست)، عدم تشكيل كلني روي محيط بلادآگار (سمت چپ)
تستهاي سرولوژيك جهت تشخيص آنتيبادي بر عليه گونههاي لژيونلا، تكنيك ايمونوفلورسانس غيرمستقيم، ارزيابي آنزيمي و ميكروآگلوتيناسيون، در بيماري لژيونر بهكار رفته است. استفاده از روش هماگلوتيناسيون غیرمستقیم، براي تشخيص لژيونلاهاي سروگروه 1 تا 4 و تكنيكهاي ديگر شامل كانتر ايمنو الكتروفورز در تشخيص اين باکتري کاربرد دارد. استفاده از فلاژل در تست اليزا فقط در مورد لژيونلا پنوموفيلا سروگروه 1 مؤثر است. از تست اليزا براي تشخيص آنتيژنهاي ديگر لژيونلا پنوموفيلا سروگروه 1 تا 6 استفاده شده است.
افزایش چهار برابری یا بیشتر در تیتر منفرد آنتیبادی تا حداقل 1:128 تیتر سرم در مرحله نقاهت نسبت به مرحله حاد بر ضد لژیونلا پنوموفیلا در نمونه سرم دلیل بر بیماری است. مشاهده یک تیتر منفرد آنتیبادی 1:256 شاهد احتمالی بر عفونت قبلی است. حساسیت تشخیص سرولوژی برای بیماری ایجادشده توسط سایر گونهها به غیر از لژیونلا پنوموفیلا سروگروپ 1 شناخته نشده است. اختصاصیت تستهای آنتیبادی برای بیماری ایجادشده توسط سایر گونهها کمتر از لژیونلا پنوموفیلا سروگروپ 1 است.
تشخيص سرولوژيك بيماري لژيونر در ابتدا متداولترين روش تشخيصي بوده، اما نياز به نمونههاي سرم كه در هفته سوم و ششم بيماري بايستي گرفته میشد، باعث كاهش استفاده از اين روش شده است. در حال حاضر تشخيص آنتيژنهاي ادراري با استفاده از روش اليزا متداولترين روش تشخيص بيماري لژيونر است.
تشخيص آنتيژنهاي ادراري لژيونلا
تشخيص آنتيژنهاي لژيونلا در ادرار با روش الیزا (ELISA) و رادیو ایمونو اسی (RIA)، تشخيص اوليه و سريع بيماري را ممکن ميسازد. آنتيباديي كه در اين روش استفاده ميشود، عمدتاً براي لژيونلا پنوموفيلا سروگروه 1 است. اگرچه اكثر موارد بيماري لژيونر در انسان، توسط لژيونلا پنوموفيلا ايجاد میشود، با اين حال 40 درصد از كل موارد لژيونلوز، با اين روش ممكن است تشخيص داده نشوند، همچنين آنتيژنهاي موجود در ادرار، پس از نگهداري طولاني مدت ممكن است تجزيه شوند. اين آنتيژنها شامل قسمتي از ليپوپليساكاريد ديواره سلولي لژيونلا بوده و به حرارت مقاومند. مطالعات نشان داده كه اين آنتیژن، 3 روز پس از ابتلا به بيماري و شروع علائم، در ادرار حضور داشته و براي بيش از 30 روز تا چند ماه باقي ميماند. حساسيت اين روش 93 و اختصاصيت آن 100 درصد گزارش گرديده است.
نکته مهم: تشخيص تب پونيتاك بیشتر سرولوژيكي است.
بروز مشكلاتي بهواسطه وجود واكنشهاي متقاطع در متدهاي سرولوژيك، محققين را تشويق به استفاده از تكنيكهاي مولكولي، بهویژه PCR نموده است. تكنيكهاي DNA-probe مبتني بر استفاده از ژن rRNA در تشخيص لژيونلا پنوموفيلا بهكار گرفته شده است. حساسيت تست ضعيف بوده و قادر به تشخيص 1000 ارگانيسم در نمونه است. تكنيك PCR براي تشخيص اين باکتري در آبهای محيطي و نمونههاي كلينيكي داراي حساسيتي بيش از روش DNA-probe است. تكنيك PCRاز آنچنان حساسيتي برخوردار است كه ميتواند حضور حتي يك باکتري را در نمونه رديابي نمايد.
مطالعات نشان داده است که حساسیت PCR جهت شناسایی مستقیم گونههای لژیونلا در نمونههای بالینی 64 تا 100 درصد و اختصاصیت آن 88 تا 100 است. جهت شناسایی ایزولهها میتوان از تعیین توالی ایزولههای کشت دادهشـده استفاده کرد. برای تعیین حساسیت عمدتاً از ژن mip، 5S rRNA، 16S rRNA، توالي ناحيه بين 16S -23S rRNA و ژن dnaJ استفاده شده است. از اين ميان ژنmip بيش از سايرين مورد توجه بوده است.
نکته مهم: بهطور خلاصه، بهترين راه تشخيص، كشت باكتري از آسپيره ناي است. بعداً ميتوان براي تأييد بيشتر، خلط را رنگآمیزی گيمنز كرد و DFA انجام داد و ادرار را براي حضور آنتیژنهای لژيونلا جستجو نمود.
درمان و تعیین حساسیت دارویی:
درمان بيماري لژيونر معمولاً با اريترومايسين و گاهي تركيب با ريفامپين صورت ميگيرد. در روش ديگر بيماران بهطور موفقیتآمیز با تريمتوپريم سولفامتوكسازول، يك ماكروليد جديد، تتراسايكلين يا داكسيسايكلين نيز درمانمی شوند. آنتیبیوتیکهای بتالاکتام دارای فعالیت درون سلولی مورد قبول علیه لژیونلا پنوموفیلا نیستند. در افراد داراي ايمني سالم، آنتیبیوتیک 10 تا 14 روز بايد مصرف شود و در مبتلايان به نقص ايمني درمان آنتیبیوتیکي طولانیتر است.
بيماران معمولاً 3 تا 5 روز بيماري را نشان میدهند، اما علائم راديولوژي بسيار كند حذف ميشوند. بيشتر افراد با ايمني سالم سريع به درمان جواب میدهند، اما ميزان مرگومیر در بيماراني كه به بیماریهای وخيم مبتلا هستند به 50 درصد میرسد. اغلب تأخير در تشخيص سبب تأخير در آغاز درمان و سبب شكست درمان ميگردد.
بيماران مبتلا به تب پونتياك معمولاً بدون درمان طي يك هفته خوب ميشوند.
به دلیل اینکه باکتری درون سلولی بوده و تعيين حساسيت ضد ميكروبي در شرايط in vitro ارتباطي با درمان ضد ميكروبي در بيماران ندارد، انجام تستهاي تعيين حساسيت به عوامل ضد ميكروبي روي لژيونلاها در آزمايشگاه توصيه نميشود.
[1] -Joe McDade
[2] -Legionella pneumophila
[3]– Hugh Tatlock
[4]– Tatlock agent
[5]-Legionnaires’ disease
[6] -L. micdadei
[7] -L. bozemanii
[8] -L. dumoffii
[9] -L. longbeachae
[10]– Charcoal-yeast extract agar
[11]– Attenuated
[12]– Hartmannella
[13] -Naegleria
[14] -Ciliated Tetrahymena
[15] – Major Outer Membrane Protein(MOMP)
[16] – Macrophage infectivity potentiator
[17]– Peptidyl prolyl cis-trans isomerase
[18] -Folding
[19] -Iodinate
[20] -Chymotrypsinlike protease
[21] -Tubulin
[22] -Legiolysin
[23]– Chronic obstructive pulmonary disease
https://www.cdc.gov/legionella/about/causes-transmission.html
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام