آزمایشهای فارماکوژنومیک
و تأثیر بر درمان بر اساس ژنتیک بیمار
دکتر علی عجمی1، انسیه خیراللهی2
- دکتری علوم آزمایشگاهی-آزمایشگاه پاتوبیولوژی نوبل
- کارشناسی ارشد بیوتکنولوژی- آزمایشگاه پاتوبیولوژی نوبل
مقدمه
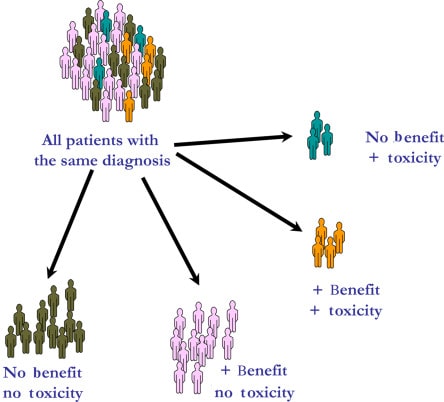
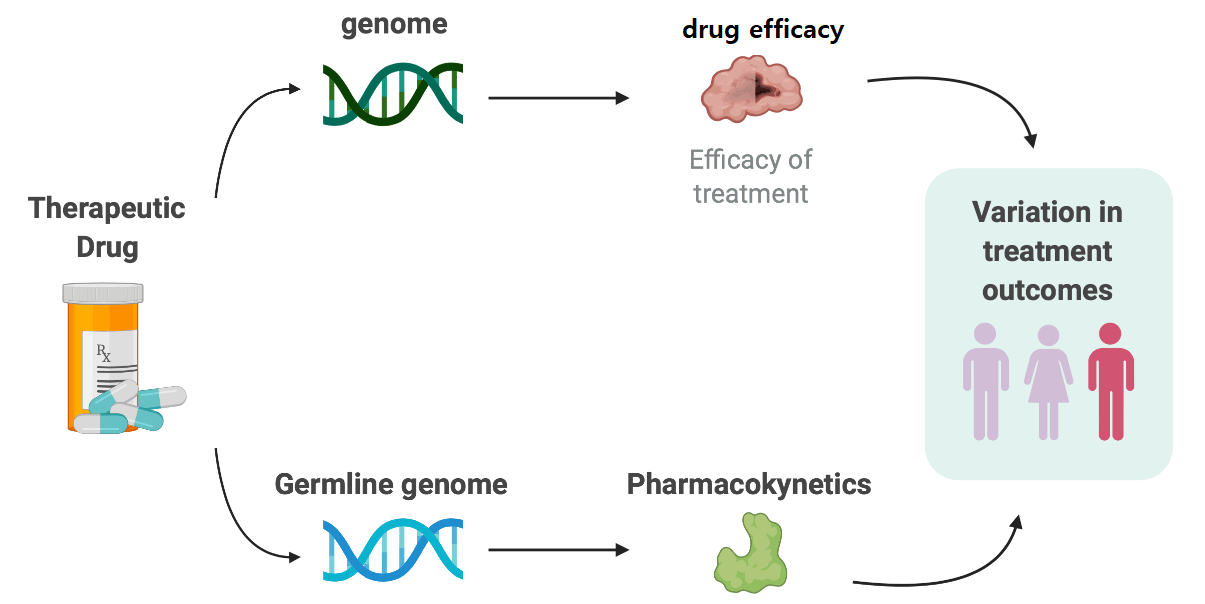
علم فارماکوژنومیکس با شناسایی انواع ژنتیکی که بر اثرات داروها تأثیر میگذارند، تمرکز میکند. این تأثیر معمولاً از طریق تغییرات در فارماکوکینتیک (یعنی نحوه جذب، توزیع، متابولیزه شدن یا حذف دارو) یا فارماکودینامیک، (یعنی تغییر هدف یا ایجاد اختلال در مسیرهای بیولوژیکی مؤثر بر دارو) اعمال میشود. در این مطالعات حساسیت بیمار نسبت به دارو بررسی میشود.
در بیماریهایی غیر از سرطان و بیماریهای عفونی، در درجه اول تغییرات ژنتیکی موردنظر در DNA ژرمین دارای اهمیت هستند که از والدین به ارث میرسند و پس از آن تغییرات جدیدی هستند که عملکرد محصولات ژنی را تغییر میدهند. در سرطان، هر دو نوع ارثی و اکتسابی جسمی میتوانند بر پاسخ بیمار به درمانها تأثیر بگذارند.
در بیماریهای عفونی، تنوع ژنتیکی میتواند بر حساسیت پاتوژن به داروهای ضد میکروبی تأثیر بگذارد. پیشرفت فنآوریهای جدید در زمینهٔ بررسی تغییرات ژنتیکی و تحلیل نتایج مربوط به آنالیزهای ژنومی آگنوستیک بیماران با فنوتیپهای خاص واکنش به دارو (بهطور مثال بررسی سمیت دارو یا اثرات فارماکولوژیک) کمک شایانی به علم فارموکوژنومیکس داشته است. درواقع مهمترین دستآورد این فنآوریها تعریف فنوتیپ پاسخ دارویی پس از تحلیل و بررسی ژنوم میباشد.
هنگامیکه یک رابطه فارماکوژنومیک کشف شد و تائید شد، هنوز موانع زیادی برای اعمال آن به درمان بالینی وجود دارد. این امر مستلزم آن است که درمان مؤثر و جایگزین برای افرادی که دارای ژنوتیپهای پرخطر هستند، همچنین بهبود سیستمهای مراقبتهای بهداشتی و رویکردهای ساختاریافته برای راهنمایی تجویز (بهعنوانمثال، الگوریتمها) در دسترس باشد.
تکامل فارماکوژنومیک
در سال 1959، فردریش ووگل، ژنتیکشناس آلمانی، اولین کسی بود که از اصطلاح “فارماکوژنتیک” استفاده کرد، این مفهوم در ابتدا توسط مطالعات فارماکولوژیست الیوت وسل و جان جی پیج آشکار شد، در مطالعهی مذکور ثابت شد مشخصات فارماکوکینتیک داروی ضد درد آنتیپیرین در دوقلوهای تک تخمکی شباهت بیشتری نسبت به دوقلوهای دو تخمکی دارد.
ارتباط بین فارماکوکینتیک و ژنتیک افراد در مطالعهای در زمینهٔ تفاوت در متابولیسم ایزونیازید و عوارض جانبی آن در خانوادهها و گروههای دارای توارث ژنتیکی بیشتر آشکار شد. دههها بعد، نشان داده شد که تفاوتها در متابولیسم ایزونیازید ناشی از انواع ژن NAT2 است که آنزیم N-استیل ترانسفراز 2 را کد میکند. با ادامهی مطالعات، وراثت برای بسیاری از اثرات دارویی مورد ارزیابی قرار گرفت و درنتیجه منجر به مطالعات مولکولی شد که عوامل ارثی را برای بسیاری از صفات مربوط به درمانهای دارویی نشان داد. در سال 1987، CYP2D6 اولین ژن متابولیزه کننده داروی انسانی مشخص شد.
در دهه 1990، کاربرد بالینی بالقوه فارماکوژنومیک بهوضوح برای چندین ژن، ازجمله TPMT، که آنزیم تیوپورین متیل ترانسفراز را کد میکند، نشان داده شد. مانند بسیاری از زمینههای ژنتیک، سرعت کشف فارماکوژنتیک توسط پروژه ژنوم انسانی و با فناوریهای بهبودیافته برای بررسی تنوع در کل ژنوم تسریع شده است. این استراتژیهای گسترده ژنومی همچنین به وارد کردن اصطلاح “فارماکوژنومیک” به فرهنگ واژگان فارماکولوژی کمک کردند. برخی از مطالعات دامنه خود را برای ارزیابی تأثیر آزمایش بر کل سیستم مراقبت بهداشتی، ازجمله مقایسه هزینههای آزمایش ژنتیکی با سایر مداخلات مراقبتهای بهداشتی و همچنین بررسی اینکه چگونه و تا چه حد میتواند این آزمایشها بر روال درمانی توسط پزشک تأثیر بگذارد، گسترش دادهاند.
به عنوان مثال، هنگکنگ سیاستی را برای غربالگری آلل HLA-B*1502 قبل از تجویز داروهای ضد صرع معرفی کرد زیرا بیماران مبتلا به این آلل در معرض خطر بالایی برای ایجاد واکنشهای پوستی شدید به داروی کاربامازپین هستند. لذا این سیاست باعث شد که پزشکان از تجویز کاربامازپین خودداری کنند و در عوض شروع به تجویز فنیتوئین کردند.
در سرتاسر جهان، گروههای زیادی برای به اشتراک گذاشتن منابعی کار میکنند که اجرای بالینی آزمایشهای فارماکوژنتیک را تسهیل میکند. کنسرسیوم پیادهسازی فارماکوژنتیک اروپا یک نهاد بینالمللی است که هدف آن بهبود درمان با ادغام اطلاعات فارماکوژنتیک در مراقبتهای بالینی است. در ایالاتمتحده، اعضای شبکه تحقیقاتی فارماکوژنوم IC NIH، پروژه فارماکوژنتیک 57-61،101-103 را سازماندهی کردند که به اشتراکگذاری بهترین شیوهها برای اجرای بالینی دستورالعملهای فارماکوژنومیک CPIC اختصاص دارد.
در همین حال، شبکههای الکترونیکی پروندههای پزشکی و ژنومیک (eMERGE) و پیادهسازی ژنومیکس در عمل (IGNITE) در حال آزمایش استراتژیهای پیادهسازی فارماکوژنتیک هستند. در تایلند و سنگاپور، جایی که نوع HLA-B*15:02 گسترده است و بیماران را بهشدت مستعد مسمومیت شدید پوستی پس از درمان با داروهای خاص میکند، آزمایش فارماکوژنتیک رایج است 106-108 Genomic Medicine Alliance109 استفاده بالینی فارماکوژنومیک را تسهیل میکند و پایگاه دادهای ایجاد کرده است که داروها را با ژنها پیوند میدهد.
مراحل اجرای فارماکوژنومیک
PharmGKB (http://www.pharmgkb.org) بهعنوان یک پایگاه دانش مبتنی بر وب در دسترس عموم است که هدف آن کمک به محققان در درک اینکه چگونه تنوع ژنتیکی بین افراد به تفاوت در واکنشها به داروها کمک میکند است. خلاصه تصویری از دادههای موجود و نحوه ادغام انواع مختلف اطلاعات در PharmGKB در هرم دانش PharmGKB ارائه شده است.
توسعه و تلفیق مفاهیم اساسی فارماکوکینتیک و فارماکودینامیک همراه با نتایج آزمایشهای مختلف بالینی مانند آزمایشهای HLA و آزمایشهای مولکولی خاص، امکان فردی کردن دوز دارو در جمعیتهای مختلف بیماران را فراهم نموده است. همچنین متخصصان بیهوشی را قادر میسازد تا عوامل بیهوشی را بر اساس ویژگیهای ژنتیکی فرد در دوز مناسب انتخاب کنند. استفاده از این مفاهیم در انواع سناریوهای بالینی و جمعیت بیماران امکان اختصاصی کردن دوز را فراهم میکند و درنتیجه خطر عوارض را کاهش میدهد.
با کسب دانش بیشتر در مورد تفاوتهای پاسخ به دارو، دوز تجربی مانند میلیگرم به ازای هر کیلوگرم وزن کل بدن در حال حذف از تخصص بیهوشی است. همچنین در متابولیسم داروها بخش عمدهای از متابولیسمها در فاز I توسط آنزیمهای چندشکلی، بهویژه اشکال مختلف سیتوکروم P450 (CYP) انجام میشود. تأثیر پلیمورفیسمهای ژنتیکی داروهای متابولیزهشده توسط CYP2C9، CYP2C19 و CYP2D6 در نفوذ قابلتوجهی از این پلیمورفیسمها، بر متابولیسم 20 تا 30 درصد داروهای مورداستفاده بالینی تأثیر میگذارد.
پلیمورفیسم ژنتیکی چندین آنزیم فاز II، ازجمله برخی مربوط به شیمیدرمانی سرطان، نیز مهم است .همچنین دادههای فارماکوژنومیک برای درمان بیماران قلبی در خصوص نوع و دوز دارو دارای اهمیت میباشد. پس از بررسیهای فارماکولوژی و بررسی مکانیسم انتقال و تأثیر دارو، آزمایشهای بالینی مولکولی مربوطه بر روی فرد انجام شده و استعداد هر فرد در پاسخ به درمان و اثرات جانبی مشخص میشود، لذا در هر نوع درمان پس از انجام این آزمایشهای بالینی نوع و دوز دارو با حداکثر تأثیر و حداقل عوارض انتخاب میشود.
آزمایشهای بالینی
چندین آزمایش فارماکوژنومیک در حال حاضر برای استفاده در بخش بالین در دسترس هستند، مشابه هر درمان یا آزمایش جدید، آزمایشهای فارماکوژنومیک نیز باید قبل از اتخاذ در عمل بالینی ازنظر اقتصادی و مقرونبهصرفه بودن بررسی شوند؛ بنابراین، با صعود قیمت دارو و محصولات بیولوژیکی که از طریق فارماکولوژی طراحی شدهاند از یکسو و تجزیهوتحلیل مقرونبهصرفه از سوی دیگر، بهطور فزایندهای تقاضای متخصصان جهت درمان افزایش یافته است.
در این روش پس از شناخت ارتباط ژن موردنظر با مکانیسم عمل دارو، آزمایشهای لازم جهت تشخیص ژنوتیپ هدف در بیمار انجام شده و دوز یا نوع دارو انتخاب میشود. بهطور مثال، اگزالیپلاتین یک داروی ضد سرطان است که بهطورمعمول برای درمان سرطانهای روده بزرگ، معده مری، تخمدان، سینه و دستگاه تناسلی استفاده میشود. قطع درمان اگزالیپلاتین بیشتر به دلیل نوروپاتی محیطی است. چندین استراتژی برای جلوگیری از سمیت عصبی تاکنون بررسی شده است.
برای غلبه بر این عارضه جانبی تهدیدکننده زندگی، درحالیکه از فعالیتهای ضد نئوپلاستیک اگزالیپلاتین بهره میبریم، یافتههای اخیر در مورد مکانیسمهای زمینهای انواع ژنتیکی مرتبط با سمیت و مقاومت به شیمیدرمانی مبتنی بر اگزالیپلاتین در سرطان کولورکتال مشخص شده است. یک پنل جامع از هشت پلیمورفیسم که قبلاً بهعنوان نشانگرهای مهم مرتبط با سمیت اگزالیپلاتین تائید شدهاند.
درواقع با ارزیابی اولیه از هزینهها و روشهای ژنوتیپسازی و اثرات جانبی و درمانی با این دارو میتوان نتیجهگیری کرد بررسی ژنوتیپ بیمار جهت تعیین دز درمانی بهصرفه میباشد. با در دسترس بودن پروفایلهای فارماکوژنومیک فردی، انکولوژیستها ابزار جدیدی برای تصمیمگیری درمانی برای بیماران خود خواهند داشت که حداکثر سود و حداقل سمیت را دارند. با در نظر گرفتن این هدف، پزشک بالینی و مدیر آزمایشگاه باید برای ارزیابی مزایا و محدودیتها، ازنظر هزینه و قابلیت کاربرد، مناسبترین آزمایشهای فارماکوژنومیک برای ادغام روتین در عمل بالینی همکاری کنند.
رویکرد پیشرو از فارماکوژنومیکس
به نظر میرسد که پیشرفتهای فناوری و ابزار به کمک علوم بیولوژِی و پزشکی که مدلهای پلیمرفیسم را برای بهینهسازی درمان دارویی ایجاد میکنند، هزینههای مطالعات و فعالیتهای بالینی را کاهش میدهد؛ اما ازآنجاییکه استراتژیهای فارماکوژنومیک به بخشی معمول از کشف و توسعه دارو تبدیل میشوند، چنین مدلهایی باید از آزمایشهای بالینی در مقیاس بزرگ و پیگیری داروهای جدید پدیدار شوند. ابتکارات عمومی – مانند شبکه تحقیقات فارماکوژنتیک (http://www.PharmGKb.org) که توسط مؤسسه ملی بهداشت تأمین میشود – همراه با سایر ابتکارات دانشگاهی و صنعتی، نیروی محرکه این علم را تأمین خواهد کرد. با توجه به میلیونها پلیمورفیسم ژنومی انسانی، بهترین راه پیش رو احتمالاً از طریق تکرار آزمایشهای بالینی در مقیاس بزرگ بر روی بیمارانی است که بهطور یکنواخت درمان و ارزیابی شدهاند.
این کارآزماییها باید شامل مطالعات فارماکوژنومیک جامع و دقیق، همراه با مدلهای تجربی پیش بالینی باشد که ارتباط بالینی ژنوتیپ- فنوتیپ را تقویت میکند. ادغام آزمایشهای ژنتیکی در کارآزماییهای بالینی ممکن است ازنظر بررسی همتایان معمولی «نوآورانه» تلقی نشود، اما برای پیشرفت بالینی ضروری است. اگر قرار است استفاده از دارو از رویکرد “آزمون و خطا” به درمان فردی با استفاده از ژنتیک تبدیل شود، حداقل دو جنبه از مراقبتهای بهداشتی باید تغییر کند.
ما باید محافظت در برابر سوءاستفاده از اطلاعات ژنتیکی را معرفی کنیم و هزینههای اضافی را که ممکن است در طول انتقال به تصمیمات هدایت شده ژنتیکی در مورد دارودرمانی متحمل شوند، بپذیریم. در درازمدت، کاهش فراوانی عوارض جانبی دارو و افزایش احتمال موفقیتآمیز بودن درمان احتمالاً هزینه مراقبتهای بهداشتی را کاهش میدهد. فارماکوژنومیکس این پتانسیل را دارد که این فرآیند را با ترجمه دانش تنوع ژنوم انسانی به درمانهای بهتر تسهیل کند.
REFERENCES:
- Relling MV, Evans WE. Pharmacogenomics in the clinic. Nature. 2015 Oct;526(7573):343-50.
- Whirl‐Carrillo M, McDonagh EM, Hebert JM, Gong L, Sangkuhl K, Thorn CF, Altman RB, Klein TE. Pharmacogenomics knowledge for personalized medicine. Clinical Pharmacology & Therapeutics. 2012 Oct;92(4):414-7.
- Eichelbaum M, Ingelman-Sundberg M, Evans WE. Pharmacogenomics and individualized drug therapy. Annu. Rev. Med.. 2006 Feb 18;57:119-37.
- Evans WE, Relling MV. Moving towards individualized medicine with pharmacogenomics. Nature. 2004 May;429(6990):464-8.
- Di Francia R, Siesto RS, Valente D, Del Buono A, Pugliese S, Cecere S, Cavaliere C, Nasti G, Facchini G, Berretta M. Current strategies to minimize toxicity of oxaliplatin: selection of pharmacogenomic panel tests. Anti-cancer drugs. 2013 Nov 1;24(10):1069-78
- Beaulieu M, De Denus S, Lachaine J. Systematic review of pharmacoeconomic studies of pharmacogenomic tests. Pharmacogenomics. 2010 Nov;11(11):1573-90.
- Jain KK. Innovative diagnostic technologies and their significance for personalized medicine. Molecular diagnosis & therapy. 2010 Jun;14(3):141-7.
https://medlineplus.gov/genetics/understanding/genomicresearch/pharmacogenomics/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام