اختلالات غده آدرنال (4)
فئوکروموسیتوما
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفی: کارشناس ارشد میکروبشناسی، دانشگاه علوم پزشكي جندي شاپور اهواز
مقدمه
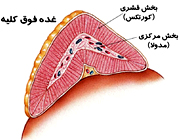
بر روی هر کلیه، یک عدد غده فوق کلیوی (آدرنال) وجود دارد. این غده، یک غده درونریز است و با ترشح هورمونها، سلامت بافتها و اعضای بدن را حفظ میکند. غده فوق کلیه، به بخش داخلی (مدولا) و بخش خارجی (کورتکس) تقسیم میشود. بخش داخلی (مدولا) غده فوق کلیه که حدود 20% غده را شامل میشود، از نظر عملی، با سیستم سمپاتیک مرتبط بوده و مسئول ترشح هورمونهای اپینفرین و نوراپینفرین است. این هورمونها نیز بهنوبه خود موجب بروز همان اثرات تحریک مستقیم اعصاب سمپاتیک در تمام قسمتهای بدن میشوند.
بیوسنتز نوراپینفرین و اپینفرین
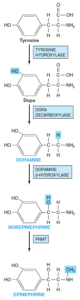
هورمونهای دوپامین، نوراپینفرین و اپینفرین در سلولهای کرومافین مدولای آدرنال و از تیروزین ساخته میشوند. این 3 هورمون مجموعاً کاتکولامینها نامیده شده و جزو خانواده آمینهای حیاتی (Bioamines) میباشند و محصول ترشحی سیستم سمپاتوآدرنال هستند. کاتکولامینها برای تطابق (Adopt) بدن با طیف وسیعی از استرسهای حاد و مزمن، لازم هستند.
در ابتدا، تیروزین توسط تیروزین هیدروکسیلاز و بر روی حلقه، هیدروکسیله شده و تولید دوپا میکند، سپس دوپا دچار دکربوکسیلاسیون شده و تولید دوپامین مینماید. دوپامین نیز بهنوبه خود با هیدروکسیله شدن (توسط دوپامین β- هیدروکسیلاز) بر روی زنجیره جانبی، تولید نوراپینفرین میکند. نوراپینفرین توسط PNMT (فنیل اتانول آمین N- متیل ترانسفراز)، متیله شده و تولید اپینفرین مینماید.
محصول اصلی تولیدشده در مدولای فوق کلیه، اپینفرین بوده که حدود 85-80% کاتکولامینهای مدولا را تشکیل داده و در بافتهای خارج از مدولا، تولید نمیشود. برعکس، قسمت عمده نوراپینفرین نهتنها در مدولای فوق کلیه که در نواحی مختلف سیستم عصبی مرکزی (Central Nerves System; CNS) و در انتهای عصبی سیستم عصبی آدرنرژیک نیز ساخته شده و از طریق گردش خون به بافتهای هدف میرسد.
دوپامین عمدتاً بهعنـــوان یــک نروترانســــمیتر عمـــل کــرده و دارای اثر کمی بر متابولیسم سوخت (Fuel metabolism) میباشد.
تصویر: مسیر بیوسنتز کاتکولامینها
PNMT: Phenylethanolamine-N-methyltransferase
ترشح کاتکولامینها:
ترشح نوراپینفرین و اپینفرین از مدولای آدرنال، توسط استرسهای مختلف شامل درد، هموراژی (خونریزی)، فعالیت، هیپوگلیسمی (کاهش میزان قند خون) و هیپوکسی (کاهش اکسیژنرسانی به بافتها) تحریک میشود. آزاد شدن این هورمونها توسط انتقال ایمپالسهای عصبی القاء شده توسط استرس
((Stress-induced transmission of nerve impulses که از هسته آدرنرژیک هیپوتالاموس نشأت میگیرند، وساطت میشود. این ایمپالسها، موجب تحریک آزاد شدن نروترانسمیتر استیل کولین از نرونهای پرهگانگلیونیک شده که به سلولهای مدولای آدرنال، پیامدهی میکنند. استیل کولین موجب دپلاریزاسیون غشاء پلاسمایی این سلولها (سلولهای مدولای آدرنال) شده که موجب ورود سریع یونهای کلسیم خارج سلولی به درون سیتوزل میشود. کلسیم باعث سنتز و آزاد شدن نوراپینفرین و اپینفرین از گرانولهای کرومافین به فضای خارج سلولی توسط پدیده اگزوسیتوز میشود.
اثرات فیزیولوژیک نوراپینفرین و اپینفرین:
کاتکولامینها از طــــــــــــریق دو نوع رسپتور اصلی در غشاء پلاسمایی سلولهای هدف شامل رسپتورهای α- آدرنرژیک و β – آدرنرژیک میشود. عملکرد نوراپینفرین و اپینفرین در کبد، آدیپوسیتها (سلولهای چربی)، سلولهای عضله اسکلتی و سلولهای α و β پانکراس، به طور مستقیم، متابولیسم سوخت را تحت تأثیر قرار میدهد. این کاتکولامینها دارای اثرات متابولیک بر روی انتقال سوختها از محلهای ذخیره خود برای اکسیده شدن توسط سلولهای نیازمند به انرژی بالا در استرسهای حاد و مزمن هستند. کاتکولامینها همزمان موجب سرکوب ترشح انسولین میشوند تا اطمینان حاصل شود که جریان آزاد شدن سوختها برای استفاده سوختی تا زمانی که محرک استرسزا وجود دارد، ادامه دارد.
علاوه بر آن، نوراپینفرین بهعنوان یک نروترانسمیتر عمل کرده و سیستم عصبی سمپاتیک در قلب، ریهها، عروق خونی، مثانه، روده و سایر ارگانها را تحت تأثیر قرار میدهد. این اثرات کاتکولامینها بر روی قلب و عروق خونی، موجب افزایش برونده قلبی و فشارخون سیستمیک به منظور تسهیل تحویل مواد سوختی منتقل شونده از طریق خون به بافتهای فعال از نظر متابولیکی میشود.
جدول: خلاصه فعالیتهای مهم اپینفرین و نوراپینفرین
| گیرنده | فعالیت |
| α1 | افزایش گلیکوژنولیز کبدی |
| α2 | مهار آزادسازی انسولین |
| β1 | تحریک آزادسازی رنین |
| افزایش لیپولیز | |
| β2 | تحریک آزادسازی انسولین |
| افزایش گلیکوژنولیز کبدی و عضلانی | |
| β3 | تحریک لیپولیز |
| افزایش تولید کالری در اکثر بافتها |
اپینفرین دارای نیمهعمر کوتاهی در خون بوده و برای داشتن اثر فارماکولوژیکی مؤثر، باید بهصورت تزریقی تجویز گردد. اپینفرین ممکن است در کلینیک به منظور تقویت ضربان قلب، گشاد کردن عضلات برونشی ملتهب شده و حتی کاهش خونریزی از ارگانها در طی جراحی استفاده شود.
متابولیسم و غیرفعال سازی کاتکولامینها
کاتکولامینها دارای افینیتی (تمایل) نسبتاً کمی به رسپتورهای α و β هستند. آنها پس از اتصال به این رسپتورها، بلافاصله از رسپتورها جدا شده و موجب میشوند که دوره پاسخ بیولوژیک، کوتاه باشد. هورمون آزاد، از راههای مختلفی تجزیه میگردد.
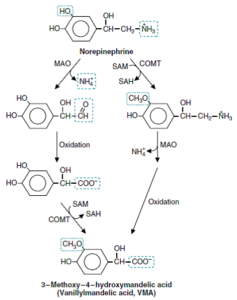
عملکرد کاتکولامینها از طریق بازجذب به درون ترمینالهای پیشسیناپسی و انتشار از سیناپس، خاتمه مییابد. آنزیمهای تجزیهکننده در ترمینالهای پیشسیناپسی و سلولهای مجاور شامل سلولهای گلیال و سلولهای اندوتلیال وجود دارند. دو تا از واکنشهای اصلی در پروسه غیرفعالسازی و تجزیه کاتکولامینها بهوسیله مونوآمین اکسیداز (MAO) و کاتکول–O– متیل ترانسفراز (COMT) کاتالیز میشوند. MAO در غشاء خارجی میتوکندری بسیاری از سلولها وجود داشته و موجب اکسیده شده کربن دارای گروه آمین به یک آلدئید و درنتیجه، آزاد شدن یون آمونیوم میشوند.
در ترمینال پیشسیناپسی، MAO موجب غیرفعال شدن کاتکولامینهایی میشود که در وزیکلهای ذخیرهای محافظت نشدهاند، بنابراین داروهایی که موجب خالی شدن وزیکلهای ذخیرهای میشوند، به طور غیرمستقیم، موجب افزایش تجزیه کاتکولامینها میشوند.
COMT نیز در بسیاری از سلولها از جمله گلبولهای قرمز یافت میگردد. COMT بر روی طیف وسیعی از کاتکولهای خارج نرونی و آنهایی که از سیناپس انتشار پیدا کردهاند، میشود. COMT موجب انتقال یک گروه متیل از SAM (S–آدنوزیل متیونین) به یک گروه هیدروکسیل در کاتکولامین یا محصول تجزیهشدهی آن میشود. از آن جایی که واکنش غیرفعالسازی، نیازمند وجود SAM میباشد، بنابراین، این روند بهصورت غیرمستقیم به وجود ویتامینهای B12 و اسید فولیک وابسته است.
تصویر: غیرفعال سازی کاتکولامینها
MAO: Monoamine oxidase
COMT: Catechol O-methyltransferase
SAM: S-adenosylmethionine
SAH: S-adenosylhomocysteine
تعریف بیماری فئوکروموسیتوما
فئوکروموسیتوما یک تومور ترشحکننده کاتکولامین بوده که از سلولهای کرومافین قسمت مرکزی (مدولا) آدرنال (90% موارد) منشأ میگیرد. این تومور ممکن است در نواحی خارج آدرنال (گردن، شکم، …) (10% موارد) هم دیده شود که به پاراگانگلیوما (گانگلیای سمپاتیک) موسوم است. این تومور در صورت تشخیص و درمان صحیح، علاجپذیر بوده، اما در صورت تشخیص و یا درمان نادرست، میتواند کشنده باشد. این تومور مقادیر زیادی اپینفرین و نوراپینفرین ترشح میکند.
شیوع
فئوکروموسیتوما یک نئوپلاسم نادر با شیوع سالیانه 2 تا 8 مورد در هر 1 میلیون نفر میباشد. فئوکروموسیتوما کمتر از 0/2% افراد دارای هیپرتانسیون (فشارخون بالا) را دربرمیگیرد. سن شیوع آن اغلب دهه چهارم و پنجم زندگی میباشد.
طبقهبندی فئوکروموسیتوما
در 10% موارد، فئوکروموسیتوما خارج از آدرنال رخ میدهد. 10% موارد فئوکروموسیتوما در کودکان رخ میدهد. در 10% موارد دوطرفه است، در 10% موارد عود میکند، در 10% موارد بدخیم است، در 10% موارد فامیلیال است.
| سندرم فامیلیال | ||
| Familial pheochromocytoma | ||
| فئوکروموسیتوما، کارسینوم مدولاری تیروئید و هیپرپاراتیروئیدیسم | MEN Type 2 A | Multiple endocrine neoplasia (MEN) type 2 |
| فئوکروموسیتوما، مدولاری کارسینومای تیروئید، نورومای مخاطی و چهره مارفانوئید | MEN Type 2 B | |
| نوروفیبروما (تومور اعصاب محیطی ناشی از پرولیفراسیون غیرطبیعی سلولهای شوان) و نقاط پوستی به رنگ قهوهای روشن به نام Café-au-lait | Neurofibromatosis type 1 (NF1) | |
| همانژیوبلاستومای (تومور خوشخیم عروقی) سیستم عصبی مرکزی، رتینال آنژیوما (تومور عروق خونی شبکیه)، کارسینومای سلولهای کلیه، کیستهای احشایی، فئوکروموسیتوما و تومورهای سلول جزیرهای پانکراس | Von Hippel-Lindau disease (VHL) | |
علائم و نشانههای فئوکروموسیتوما
علائم آن شامل تریاد کلاسیک تپش قلب، تعریق و سردرد است. در کنار این علائم، میتواند علائم دیگری نیز مانند تهوع، استفراغ، درد شکم و فلاشینگ وجود داشته باشد که غیراختصاصی هستند. از دیگر علائم آن میتوان به فشارخون بالا اشاره نمود.
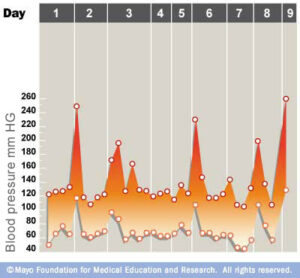
فئوکروموسیتوما میتواند سبب نوسانات شدید در فشارخون با فشارخون طبیعی در فواصل بین آنها شود که این شرایط، تشخیص را مشکلتر میسازد. نمودار، یک دوره 9 روزه از افزایشهای کوتاه و غیرمنظم فشارخون ناشی از فئوکروموسیتوما را نشان میدهد. نقاط پایینی، نشاندهنده فشار دیاستولیک و نقاط بالایی بیانگر فشار سیستولیک هستند. بهعنوان مثال، نخستین افزایش در فشارخون در روز دوم با مقدار 250/110 میلیمتر جیوه مشاهده میشود.
یافتههای آزمایشگاهی
- کاتکولامینها و متانفرینهای ادرار 24 ساعته: حساسیت و اختصاصیت این آزمایش حدود 98% است. در این آزمایش، اندازهگیری کراتینین ادرار نیز به منظور حصول اطمینان از جمعآوری صحیح ادرار 24 ساعته باید انجام شود. نتایج بالاتر از 2 برابر محدوده بالایی میزان طبیعی کاتکولامینها و متانفرین های ادرار بهعنوان تست مثبت در نظر گرفته میشوند.
اندازهگیری متانفرینها، حساسیت تشخیصی بالاتری نسبت به اندازهگیری کاتکولامینها در بیماران مبتلا به فئوکروموسیتوما دارد.
داروهای الکل (اتیل)، آمینوفیلین، کلرال هیدرات، کلونیدین (درمان مزمن)، مواد حاجب رادیوگرافیک یددار، دیسولفیرام، اپینفرین، اریترومایسین، انسولین، متنامین، متیل دوپا، نیکوتینیک اسید (دوزهای زیاد)، نیتروگلیسرین، کوانیدین، ریبوفلاوین و تتراسایکلینها ممکن است موجب افزایش سطح کاتکولامینها شوند.
داروهای گوانتیدین، رزرپین و سالیسیلاتها ممکن است موجب کاهش سطح کاتکولامینها شوند.
- وانيليل ماندليك اسيد (VMA) (Vanillylmandelic acid) در ادرار 24 ساعته: وانيليل ماندليك اسيد (VMA)، متابوليت اصلي ناشي از متابوليسم كاتكولامینها ميباشد. در هنگام افزايش كاتكولامینها، ميزان توليد VMA نيز افزايش مييابد. استرس، هيپوگليسمي، هيپرتيروئيديسم، ورزش شدید، گرسنگی، استعمال دخانيات، برخی غذاهای خاص (چای، قهوه، شکلات، وانیل و کاکائو) و برخي داروها مانند لوودوپا، اپینفرین، لیتیوم و نیتروگلیسرین ميتوانند منجر به افزايش توليد كاتكولامينها و در نتيجه افزايش VMA شوند.
کاهش کاذب VMA ممکن است در اورمیا، ادرار قلیایی، مصرف برخی داروها مانند کلونیدین، دیسولفیرام، گوانتیدین، ایمیپرامین، بازدارندههای مونوآمین اکسیداز، فنوتیازینها و رزرپین و مواد حاجب یددار رادیواکتیو مشاهده شود. اسكن راديواكتيو ميتواند به مدت يك هفته در اين آزمايش تداخل نمايد.
مقدار طبیعی VMA در افراد بالغ، کمتر از 6/8 میلیگرم در 24 ساعت میباشد.
- هومووانیلیک اسید (HVA) در ادرار 24 ساعته: هومووانیلیک اسید (HVA) نیز مانند سایر متابولیتهای کاتکولامینها (VMA و دوپامین) در افراد دارای تومورهای تولیدکننده کاتکولامینها (فئوکروموسیتوما، نروبلاستوما و …) افزایش مییابد. HAV و VMA ممکن است در مانیتورینگ بیماران مبتلا به تومورهای تولیدکننده کاتکولامین که تحت درمان هستند، مفید باشد. سطح HAV در اختلالات متابولیسم کاتکولامینها تحت تأثیر قرار میگیرد، به طوری که در کمبود مونوآمین اکسیداز A، سطح آن کاهش یافته، اما در کمبود دوپامین β- هیدرولاز (آنزیم تبدیلکننده دوپامین به نوراپی نفرین)، سطح HAV افزایش مییابد، بنابراین افزایش سطح HAV در فئوکروموسیتوما، نروبلاستوما، کمبود دوپامین β- هیدرولاز و تجویز L – دوپا مشاهده میشود. کاهش سطح HAV نیز میتواند نشاندهنده کمبود افزایش سطح مونوآمین اکسیداز A باشد.
از مصرف L– دوپا باید (با نظر پزشک معالج)، 24 ساعت قبل از انجام آزمایش و همچنین در طی دوره جمعآوری نمونه خودداری شود.
مصرف باکتریم (Bactrim) (sulfamethoxazole and trimethoprim) ممکن است موجب تداخل در نتیجه آزمایش HVA و VMA شود.
مقدار طبیعی HVA در افراد بالغ، قابل اندازهگیری نیست.
- متانفرینهای آزاد پلاسما: برخی گروهها معتقدند که مقدار متانفرینهای آزاد پلاسما باید بهعنوان تست خط اول تشخیص فئوکروموسیتوما در نظر گرفته شوند. سهولت جمعآوری نمونه خون نسبت به جمعآوری ادرار 24 ساعته و ارتقاء تکنیکهای آزمایشگاهی باعث شده که تست اندازهگیری مقادیر آزاد پلاسمایی متانفرین و نورمتانفرین به روش “کروماتوگرافی مایع با فشار بالا” (HPLC) همراه با اسپکترومتری جرمی بهعنوان آزمایش ابتدایی برای تشخیص فئوکروموسیتوما مطرح باشد.
حساسیت و اختصاصیت این تست به ترتیب 100-96% و 89-85% میباشد، بنابراین ارزش پیشگویی منفی تست، بسیار بالا است.
بیمار باید قبل از انجام آزمایشهای “کاتکولامینها و متانفرینهای ادرار 24 ساعته” و ” متانفرینهای آزاد پلاسما”، از مصرف داروهای مداخله کننده در اندازهگیری این ترکیبات، تحت نظر پزشک معالج، خودداری کند. مصرف کافئین و الکل، ورزش شدید، استرس، گرسنگی و داروهای ضدافسردگی سه حلقهای، لابتالول، لوودوپا، لیتیوم، نیتروگلیسرین، دکونژستانها، آمفتامینها، اتانول و بنزودیازپینها میتوانند موجب افزایش کاذب نتایج این تستها شوند.
داروهای متیروزین و متیل گلوکامین که در مواد حاجب رادیوگرافیک مشاهده میشوند، میتوانند موجب کاهش کاذب نتایج این تستها شوند.
مصرف استامینوفن میتواند با اندازهگیری متانفرینها به روش HPLC تداخل کند و از این رو، باید 48 ساعت قبل از انجام آزمایش مصرف آن قطع گردد.
قبل از انجام این تست، فرد باید به مدت 30 دقیقه به حالت تکیهداده، بر روی صندلی بنشیند و سپس از وی نمونهگیری به عمل آید. نمونه باید بر روی ضد انعقاد EDTA و بر روی ظرف حاوی یخ گرفته شود.
مقدار طبیعی نورمتانفرین، کمتر از 0/5 نانومول در لیتر و مقدار طبیعی متانفرین کمتر از 0/9 نانومول در لیتر میباشد. هنگامی که مقادیر هرکدام از این دو ماده (نورمتانفرین و متانفرین) بیشتر از 4 برابر حد بالای مقدار طبیعی باشد، تشخیص فئوکروموسیتوما داده میشود. در مواقعی که مقادیر نورمتانفرین و متانفرین کمتر از 4 برابر حد بالای مقدار طبیعی باشد، تستهای تکمیلی (تست سرکوب کلونیدین و تست تحریکی گلوکاگن) باید انجام شوند.
- تست سرکوب کلونیدین (Clonidine suppression test; CST): در افراد با فشارخون بالای مقاوم به درمان، هنگامی که سطح کاتکولامینها بالا (نوراپی نفرین بیشتر از 2000 پیکوگرم در میلیلیتر) میباشد، تشخیص فئوکروموسیتوما به سهولت داده میشود، اما در مواردی که سطح پایه کاتکولامینها به طور قابلتوجـــــــــــــهی بالا نیست، تشخیص افتراقی هایپرتانسیون اساسی (Essential hypertension) از فئوکروموسیتوما مشکل میباشد. در این هنگام، استفاده از تستهای سرکوبکننده و تحریکی ممکن است ضرورت داشته باشد.
کلونیدین یک آگونیست α-آدرنرژیک و سرکوبکننده قوی تولید کاتکولامینها میباشد، اما هیچ اثری (و یا تنها اثر اندکی) بر سرکوب تولید کاتکولامینها در بیماران فئوکروموسیتوما دارد.
قبل از انجام این تست، فرد باید به مدت 30 دقیقه به حالت تکیهداده، بر روی صندلی بنشیند. سپس 0/3 میلیگرم (300 میکروگرم) کلونیدین (برای یک فرد با وزن 80 – 60 کیلوگرمی) بهصورت خوراکی به فرد داده شده و 3 ساعت بعد، نمونهگیری انجام خواهد شد.
نمونه باید بر روی ضدانعقاد EDTA و یا هپارین گرفته شده و بر روی ظرف حاوی یخ قرار گیرد. پلاسمای نمونه باید در کمتر از 30 دقیقه جدا شود.
در تست سرکوب کلونیدین، در حالت طبیعی، مقدار نوراپینفرین و اپینفرین، بیشتر از 50% نسبت به حالت پایه، کاهش خواهد داشت. در حالی که در بیماران مبتلا به فئوکروموسیتوم، کلونیدین قادر به سرکوب مقادیر پلاسمایی نوراپینفرین نخواهد بود.
- تست تحریک گلوکاگون (Glucagon stimulation test): گلوکاگن بهعنوان یک ماده تحریکی در تولید کاتکولامینها عمل میکند. در بیماران مبتلا به فئوکروموسیتوما، این پاسخ تحریکی قابل توجه میباشد.
قبل از انجام این تست، فرد باید به مدت 30 دقیقه به حالت تکیهداده، بر روی صندلی بنشیند. سپس 1 میلیگرم گلوکاگن بهصورت تزریقی تجویز شده و 2 دقیقه بعد، نمونهگیری انجام خواهد شد. نمونه باید بر روی ضد انعقاد EDTA و یا هپارین گرفته شده و بر روی ظرف حاوی یخ قرار گیرد. پلاسمای نمونه باید در کمتر از 30 دقیقه جدا شود.
در تست تحریکی گلوکاگن، در حالت طبیعی، مقدار نوراپینفرین، کمتر از 3 برابر حالت پایه، افزایش خواهد داشت.
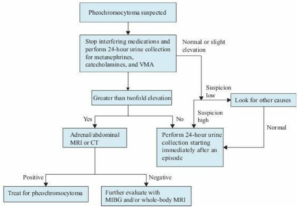
تصویر: الگوریتم بررسی فئوکروموسیتوما
CT: Computed Tomography
MIBG: [123I]-metaiodobenzylguanidine (MIBG) scintigraphy
MRI: Magnetic resonance imaging
VMA: Vanillylmandelic acid
سایر مطالعات و بررسیها
تکنیکهای “تومــوگرافی کامپــیوتری” (CT) و “تصـــویربرداری رزونانــس مغــــناطیسی” (MRI) قــــادر به تشخـــیص اغلب تومــــورهای منفرد هســــتند؛ زیرا آنها اغـــلب بزرگتر از 3 سانتیمتر هســــــــتند. در بیماران مشکـــوک به فئوکروموسیتوما که نتایج CT و MRI آنها منفــــی میباشـــــد، [123I]-metaiodobenzylguanidine (MIBG) scintigraphy میتواند کمککننده باشد.
Refrences:
1- Arneson W, Brickell J. Clinical chemistry; a laboratory perspective. 2007.
2- Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2015; 12th edition.
3-Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J. Harrison’s principles of internal medicine. 2015; 19th edition.
4- Crook MA. Clinical biochemistry and metabolic medicine. 2012; 8th edition.
5-Rodwell VW, Bender DA, Botham KM, Kennelly PJ, Weil PA. Harper’s illustrated biochemistry. 2015; 30th edition.
6- Smith CS, Marks AD, Lieberman M. Marks basic medical biochemistry. 2012; 4th edition.
7-Williamson MA, Snyder LM. Wallasch’s interpretation of diagnostic tests. 2015; 10th edition.
8- Chatterjea MN, Chawla R. Clinical chemistry. 2010; 2nd edition.
9- محمدی رضا. هورمونشناسی تئوری. 1392. چاپ اول.
سرطان آدرنال (سرطان غده فوقکلیه) قسمت سوم
اختلالات غده آدرنال (2) بیماری آدیسون
https://emedicine.medscape.com/article/124059-overview
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام


عالی