عوامل ضد باکتریایی
(بخش سوم)
دكتر رضا ميرنژاد (استاد تمام دانشگاه)
ادامه مبحث آنتیبیوتیکهای مهارکننده سنتز دیواره سلولی
در بخش گذشته در خصوص گروهی از آنتیبیوتیکهای مهارکننده سنتز دیواره سلولی یعنی خانواده پنیسیلینها بهطور مفصل بحث گردید. در این بخش به دیگر آنتیبیوتیکهایی که مانع سنتز دیواره سلولی میشوند و بسیار هم رایج هستند اشارهای کوتاه میگردد.
سفالوسپورینها، سفامایسین و آنتیبیوتیکهای وابسته:
سفالوسپورینها و همخانواده آنها، سفامایسینها، گروه بزرگی از آنتیبیوتیکهای بتالاکتام را تشکیل میدهند.
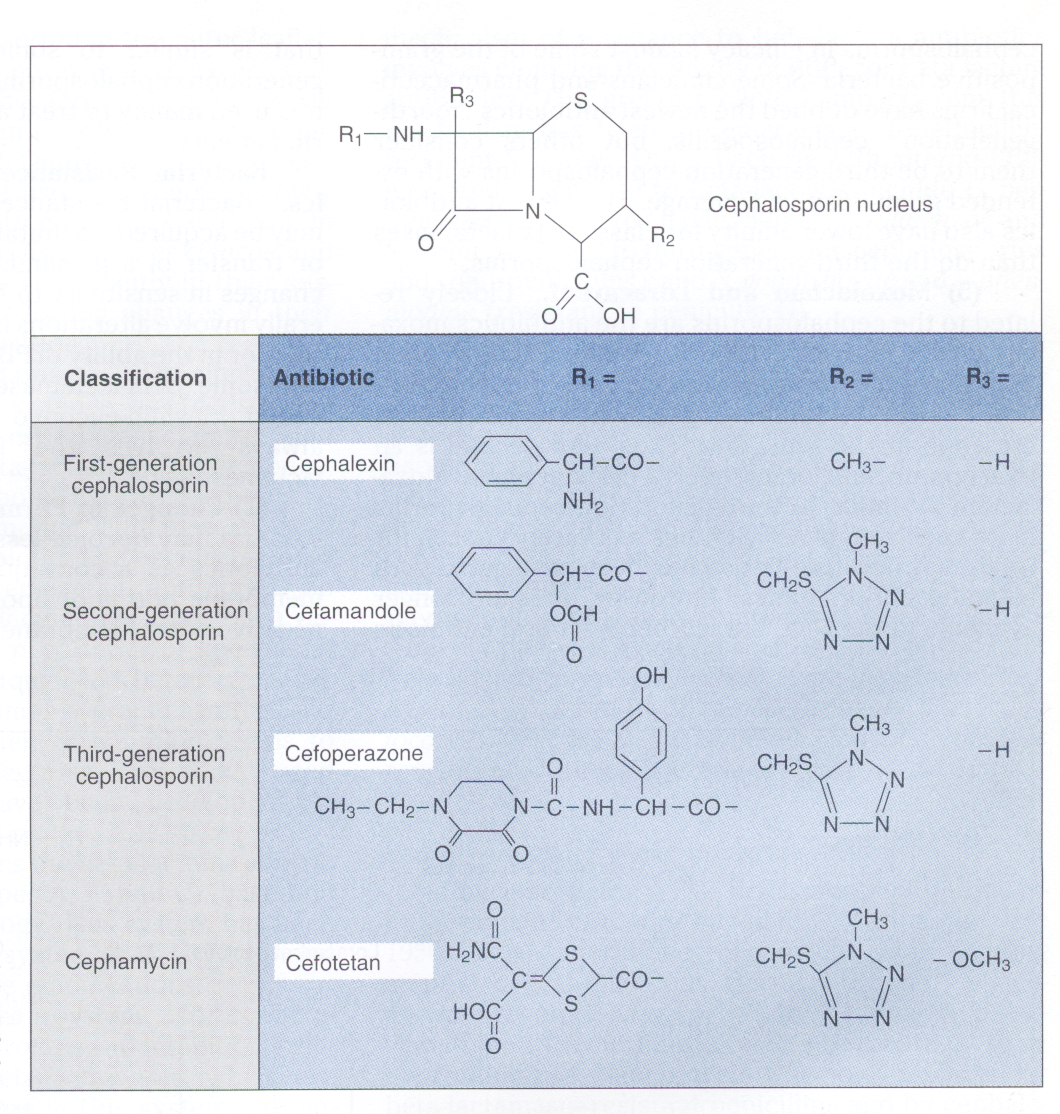
سفالوسپورینها نیمه سنتتیک هستند و از 7- آمینوسفالوسپورانیک اسید[1] مشتق شدهاند و دارای حلقه بتالاکتام و حلقه شش عضوي دی هیدروتیازین میباشند (شكل 1).
سه گروه R به هر سفالوسپورین متصل است:
گروه 1 R به همان سایت گروه R پنیسیلین متصل میشود و تفاوت در این گروه، بر فعالیت ضدمیکروبی آنتیبیوتیک از طریق پایدار شدن آن در برابر بتالاکتامازهای خاص، اثر میگذارد.
گروه 2 R که به محل 3 حلقه دی هیدروتیازین چسبیده، تأثیر بر روی متابولیسم و خواص فارماکوکینتیک دارو دارد.
چند سفالوسپورین و تمام سفامایسین ها گروه R سومی هم دارند که به حلقه بتالاکتام چسبیده است. این گروه آنتیبیوتیک را در برابر فعالیت بسياري از بتالاکتامازها مقاوم میسازد.
هسته سفالوسپورین (7-آمینوسفالوسپورانیک اسید) توسط کپک سفالوسپورینوم آکرومونیوم[2] ترشح میشود. هرکدام از سفامایسینها که بهواسطه داشتن یک گروه 7-α- متوکسی با سفالوسپورینها فرق میکنند، بهصورت نیمهصنعتی از منابع مختلف مشتق شدهاند. سفوكسیتين از سفامايسين C، سفوتتان از ارگانومايسين G و سفمتازول از آمینوسفالوسپورانیک اسید مشتق شدهاند. سفالوسپورینها نسبت به عمل پنیسیلیناز مقاومند و بعضی از سفالوسپورینها (نسل سوم) در برابر غیرفعال شدن توسط بتالاکتامازها بجز بتالاکتامازهای کلاس I کروموزومی و یک کلاس جدید از بتالاکتاماز کد شونده توسط پلاسمیدها که فقط در باکتریهای کمی یافت میشوند، مقاومت میکنند.
سفالوسپورینها بر اساس تأثیر بر باکتریهای گرم منفی، به سه گروه یا نسل اصلی تقسیم میشوند. پیشرفتهای اخیر در تولید سفالوسپورینها منجر به پیدایش نسل چهارم نیز شده، اما این تقسیمبندی هنوز بهطور وسیع مورد قبول واقع نشده است. مثالهایی از اختلاف ساختمانی كه سبب اختلاف در نسلهای مختلف سفالوسپورینها است، در شكل 1 ارائه شده است.
شکل 1: هسته سفالوسپورینها و مثالهایی از ساختمان سفالوسپورینهای نسل اول و دوم و سوم و سفامایسین
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
(1) سفالوسپورینهای نسل اول:
سفالوسپورینهای نسل اول، اولین سفالوسپورینهايي بودند كه تولید شدند. این آنتیبیوتیکها ابتدا بر روی دستهای از باکتریهای گرم مثبت مثل پنوموککها، استرپتوکوکها، کلستریدیوم پرفرنژنز، کورینه باکتریوم دیفتریه، استافیلوکوکوس اپیدرمیدیس و استافیلوکوکوس اورئوس حساس به متیسیلین مؤثر بودند و بر روی سایر گروههای گرم مثبت که به تمام نسلهای سفالوسپورین مقاومند، مثل انتروکوکوس فکالیس، لیستریا منوسیتوژنز و استافیلوکوکوس اورئوس مقاوم به متیسیلین مؤثر نیستند. همچنین نسل اول سفالوسپورینها بر روی سویههای تولیدکننده بتالاکتاماز استرپتوکوک پنومونیه اثری ندارند. طیف کلینیکي فعالیت سفالوسپورینهاي نسل اول بر ضد باکتریهای گرم منفی محدود به باکتریهای رودهای اشريشیا کلی، کلبیسلا و پروتئوس میرابیليس است. بیشتر سفالوسپورینهای خوراکی از گروه نسل اول هستند.
(2) سفالوسپورینهای نسل دوم:
سفالوسپورینهاي نسل دومی از سفالوسپورینهاي نسل اول بیشتر اصلاح شدهاند. بعلاوه، بیشتر سفامایسینها، مشابه سفالوسپورینهاي نسل دوم هستند. سفالوسپورینهاي نسل دوم بر روی باکتریهای گرم منفی مؤثرتر هستند و تأثیر آنها بر روی باکتریهای گرم مثبت، مشابه یا فقط کمی کمتر از سفالوسپورینهاي نسل اول است. سفوروکسیم بیشترین تأثیر بر روی سویههای تولیدکننده بتالاکتاماز هموفيلوس انفلوانزا و نایسریا مننژیتیدیس (دو عامل عمده مننژیت کودکان) را داشته است. بعلاوه سفوتتان و سفوکسیتین بر روی نایسریا گونورهآی که تولید پنیسیلیناز میکند، نیز تأثیر دارند. سفوتتان و سفومایسین که بسیاری آنها را جزو سفالوسپورینهاي نسل سوم میدانند، بر روی باکتریهای رودهای (مثل اشریشیا کلی، کلبسیلا یا پروتئوس) بسیار مؤثر هستند.
البته سفالوسپورینهاي نسل دوم زیاد برای درمان باکتریهای گرم مثبت توصیه نمیشوند، زیرا خیلی گرانتر از سفالوسپورینهاي نسل اول هستند و بیشتر بهصورت جانبی مصرف میگردند. نسل دوم سفالوسپورینها، روی سودوموناس ائروژینوزا مؤثر نیستند.
(3) سفالوسپورینهای نسل سوم:
بسیاری از سفالوسپورینهاي نسل سوم در مقابل فعالیت بتالاکتامازها مقاومند، چراکه دارای گروههای R بزرگتر و غیرمعمول میباشند. اگرچه اثر این آنتیبیوتیکها، بر ضد باکتریهای گرم منفی از تمام نسلهای سفالوسپورینها بیشتر است، اما آنها تأثیر کمی بر باکتریهای گرم مثبت دارند. معمولاً، نسل سوم بیشتر بر ضد باکتریهای گرم منفی نظیر نایسریا گونورهآ (سویههای تولیدکننده پنیسیلیناز)، نایسریا مننژیتیديس، هموفيلوس انفلوانزا، موراکسلا کاتارالیس و بیشتر باکتریهای رودهای (مثل بیشتر سویههای سیتروباکتر، اشريشیا کلی، کلبیسلا، مورگانلا، پروتئوس، پروویدنسیا، سالمونلا و شیگلا) مؤثر است.
اثر عالی سفالوسپورینهاي نسل سوم بر روی این باکتریها به دلیل تمایل زیاد اين آنتیبیوتیکها به PBP باکتریهای گرم منفی و مقاومت غیرمعمولشان در برابر غیرفعالسازی با بتالاکتامازها است. سفالوسپورینهای نسل سوم توسط بتالاکتامازهای کلاس I کروموزومی (که توسط بعضی از سویههای سیتروباکتر، انتروباکتر و سودوموناس تولید میشود) غیرفعال میگردند، اما در برابر غیرفعال شدن توسط بیشتر بتالاکتامازها مقاومت میکنند. سفتازیدین قویترین فعالیت را و سفوپرازون فعالیت ملايمي بر ضد سودوموناس دارند.
(4) سفالوسپورینهای نسل چهارم:
شامل سفالوسپورینهای پیشرفته جدید نظر سفيپیم و سفپرین میباشند. اگرچه این داروها از نظر فعالیت علیه باکتریهای گرم منفی مشابه سفالوسپورینهاي نسل سوماند، اما از نظر تأثیر بر باکتریهای گرم مثبت شدیداً شبیه سفالوسپورینهاي نسل اول هستند.
بعضی پزشکان و داروسازان به سفالوسپورین نسل چهارم اعتمادی ندارند، ولی برخی، آنها را نظیر سفالوسپورینهاي نسل سوم، منتها با اثر وسیعتر بر روی باکتریهای گرم مثبت میدانند. در ضمن این آنتیبیوتیکهای جدید، تمایل کمتری از سفالوسپورینهاي نسل سوم به بتالاکتامازهای کلاس I دارند.
عوارض سفالوسپورینها آنافیلاکسی، نفریت، گرانولوسیتوپنی، آنمی همولیتیک، ترومبوفلیت است.
(5) موکسالاکتام و لوراکاربف:
آنتیبیوتیکهای موکسالاکتام و لوراکاربف از خویشاوندان نزدیک سفالوسپورینها هستند. موکسالاکتام به واسطه داشتن یک اکسیژن در کربن یک حلقه ششوجهی خود، با سفالوسپورینها فرق میکند، درحالیکه لوراکاربف در همان محل، یک کربن دارد؛ بنابراین موکسالاکتام یک اوگزاسفام[3] و لوراکاربف یک کرباسفام[4] هستند. موکسالاکتام از لحاظ طیف اثر شبیه سفالوسپورینهای نسل سوم است؛ اما بندرت برای درمان انتخاب میشود، زیرا مصرف آن سبب ناهنجاریهایی در خونریزی میشود. اين آنتیبیوتیک اكنون در ایالات متحده آمريكا مصرف نمیشود. لوراکاربف یک آنتیبیوتیک خوراکی است که از نظر طیف اثر بسیار شبیه سفالوسپورینهاي نسل اول و دوم است و بیشتر برای درمان عفونت گوش میانی در کودکان مصرف میشود.
مقاومت به آنتیبیوتیکهای بتالاکتام:
مقاومت اکتسابی باکتریها به آنتیبیوتیکهاي بتالاکتام، احتمالاً از طريق جهش ژنهای کروموزومی یا انتقال از راه پلاسمید بدست آمده است. عموماً تغییرات وابسته به کروموزوم در حساسیت به آنتیبیوتیکهای بتالاکتام شامل تغییر در نفوذپذیری آنتیبیوتیک یا تغییر در توانایی PBPها برای شناسایی آنتیبیوتیکها است؛ اما بعضی از بتالاکتامازها توسط کروموزوم کد میشوند. مقاومت کد شده توسط پلاسمید نسبت به بتالاکتامها، همیشه بهصورت معرفی یک ژن بتالاکتاماز است.
(1) تغییر در نفوذپذیری باکتری: نفوذپذیری باکتریها نسبت به بتالاکتامها ممکن است در اثر تغییر در پورینها یا تغيير در لیپوپلیساكاریدهای غشاء خارجی، کاهش یابد. غشاء خارجی باکتریهای گرم منفی بهصورت غیر قرینه است، یعني پورینها و لیپوپلیساکارید در قسمت خارجی آن قرار دارند. اشريشیا کلی حدود 105×1 مولکول پورین در هر سلول دارد كه میتواند بهصورت کانالهای بزرگ (OmpF) یا کوچک (OmpC) باشد. در ابتدا، وقتی كه غشاء خارجی اشریشیا کلی دارای کانالهای OmpC شده است، کاربنیسیلین و سایر داروهایی که معمولاً به آهستگی نفوذ میکنند، بهطور اساسی قادر به ورود به باکتری نیستند. برخلاف سویههای اشریشیا کلی، سویههای انتروباکتر کلوآكه و سودوموناس ائروژینوزا بهوضوح با تغییر در ترکیب لیپوپلیساکاریدشان در مورد حساسیت به پنیسیلین با اشریشیا کلی تفاوت دارند.
(2) تأثیر بتالاکتامازها: پردردسرترين مکانیسمهای مقاومت به آنتیبیوتیک، متعلق به بتالاكتامازها بوده است. يك بتالاکتاماز، آنزیمی است که بهصورت غیرکووالانت به آنتیبیوتیکهاي بتالاکتام باند میکند و با تشکیل یک پیوند کووالانت، سبب هیدرولیز باند آمیدی حلقوی حلقه لاکتام و آزاد شدن آنتیبیوتیک تغییریافته (غیرفعال) میگردد. بتالاکتامازها براي آنتیبیوتیکهای بتالاکتام، با PBPها رقابت میکنند. امروزه بیشتر از 80 نوع بتالاکتاماز شناخته شده که هر کدام الگو، اختصاصیت و تمایل مربوط به خود را دارند. اگرچه بتالاکتامازها در بین باکتریهای گرم مثبت و منفی بسیار پخش شدهاند، اما به نظر میرسد که توزیع آنها بهصورت چند دستهبندی بزرگ است که دو نوع طبقهبندی زیر بسیار معمول است.
اولین سیستم، بر اساس اندازه مولکول و همولوژی آنها، بتالاکتامازها را به سه گروه بزرگ (تیپ A,B,C) تقسیمبندی میکند. این سیستم زیرمجموعه سیستمهای M.H.Richmond R.B.Sykes است.
سيستم Richmond-Sykes بتالاکتامازها را بر اساس نوع سوبسترا و مطالعات مهاری طبقهبندی میکند. بتالاکتامازهای باکتریهای گرم مثبت که در این سیستم در یک کلاس واحد قرار دارند، آنزیمهایی هستند که به مقدار زیاد تولید شده و به محیط خارج ترشح میشوند، بطوریکه در خارج سلول میتوانند، بتالاکتامها را غیرفعال کنند. در این حالت، آنها از باکتریهایی که خودشان بتالاکتاماز تولید نمیکنند، نیز حفاظت میکنند. این پدیده اثر تلقيح[5] نامیده میشود و به هر آنزیم غیرفعالکننده آنتیبیوتیکی که توسط باکتریهای مقاوم به محیط ترشح میشود، مرتبط است. در باکتریهای گرم منفی، بتالاکتامازها به شش کلاس اصلی تقسیم میشوند. احتمالاً مهمترین بتالاکتامازهای سیستم ريچموند- سایکس در كلاس I قرار دارند.
بتالاکتامازهای کلاس I توسط کلاوولانات یا سولباکتام مهار نمیشوند و بعضی از آنها، سفالوسپورینهای نسل سوم را میتوانند هیدرولیز نمایند. بیشتر بتالاکتامازها ساختمانیاند، اما بتالاکتامازهای استافیلوکوکی و کلاس I توسط سفامندول، سفوکسیتین و ایمیپنم القاء میشوند. بتالاکتامازهای کلاس II تا کلاس IV همگی توسط کلاولانات یا سولباکتام مهار میشوند. این بتالاکتامازها به میزان کم تولید شده و محدود به فضای پریپلاسمیک هستند؛ بنابراین نفوذپذیری غشاء خارجی بسیار بر عملکرد آنها اثر میگذارد و اثر تلقیحی نیز وجود ندارد. اگر تغییری در پورین روی دهد که سبب کم شدن نفوذپذیری شود، تأثیر بتالاکتامازها احتمالاً به میزان زیادی افزایش مییابد.
(3) تغییر در افینیتی اهداف آنتیبیوتیک: سومین مکانیسم مقاومت به آنتیبیوتیکهای بتالاکتام شامل تغییر در تمایل PBPها نسبت به آنتیبیوتیکهای بتالاکتام است. بزرگترین ضربه کلینیکی حاصل از این مکانیسم، ظهور استافیلوکوک اورئوسهای مقاوم به پنیسیلین بوده است. سایر باکتریهایی که مقاومتشان نسبت به بتالاکتامها به دلیل تغییر در PBP است عبارتند از: کلستریدیوم پرفرنژنز (مقاومت به تمام پنیسیلینها)، هموفيلوس انفلوانزا و سراشیا (مقاومت به سفالوسپورینهاي نسل سوم و بعضی از پنیسیلینها) و نایسریا گونورهآ و استرپتوکوک پنومونیه (مقاومت به پنیسیلین G).
(4) نقص در القاء اتولیز: به نظر میرسد که بعضی از باکتریها نسبت به بتالاکتامها تحمل پیدا کردهاند. آنتیبیوتیکهای بتالاکتام در این باکتریها نمیتوانند آنزیمهای اتولیتیک را القا كنند و نسبت MBC به MIC بیشتر یا مساوی 32 است. این بدان معنی است که پنیسیلین یا سفالوسپورین بیشتر از اينكه باکتریوسید باشد، باکتریواستاتیک است، مگر اینکه میزان بسیار زیادی آنتیبیوتیک مصرف شود. این امر در درمان افراد با ایمنی سرکوب شده و یا بیماران نوتروپنی مشکل ایجاد میکند. باکتریهایی که گاهگاهی تحمل به بتالاکتاماها را نشان میدهند عبارتند از: لیستریا منوسیتوژنز، استافیلوکوکوس اورئوس، استافیلوکوکوس اپیدرمیدیس، استرپتوکوکوس آگالاکتیه و استرپتوکوکوس سانگوئیس. تمام این باکتریها گرم مثبت هستند.
وانکومایسین و سایر آنتیبیوتیکهای گلیکوپپتیدی
ویژگی:
وانکومایسین اولین آنتیبیوتیک گلیکوپپتیدی است كه در اواخر دهه 1950 بهعنوان روش جديدي در درمان عفونتهای استافیلوکوکی مقاوم به پنیسیلین G معرفی شد. از آنجا که وانکومایسینهای اولیه، نسبتاً خالص نبودند، پزشکان دریافتند که سمیت آنتیبیوتیک برای مصرف قابل قبول نیست. بهزودی وانکومایسین با پنیسیلینهای مقاوم به بتالاکتاماز و سفالوسپورینها جایگزین شد. با ظهور استافیلوکوک اورئوسهای مقاوم به متیسیلین و سایر کوکسیهای گرم مثبت بسیار مقاوم، دوباره وانکومایسین به یکی از مهمترین آنتیبیوتیکها تبدیل شد.
علاوه بر وانکومایسین، اکنون فامیل گلیکوپپتید شامل تیکوپلانین، ریستوستین و راموپلانین است. در حالی که وانکومایسین و تیکوپلانین بهصورت تجاری، مصارف انسانی قرار دارند، راموپلانین فقط بهصورت داروی تحقیقاتی قابل دسترسی است. ریستوستین نیز برای مصرف کلینیکی بسیار سمی است، اما اغلب در آزمایشگاههای هماتولوژی بهعنوان یک ماده تجمعدهنده پلاکت مصرف میشود.
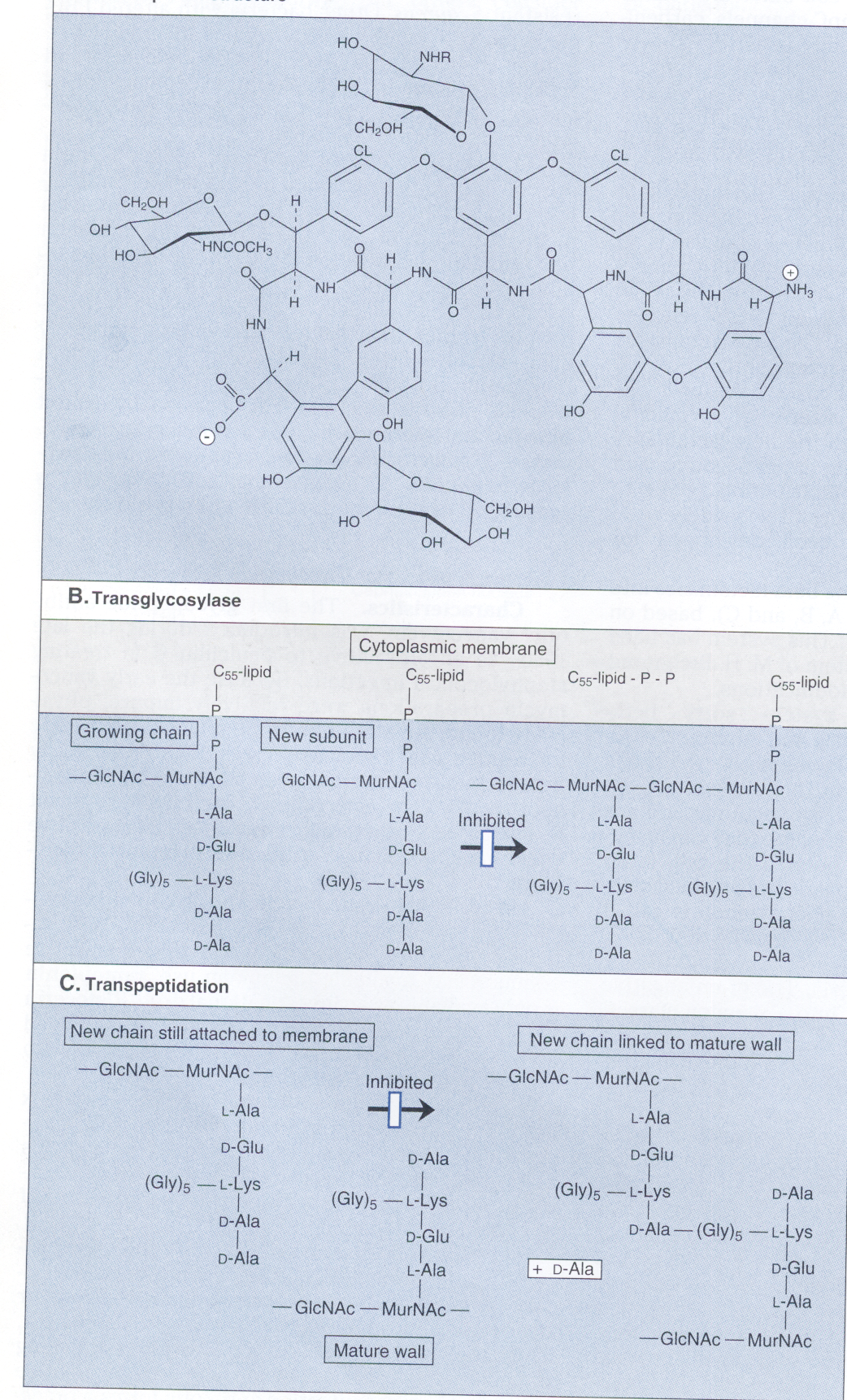
آنتیبیوتیکهای گلیکوپپتیدی بزرگ هستند و آنتیبیوتیکهای کمپلکس توسط گونههای اکتینوپلان[6] و استرپتومایسس[7] تولید میشوند و هرکدام دارای یک ریشه 7 اسیدآمینهای در هسته خود هستند که پنج تا از اسیدآمینهها در تمام گلیکوپپتیدها یکسان است. ساختمان تيكوپلانين در شكل 2 توضيح داده شده است.
شکل 2- ساختمان و مکانیسم اولیه فعالیت تیکوپلانین (یک آنتیبیوتیک گلیکوپپتیدی).
شکل A ساختمان شیمیایی تیکوپلانین را نشان میدهد.
شکل B مکانیسم اولیه فعالیت مهار، ارائه N–استیل گلوکز آمین–N– استیل مورامیک اسید
(GlcNAC – urNAC) بهوسیله باکتوپرنول دی فسفات به نقطه رشد مورین (پپتیدوگلیگان) را نشان میدهد.
دیاگرام C نشان میدهد که اغلب، گلیکوپپتیدها بهطور کامل واکنش ترانس پپتیداسیون را متوقف میسازند.
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
مکانیسم عمل دارو:
از آنجایی که گلیکوپپتیدها مولکولهای بزرگی هستند، نمیتوانند از غشاء خارجی باکتریهای گرم منفی یا غشاء سیتوپلاسمی باکتریهای گرم مثبت بگذرند، بنابراین، فعالیت آنها محدود به اتفاقاتی است که در خارج از غشاء سیتوپلاسمی باکتریهای گرم منفی روی میدهد. هر آنتیبیوتیک گلیکوپپتیدی شبیه بازوبندی است که به اهداف خود محکم میچسبد. مشخص شده که سایت فعال وانکومایسین و تیکوپلانین، تریپپتیدهایی با شکل استروشیمیایی L-D-D را تشخیص میدهند. این ساختمان تریپپتیدی فقط در MurNAC- پنتاپپتید در جایی که یک اسیدآمینه L در موقعیت سوم به دنبال یک D-آلانین قرار دارد، یافت میشود.
وقتی وانکومایسین برای باکتریهای حساس تجویز میشود، ابتدا (از طریق پیوند هیدروژنی) به تمام واحدهای آسیل– D- آلانین– D- آلانین موجود در دیواره سلولی میچسبد. بعد از اشباع این مولکولها، به آسیل– D- آلانین– D- آلانین قطــــــــــــعات GlcNAC-MurNAC که به باكتوپرنول دیفسفات (P-P باکتوپرنول) متصل میباشند و در قسمت خارجی غشاء سیتوپلاسمی قرار دارند، میچسبد. در این حالت، وانکومایسین فعالیتش را در دو نقطه اعمال میکند؛ اول، وانکومایسین که به -GlcNAC-MurNAC باکتوپرنل وصل شده، بهعنوان یک جسم اشغالکننده فضا که توانایی ترانس گلیکوزیداز پپتیدوگلیکان را مهار میکند، عمل مینماید. در این حالت دیساکاریدهای کافی به نقطه رشد مورینی (پپتیدوگلیکان) نمیتوانند برسند.
دوم، با اتصال وانکومایسین به آسیل- D- آلانین–D- آلانین (دیپپتیدهایی بدون پلهای تقاطعی) مانع کراس لینک آنها میگردد. در تمامی مراحل، اثر آنتیبیوتیک، بستگی به توانایی آن برای محافظت سوبسترای خود از آنزیم مربوطه دارد. عموماً به نظر میرسد، مرحله مهم در تأثیر وانکومایسین، مربوط به توانایی آن برای مهار ارائه واحدهای دیساکارید به نقطه رشد مورینی باشد.
کاربرد و عوارض دارو:
وانکومایسین و تیکوپلانین برای درمان عفونتهای وخیم حاصل از کلستریدیوم دیفیسیل، استافیلوکوک اورئوسهای چند مقاومتی (مثل سویههای مقاوم به متیسیلین)، استافیلوکوکهای کوآگولاز منفی و سویههای تولیدکننده پنیسیلیناز استرپتوکوکوس پنومونیه و استرپتوکوکوس پیوژنز استفاده میشوند.
اگرچه مصرف وانکومایسین گاهگاهی منجر به اتوتوکسیسیته، نفروتوکسیسیته و واکنشهای آزادسازی غیرایمونولوژیکی هیستامین میگردد، ولی موارد بسیار خالص وانکومایسین که بسیار نیز ایمن هستند وجود داشته و در درمان بیماران استفاده میگردد.
مقاومت باکتریها به آنتیبیوتیکهای گلیکوپپتیدی:
مقاومت به آنتیبیوتیکهای گلیکوپپتیدی بیشتر در میان گونههای انتروکوک روی میدهد و مربوط به تولید پروتئین متصل به غشاء سلولی بنام VanA است. VanA یک D- آلانین– D- آلانین لیگاز است و تولید دیپپتیدهای دیگری میکند که در ان-استیل مورامیک اسید میتوانند جانشین D- آلانین– D- آلانین شوند. انتروکوکهای دارای VanA به دلیل نداشتن اهدافD- D برای اتصال به آنتیبیوتیک، به گلیکوپپتیدها مقاوم هستند. VanA از طریق کونجوگیشن به سایر باکتریها منتقل میگردد. عمل پروتئینهای B Van و VanC که کمتر معمول هستند، شبیه به VanA است، با این تفاوت که از طریق کونجوگیشن منتقل نمیگردند.
باسیتراسین و سیکلوسرین
ویژگی و مکانیسم عمل:
پپتیدوگلیکان، تیکوئیک اسید، لیپوپلیساکارید و کپسول متوقف میسازد. سیکلوسرین آنالوگ D- آلانین– D-آلانین است و با عمل مهار رقابتی با آنزیمهای ترانس پپتیداز، مانع تشکیل پلهای تقاطعی در پپتیدوگلیکان میگردد.
کاربرد و عوارض دارو:
مصارف تزریقی، باسیتراسین بسیار سمی است، بنابراین، فقط بهصورت پماد و خوراکی مصرف میگردد. در پمادهای چشمی و پوستی برای درمان عفونتهای استافیلوکوکی و استرپتوکوکی و در قرصهای خوراکی برای درمان کولیت سودوممبران حاصل از كلستريديوم دیفیسیل (یک بیهوازی گرم مثبت)، یافت میشود. وقتی باسیتراسین بهصورت خوراکی مصرف شود، جذب نمیگردد.
سیکلوسرین بهعنوان درمان ثانویه سل استفاده میشود. باید توجه داشت که با مصرف آن احتمال بروز تشنج وجود دارد.
عوامل برهمزننده یکپارچگی غشاء سلولی
آنتیبیوتیکهای پلیمیکسین، آنتیبیوتیکهای بزرگ پلیپپتیدی کاتیونی هستند که دارای اسید چرب، شارژ مثبت و یک زنجیره جانبی آلکیلی بلند میباشند. پلیمیکسین بهصورت یک دترجنت کاتیونیک عمل کرده و محکم به لیپوپلیساکارید و فسفاتیدیل اتانول آمین غشاء خارجی باکتریهای گرم منفی میچسبد. این آنتیبیوتیک اتصال ضعیفی به فسفاتیدیل کولین که در سلولهای انسانی وجود دارد و در غشاء سلولی باکتریها یافت نمیشود، دارد؛ بنابراین، پلیمیکسینها بر ضد باکتریهای گرم منفی تأثیر دارند. چون این آنتیبیوتیکها یکپارچگی غشاء خارجی را به هم میزنند، آنها بدون نیاز به تقسیم باکتری مورد هدف، باکتریوسیدال هستند.
دو پلیمیکسین در ایالات متحده آمریکا ساخته میشود: پلیمیکسین B و پلیمیکسین E. به دلیل سمیت پلیمیکسینها، در درمان هیچکدام از عفونتهای باکتریایی، داروی انتخابی نیستند. آنتیبیوتیکها بهعنوان درمان ثانویه در عفونتهای وخیم یا طولانی مدت حاصل از سودوموناس ائروژینوزا یا سایر باسیلهای گرم منفی که به درمانهای استاندارد پاسخ نمیدهند، مصرف میشوند.
[1]– 7-Aminocephalosporanic acid
[2]– Cephalosporium acromonium
[3]-Ooxacepham
[4] -Carbacepham
[5]– Inoculum effect
[6]-Actinoplanes
[7] -Streptomyces
https://www.drugs.com/drug-class/cephalosporins.html
https://www.healthline.com/health/cephalosporins
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام