تکنیکهای تکثیر چندگانه کاوشگر
دکتر مهدی فصیحی راوندی، عضو هیئت علمی دانشگاه علوم پزشکی بقیها…(عج)
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (دانشیار دانشگاه)
تعیین تعداد نسخههای یک ژن در ژنوم (دوزاژ ژنی) کاربردهای فراوانی در تحقیقات بیولوژیک، پزشکی و بالینی دارد، همچنین تغییر تعداد نسخههای یک ژن در درمان، پیشآگهی و تشخیص بیماری کاربرد دارد؛ بهعنوان مثال ژن ERBB2 (Her2) در اکثر سرطانهای سینه و تخمدان تکثیر شده و تعداد نسخههای آن در ژنوم افزایش مییابد. میزان این افزایش نسخهها با پیشآگهی بد، عود مجدد بیماری و طول عمر کوتاه ارتباط دارد، یا در بررسی حذف هتروزیگوسیتی (LOH[1])، تعداد نسخههای یک ژن سرکوبگر تومور بررسی میشود که در تشخیص و تعیین پیشآگهی انواع سرطانهای سینه، کولون و کبد کاربرد دارد. یکی دیگر از مهمترین کاربردهای تعیین دوزاژ ژنی در تشخیص بیماریهای ژنتیکی است. در بیماریهایی مثل سندرم دوشن، شارکوت- ماری توث، آنمی فانکونی، هیپرپلازی مادرزادی آدرنال و بعضی از اختلالات نادر متابولیکی مثل هیپرگلایسمی غیرکتونی جهشهای حذف و اضافه وجود دارد.
حذف و اضافههای کوچک (در حد چند باز) به کمک تکنیک PCR و تعیین توالی و حذف و اضافههای بزرگ (در حد چند مگاباز) به کمک تکنیکهای سیتوژنتیک شناسایی میشوند، اما جهشهای حذف و اضافه متوسط با این روشها تعیین نشده و تشخیص داده نمیشوند. از تکینکهای تعیین حذف و اضافه میتوان به FISH، ساترن بلات به کمک PFGE، PCR کمّی و نیمه کمّی، اشاره نمود. همچنین تکنیکهای جدیدتری نیز بدین منظور توسعه یافتهاند که از آن میان میتوان به [2]MLPA و MAPH[3] اشاره کرد. این دو تکنیک بر اساس اتصال کاوشگر به توالی هدف و تکثیر آن به کمک آغازگر عمومی است. استفاده از یک جفت آغازگر عمومی در واکنشهای چندگانه[4] باعث تسهیل تکنیک میشود، همچنین بهجای استفاده از چندین کاوشگر با رنگهای فلورسانس مختلف، از یک آغازگر فلورسنته استفاده شده و در نتیجه هزینه انجام واکنش بهمراتب کمتر خواهد بود. بهمنظور تولید کاوشگر، توالی هدف درون ناقلین مناسب همسانه سازی[5] و به کمک آغازگر تکثیر میشود. این آغازگر، مکمل توالی موجود بر روی پلاسمید بوده و به آن متصل میشود. ازآنجاکه این آغازگر (بدون توجه به توالی کاوشگر) به توالی خاص روی ناقلین متصل میشود، در نتیجه دو انتهای همه کاوشگرهای حاصل ثابت است. یکی از محدودیتهای ساخت کاوشگر اندازه آن است؛ به همین دلیل باید توجه داشت که در واکنشهای چندگانه که همزمان چند کاوشگر مورداستفاده قرار میگیرد، کاوشگرها باید دارای اندازههای متفاوتی باشند تا بتوان محصولهای واکنش را بر روی ژل الکتروفورز از یکدیگر تمیز داد.
تکنیک MAPH
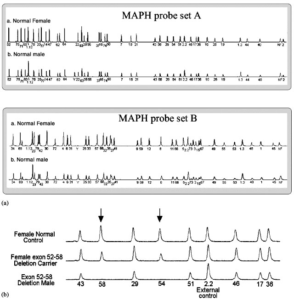
در این تکنیک، یک میکروگرم از DNA ژنومی را بر روی یک غشا متصل کرده و به کمک کاوشگرهای مختص توالی هدف، دورگهسازی انجام میشود. پس از اتصال کاوشگرها، غشا را کاملاً شسته تا کاوشگرهای آزاد حذف شوند. کاوشگرها بهطور اختصاصی به قطعات موردنظر متصل میگردند. پس از این مرحله کاوشگرها از غشا شسته شده و به کمک آغازگرهای عمومی تکثیر میشوند. بسته به تعداد نسخههای یک ژن، تعداد متفاوتی از کاوشگرها به غشا متصل میشوند. درنهایت محصول PCR بر روی ژل الکتروفورز شده و شدت باند یا شدت نور فلورسنت اندازهگیری و با کنترل داخلی مقایسه میگردد. اگر میزان محصول نمونه مورد آزمایش در مقایسه با کنترل کاهش یابد، بیانگر کاهش نسخههای ژن (حذف) میباشد. همچنین افزایش تعداد نسخههای ژن منجر به افزایش شدت فلورسانس یا شدت باند الکتروفورز میشود. تا 40 کاوشگر مختلف را میتوان همزمان مورد آزمایش قرار داد و نتیجه را قرائت نمود. تاکنون از این تکنیک بهمنظور شناسایی حذف در سندرم دوشن، حذفهای ساب تلومریک و همچنین تایپینگ لوسمی میلوژنی مزمن (CML) استفاده شده است. در این تکنیک مرحله دورگهسازی بهصورت شب تا صبح[6] بوده و سپس شستشو، PCR و شناسایی و اندازهگیری محصول انجام میشود. در نتیجه، این تکنیک نیاز به 3-2 روز زمان دارد. تصویر زیر نمونهای از آنالیز ژن دیستروفین به کمک تکنیک MAPH است که با استفاده از کاوشگرهای فلورسنته انجام گرفته است.
شکل 1: آنالیز ژن دیستروفین به کمک تکنیک MAPH
a: دو مجموعه از کاوشگر که تمامی اگزونها را بررسی میکنند
b: بخشی از مجموعه کاوشگرهای A که یک حذف در اگزون 58-52 را نشان میدهد
تکنیک MLPA
روش MLPA یا تکثیر چندگانه کاوشگر که به کمک واکنش اتصال انجام میشود، روشی آسان و با کارآیی بالا است. اساس این تکنیک ساده PCR نیمهکمی میباشد. از این تکنیک بهمنظور مطالعه تغییر تعداد نسخههای یک قطعه از DNA و همچنین وضعیت کمّی متیلاسیون DNA و پروفایل mRNA استفاده میشود. در اینجا کاوشگرها در فاز محلول به DNA ژنومیک متصل میشوند.
کاوشگرهای مورد استفاده در این تکنیک دو نوع میباشند:
- کاوشگرهایی با دو بخش اولیگونوکلئوتیدی سنتتیک و مشتق از فاژ M13. اندازه محصول PCR این دو کاوشگر 481-130 نوکلئوتید خواهد بود. در این تکنیک نیز دو کاوشگر برای هر واکنش به کار میرود. در کاوشگر اول دو بخش وجود دارد؛ بخش اختصاصی هدف که به توالی هدف متصل میشود و 30-20 نوکلئوتید طول دارد و در طرف دیگر کاوشگر توالی مربوط به آغازگر عمومی وجود دارد، اما در کاوشگر دوم، بین دو بخش اختصاصی هدف (43-25 نوکلئوتید) و توالی مکمل آغازگر عمومی، یک قطعه با طول متغیر (370-19 نوکلئوتید) قرار گرفته تا اختلاف اندازه بین محصولات واکنش را موجب شود. این توالی که به نام Stuffer fragment شناخته میشود، درون ناقلین مشتق از فاژM13 وجود دارد و هنگامی که توالی اختصاصی هدف درون این ناقلین همسانهسازی میشود این قطعه به توالی اختصاصی اضافه میگردد. این دو کاوشگر ابتدا بهصورت یک توالی پیوسته درون ناقل همسانهسازی شده و پس از اینکه بهصورت DNA تکرشتهای تخلیص شدند به کمک اولیگونوکلئوتیدها، دو رشتهای میشوند. این توالی در محل دو رشتهای شدن به کمک آنزیم محدودگر بریده شده و به دو کاوشگر مجزا تبدیل میشود. این نحوه ساخت موجب میشود که دو کاوشگر دقیقاً در نزدیکی یکدیگر به توالی هدف متصل شده و واکنش اتصال این دو به یکدیگر بهراحتی انجام گردد (شکل 2).
- نوع دوم کاوشگرها که حاوی دو بخش سنتتیک میباشد و پس از اجرای PCR با این نوع از کاوشگرها، محصولی به طول 130-94 نوکلئوتید تولید خواهد شد.
شکل 2: کاوشگرهایی با بخشهای اولیگونوکلئوتیدی سنتتیک و مشتق از فاژ M13
شیمی کاوشگرها
کاوشگرها شامل دو اولیگونوکلئوتید هستند که هرکدام حاوی یک قطعه آغازگر PCR و یک قطعه مکمل توالی هدف، تحت عنوان توالی دورگهسازی میباشند. این دو کاوشگر در کنار هم به توالی هدف متصل شده و پس از آن به کمک آنزیم لیگاز مقاوم به حرارت، دو کاوشگر به هم متصل میشوند. آغازگرها طی PCR، کاوشگرهای متصلشده را، بهصورت تصاعدی تکثیر میکنند. یکی از این آغازگرها با رنگ فلورسانس نشاندار شده و به کمک آن میتوان محصول واکنش را شناسایی نمود. محصول واکنش مشابه آنچه در تعیین توالی داشتیم الکتروفورز شده و از روی اختلاف اندازه محصول با کاوشگرها میتوان آن را شناسایی نمود.
مراحل انجام آزمایش
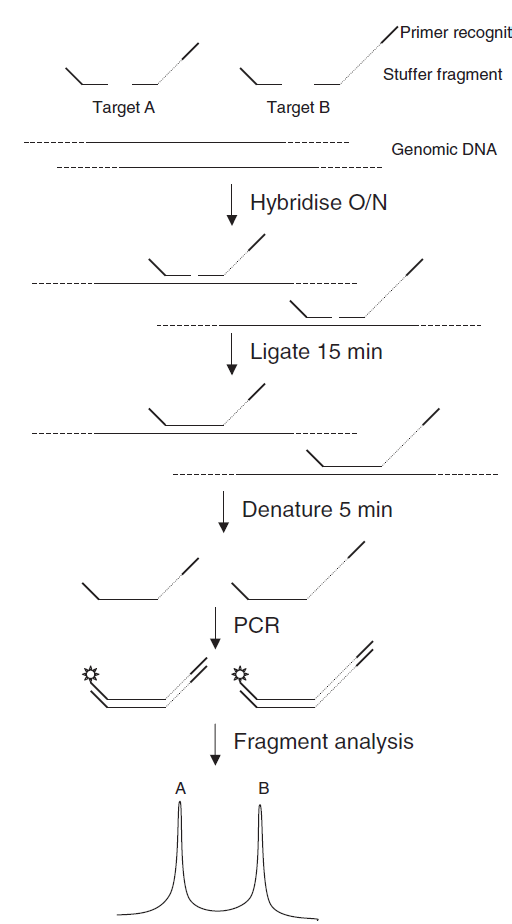
واسرشت سازی: در این مرحله DNA در دمای 98 درجه سلسیوس واسرشت شده و تکرشتهای میشود. دورگهسازی و اتصال: کاوشگرها به توالی هدف متصل شده و به کمک آنزیم لیگاز مقاوم به حرارت به یکدیگر متصل میشوند. تعداد کاوشگرهایی که به ژنوم متصل میشود بستگی به تعداد نسخههای قطعه هدف در ژنوم دارد. اگر ژن هدف تکثیر یافته یا دو برابر شده باشد، کاوشگرهای اضافی به آن متصل شده و محصول PCR زیاد میشود و اگر حذفی در این قطعه وجود داشته باشد کاوشگر به آن متصل نشده و محصول PCR وجود نخواهد داشت.
شکل 3: دورگهسازی و اتصال کاوشگرها
تکثیر: در این مرحله آغازگرها (که یکی از آنها نشاندار شده است)، dNTP، آنزیم Taq پلیمراز، یون منیزیم و بافر به واکنش اضافه میشود. آغازگرها مکمل کاوشگرها بوده و باعث تکثیر کاوشگرهای متصلشده میگردند. برای شناسایی چند قطعه مختلف میتوان واکنش را بهصورت چندگانه[7] طراحی نمود. بدین منظور باید کاوشگرهای مربوط به هر قطعه طوری طراحی شوند که قطعات حاصل از نظر اندازه با هم متفاوت بوده و بر روی ژل قابل تفکیک باشند. طراحی کاوشگرها نکته اساسی و کلیدی این تکنیک میباشد (شکل 4).
شکل 4: نمای کلی از مراحل اجرای تکنیک MLPA
کاربرد تکنیک MLPA:
1: تشخیص تعداد نسخههای یک ژن: به کمک این تکنیک میتوان تا 40 نسخه از یک ژن که در ژنوم وجود دارد را تشخیص داد. تغییر تعداد نسخههای یک ژن از موارد مهمی است که در ابتلا به بیماری نقش داشته و تشخیص آن از اهمیت زیادی برخوردار است.
2: تشخیص کمّی حذف، اضافه و جهشهای نقطهای: تکنیک MLPA حتی تغییر یک نوکلئوتید را نیز میتواند شناسایی کند. اتصال کاوشگر به توالی هدف کاملاً دقیق و حساس بوده و تغییر یک نوکلئوتید نیز میتواند مانع از اتصال کاوشگرها شود، به همین دلیل میتوان از این تکنیک در تشخیص جهشهای شناخته شده استفاده نمود.
3: بررسی متیلاسیون DNA و پروفایل mRNA: متیلاسیون جزایر CpG میتواند باعث خاموشی ژن شود. خاموشی ژنهای سرکوبگر تومور به کمک متیلاسیون، در سرطانها مشاهده شده است. متیلاسیون توالیهای مختلف (تا 40 توالی مختلف) را میتوان با این تکنیک تشخیص داد.
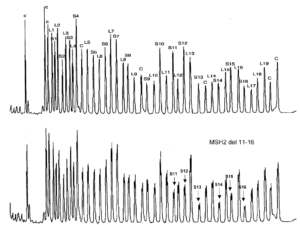
یکی از کاربردهای این تکنیک در آنالیز ژنهای MSH2 و MLH1 دخیل در بیماری سرطان ارثی غیرپولیپی کولون (HNPCC) است که کیت آن بهصورت تجاری در بازار موجود است (شکل 5). امروزه کیتهای مختلفی برپایه این تکنیک توسط شرکتهای زیادی برای شناسایی سریع و دقیق بیماریهای بالینی ارائه شده است (جدول 1).
شکل 5: نمونهای از کاربرد کیت MLPA در آنالیز ژن MSH2/MLH1
یک حذف در اگزون 16-11 ژن MSH2 مشاهده میگردد
جدول 1: کیتهای MLPA که بهصورت تجاری در کمپانی MRC-Holland موجود است
پارامترهای مؤثر در طراحی کاوشگرها:
- طول کاوشگر: طول قسمت دورگهسازی باید حداقل 21 نوکلئوتید باشد و قسمت دورگهسازی هر دو کاوشگر باید کاملاً در کنار یکدیگر باشد تا واکنش اتصال صورت گیرد.
- طول محصول واکنش: باید به طول محصول واکنش نیز توجه کرد؛ طول محصول باید طوری باشد که PCR بهراحتی انجام گرفته و بر روی ژل قابل تشخیص باشد. همچنین اگر واکنش بهصورت چندگانه انجام میشود، طول محصول هر قطعه باید متفاوت از بقیه قطعات باشد.
- Tm کاوشگرها: Tm کاوشگرها باید نزدیک به هم بوده و حدود 5±72 درجه سلسیوس باشد.
- همولوژی کاوشگرها: کاوشگرها بعد از طراحی با نرمافزارBLAST باید چک شوند که با همدیگر همولوژی نداشته و به یکدیگر متصل نشوند. همچنین کاوشگرها نباید به توالیهای غیراختصاصی ژنوم متصل شوند.
- ساختار ثانویه: کاوشگرها باید از لحاظ تشکیل ساختار ثانویه از قبیل ساختمان سنجاقسری، دایمر با خود و دایمر با دیگر کاوشگرها بررسی شوند.
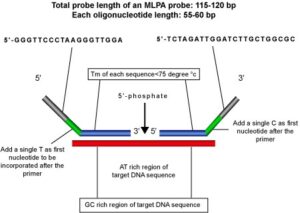
- اولین نوکلئوتید در ‘3 آغازگر نیز ترجیحاً A یا T نباشد. ازآنجاکه اتصال این نوکلئوتید ضعیفتر از پیوند CG است، در نتیجه میزان محصول PCR کاهش مییابد. همچنین برای افزایش اختصاصیت واکنش بهتر است نوکلئوتیدهای اطراف محل اتصال دو کاوشگر بیشتر AT باشند و هر چه از این محل به دو طرف کاوشگر نزدیک شویم CG افزایش یابد (شکل 6).
شکل 6: ویژگیهای مختلف کاوشگرهای مورد استفاده در تکنیک MLPA
مزایا و معایب MLPA و MAPH:
در این دو تکنیک برخلاف تکنیک PCR چندگانه، فقط به یک جفت آغازگر نیاز است. این امر انجام واکنش PCR را آسان نموده است، زیرا مشکلات مربوط به تشکیل دایمر آغازگرها و همچنین پیچیدگی PCR وجود ندارد و فقط کاوشگرها هستند که با یک جفت آغازگر تکثیر میشوند. در نتیجه این تکنیکها ساده، ارزان و سریع خواهند بود. تولید کاوشگر MAPH سادهتر از تولید کاوشگر MLPA به روش M13 است. البته کاوشگر MLPA را نیز میتوان به روش سنتتیک تهیه نمود، ولی چون در ساخت یک توالی سنتتیک با طول بلند محدودیت وجود دارد، افتراق باندهای ایجادشده در طی الکتروفورز با این روش مشکل و محدود خواهد بود؛ اما ازآنجاکه کاوشگر MAPH بهتنهایی قابل تکثیر شدن است، احتمال آلودگی و مثبت کاذب در MAPH بیشتر از MLPA (که فقط بعد از واکنش لیگاز تکثیر میشود) است. MAPH نیاز به شستشوی دقیق غشا و جداسازی و انتقال کاوشگر از غشا به سیستم PCR را داشته و طی این مراحل علاوه بر صرف زمان و نیروی کار، احتمال آلودگی نیز وجود دارد، درحالیکه MLPA در فاز مایع انجام شده و قابلیت اتوماسیون شدن را دارد. میزان DNA موردنیاز برای انجام تکنیک MAPH، gµ1 است، ولی در روش MLPA فقط به ng20 از DNA نیاز میباشد.
ازآنجاکه تکنیک MLPA حساستر از روش MAPH است، حتی عدم اتصال یک باز موجب عدم انجام واکنش اتصال و درنهایت عدم مشاهده محصول PCR میشود؛ در نتیجه یک جهش تک نوکلئوتیدی ممکن است حذف یک اگزون تلقی و تفسیر شود، به همین علت پیشنهاد میشود حذفهایی که با این روش شناسایی میگردد، به کمک تکنیک دیگر تأئید شود. عکس این مسئله در مورد تکنیک MAPH نیز صادق است. توالی اختصاصی کاوشگر MAPH، 200-100 نوکلئوتید طول داشته و جهشهای تک نوکلئوتیدی ممکن است تأثیر زیادی در اتصال کاوشگر به توالی هدف نداشته و حذفهای کوچک شناسایی نشوند.
[1] Loss of heterozygosity
[2] Multiplex Ligation-dependent Probe Amplification
[3] Multiplex amplifiable probe hybridization
[4] Multiplexing
[5] Cloning
[6] Overnight
[7] Multiplex
مقدمهای بر تکنیک واکنش زنجیرهای پلیمراز و انواع آن
تکنیکهای تکثیر همدمای اسید نوکلئیک
مقدمهای بر تکنیک PCR در زمان واقعی و انواع آن
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام