نویسنده: محمدرضا یزدانی، کارشناس ارشد دانشگاه علوم پزشکی شیراز
مقدمه:
بیماری مرتبط با (IgG4-RD) IgG4 یک بیماری فیبرو التهابی سیستمیک است که با نفوذ متراکم سلولهای پلاسمایی IgG4 مثبت در بافت(های) آسیبدیده با یا بدون افزایش سطح IgG4 پلاسما مشخص میشود[1]. مشخصه پاتولوژیک این بیماری ارتشاح لنفوپلاسمی متراکم با سلولهای پلاسمایی IgG4 مثبت، فیبروز استوریفورم، فلبیت انسدادی و مقدار متغیر ائوزینوفیل است. افزایش سطح سرمی IgG4 شایع است.
آسیبشناسی بسیار خاص است و در همه اندامها مشابه به نظر میرسد. به دلیل این یافته، آن را مشابه سارکوئیدوز سیستمیک در نظر میگیرند. بیماران مبتلا به IgG4-RD اغلب به عنوان بدخیمی تشخیص داده میشوند زیرا ضایعات میتوانند تومورها، عفونتها یا بیماریهای ناشی از سیستم ایمنی را تقلید کنند. این مورد به دلیل عدم وجود رویکرد سیستمیک است و از این رو این بیماری کمتر تشخیص داده میشود.
این بیماران معمولاً پس از درمان با گلوکوکورتیکواستروئیدهای سیستمیک بهبود خوبی دارند. پاسخ به استروئیدها آنقدر چشمگیر است که به عنوان یکی از معیارهای تشخیصی این بیماری پیشنهاد شده است[2].
تظاهرات بالینی:
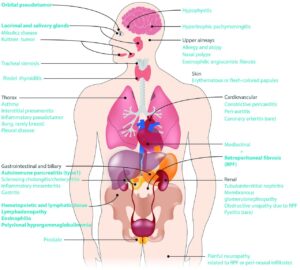
تظاهرات بالینی این بیماری متنوع است، زیرا IgG4-RD میتواند تقریباً همه اندامهای بدن بهجز بافت سینوویال را تحت تأثیر قرار دهد. اندامهای آسیبدیده معمولاً درخت صفراوی، غدد بزاقی اصلی، بافتهای اطراف چشم، کلیهها، ریهها، غدد لنفاوی و خلف صفاق هستند. علاوه بر این، درگیری مننژها، آئورت، پروستات، تیروئید، پریکارد، پوست و سایراندامها در IgG4-RD به خوبی شناخته شده است.
IgG4-RD معمولاً به صورت تحت حاد تظاهر میکند و حتی در شرایطی که بیماری چندین عضو را درگیر میکند، اکثر بیماران تب یا افزایش شدید سطح پروتئین واکنشگر C را ندارند. با این حال، برخی از بیماران کاهش وزن قابل توجهی را در طی چند ماه تجربه میکنند. دو ویژگی مشترک IgG4-RD بیماری آلرژیک و تمایل به ایجاد ضایعات متورم و شبه توموری است.
حدود 40 درصد از بیماران IgG4-RD دارای تظاهرات آلرژیک مانند آتوپی، اگزما، آسم، پولیپ بینی، سینوزیت و ائوزینوفیلی متوسط در خون محیطی هستند. همچنین به نظر میرسد که IgG4-RD مسئول پیدایش درصد قابل توجهی از تورمهای توموری (تومور کاذب) در بسیاری از دستگاههای بدن است. محل شایع تومورهای کاذب عبارتند از غدد اشکی، غدد بزاقی اصلی، ریهها و کلیهها.
شکل 1. تظاهرات بیماری مرتبط با IgG4
شایعترین ویژگیهای بیماری اولیه با خط پررنگ نشان داده شده است[3]
|
جدول 1: تظاهرات بيماري مرتبط با IgG4 در اندامها |
|
|
اندام |
تظاهرات باليني اصلي |
| حدقه و بافتهاي دور حدقهاي | تورم بدون درد پلک يا بافت دور چشمي؛ تومر کاذب حدقه، التهاب غدد اشکی؛ ميوزيت حدقهاي و ضايعات تودهاي که درون حفرة بالي – کامي (pterygopalatine fossa) پيش ميروند و در امتداد عصب سه قلو ارتشاح مييابند. |
| گوش، بيني و سينوسها | پديدههاي آلرژيک (پوليپهاي بيني، آسم، رينيت آلرژيک، ائوزينوفيلي محيطي)، انسداد بینی، رينوره، نابويايي، سينوزيت مزمن، گاه به گاه ضايعات تخريبي استخوان |
| غدد بزاقي | بزرگي غدة تحت فکي و /يا بناگوشي (درگيري منفرد دو طرفة غدة تحت فکي شايعتر است)، غدد بزاقي فرعي گاه درگير ميشوند. |
| مننژها | سردرد، تحت فشار بون عصب، فلج اعصاب جمجمهاي، يا نشانههاي ديگر بر اثر تحت فشار قرارگیری طناب نخاعي، تمايل به تشکيل ضايعات تودهاي، MRI نشانگر ضخيم شدگي شديد و تقويت [وضوح] سختشامه است. |
| هيپوتالاموس و هيپوفيز | سندرمهاي باليني ناشي از درگیری هيپوتالاموس و هيپوفيز؛ مثلاً کمبود هورمونهاي هيپوفيز قدامي، ديابت بيمزة مرکزي، يا هر دو، تصویربرداری نشانگر ضخيم شدگي ساقه هيپوفيز يا تشکيل توده بر روي آن، تورم غدة هيپوفيز، يا تشکيل توده درون هيپوفيز است. |
| عقدههاي لنفاوي | لنفآدنوپاتي فراگير يا بيماري متمرکز (لوکاليزه) در مجاورت يک اندام مبتلاي خاص، عقدههاي لنفي مبتلا معمولاً cm 1-2 قطر دارند و حساس نيستند. |
| غده تيروئيد | تيروئيد ريدل (Riedel’s t)؛ ونه فيبروززاي تيروئيديت هاشيموتو |
| ريهها | يافتههاي بيعلامت در تصويربرداري از ريه؛ سرفه، خلط خوني، تنگي نفس، افوزيون پلور، يا احساس ناراحتي در سينه؛ همراه با درگيري پارانشيم ريه، بيماري پلور، يا هر دو؛ چهار سندرم باليني ريوي اصلي: تومور کاذب التهابي، تودة اطراف مهرهاي که اغلب بر روي چندي مهره گسترش مييابد، بيماري راههاي هوايي مرکزي و پنوموني بينابيني متمرکز یا منتشر (گاه همراه با افوزيون پلور) يافت ميشود. |
| آئورت | يافتههاي بيعلامت در بررسيهاي راديولوژيک، يافتههاي غيرمنتظره در جراحي غير فوري (الکتيو) آئورت، ديسکسيون آئورت، سندرمهاي باليني – آسيبشناختي توصيه شده شامل موارد زير هستند: آئورت لنفوپلاسماسيتي آئورت سينهاي يا شکمي، ديسکسيون آئورت، پريآئورتيت و پريآرتريت و آنوريسم التهابي آئورت شکمي |
| رتروپريتوئن | کمردرد، درد بخش پاييني شکم، ادم اندام تحتاني، هيدرونفروز ناشي از درگيري حالب، يافتههاي بيعلامت در بررسيهاي راديولوژيک. نماي راديولوژيک کلاسيک عبارت است از التهاب دور آئورتی که رو به پايين پيش ميرود تا رگهاي ايلياک را درگير کند. |
| کليهها | نفريت لولهاي-بينابيني، گلومرولونفريت غشايي در اقليت کوچکي از بيماران؛ ضايعات توموري بيعلامت، معمولاً متعدد و دو طرفه، گاه در بررسيهاي راديولوژيک تشخيص داده ميشوند، درگيري کليوي که به شدت با هيپوکمپلمانمي همراه است. |
| پانکراس | پانکراتيت خود ايمن نوع 1 که به صورت درد خفيف شکم، کاهش وزن و زردي انسدادي حاد بروز ميکند و از آدنوکارسيوم پانکراس (شامل يک توده پانکراسي) تقليد ميکند، 50-20% بيماران با عدم تحمل خادگلوکز رجوع ميکنند؛ تصويربرداري نشانگر بزرگي منتشر (تحت عنوان «پانکراس سوسيس شکل») يا قطعه قطعه پانکراس، همراه با از ميان رفتن لوبولاريتة طبيعي آن است؛ وجود توده اغلب شک به بدخيمي را برمیانگیزد. |
| درخت صفراوي و کبد | زردي انسدادي همراه با روند خود ايمني در بيشتر موارد، استئاتوره، درد شکم و ديابت قندي نوظهور، مقلد کلانژيت اسکلروزان اوليه و کلانژيوکارسينوم |
| ساير اندامها | کيسه صفرا، کبد (توده)، پستان (تومور کاذب)، پروستات (پروستاتيسم)، پريکارد (پريکارديت فشارنده)، مزانتر (مزانتريت اسکلروزان)، ميان سينه (مدياستينيت فيبروززا)، پوست (پاپولهاي قرمز يا گوشتی رنگ)، عصب محيطي (التهاب دور عصبی) |
اتیولوژی:
علت نامشخص است، تصور میشود که به زمینه ژنتیکی، عفونت باکتریایی و تقلید مولکولی و بیماری خودایمنی مربوط باشد.
اپیدمیولوژی:
بروز IGG4-RD ناشناخته باقی مانده است. این به دلیل چالشهایی است که در تشخیص بیماری وجود دارد زیرا این بیماری اغلب تشخیص داده نمیشود یا اشتباه تشخیص داده میشود. در یک مطالعه کوهورت از 125 نمونه IgG4-RD اثبات شده در بیوپسی، میانگین سنی در هنگام تشخیص 55 سال بود (50 سال در شروع علائم) که از این تعداد 78 درصد سفیدپوست و 61 درصد مرد بودند.
بافتهای سر و گردن بیشترین آسیبدیدگی را داشتند. کلینیک مایو 166 بیمار مبتلا به IgG-RD را گزارش کرد. میانگین سن شروع 61 سالگی و نسبت مرد به زن 3:1 بود. 80 درصد بیماران سفیدپوست بودند. در گزارش کلینیک مایو؛ IgG4-RD کبد صفراوی شایعترین یافته بود. یک مطالعه از ژاپن 114 مورد را با نسبت مرد به زن مشابه 3:1 گزارش کرد.
بروز بیشتر بیماری در مردان بدون توجه به بافت آسیبدیده ادامه داشت، به استثنای IgG4-RD در سر و گردن (سیالادنیت یا داکریوآدنیت) که در آن توزیع مرد به زن برابر بود. در این گروه میانگین سنی در هنگام تشخیص 64 سال بود.
یک بررسی سیستماتیک 22 مورد IgG4-RD را در کودکان با میانگین سنی 13 سال (محدوده سنی 22 ماه تا 17 سال) نشان داد. 64% در مقایسه با مردان در بیماری بزرگسالان زن بودند. در جمعيت اطفال، IgG4-RD چشمي شایعترین بيماري بود كه در 44 درصد موارد ديده شد[4].
پاتوژنز
پاتوژنز IgG4-RD به طور ناقص تعریف شده است. عدم وجود محرکهای عفونی، تصویر بالینی و پاسخ معمولاً خوب به گلوکوکورتیکوئیدها یا سایر داروهای سرکوبکننده سیستم ایمنی، منشأ با واسطهی ایمنی را نشان میدهد.
شواهدی برای ارتباط محرکهای محیطی در IgG4-RD وجود دارد. یک مطالعه هلندی شامل بیماران مبتلا به کلانژیت و پانکراتیت مرتبط با IgG4، قرار گرفتن شغلی در معرض حلالها، روغنها و گرد و غبارهای صنعتی و فلزی را به عنوان عوامل خطر گزارش کرده است[5] ما ارتباط بین فیبروز خلفی صفاقی (RPF)، سیگار کشیدن و قرار گرفتن در معرض آزبست را گزارش کردیم[6].
در حال حاضر، هیچ ارتباط ژنتیکی واضحی با IgG4-RD وجود ندارد، با این حال، برخی از مطالعات نشان دادهاند که اجزای ژنتیکی در حساسیـت به IgG4-RD یا برخی از تظاهرات آن نقش دارند. به طور خاص، انواع HLA و غیر HLA به عنوان عوامل خطر توصیف شدهاند؛ به عنوان مثال، در بیماران مبتلا به RPF یک ارتباط معنیدار ژنومی با HLA-DRB1*03 گزارش شده است[7].
سلولهای B و T به عنوان بازیگران کلیدی در پاتوژنز بیماری شناخته شدهاند، اما نقش دقیق آنها هنوز مشخص نیست. اثربخشی آنتیبادی ضد CD20 ریتوکسیماب (RTX) در بیماران IgG4-RD باعث میشود که سلولهای B در پاتوژنز بیماری مرکزی باشند. سلولهای B که توسط آنتیژنهای ناشناخته هدایت میشوند، گسترش یافته و به پلاسمابلاستهای تولیدکننده IgG4 و سلولهای پلاسما تمایز مییابند[8].
پلاسمابلاستها همچنان توانایی تکثیر را در حالی که نیمه عمر کوتاهی دارند حفظ میکنند و در نهایت به سلولهای پلاسما تمایز مییابند. پلاسمابلاستهای در گردش که در افراد سالم نادر است، در بیماران مبتلا به IgG4-RD فعال افزایش یافته[9] و تعداد آنها پس از درمان RTX کاهش مییابد[10]. نقش سلولهای T پس از یافتهها، در بیوپسیهای بیماران مبتلا به IgG4-RD، بیان بالای سیتوکینهای مرتبط با یک سلول T تنظیمکننده و فنوتیپ سلول Th2 مورد تأکید قرار گرفت (مانند IL-4، IL-10، IL-13،TGF-β).
این سیتوکینها میتوانند فنوتیپ فیبروتیک را ترویج کرده و باعث تغییر کلاس ایمونوگلوبولین به تولید IgG4 شوند. اخیراً، شناسایی سلولهای T سیتوتوکسیک +CD4 در IgG4-RD بینشهای پاتوفیزیولوژیکی جدیدی ارائه کرده است. یک جمعیت از لنفوسیتهای T سیتوتوکسیک +CD4 در خون محیطی و ضایعات بافتی بیماران IgG4-RD نشان میدهد که این سلولها بیماریزا هستند. علاوه بر این، سلولهای کمکی فولیکولی Tکه عمدتاً در مراکز ژرمینال قرار دارند و به تمایز و گسترش سلولهای B کمک میکنـــند، در خون محیطی و در بافتهای آسیبدیده بیماران IgG4-RD افزایش مییابد.
پاسخ کمکی فولیکولی T احتمالاً باعث ایجاد مراکز ژرمینال در غدد لنفاوی و اندامهای آسیبدیده و تولید سیتوکینهایی میشود که سوئیچ کلاس IgG4 را هدایت میکنند. در نهایت، فیبروسیتها؛ پیشسازهای فیبروبلاستهای بافت بالغ ممکن است به بافتهای هدف نفوذ کرده و تحت تأثیر سیتوکینهای Th2 و کموکاینهایی مانند (CXCL12 لیگاند کموکاین موتیف C-(X-C 12 به فیبروز کمک کنند[11].
تشخیص
تشخیص IgG4-RD میتواند چالشبرانگیز باشد و رویکرد تشخیص به محل آسیبدیده بستگی دارد. همیشه باید یک فرآیند کامل را برای رد بیماریهای مختلف که میتوانند IgG4-RD را تقلید کنند دنبال کرد. این بیماریها شامل طیف گستردهای از شرایط از جمله بدخیمی، اختلالات لنفوپرولیفراتیو، واسکولیت مرتبط با آنتیبادیهای سیتوپلاسمی آنتی نوتروفیل (ANCA)، سارکوئیدوز، سندرم شوگرن، بیماری کستلمن و غیره است[12].
مهم است به یاد داشته باشید که سطوح IgG4 افزایش یافته پلاسما برای IgG4-RD نه اختصاصی و نه حساس است. IgG4 نرمال را میتوان تقریباً در یک چهارم موارد مشاهده کرد و استفاده از سطح cut-off برای IgG4 برابر با 135 میلیگرم در دسیلیتر دارای ارزش اخباری مثبت، تنها 34 درصد است. در حالی که بیوپسی بافتی برای رد کردن سرطان و سایر فرآیندهای احتمالی بیماری بسیار مفید است، رنگآمیزی سلولی +IgG4 در بیوپسی به تنهایی برای تشخیص قطعی IgG4-RD کافی نیست زیرا وجود پلاسما سل +IgG 4 در بافت در سایر بیماریها از جمله بدخیمیها قابل مشاهده است.
بهعلاوه، نمونهبرداری از مکانهای خاصی که تحت تأثیر IgG4-RD قرار گرفتهاند، مانند خلف صفاق، حفره مداری و پانکراس بسیار دشوار است. تعداد زیاد پلاسمابلاستهای در گردش را میتوان در انواع شرایط التهابی مشاهده کرد، اما افزایش قابل توجهی (بیش از 2000 سلول /میلیلیتر) در IgG4-RD مشاهده شد و ممکن است به عنوان نشانگری برای تشخیص و اندازهگیری فعالیت بیماری عمل کند.
افزایش پلاسمابلاستها در IgG4-RD حتی در بیمارانی که سطح IgG4 طبیعی داشتند مشاهده شد. با این حال، آزمایش پلاسما بلاستها ممکن است به آسانی در همه سیستمهای بالینی در دسترس نباشد و مطالعات بیشتری برای توصیه به استفاده جهانی از این آزمایش موردنیاز است. معیارهای تشخیصی جامع برای IgG4-RD و IgG4-RD اختصاصی اندام (مانند بیماری کلیوی مرتبط با AIP و IgG4) وجود دارد و تظاهرات بالینی، سرولوژیکی، رادیوگرافیک و هیستوپاتولوژیک را در نظر میگیرد. با این حال، برخی از معیارهای پیشنهادی، حساسیت کم (تا 70 درصد) داشتند.
همچنین، یک اخطار بزرگ، توانایی تشخیص IgG4-RD بدون انجام بیوپسی بود که میتواند مشکلساز باشد. استفاده از این معیارها نباید جایگزین نیاز به بیوپسی از ضایعه مشکوک شود. ارزیابی باید با شرح حال کامل و معاینه فیزیکی شروع شود، سپس زمانی که شک نسبت به بیماری ایجاد گردید، آزمایش آزمایشگاهی و ارزیابی رادیولوژی مناسب به محل درگیر انجام گیرد. سطح IgG4 پلاسما باید در همه بیماران به دست آید.
اکثر موارد IgG4-RD کلیوی دارای کمپلمانهای پایینی هستند که اغلب با فعالیت بیماری مرتبط است، بنابراین سطوح کمپلمان باید در صورت مشکوک بودن به IgG4-RD کلیه به دست آید. اندازهگیری پلاسمابلاستهای در گردش، در صورت وجود، میتواند مفید باشد، به خصوص اگر سطح سرمی IgG4 نرمال باشد. انتخاب روش تصویربرداری در ارزیابی IgG4-RD به اندام تحت ارزیابی، تخصص رادیولوژی محلی و در دسترس بودن بستگی دارد.
توموگرافی کامپیوتری (CT)، CT با توموگرافی گسیل پوزیترون (CT-PET)، تصویربرداری رزونانس مغناطیسی (MRI)، کلانژیوپانکراتوگرافی رزونانس مغناطیسی (MRCP)، کلانژیوپانکراتوگرافی رتروگراد آندوسکوپی (ERCP) و سونوگرافی آندوسکوپی (EUS) روشهایی هستند که معمولاً مورد استفاده قرار میگیرند. بــــــــــــــرای ارزیابی IgG4-RD بیوپسی سنگ بنای ارزیابی باقی میماند. همانطور که اشاره شد، وجود سطح بالایی از سلولهای پلاسما IgG4+ > 10/HPF یا IgG4+/IgG4> 40% معمولی است اما تشخیصی نیست.
یافتههای فیبروز استوریفورم و فلبیت انسدادی، ویژگی تشخیص را افزایش میدهد. تشخیص IgG4-RD صفراوی یا پانکراس به دلیل مشکلات در به دست آوردن نمونههای بافتی کافی، چالشبرانگیزتر است. یافتههای تصویربرداری مشخصه و آزمایشهای سرولوژیک به معیارهای اصلی تشخیصی تبدیل میشوند. با این حال، آسپیراسیون با سوزن ظریف لوزالمعده و سیتولوژی سیستم صفراوی با brush cytology برای رد بدخیمی مهم هستند.
تشخیص با همبستگی بالینی یافتههای آزمایشگاهی، تصویربرداری و هیستوپاتولوژیک در صورت عدم وجود بدخیمی یا سایر فرآیندهای بیماری که میتواند تظاهرات را توضیح دهد، انجام میشود (شکل 2).
شکل (2): نمودار جریان پیشنهادی برای کار تشخیصی IgG4-RD
درمان:
1- درمان با کورتیکواستروئیدها
کورتیکواستروئیدها پایه اصلی درمان هستند. هیچ مطالعه تصادفی کنترل شدهای برای درمان IgG4-RD تا به امروز انجام نشده است. فوریت درمان به درگیری اندامهای حیاتی و خطر آسیب اندام بستگی دارد. تعیینکننده اصلی پاسخگویی به درمان، درجه فیبروز است. بیمارانی که فیبروز طولانی مدت دارند شانس درمان کمی دارند.
در بیماران مبتلا به اختلالات پیشرفته اندام مانند وجود فشار خون پورتال، سیروز، دیسکسیون آئورت، فیبروز غیر قابل برگشت و پوشش عروق در مزانتر و خلف صفاق، اختلال عملکرد مزمن بزاقی و غدد اشکی یا تومورهای کاذب مداری که منجر به از دست دادن بینایی میشود، مدیریت حمایتی توصیه میشود.
لنفادنوپاتی و ندولهای ریوی ممکن است خود به خود برطرف شوند. بهبود سریع پس از شروع درمان با گلوکوکورتیکوئید اغلب به عنوان یک علامت تشخیصی مفید در بیماران با تشخیص نامشخص تفسیر میشود. مشاهده شد که چنین بیمارانی دارای غلظت نسبتاً پایین IgG4 سرم بدون وجود زردی انسدادی یا دیابت بودند و تورم لوزالمعده کانونی به جای منتشر را نشان دادند. پاسخ در کسانی که بیماری التهابی اولیه دارند در مقایسه با بیمارانی که عمدتاً فیبروز دارند، چشمگیر است.
اکثر بیماران پاسخ سریع اما پایداری به گلوکوکورتیکوئید دارند. پاسخ بالینی با بهبود رادیولوژیکی، بیوشیمیایی و سرولوژیکی همراه است. پاسخ در التهاب اولیه قابل توجه است و زمان بهبودی را کاهش میدهد و عملکرد برونریز (exocrine) را بهبود میبخشد. پاسخ معمولاً در 2 تا 4 هفته شروع میشود. معمولاً حداقل یک دوره درمان 3 تا 6 ماهه توصیه میشود. سطح سرمی IgG4 پایین میآید اما نرمال نمیشود. افزایش مداوم Ig4 با خطر بالاتر عود بیماری همراه است، اما همیشگی نیست[13].
2-پردنیزون
دو نظر در مورد دوز استروئید از ژاپن و کلینیک مایو در ایالات متحده وجود دارد. هفده مرکز ارجاع در ژاپن پیشنهاد کردند که ابتدا بیماران را با پردنیزولون درمان کنند. به طور خاص 0.6 میلیگرم بر کیلوگرم در روز به مدت 2 تا 4 هفته و 3 تا 6 ماه کاهش یافت و به دوز 5 میلیگرم در روز کاهش یافت و در نهایت با دوز بین 2.5 تا 5 میلیگرم در روز تا 3 سال ادامه یافت.
در کلینیک مایو، روال کار این بود که درمان با پردنیزون 40 میلیگرم در روز شروع شود و این دوز به مدت 4 هفته حفظ شود، سپس با کاهش 7 هفتهای پردنیزون و کاهش دوز پردنیزون به میزان 5 میلیگرم در هفته قطع شود، مدت زمان کل 11 هفته بود با این حال، 50٪ از بیماران AIP در عرض 3 ماه عود کردند. میزان عود پس از درمان با استروئید بین 10 تا 53 درصد است. نگهداری گلوکوکورتیکوئیدها در مقایسه با قطع کامل استروئید با میزان عود کمتری همراه است[13]
3- استنت گذاری صفراوی
علاوه بر درمان با پردنیزون، بسیاری از بیماران مبتلا به پانکراتیت اتوایمیون نیز تحت یک روش استنت گذاری صفراوی قرار میگیرند که اعتقاد بر این است که زمان لازم برای بهبـــود علائم را کوتاه میکند[14]. همچنین درمان با گلوکوکورتیکوئیدها زمان موردنیاز برای استنتهای صفراوی را کوتاه میکند.
در بیماران مبتلا به بیماری عودکننده یا مقاوم به درمان که در حال کاهش یا قطع استروئید هستند، داروهای خط دومی که میتوانند آزمایش شوند عبارتند از آزاتیوپرین (2 میلیگرم بر کیلوگرم در روز)، مایکوفنولات موفتیل (تا 2.5 گرم در روز در صورت تحمل) و متوترکسات .با این حال، هیچ مطالعه کنترل تصادفی برای تأیید اثربخشی آنها انجام نشده است.
4- کاهش سلولهای B (B-cell depletion)
کاهش سلولهای B با استفاده از ریتوکسیماب( یک گرم وریدی [IV] هر 15 روز برای مجموع 2 دوز) روش دیگری از درمان است. بیمارانی که تحت درمان کاهش سلولهای B قرار میگیرند، پاسخ بالینی سریع و کاهش سطح IgG4 سرم را نشان میدهند؛ اما کاهش IgG4 بافت و سلولهای پلاسما قابل توجه نیست. کاهش هدفمند و اغلب سریع غلظت IgG4 سرم از طریق تخلیه سلولهای B امکانپذیر است که منجر به حفظ نسبی سایر ایمونوگلوبولینها و غلظتهای زیرکلاس ایمونوگلوبولین میشود.
این نشان میدهد که کاهش سلولهای B اثرات خود را حداقل تا حدی، با تداخل در تکمیل سلولهای پلاسمایی کوتاهمدت که IgG4 تولید میکنند، به دست میآورد.[15] هنگامی که این سلولهای تولیدکننده IgG4 ناپدید میشوند، پس از درمان ضد CD20 دوباره پر نمیشوند زیرا مجموعه سلولهای B در گردش تخلیه شده است. ریتوکسیماب باعث کاهش حتی سریعتر و شدیدتر در غلظت پلاسمابلاست خون میشود.
بورتزومیب (Bortezomib) یک مهارکننده پروتئازوم با سمیت سلولی در برابر سلولهای پلاسما است که برای مولتیپل میلوما تأیید شده است که طبق گزارشها، در بیماری ریه و اربیتال مرتبط با IgG4 مؤثر است[16].
5- درمان بیولوژیکی
ظهور داروهای بیولوژیک امکان درمان بیماران مقاوم به بیماری یا بیماری شدید را افزایش داده است. نتایج دلگرمکنندهای با کاهش سلولهای B با استفاده از RTX گزارش شده است. RTX اولین بار در سال 2010 مفید گزارش شد؛ زمانی که با موفقیت برای درمان چهار بیمار مبتلا به IgG4-RD مقاوم به درمان استفاده گردید. کاروترز و همکاران نتایج یک مطالعه آیندهنگر با برچسب باز شامل 30 بیمار IgG4-RD که با دو دوز هزار میلیگرم RTX، عمدتاً بدون گلوکوکورتیکوئیدهای همزمان درمان شدهاند، گزارش کرد.
این محققین پاسخهایی را در 97 درصد بیماران با تحمل دارویی خوب گزارش کردند. با این حال، بسیاری از نویسندگان درصد بالایی از عود را در بیمارانی که قبلاً با RTX درمان شدهاند، گزارش میکنند. یک مطالعه گذشتهنگر شامل 24 بیمار گزارش داد که 33٪ از بیماران با تأخیر متوسط 18 ماه عود کردند، بنابراین، مطالعات بیشتری برای تعریف بهتر نقش RTX در درمان IgG4-RD موردنیاز است. در نهایت، اخیراً موارد درمان شده با سایر عوامل بیولوژیکی از جمله اینفلیکسیماب و بورتزومیب گزارش شده است[11].
منابع:
- Stone JH, Zen Y, Deshpande V. IgG4-related disease. N Engl J Med. 2012;366(6):539-51.
- Wallace ZS, Stone JH. An update on IgG4-related disease. Curr Opin Rheumatol. 2015;27(1):83-90.
- Luke YCC, Andre M, Michael AS, Mollie NC. IgG4-related disease: what a hematologist needs to know. Haematologica. 2019;104(3):444-55.
- Al-Khalili OM, Erickson AR. IgG-4 Related Disease: An Introduction. Mo Med. 2018;115(3):253-6.
- de Buy Wenniger LJ, Culver EL, Beuers U. Exposure to occupational antigens might predispose to IgG4-related disease. Hepatology. 2014;60(4):1453-4.
- Goldoni M, Bonini S, Urban ML, Palmisano A, De Palma G, Galletti E, et al. Asbestos and smoking as risk factors for idiopathic retroperitoneal fibrosis: a case-control study. Ann Intern Med. 2014;161(3):181-8.
- Ishikawa Y, Terao C. Genetic analysis of IgG4-related disease. Modern Rheumatology. 2020;30(1):17-23.
- Carruthers MN, Topazian MD, Khosroshahi A, Witzig TE, Wallace ZS, Hart PA, et al. Rituximab for IgG4-related disease: a prospective, open-label trial. Annals of the rheumatic diseases. 2015;74(6):1171-7.
- Mattoo H, Mahajan VS, Della-Torre E, Sekigami Y, Carruthers M, Wallace ZS, et al. De novo oligoclonal expansions of circulating plasmablasts in active and relapsing IgG4-related disease. J Allergy Clin Immunol. 2014;134(3):679-87.
- Wallace ZS, Mattoo H, Carruthers M, Mahajan VS, Della Torre E, Lee H, et al. Plasmablasts as a biomarker for IgG4-related disease, independent of serum IgG4 concentrations. Ann Rheum Dis. 2015;74(1):190-5.
- Maritati F, Peyronel F, Vaglio A. IgG4-related disease: a clinical perspective. Rheumatology. 2020;59(Supplement_3):iii123-iii31.
- Umehara H, Okazaki K, Nakamura T, Satoh-Nakamura T, Nakajima A, Kawano M, et al. Current approach to the diagnosis of IgG4-related disease – Combination of comprehensive diagnostic and organ-specific criteria. Mod Rheumatol. 2017;27(3):381-91.
- Khosroshahi A, Stone JH. Treatment approaches to IgG4-related systemic disease. Curr Opin Rheumatol. 2011;23(1):67-71.
- Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, et al. Immunoglobulin G4-associated cholangitis: clinical profile and response to therapy. Gastroenterology. 2008;134(3):706-15.
- Khosroshahi A, Carruthers MN, Deshpande V, Unizony S, Bloch DB, Stone JH. Rituximab for the treatment of IgG4-related disease: lessons from 10 consecutive patients. Medicine (Baltimore). 2012;91(1):57-66.
- Ghazale A, Chari ST, Smyrk TC, Levy MJ, Topazian MD, Takahashi N, et al. Value of serum IgG4 in the diagnosis of autoimmune pancreatitis and in distinguishing it from pancreatic cancer. Am J Gastroenterol. 2007;102(8):1646-53.
ورود / ثبت نام