اینترابادیها و مصارف درمانی آن
جواد سنچولی، دانشجوی رشته ایمونولوژی پزشکی مقطع Ph.d، دانشگاه علوم پزشکی مشهد
E.mail: sanchoolij921@mums.ac.ir
مقدمه
آنتیبادیهای معمولی از سلولهای پلاسماسل ترشح میشوند و اصولاً در محیط خارج سلولی فعال هستند. در مقابل این آنتیبادیهای طبیعی که طویل و دوزنجیرهای هستند، اینترابادی ها قرار دارند مانند scFV که قابلیت بیان شدن در سیتوپلاسم سلول یوکاریوتی را دارند و میتوانند به هر بخشی از پروتئینهای هدف درون سلولی حمله کنند و آثار بیولوژیک اختصاصی را راهاندازی کنند.
این scFVها که بطور کلی به عنوان اینترابادی شناخته میشوند ممکن است بالقوه نقشی قوی را در ژنومیکس عملکردی داشته باشند، بویژه از طریق متوقف کردن یا مدیولیت کردن فعال رشد برخی از پروتئینهای شناخته شده درون سلولی. بنابراین اینترابادیها میتوانند در شناسایی و درک فعالیت پروتئینها مشارکت داشته باشند.
اینترابادی ها حتی ممکن است در مصارف درمانی و ژنتراپی کاربرد داشته باشند.
تنها چند نمونه موفقیتآمیز از اینترابادی ها وجود دارند ولی برخی مشکلات بر سر راه این پروتئینها وجود دارد. بیان سیتوپلاسمی این پروتئینها عموماً با برخی مشکلات از جمله پایداری، حلالیت و تمایل به تجمع این مواد روبروست.
وجود محیط سیتوپلاسمیک احیاء، از تشکیل پلهای دیسولفیدی درون دومینی بسیار حفاظت شده جلوگیری میکند و ساختار بسیار پایدار این پروتئینها به فولدینگ در غیاب باندهای دیسولفیدی نیازمند است تا اگریگیشن اتفاق نیفتد.
اینترابادی چیست؟
- مولکولهای پروتئینی هستند که عملکردشان را در درون سلول دنبال میکنند. این کار را بصورت خنثی کردن اهداف پروتئینی داخل سلولی از طریق اتصال مستقیم به دومینهای عملکردی آنها انجام میدهند یا اینکه باعث تغییر موقعیت اهداف آنتیژنی داخل سلولی میشوند.
- اینترابادی ها، یک روش بسیار مهیج برای درمان بیماریهایی هستند که از دسترس داروها خارج هستند.
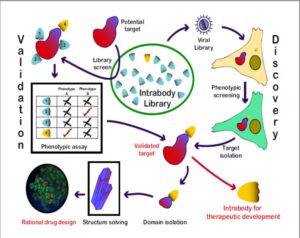
تصویر 1-1
در تصویر (1-1) مشاهده مینماییم که کتابخانهای از اینترابادی های متفاوت ایجاد شدهاند و میتوانند با اهداف خود وارد واکنش شوند. اینترابادی میتواند با اهداف خود در هرنقطهای وارد واکنش شود. در تصویر کاربردهای این پروتئین بطور خلاصه نشان داده شده است.
- در تعیین فنوتایپ
- در تعیین فنوتایپ پروتئین داخل سلولی با استفاده از فاژها
- در افزایش توانایی درمان بیماریها و کاهش استفاده از سایر داروها
- در طراحی برخی داروهای کوچک مولکول برای دومینهای اتصالی به اینترابادی
تاریخچه اینترابادی
- شروع مداخلات آنتیبادیهای مونوکلونال در سال 1975 بود.
- بعد از آن تکنولوژیهای تولید آنتیبادی در محیط آزمایشگاهی گسترش یافت، آنتیبادیهای با اختصاصیت تکگانه در مقادیر زیاد برای مطالعات بیولوژیک در دسترس قرار گرفتند و به همین میزان برای مصارف درمانی توسعه یافتند.
- آنتیبادیها قادر هستند واکنشهای بین مولکولی را متوقف کنند، به اهداف منفرد به صورت تگ بچسبند، از اضافه شدن سوبسترا به آنزیم جلوگیری کنند، عملکرد یک آنزیم را تشدید یا مهار کنند، با اتصال به مولکول هدف و متوقف کردن آن از انتقال پیام درون سلولی جلوگیری کنند، اتصالات مولکولی جدیدی را در مواد شیمیایی ایجاد کنند، بنابراین به کاتالیزهای مؤثر تبدیل میشوند. اصولاً، جایی که برای آنتیبادی در دسترس است محیط خارج سلولی و لوله آزمایش میباشد.
- در سال 1980 خنثیسازی آنتیژنهای توموری SV40 در ادامه میکروانجکشن آنتیبادی اختصاصی به داخل سلول توسط آنتمن و لوینگستون صورت پذیرفت.
- در سال 1988 گزارش شد که یک آنتیبادی کامل و سالم و فعال در داخل سیتوپلاسم سلول میتواند دستهبندی شود (ایجاد شود) و در سال 1990 بود که بیان intact Ab در سلولهای پستانداران حاصل شد.
- اولین بار در سال 1990 درمورد اینترابادی ها صحبت شد که آنتیبادیهایی وجود دارند که میتوانند اهداف خود را در داخل سلول پستانداران مورد هدف قرار دهند و این امکان برای این پروتئینها وجود دارد که در داخل سلول بیان شوند و این پروتئینها موجب شدند که تصویر بهرهبرداری و استفاده از آنتیبادیهای نوترکیب برای متوقف کردن و مدیولیت کردن مولکولهای هدف در داخل سلول به اینترابادی منتقل شود.
- اینترابادیها سپس در تحقیقات پایه وارد شدند و مصارف درمانی متعددی برای آنها کشف شد. اکنون از آنها در ممانعت از انتقال پیامهای مسیرهای داخل سلولی، ممانعت از همانندسازی ویروس ایدز و جلوگیری از رشد سلولهای توموری و جراحیهای بعد از انتقال پیوند استفاده میشود.
- تکنولوژی اینترابادی براساس زنجیرهها و دومینهای آن بنا نهاده شد که اگر با سیگنالهای محلی مناسب مجهز گردد میتواند اهداف درون سلولی بیگانه جدید را که با آنتیژنهای درون سلولی مداخله میکنند مورد هدف قرار دهد.
- از اینترابادیها میتوان در تعیین و سکوئنسینگ دومینهای غالب و مستقل پروتئینهای تارگت استفاده کرد و میتوان آنها را داخل پروتئینهای گزارشگر دیگر مانند آنتیبادیها پیوند زد تا در موقعیتهای جدید درون سلولی شرکت کنند. چندین آنتیبادی نوترکیب متفاوت ایجاد شدهاند که بطور موفقیتآمیز در داخل سلول بیان میشوند به ویژه: scFV، diabodies، single domain VL and VH…
مانند: single domain V-Like in Camelids
ساختار اینترابادی
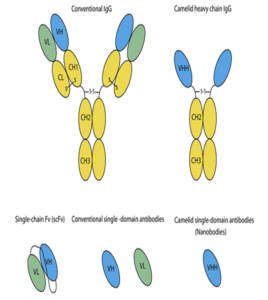
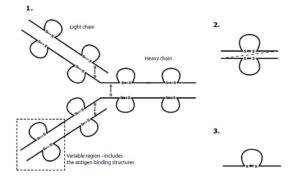
تصویر 1-2
توضیح تصویر فوق:
آنتیبادیهای طبیعی همان طور که در شکل مشاهده مینمایید از 4 زنجیره تشکیل شدهاند. برای اینترابادیها که میبایست به داخل سلول مهاجرت کنند 2 ساختار پیشبینی شده است:
- scFV که از 2 ناحیه اتصالی به آنتیژن تشکیل شده و مربوط به یک آنتیبادی هستند و بصورت تکزنجیره پلیپپتیدی قرار میگیرند و در این حالت یک پلیپپتید بصورت لینکر دو قطعه جدا از هم را بهم متصل کرده و بصورت فولدینگ مناسب نگه میدارد.
- single domsin antibody (Dab) که یکی از دو بخش (دومین) اتصالی به آنتیژن است که بصورت جدا از هم قرار میگیرند و بطور مؤثر نیمی از جایگاه اتصالی آنتیبادی استاندارد را ارائه میدهند. بهرحال در تعداد زیادی از آنتیبادیها، یکی از دو نیمه اتصالی در اتصال به هدف بصورت غالب میتواند باشد و در اکثر موارد قطعه دومین اتصالی تک را میتوان به کمک افینیتی اتصالی مقایسهای نسبت به آنتیبادی کامل دست نخورده و svFV خالصسازی و جدا کرد.
کاربردها
- درمان سرطان
- ممانعت و تنظیم منفی رسپتورهای فاکتورهای رشد
- اینترابادیهایی که هسته را هدف قرار میدهند.
- اینترابادیهایی که پروتئینهای خارج سلولی را هدف قرار میدهند.
- در مسیرهای آپوپتوزیس دخالت میکنند.
- در درمان عفونت ویروس ایدز
- برای مهار پاسخ ایمنی
- استفاده اینترابادی scFV بر ضد پروتئین هانتیگتون، که با مداخله در تشکیل تجمعهای داخل سلولی این پروتئینهای ویژه بیماری، به بهبود بیماری کمک میکند.
(جدول 1): برخی اینترابادیهای رایج که در درمان استفاده میشوند
| Target | Intrabody format | Cellular compartment |
| Cancer therapy | ||
| Bcl-2 | scFv | Cytoplasm |
| BCR- ABL | scFv | Cytoplasm , ER |
| Caspase3 | scFv | Cytoplasm |
| Caspase7 | scFv | Cytoplasm |
| Cathepsin L | scFv | ER |
| Cyclin E | scFv-Fc | Cytoplasm |
| EGFR | scFv | Cytoplasm , ER |
| erbB2 | scFv | Cytoplasm , ER |
| HP1 | scFv | Cytoplasm |
| p21Ras | scFv-IgG | Cytoplasm |
| p53 | scFv | Cytoplasm |
| IL-2R | scFv | ER |
بیماریهای ناشی از تغییرات در کونفورماسیون و فولدینگ نامناسب پروتئینها، کلاس بزرگی را تشکیل میدهند که پروتئینها در آنها فولدینگ نامناسب داشته و تجمع مییابند که شامل موارد زیر هستند:
- آلزایمر
- پارکینسون
- هانتیگتون
- کروتزفلد جاکوب
- دیابت تایپ 2
- همه بیماریهای فوق در یک ویژگی مشترک هستند که پروتئینهای محلول و نرمال آنها تغییر شکل یافته و به فرمهای نامحلول و بدون عملکرد طبیعی تبدیل میشوند و در داخل سلول تجمع و رسوب مییابند که موجب تغییرات پاتوژنیک بافتها و اندامها میشوند.
- هر یک از بیماریها همراه یک یا بیشتر پروتئین اختصاصی میباشد. مانند: Amyloid-B یا tau protein که پپتید در آلزایمر است. فرم جهشیافته m-HTT در بیماری هانتیگتون وجود دارد.
A-synuclein در بیماری پارکینسون و B-microglobulin در بیماری میلوئیدوز مرتبط با دیالیز و پروتئین پرایون در بیماری کروتزفلد جاکوب. - درمان بیماریهای ناشی از فولدینگ نامناسب پروتئینی یا براین هدف استوار است که فرم ذاتی و اولیه آن را پایدار کند و یا از تجمع و فولدینگ بد آنها پیشگیری کند و یا پاکسازی آنها را سرعت بخشد.
- اینترابادیها عوامل درمانی هستند که برای درمان بیماریهای کونفورموشنال استفاده میشوند. هم به سبب عملکرد اختصاصی آنها که بر سطح پروتئین اثر میگذارد و هم توانایی نامحدودشان در تشخیص همه انواع پروتئینهای مستعد برای فولدینگ نامناسب.
- اینترابادیها میتوانند در مداخلات درمانی برای هدف استفاده شوند:
- تنظیم منفی کنند و یا پروتئین بکر اولیه را پایدار کنند.
- اولیگومرهای محلول را خنثی کنند.
- پروتئینهای تجمع یافته با فولدینگ نامناسب را ناپایدار و پاکسازی کنند.
- از ایجاد انواع توکسیک جلوگیری کنند.
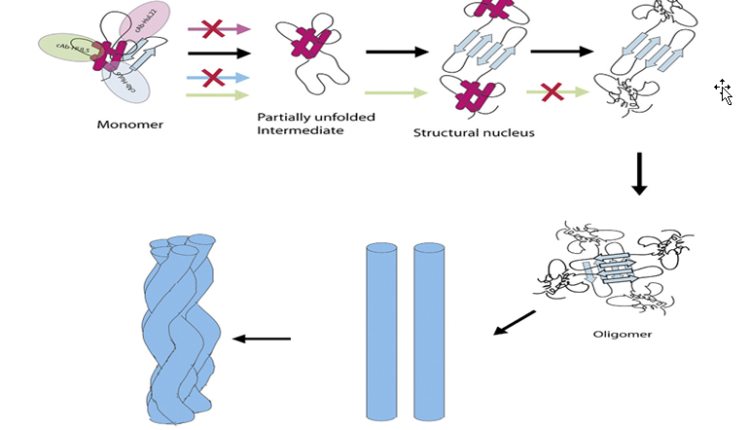
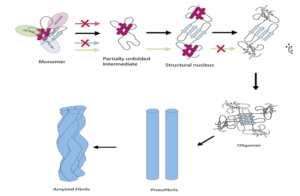
مدل کنیتیک تشکیل فیبریل در مراحل اولیه و ثانویه
همانطور که در شکل میبینیم اشکال مونومرهای محلول پروتئین که به شکل اولیگومر تبدیل میشوند این قابلیت را مییابند که به فرمهای رشتهای نامحلول تبدیل شوند. در ادامه تجمع پروتئینی ایجاد میشود.
| تصویر 1-3 |
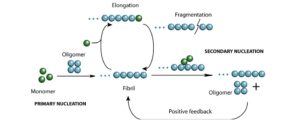
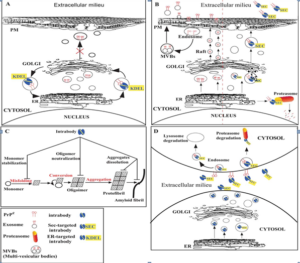
زمانی که پروتئینها عملکردشان را از دست بدهند تجمع مییابند که برای خود سلول مخرب خواهد بود. سیستمهایی برای گریز از این مشکلات وجود دارد مانند آنزیمهای پروتئاز داخل سلول و پروتئینهای چاپرون و اینترابادی
| تصویر 1-4 |
عملکرد اینترابادی ها برعلیه misfolding:
- به چرخش درآوردن مجدد آنتیژنهای مستعد به فولدینگ نامناسب در محلهای تجمع
- ممانعت از تجمع پروتئینها از طریق خنثیسازی مستقیم دومینهای آمیلوایدیوژنیک
- ناپایدارسازی انواع تجمع یافته
- ممانعت از پروسههای بعد از ترجمه پروتئین، بویژه پروسه پروتئولیتیک.
- ممانعت از ترشح پاراکرینی. (تصویر 1-5)
تصویر 1-5
1- به چرخش درآوردن مجدد
هدف قرار دادن آنتیژن در موقعیت درون سلولی عملکرد اصلی اینترابادی است. در بخش ترشحی، با اضافه کردن توالی KDEL در بخش C ترمینال اینترابادی، میتوان اینترابادی را در شبکه اندوپلاسمی محبوس کرد، بنابراین اینترابادی میتواند به عنوان یک لنگر از حضور یک پروتئین در غشاء پلاسمایی و نهایتاً از ترشح آن جلوگیری کند.
2- پیشگیری از تجمع
پایدار کردن شکل فضایی پروتئینهای اولیه، از فولدینگ نامناسب آنها جلوگیری میکند. از طرفی پایدار کردن شکل فضایی با فولدینگ نامناسب پروتئین نیز پاکسازی آنها را تسریع میکند. این دو مورد جنبههای مکمل یک مشکل مشابه هستند: حذف کردن یا لااقل انباشتگی آرام اگرگیت شدهها و انواع پروتئینهای بالقوه توکسیک. اینترابادیهای اختصاصی بطور موفقیتآمیزی برای جلوگیری از تجمع پروتئینهای آمیلوایدیوژنیک در اختلالات کونفورماسیونی مانند: HD ,PD ,AD و بیماریهای غیرنورونی مانند OPMD استفاده میشوند.
3- مهار اگریگیشن از طریق پاراکرین
ایمونیزاسیون غیرفعال که به واسطه درمان با آنتیبادی مونو یا پلیکلونال و برای مدت طولانی انجام میشود یک درمان مؤثر برعلیه بیماریهای misfolding مانند TSE و DA ایجاد میکند. محدودیت اصلی روش ایمونیزاسیون پاسیو با استفاده از آنتیبادیهای مونوکلونال و پلیکلونال، پتانسیل بروز پاسخهای ایمنی بد و معکوس است که به سبب حضور IgG FC effector و همچنین انتشار زیستی محدود و در دسترس بودن آنتیبادی کامل است بویژه در سیستم عصبی مرکزی!
برای بیماریهای پرایون، انکوباسیون آنتیبادیهای مونوکلونال جهت یافته برعلیه PrPC در سلولهای مبتلا به اسکراپی مزمن، از عفونت اسکراپی جدید جلوگیری میکند.
منابع:
- Martin R Stocks Intrabodies: Turning the Immune System Inside Out for New Discovery Tools and Therapeutics,Published on July 26, 2009 , Mill Hill, London, NW7 1AD, United Kingdom.
- Martin R. Stocks , Intrabodies: production and promise, DDT Vol. 9, No. 22 November 2004
- Erwin De Genst,Anne Messer,Christopher M.Dobson, Antibodies and protein misfolding:From structural research tools to Biochimicaet BiophysicaActa1844(2014)1907…1919.
- Alessio Cardinale and Silvia Biocca, Combating Protein Misfolding and Aggregation by Intracellular , 2 Current Molecular Medicine 2008, 8, 2-11 .
- Jayapal Manikandan, Peter N Pushparaj, and Alirio J Melendez, Protein i: interference at protein level by intrabodies
- Abner M. Mhashilkar, Debajit k. Biswas,Joyce Lavecchio,Arthur B. Pardee,and Wayne A. Marascol : Inhibition of Human Immunodeficiency Virus Type 1 Replication In Vitro by a Novel Combination of Anti-Tat Single-Chain Intrabodies and NF-kB Antagonists. JOURNAL OF VIROLOGY, Sept. 1997, p. 6486–6494
- Adrian Auf der Maur,Christian Zahnd, Franziska Fischer, Silvia Spinelli,Annemarie Honegger,Christian Cambillau,Dominik Escher, Andreas Plu,ckthun,and Alcide Barberis, Direct in Vivo Screening of Intrabody Libraries Constructed on aHighly Stable Single-chain Framework, THE Journal Of Biological Chemistry: Vol. 277, No. 47, Issue of November 22, pp. 45075–45085, 2002
- H. Antman, D.M. Livingston , Intracellular neutralization of SV40 tumor antigens following microinjection of specific antibody(intrabody) Cell, 19 (1980), pp. 627–635.
- Biocca, et al. Expression and targeting of intracellular antibodies in mammalian cells EMBO J, 9 (1990), pp. 101–108).
https://pubmed.ncbi.nlm.nih.gov/18071953/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام