اصول فنی تجهیزات آزمایشگاهی
قسمت سوم
روشهای جداسازی کروماتوگرافی
مهندس احسان درخشان نیا
کروماتوگرافی
کروماتوگرافی عبارت جامعي است براي يك مجموعه از تكنيكهاي آزمايشگاهيِ مورد استفاده در جداسازي تركيبها؛ به بیان بهتر کروماتوگرافی يك روش جداسازي توانمند است كه در تمام شاخههاي علوم كاربردهايي دارد و بهطور گسترده برای جداسازی، شناسایی و تعیین اجزای سازنده شیمیایی در مخلوطهای پیچیده بکار میرود. تا اواسط قرن نوزدهم، جداسازیهای تجزیهای عمدتاً بهوسیله روشهای کلاسیک مانند رسوبگیری، تقطیر و استخراج انجام میشد، كمي بعد از شروع قرن بيستم، کروماتوگرافی توسط گياهشناسي روسي، ميخائيل تسوت- MikhailTswett ابداع و نامگذاري شد.
او اين فن را براي جدا كردن رنگدانههاي گياهي مختلف از قبيل كلروفيل و زانتوفيل، با عبور دادن محلولهايي از اين تركيبات از داخل يك ستون شيشهاي كه با گرد نرم كلسيم كربنات انباشته شده بود، بكار برد. از آنجا كه گونههاي جداشده بهصورت نوارهاي رنگي در ستون ظاهر شدند، وي نام کروماتوگرافی را براي اين روش انتخاب كرد. لازم به ذکر است که در زبان يوناني كروما- chroma يعني «رنگ» و گرافي- graphein يعني نوشتن.
كاربرد کروماتوگرافی نه تنها به دليل ابداع چند نوع جديدِ فن کروماتوگرافی، بلكه به دليل افزايش نياز دانشمندان به روشهاي بهتر براي تشخيص اجزاي مخلوطهاي پيچيده، بهطور حیرتآوری گسترش يافته است. تأثیر شگفتآور اين روشها بر علم را ميتوان با اهداي جايــــــــــزه نوبل ۱۹۵۲ به مارتين و سينج- A. J. P. Martin and R.L. M. Syngeبه پاس اكتشافات آنها در زمينه کروماتوگرافی دريافت. شايد نشانه بارزترين تأثیر، فهرستي از دوازده جايزه نوبل باشد كه بين سالهای ۱۹۳۷ و ۱۹۷۲ به پاس تلاشهايي اهدا گرديده است كه در آنها کروماتوگرافی نقش حياتي داشته است. هماکنون اين فهرست بدون شك بهطور قابلتوجهی افزايش يافته است.
در تمام جداسازيهاي كروماتوگرافي، نمونه، در يك فاز متحرك كه ممكن است گاز، مايع يا سيال ابر بحراني- Supercritical Fluid باشد، حل ميشود. سپس اين فاز متحرك از درون يك فاز ساكن امتزاجناپذير كه بر سطح يك جامد يا در محلي داخل ستون تثبيت شده است، با فشار عبور داده ميشود. دو فاز طوري انتخاب ميشوند كه اجزاي نمونه خود را با درجات مختلفي بين فاز ساكن و متحرك توزيع كنند. آن اجزائي كه با فاز ساكن قوياً نگه داشته ميشوند به آهستگي با جريان فاز متحرك حركت ميكنند.
در مقابل، اجزائي كه بهطور ضعيف بهوسیله فاز ساكن نگه داشته ميشوند، بهسرعت حركت ميكنند. در نتيجهي اين اختلافات در تحرك، اجزاي نمونه به نوارهاي مجزا جدا ميشوند كه ميتوان از آنها در تجزيهي كيفي و يا كمي استفاده كرد. فاز ساکن، مايع و يا جامد و فاز متحرك، گاز و مايع ميباشد. عاملي كه بين تمام روشهاي كروماتوگرافي مشترك است، اختلاف در آهنگ حركت مؤلفههاي مخلوط در فاز متحرك است كه در اثر واكنش بين مؤلفههاي با فاز ساکن كه براي جداسازي اجزاء بکار ميرود، اتفاق ميافتد.
روشهاي كروماتوگرافي را ميتوان به دو طريق دستهبندی كرد؛ اولين طريق بر اساس ابزار فيزيكي بنا شده است كه به كمك آن فازهاي متحرك و ساكن با يكديگر تماس برقرار ميكنند. در كروماتوگرافي ستوني، فاز ساكن در يك ستون باريك قرار دارد كه از داخل آن فاز متحرك تحت تأثیر نيروي فشار عبور داده ميشود. در كروماتوگرافي مسطح، فاز ساكن بر روي يك صفحه مسطح و يا در لابهلای يك صفحه كاغذ قرار داده ميشود؛ در اينجا فاز متحرك از لابهلای فاز ساكن تحت اثر مويينهاي حركت ميكند.
يك دستهبندی اساسيتر روشهاي كروماتوگرافي بر پايه انواع فازهاي متحرك و ساكن و انواع تعادلهاي درگير در انتقال مواد حل شده بين فازها بنا شده است. سه گروه عمومي كروماتوگرافي مايع- LC، كروماتوگرافي گازي- GC و كروماتوگرافي سيال ابر بحراني- SFC. همانطور كه از نام آنها پيداست، فاز متحرك در سه گروه به ترتيب عبارتند از: مايعات، گازها و سيالات ابر بحراني. به بیان دیگر، اگر فاز متحرک گاز باشد، سیستم حاصل کروماتوگرافی گازی نامیده میشود و اگر فاز متحرک مایع باشد، نتیجه یک سیستم کروماتوگرافی مایع خواهد بود. اگر فاز متحرک سیال فوق بحرانی باشد، کروماتوگرافی سیال فوق بحرانی نامیده میشود که این سیال از نظر حلالیت شبیه مایعات است و از نظر نفوذپذیری شبیه گازهاست. کروماتوگرافی سیال فوق بحرانی یک نوع هیبرید از کروماتوگرافی گازی و مایع است که بعضی از بهترین جنبههای هردو را ترکیب میکند.
اگر بهطور خلاصه بخواهیم اشاره کنیم، در واقع کروماتوگرافی متکی بر حرکت نسبی دو فاز است. یکی از فازها بدون حرکت است و فاز ساکن نامیده میشود و دیگری را فاز متحرک مینامند. مخلوط نمونه بین دو فاز در بستر کروماتوگرافی (ستون یا صفحه) توزیع میشود.
در ادامه به بررسی کروماتوگرافی مایع با کارایی بالا میپردازیم.
كروماتوگرافي مايع با کارایی بالا
High Performance Liquid Chromatography technique
واژهی کروماتوگرافی مایع، دربرگیرندهی تکنیکهای جداسازی مختلفی همچون کروماتوگرافی مایع- جامد، مایع- مایع، تبادل یونی و بهدام اندازی بر اساس ابعاد ذرات میباشد که در تمامی آنها فاز متحرک مایع میباشد. در نوع کلاسیک کروماتوگرافی مایع، یک ستون شیشهای با قطر بالا محتوی فاز ساکن وجود دارد که فاز متحرک با توجه به نیروی جاذبه از بین آن عبور میکند. این فرآیند نسبتاً آهسته بوده و آزمایشهای مکرر با آن خستهکننده میباشد. از حدود سال ۱۹۶۹ میلادی، این روش با ساخت دستگاه کروماتوگرافی مایع با کارایی بالا- HPLC توسعه یافت.
کروماتوگرافی مایع با کارایی بالا روشی است توسعه یافته با مبنای کروماتوگرافی مایع که قطر ذرات داخل ستونهای آن بسیار کوچک شده و جداسازی را بهتر انجام میدهند و همچنین در درون این سیستمها، پمپهایی وجود دارند که سرعت تعادلی مناسب ایجاد مینمایند. بهطور کلی، استفاده از انواع آشکارسازهای اسپکتروفتومتری، فلوئوریمتری، الکتروشیمیایی، ضریب شکست و غیره و همچنین پیشرفتهایی که در ساخت ستون، پمپ و سایر تجهیزات HPLC پدید آمد، کارایی، سرعت جداسازی و دامنه کاربردهای این روش را بهطور قابل ملاحظهای افزایش داد.
در حال حاضر در میان روشهای مختلف جداسازی تجزیهای، کروماتوگرافی مایع با کارایی بالا از بیشترین رشد برخوردار میباشد. چنین رشد گستردهای را میتوان به توانایی این روش در جداسازی طیف وسیعی از مواد با نقطه جوش بالا و موادی که در اثر حرارت تجزیه میشوند، اندازهگیریهای کمّی و صحیح، حساسیت، توانایی در جداسازی سریع مخلوطهای پیچیده و کاربرد گسترده آن در زمینه موادی که از نظر صنعتی اهمیت دارند، نسبت داد. از میان موادی که بهوسیله این روش مورد تجزیه قرار گرفتهاند میتوان به اسیدهای آمینه، پروتئینها، اسیدهای نوکلئیک، هیدروکربنها، کربوهیدراتها، داروها، استروئیدها، آنتیبیوتیکها و … اشاره نمود.
تجهیزات کروماتوگرافی مایع با کارایی بالا
بهطور خلاصه و ساده میتوان گفت:
جریانی از یک حلال به نام فاز متحرک، از درون یک ستونِ پر شده به نام فاز ساکن عبور میکند و نمونه آزمایش از قسمت تزریق وارد ستون شده و اجزاء نمونه بر اساس ماهیت شیمیایی با فاصله زمانی متفاوتی از ستون شسته میشوند، سپس بهوسیله آشکارساز شناسایی شده و نتایج بهصورت پیکهایی به ثبت میرسد.
دستگاه HPLC، میتواند مجموعهای از مدولها یا اجزای سازنده جداگانه باشد، این در حالیست که میتواند بهصورت یک دستگاه تک نیز طراحی شود. مفهوم مدول در مورد خرابی یک جزء سازندهی تک، انعطافپذیر است، بهعلاوه لزومی ندارد که قطعههای تک همه از یک سازندهی دستگاه باشند. در صورتی که تمایل نداشته باشید خود تعمیرات جزئی را انجام دهید بهتر است یک دستگاه جمعوجور یکپارچه خریداری کنید. بههرحال این دستگاه فضایی کمتر از یک مجموعه مدولی را اشغال نخواهد کرد.
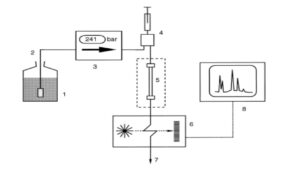
دستگاه HPLC شامل حداقل اجزای سازندهای است که در شکل ۱ نشان داده شدهاند:
شکل ۱. نمودار شمایی یک واحد HPLC
۱= مخزن حلال، ۲= خط انتقال با چینی متخلخل، ۳= پمپ (با فشارسنج)، ۴= تزریق نمونه،
۵= ستون (با دماپا)، ۶= آشکارساز، ۷= فاضلاب، ۸= کسب دادهها
مخزن حلال، خط انتقال با چینی متخلخل، پمپ با فشار زیاد، وسیله تزریق نمونه، ستون، آشکارساز و ثبات دادهها معمولاً همراه با ارزیابی دادهها. گرچه ستون مهمترین قسمت است، ولی معمولاً کوچکترین قطعه است. برای جداسازیهای همدما، ستون معمولاً در یک دماپا محبوس شده است. کاملاً متداول است بیش از یک حلال بکار بریم، بنابراین به یک مخلوطکن و کنترلکننده نیاز است. در صورتی که کسب دادهها با یک کامپیوتر انجام شود، آنرا میتوان برای کنترل کل سیستم نیز بکار گرفت.
هر قسمتی از سیستم که در تماس با فاز متحرک است باید از موادی ساخته شود که بهوسیله حلالهای مورد استفاده آسیب نبیند. قسمتهایی که در تماس با حلال هستند معمولاً از فولاد ضدزنــــــــــگ یا پلی تترافلوئورواتیلن یا مواد دیگر مانند یاقوت کبود یا سرامیک ساخته شدهاند، همچنین قسمتهایی نظیر خروجی پمپ تا انتهای ستون که معمولاً در معرض ایجاد فشار قوی قرار میگیرند باید آنقدر محکم باشند که تحمل فشار را داشته باشند. نکته مهم دیگر در طراحی دستگاههای HPLC این است که بین تزریق جسم و آشکار کردن آن باید حجم مرده به کمترین حد خود برسد. منظور از حجم مرده فضاهای خالی یا اشغال نشده میباشد. وجود حجم مرده زیاد سبب از دست دادن شدید کارایی سیستم میگردد. واضح است که ستون نیز در جاهایی که توسط فاز ساکن پر نشده دارای مقدار کمی حجم مرده است.
- مخازن فاز متحرك و سيستمهاي مورد عمل قرار دادن حلال
يك دستگاه جديد HPLC به يك و يا تعداد بيشتري مخزن شيشهاي و يا فولاد زنگنزن مجهز است كه حاوي ۵۰۰ میلیلیتر و يا بيشتر از حلال است. مخازن اغلب به وسايلي براي حذف گازهاي حل شده (معمولاً اكسيژن و نيتروژن) مجهزند. این گازها با تشكيل حبابها سبب پهن شدن نوار پيكها ميشوند و علاوه بر اين، اغلب با عملكرد آشكارساز تداخل ميكنند. گاززداها ممكن است به يك سيستم پمپ خلأ، يك سيستم تقطير، وسايلي براي گرم كردن و هم زدن حلال و همچنین به سيستمهايي براي وارد كردن و پاشيدن حبابهاي يك گاز بياثر براي خارج كردن گازهاي حل شده از محلول، مجهز باشند.
همچنين اغلب اوقات سيستم وسيلهاي براي صاف كردن گردوغبار ذرات از حلال دارد تا از آسيب ديدن پمپ يا وسيلهي تزريق يا گرفتگي ستون بهوسیلهي اين ذرات جلوگيري شود. لزومي ندارد كه گاززداها و صافيها، جزء لاينفك دستگاه HPLC باشند. مثلاً، يك راه مناسب، آمادهسازی حلالها قبل از هدايت آنها به مخزن، صاف كردن حلال از داخل يك صافي ريزمنفذ در خلأ است. اين آمادهسازی، گازها و همچنين مواد معلق را حذف ميكند.
- سیستمهای پمپکننده
وظیفه اصلی پمپ در HPLC این است که فاز متحرک را با فشار بالا و با سرعت عبور کنترل شده، از ستون عبور دهد. یک نوع پمپ (پمپ با فشار ثابت)، این عمل را با وارد آوردن فشار ثابت به فاز متحرک انجام میدهد و سرعت عبور از ستون با توجه به مقاومت ستون در برابر عبور جریان و مقاومتهای دیگر موجود بین پمپ و آشکارساز تعیین میشود. نوع دیگر (پمپ با جریان ثابت)، این کار را با عبور جریان در حد خواسته شده انجام میدهد و در اینجا میزان فشار با توجه به مقاومت در برابر عبور تنظیم میگردد.
ممکن است مقاومت در برابر عبور در یک سیستم، با زمان تغییر کند. این کار با ورم کردن یا نشت انباشتههای ستون، تغییر درجه حرارت و یا تجمع ذرات خارجی موجود در نمونه، در پمپ و یا در واحد تزریق امکانپذیر است. اگر پمپی با فشار ثابت مورد استفاده قرار گیرد، به هنگام تغییر مقاومت در برابر عبور، سرعت عبور نیز تغییر خواهد کرد؛ اما در پمپ با جریان ثابت، تغییر مقاومت در برابر عبور، توسط تغییر فشار جبران میشود. تغییر در سرعت عبور سبب از دست دادن دقت و ایجاد خطوط پایه در دستگاه ثبات میشود.
علاوه بر اینکه پمپ باید قادر باشد تا فاز متحرک را در فشار بالا و با سرعت عبور یکنواخت از ستون عبور دهد، باید دارای خصوصیات زیر نیز باشد:
- قسمتهای داخلی پمپ که در تماس با حلالها هستند نباید بهوسیله حلالهای مورد استفاده آسیبدیده و فاسد شوند.
- پمپ باید قادر باشد تا گسترهای از سرعت عبور را فراهم آورد و ایجاد تغییر در سرعت عبور باید آسان باشد.
- عبور حلال باید بدون ضربان باشد.
- حجم درونی پمپ کم باشد تا تغییر فاز متحرک از یک نوع به نوع دیگر بهآسانی امکانپذیر شود.
- پمپ باید بهگونهای باشد که تعمیر و جدا کردن آن از سیستم بهآسانی میسر باشد.
لازم به ذکر است که فشار بالا به خودی خود چیزی نیست که در HPLC به دنبال آن هستیم. واقعیت این است که فاز متحرک، یک مایع است که برای عبور آن از درون یک بستر پرشده متراکم به فشار بالایی نیاز است. ذرات کوچک مسیرهای نفوذ کوتاهی دارند و بنابراین تعداد زیادی از بشقابکهای نظری در واحد طول در اختیار میگذارند. در تئوری بشقابکهای فرضی یا نظری (Plates) فرض میشود که هر ستون از یک سری لایههای باریک، افقی و کاملاً مجزا از هم که بهطور متوالی قرار گرفتهاند، تشکیل شده است.
به هر یک از این لایهها، بشقابک گفته میشود. در هرکدام از این بشقابکها، آنالیت یا مادهی مورد تجزیه در تعادلی بین فاز متحرک و ساکن قرار دارد و در نهایت با انتقال بین بشقابکها عمل جداسازی صورت میپذیرد. کارایی هر ستون به تعداد بشقابکهای موجود در ستون و یا به عبارت دیگر، به تعداد تعادلهای ایجاد شده در ستون بستگی دارد؛ بنابراین برای بررسی کارایی ستون، تعداد بشقابکهای فرضی (N) را از رابطه زیر محاسبه میکنند. در این رابطه H نشاندهنده ارتفاع هر بشقابک و L طول ستون را به نمایش میگذارد.
- پمپهای با فشار ثابت
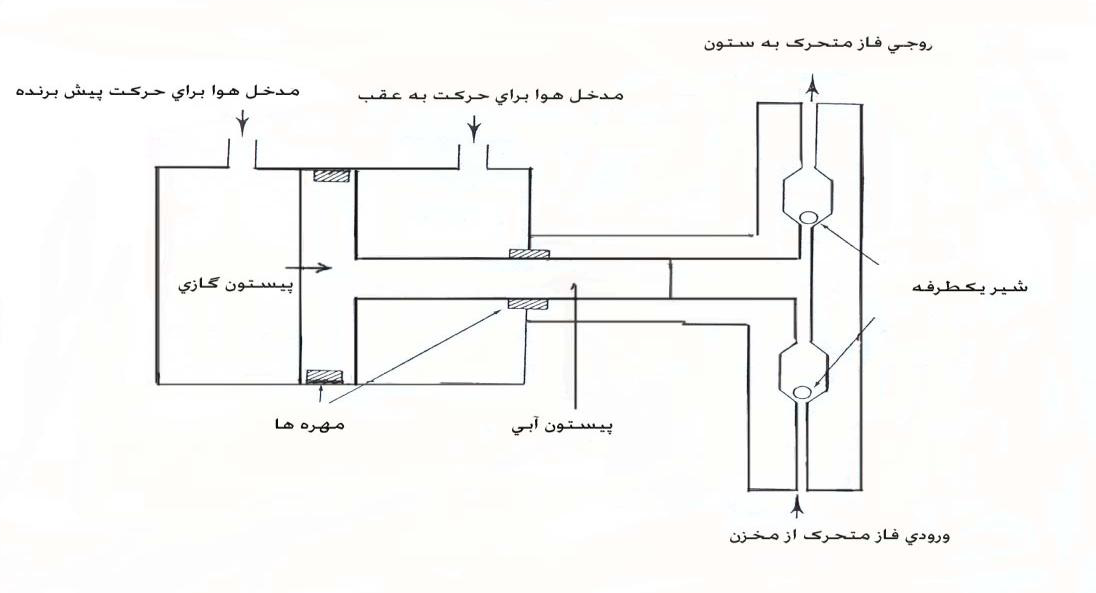
در اولین نوع پمپهای با فشار ثابت در HPLC (پمپهای حلقوی)، گاز متراکم درون سیلندر با فشار زیاد فاز متحرک موجود در مسیر اتصال (بین مخزن حلال و ورودی ستون) را به درون ستون میراند. این نوع پمپ در انواع قدیمی HPLC استفاده میشد و هماکنون تنها از جنبه تاریخی جالب است. پمپهای بادی از جمله پمپهای با فشار ثابت میباشند. اصول عملکرد پمپهای بادی تشدیدکننده در شکل ۲ زیر نشان داده شده است.
شکل ۲. پمپ بادی تشدیدکننده
- پمپهای با جریان ثابت
در HPLC دو نوع پمپ با جریان ثابت مورد استفاده قرار میگیرد.
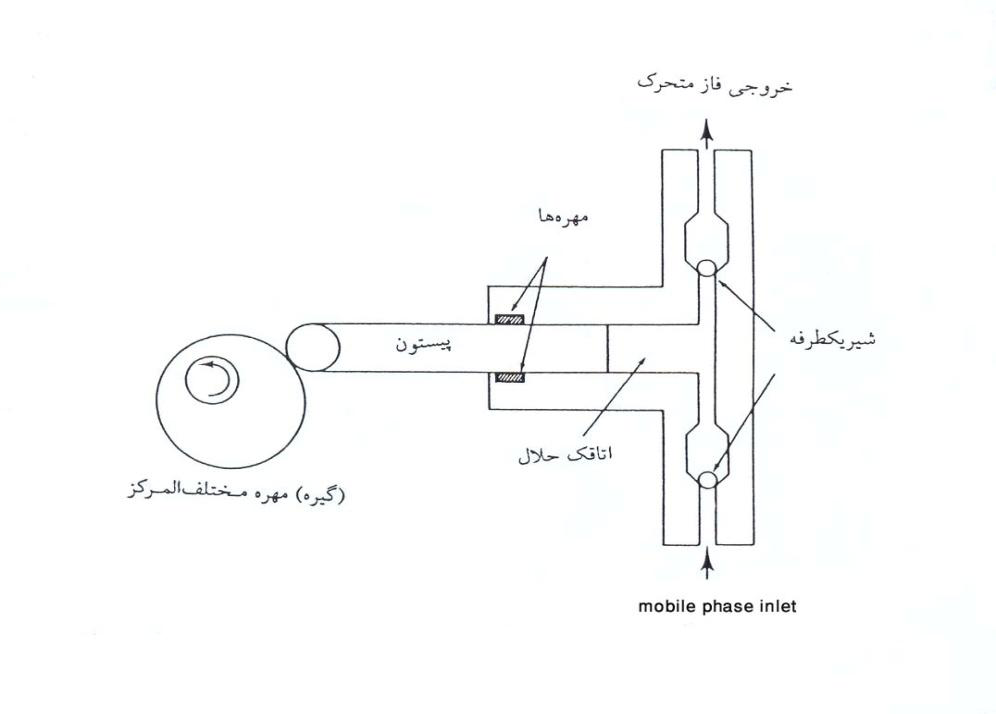
در پمپ سرنگی (شکل ۳)، فاز متحرک توسط یک اتاقک از یک موتور جدا میشود. این موتور با سرعت متفاوت پیچی را گردانده که آن نیز سبب گردش پیستون میشود. جریان در اینجا بدون نبض- Pulse است و میتواند با تغییر سرعت موتور تغییر پیدا کند. اتاقک در حدود ۲۰۰ تا ۵۰۰ سانتیمتر مکعب حجم دارد و ظرفیت فاز متحرک محدود به ظرفیت اتاقک است. اگرچه میزان حجم اتاقک زیاد است و قبل از پر کردن مجدد آن، تعداد زیادی نوار جذبی کروماتوگرافی میتوان بدست آورد، اما زمانی که تغییر حلال لازم است برای خارج کردن آن از اتاقک، میزان زیادی حلال از بین میرود.
شکل ۳. پمپ سرنگی
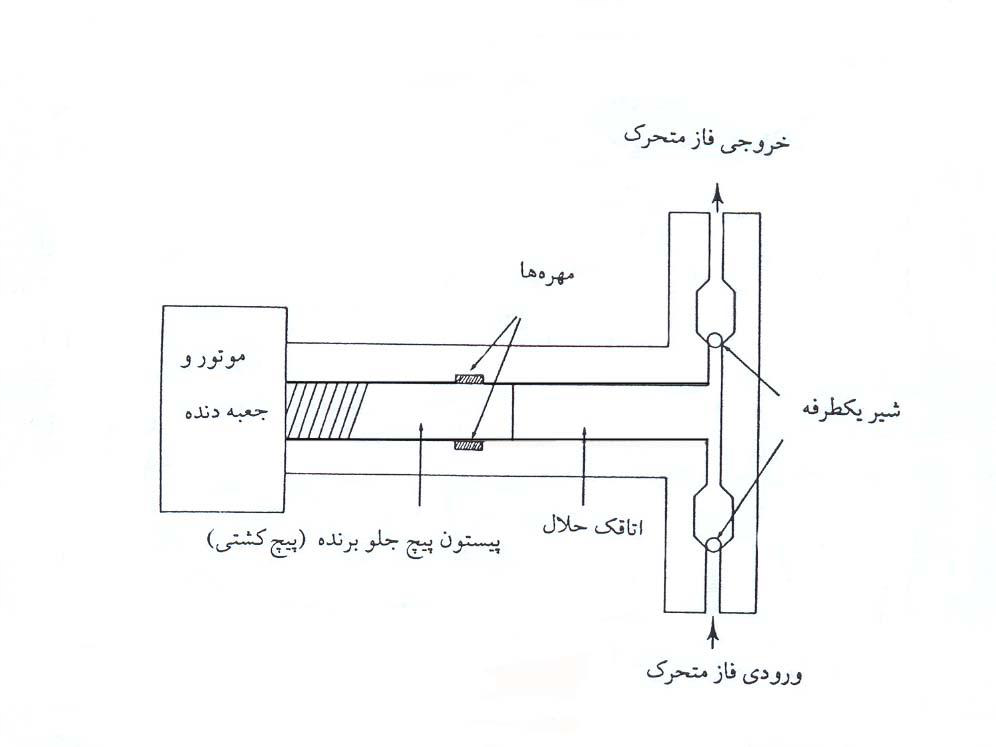
نوع دیگر پمپ که در دستگاهها مورد استفاده قرار میگیرد، پمپ متناوب میباشد که در شکل ۴ نشان داده شده است.
با استفاده از دنده یا گیرهی مختلفالمرکز، پیستون به درون اتاقک حلال رفته و برمیگردد. در حرکت پیشبرنده، شیر یکطرفهی ورودی بسته شده و شیر یکطرفه خروجی باز میباشد لذا فاز متحرک به درون ستون میرود. در حرکت به عقب، شیر یکطرفه خروجی بسته و شیر یکطرفهی ورودی باز میشود تا اتاقک پر از حلال گردد. پمپهای متناوب برخلاف پمپهای سرنگی دارای ظرفیت نامحدود میباشند و حجم داخلی آنها میتواند خیلی کوچک باشد. سرعت جریان میتواند با تغییر طول پیستون و یا سرعت موتور تغییر کند و دسترسی به شیرها و مهرهها در این پمپها ساده میباشد.
در پمپهای متناوب یکدهانهای (همانند شکل ۴) در ازای یک نیمدایره پمپ، فاز متحرک به درون ستون پمپاژ میشود و در ازای نیمدایره دیگر، اتاقک حلال پر میشود؛ بنابراین سرعت جریان همواره ثابت نیست؛ اما با استفاده از پمپهای متناوب دودهانه که دو دهانه با اختلاف فازِ برابر با ۱۸۰ درجه کار میکنند، زمانی که یک دهانه، حلال را به درون ستون میبرد، دهانه دیگر در حال پر کردن اتاقک حلال خود میباشد، در نتیجه عملکرد دودهانهای که ۱۸۰ درجه اختلاف فاز دارند سبب جریان بدون نبض میشود.
شکل ۴. پمپ متناوب
- پمپهای پیستونی
این پمپها معمولاً از یک محفظه کوچک تشکیل شدهاند که در آن حلال با حرکت رفت و برگشت یک پیستون توسط موتور پمپ میشود. دو شیر یکطرفه که بهطور متناوب باز بسته میشوند، جریان حلال به داخل و به خارج از سیلندر را کنترل میکنند. حلال در تماس مستقیم با پیستون است یا اینکه ممکن است فشار از طریق یک دیافراگم انعطافپذیر که خود نیز توسط یک پیستون رفت و برگشتی به طریق هیدرولیکی پمپ میشود، به حلال منتقل شود. از مزیتهای پمپهای پیستونی میتوان به حجم داخلی کوچک، فشارهای خروجی زیاد (تا 10000 psi) و سرعت جریانهای ثابت اشاره کرد.
بهطور کلی نيازمنديهاي مهم براي يك سيستم پمپكنندهي HPLC عبارتند از:
- تولید فشارهای تا 6000 psi
- خروجي بدون نبض یا ضربان- pulse
- سرعت جریان در گسترهی 0/1 تا 10 (ml/min)
- اجزاي سازندهي مقاوم در مقابل خوردگي
- سیستم تزریق نمونه
متداولترین روش وارد کردن نمونه در کروماتوگرافی مایع که بهطور گستردهای مورد استفاده قرار میگیرد، توسط حلقههای نمونهبردار- loop/valve injector است. این وسایل اغلب از قسمتهای اصلی دستگاههای HPLCاند و قابلیت تعویضپذیری دارند که انتخاب اندازههای نمونه از ۵ تا ۵۰۰ میکرولیتر را فراهم میآورند. این وسیله بهمنظور نگهداری و سپس ورود مقدار مشخصی از نمونه به درون فاز متحرک طراحی شده است. نمونه معمولاً توسط سرنگ و بهصورت دستی و یا بهصورت اتوماتیک از درون ویالها به درون حلقه این وسیله وارد میشود. زمانی که لازم است تا تزریق صورت پذیرد، یک سوئیچ چرخشی حرکت میکند و جریان از درون حلقه حاوی نمونه عبور میکند.
- ستون و پیشستون
ستونها قلب کروماتوگرافی هستند و موفقیت یا عدم موفقیت یک آنالیز بستگی به انتخاب ستون دارد. جنس ستونها معمولاً از فولاد ضدزنگ میباشد که با ماده پرکننده ستون پر شده است. این ماده پرکننده دو نوع میباشد:
- مواد غیرآلی سرامیکی مانند سیلیکا و آلومینا که دارای استحکام بالایی میباشند و در هر حلالی حل نمیشوند.
- پلیمرهای آلی که دو نوعِ پلی استایرن دیوینیل بنزن و همچنین متاکریلیتها میباشند که نسبت به مواد غیرآلی استحکام کمتری دارند و زودتر فشرده میشوند، ضمن اینکه حلالها با نفوذ در ماتریس پلیمری آنها باعث حل شدن (خوردگی) ذرات میشوند که نتیجتاً باعث پایین آمدن کارایی ستون با کاهش سرعت انتقال آنها میشود.
طول اکثر ستونهای کروماتوگرافی مایع ۱۰ تا ۳۰ سانتیمتر است. معمولاً ستونها مستقیماند و هر زمان که به طولهای بیشتری احتیاج باشد، با متصل کردن دو یا چند ستون به یکدیگر، این کار انجام میشود. قطر داخلی ستونهای مایع اغلب ۴ تا ۱۰ میلیمتر است. متداولترین اندازه ذرات پرکنندهها ۵ و ۱۰ میکرومتر است. بطورکلی میتوان گفت که نام ستونها بنا بر کارخانه سازنده، مختلف میباشد وگرنه همگی دارای خواص کاربردی تقریباً یکسانی هستند. در زیر چند گروه از ستونها نام برده شده است:
- ستونهایی که زنجیرههایی با ۸ کربن دارند (C8)
- ستونهایی که زنجیرههایی با ۱۸ کربن دارند (C18)
- ستونهای سیلیکائی (SI)
- ستونهای با گروه آمینی (NH2-)
- ستونهایی با گروه سیانو (CN-)
- ستونهایی با گروه فنیلی (PHENYL)
- ستونهایی با گروه دیالی (OH-)
اغلب، یک ستون کوتاه محافظ (پیشستون) قبل از ستون تجزیهای به کار میرود. این کار عمر ستون تجزیهای را افزایش میدهد.
- دماپای ستون
براي بسياري از كاربردها، كنترل دقيق دماي ستون لازم نيست و ستون را ميتوان در دماي محيط بكاربرد. با وجود اين، اغلب اوقات، با ثابت نگهداشتن دماي ستون تا چند دهم درجه سانتيگراد، كروماتوگرافي بهتري بدست ميآيد. اكثر دستگاههاي تجاري جديد امروزه به گرمكنندههاي ستوني مجهزند كه دماي ستون را تا چند دهم درجه از نزديك دماي محيط تا ۱۰۰ الی ۱۵۰ درجه سانتیگراد كنترل ميكنند.
- آشکارسازها
عامل وجودی آشکارساز در HPLC، آشکار کردن فاز متحرکی است که از ستون بیرون میآید؛ بنابراین، آشکارساز باید تغییر در ترکیب فاز متحرک را به طریقی نظارت و پایش و به یک علامت الکتریکی تبدیل کند. خروجی آشکارساز این علائم الکتریکی است که با خصوصیات فاز متحرک یا جزء نمونه متناسب است، سپس این علامت به ثبات یا صفحه نمایش انتقال مییابد که در آنجا بهصورت انحرافی از خط مبنا نشان داده میشود. یک آشکارساز ایدهال باید مشخصات زیر را داشته باشد:
- حساسیت کافی
- پایداری خوب و تکرارپذیری
- زمان عکسالعمل کوتاه که مستقل از سرعت جریان است
- قابلیت اعتماد بالا و سهولت کار
- حجم مرده- Dead Volume پایین
- حد تشخیص پایین (یعنی قادر باشد مقادیر کوچک نمونه را نظارت کند)
- ارزان قیمت و دستکاری آن ساده باشد
بهندرت میتوان آشکارسازی یافت که تمام موارد فوق را دارا باشد و میتوان گفت که خصلتها یا ویژگیهای مختلف یک آشکارساز بر یکدیگر تأثیر میگذارند.
انواع آشکارسازها در HPLC به قرار زیرند:
- آشکارسازهای جاذب ماوراء بنفش-UV
- آشکارسازهای ضریب شکست
- آشکارسازهای فلوئورسانی
- آشکارسازهای الکتروشیمیایی
- آشکارسازهای پراکندگی نور
- آشکارسازهای رسانندگی
- آشکارسازهای زیرقرمز (IR)
- آشکارسازهای پرتوزایی
در این میان، آشکارسازهای جذب UV، عمومیترین آشکارساز HPLC بشمار میروند؛ زیرا میتوانند نسبتاً حساس باشند، گسترهی خطی وسیعی دارند و تا حد زیادی تحت تأثیر افتوخیزهای دما قرار نمیگیرند. اصول کارکرد این آشکارسازها بر این مبنا است که فاز متحرک از ستون به درون محفظهای کوچک جاری میشود، محفظه در مقابل اشعه فرابنفش/ مرئی منتشرشده از دستگاه نورسنج یا طیفسنج قرار میگیرد. این آشکارسازها انتخابگر بوده و فقط میتوانند اجزاء نمونهای که نور فرابنفش یا مرئي را جذب میکنند، آشکار سازند؛ یعنی در صورتی که ملکول دارای حداقل یکی از موارد زیر باشد، جذب در طولموج بالای ۲۰۰ نانومتر صورت میگیرد.
- برم، ید یا گوگرد
- یک گروه کربونیل C=O یا گروه نیترو NO2
- دو پیوند دوگانه مزدوج X=X-X=X
- یک حلقه آروماتیک
- یونهای معدنی شامل: –Br–،I–، NO3–، NO2
بهطور کلی آشکارسازهای جذب UV فقط در برخی مواد همچون آلکانها، ترکیبات آروماتیک و ترکیبات دارای پیوند چندگانه که در داخل فاز متحرک جاذب نور ماوراء بنفش میباشند، انتخابی عمل میکنند.
آشکارسازهای ضریب شکست این مزیت مهم را دارند که نسبت به تمام مواد حل شده جواب میدهند. علاوه براین، این آشکارسازها اعتماد پذیرند و سرعت جریان بر آنها اثری ندارد. ضمن اینکه این آشکارسازها خیلی حساس به حرارت هستند.
امتیاز ذاتی آشکارسازهای فلوئورسانی حساسیت بالای آنهاست که نوعاً ده مرتبه یا بیشتر، بزرگتر از آشکارسازهای جاذب ماوراء بنفش است. بااینحال این آشکارسازها نسبت به دیگر آشکارسازها کم مورد استفاده قرار میگیرند چون موادی که خاصیت فلورسانس داشته باشند، زیاد نیستند.
- پردازشگر سیگنال
پردازشگرها شامل یک سیستم کامپیوتری میباشند که سیگنالهای حاصل از آشکارساز را به شکلی که برای کاربر قابل استفاده باشد، تبدیل میکنند که حاصل این تبدیل بهصورت کروماتوگرام نمایش داده میشود که متشکل از یک یا چند پیک میباشد که مساحت زیر پیک و ارتفاع پیک متناسب با غلظت آنالیت است. از این مسئله (مساحت زیر پیک و ارتفاع پیک) برای آنالیز کمی و از شکل و زمان پیک نیز برای آنالیز کیفی استفاده میشود.
انواع روشهای کروماتوگرافی HPLC
چهار نوع مکانیزم یا فرآیند برای بازداری مولکولهای نمونه توسط فاز ساکن وجود دارد. این چهار فرآیند باعث ایجاد چهار روش اساسی در کروماتوگرافی مایع میشود:
- کروماتوگرافی تقسیمی
Partition chromatography
- کروماتوگرافی جذبی
Absorption chromatography
- کروماتوگرافی غربال ملکولی (ژلی)
Size exclusion chromatography
- کروماتوگرافی تبادل یونی
Ion exchange chromatography
كروماتوگرافي تقسيمي در بين چهار روش فوق، بيشتر از همه بكار برده شده است. این روش شامل فاز ساکن میشود که نوع ترکیب آن، از فاز مایع در حال حرکت متفاوت است. مولکولهای نمونه مورد آزمایش در این روش بین فازهای ساکن و متحرک توزیع میگردند. ضمن اینکه فاز ساکن و متحرک نباید قابل امتزاج در یکدیگر باشند.
در کروماتوگرافی غربال ملکولی، جداسازي مبتني بر اَلَك كردن مولكولي بر روي اجسام بیبار در جريان مهاجرت الكترواسمزي از داخل ژلها انجام ميشود، بدين ترتيب كه جداسازي بر مبناي اندازههاي نسبي مولكولها انجام شده و از اصطلاح صاف كردن بهوسيله ژل استفاده ميشود. ژل استفاده شده در اين روش بايد بیاثر و پايدار باشد. فاز ساكن از يك قالب متخلخل تشكيل شده كه منفذهاي آن بهوسيله حلالي كه فاز متحرك را تشكيل داده پر شده است. از آنجايي كه اساس جداسازي بر اين مبناست كه مولکولهای بزرگتر از حد وارد سوراخها نشده و به ترتيب جرم مولكولي از ستون خارج شوند و مولكولهاي کوچکتر برحسب شدت نفوذشان سوراخها را پر كنند، پس اندازه سوراخ بسيار مهم است. از ديگر عوامل مهم حجم نمونه است، بدين ترتيب كه هر چه حجم نمونه كمتر باشد، غلظت هر جزء در محلول خارجشده نيز كمتر خواهد بود.
جهت جدا نمودن موادي كه داراي بار الكتريكي میباشند میتوان از کروماتوگرافی تبادل یونی استفاده نمود. در اين حالت، ستون كروماتوگرافي داراي ذراتي با بار مثبت و منفي ميباشد كه عناصر باردار، نمونه مورد نظر را جذب مينمايند، لذا نمونههایي كه خارج ميگردد، فاقد هرگونه ذرات باردار خواهد بود. ستون ميتواند داراي يون مثبت يا منفي و يا هر دوي آنها باشد.
برخی از منابع
- بهزاد حسینیپور، «بهینهسازی شرایط بهمنظور جداسازی، تشخیص و اندازهگیری مشتق برمدار گاما بوتیرولاکتون در محیط سنتز بهوسیله تکنیک کروماتوگرافی مایع با کارایی بالای فاز معکوس (HPLC) با دتکتور فرابنفش (UV)»، پایاننامه کارشناسی ارشد شیمی تجزیه، دانشگاه بینالمللی امام خمینی
- محمد کریمی، «شناسایی همزمان بنزودیازپینها در بعضی نوشیدنیهای غیرالکلی با روش کروماتوگرافی مایع با کارکرد عالی»، پایاننامه کارشناسی ارشد در رشته سمشناسی دانشگاه تربیت مدرس
- زهرهسادات حسینیفرد، «آنالیز سفوروکسیم سدیم در نمونههای دارویی با استفاده از جاذبهای نوین و کروماتوگرافی مایع با کارایی بالا»، پایاننامه کارشناسی ارشد شیمی تجزیه، دانشگاه آزاد واحد تهران مرکزی
- محسن کرمی، «میکرواستخراج پخشی داروی کلوزاپین و اندازهگیری آن توسط HPLC در ماتریکس دارویی»، پایاننامه کارشناسی ارشد شیمی کاربردی دانشگاه آزاد واحد تهران مرکزی
- عليرضا ابراهيمي و همکاران، استفاده از روش كاپيلاري الكتروفورز جهت غربالگري اختلالات هموگلوبيني شايع در ايران، مجله دانشكده پزشكي، دانشگاه علوم پزشكي تهران، خرداد ١٣٩٥، دوره ٧٤، شماره ٣، صفحههاي ١٤٧ تا ١٥٨
- کتاب اصول فیزیکی دستگاههای آزمایشگاهی، دکتر داریوش شهبازی گهرویی
- Greene DN, Vaughn CP, Crews BO, Agarwal AM. Advances in detection of hemoglobinopathies. Clin Chim Acta 2015;439:50-7.
- Winichagoon P, Svasti S, Munkongdee T, Chaiya W, Boonmongkol P, Chantrakul N, et al. Rapid diagnosis of thalassemias and other hemoglobinopathies by capillary electrophoresis system. Transl Res 2008;152(4):178-84
- Giambona A, Passarello C, Renda D, Maggio A. The significance of the hemoglobin A(2) value in screening for hemoglobinopathies. Clin Biochem 2009;42(18):1786-96.
- Greene DN, Pyle AL, Chang JS, Hoke C, Lorey T. Comparison of Sebia Capillarys Flex capillary electrophoresis with the BioRad Variant II high pressure liquid chromatography in the evaluation of hemoglobinopathies. Clin Chim Acta 2012;413(15-16):1232-8.
كروماتوگرافي مايع با كارآيي بالاي دناتوره
آشنایی با کروماتوگرافی با کارایی بالا HPLC و کاربردهای آن
https://www.britannica.com/science/chromatography
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام