آپتامر، فرآیندهای تولید و کاربردهای آن
جمشید قلیزاده نواشنق
دانشجوی دکتری تخصصی ایمونولوژی
مقدمه
امروزه توسعه درمانهای هدفمند[1] و روشهای تشخیص اختصاصی بیماریهایی نظیر سرطان و عفونتها بطور چشمگیری در حال گسترش است. مولکولهایی نظیر آنتیبادی و پپتیدها بهعنوان انواعی از رویکردهای مورد استفاده در هدفگیری[2] میباشند. اگرچه درمانهای هدفمندی که با استفاده از آنتیبادیها صورت میگیرد بسیار اختصاصی هستند، اما ایمنوژنیسیتی و هزینههای بالای تولید، کاربرد بالینی آنها را محدود کرده است. برای غلبه بر این مشکل درمانهای هدفمند بر پایه آپتامرها اخیراً توسعه یافتهاند.
آپتامرها مولکولهای پپتیدی یا اولیگونوکلئوتیدی هستند که به مولکول هدف خاصی متصل میشوند. آپتامر از دو کلمه لاتین آپتوس[3] (به معنای متناسب[4]) و مروس[5] (به معنای بخش[6]) مشتق شده است. مولکولهای آپتامر بهطور معمول از یک مجموعه بزرگ توالیهای سنتتیک صناعی گزینش میشوند اما در ریبوسوئیچها[7] بهطور طبیعی یافت میشوند. ایدهی وجود اسیدهای نوکلئیک با قابلیت اتصال به پروتئینها در دهه 1980 بوجود آمد که در تحقیقات صورت گرفته بر روی آدنوویروسها و HIV مشاهده شد که این ویروسها RNAهای کوچکی کد میکنند که توانایی بالایی در اتصال اختصاصی و با افینیتی بالا به پروتئینهای ویروسی و سلولی دارد.
بطور کلی آپتامرها به دو دسته تقسیمبندی میگردند:
آپتامرهای پپتیدی
آپتامرهای اولیگونوکلئوتیدی
آپتامرهای پپتیدی، پروتئینهایی هستند که برای ایجاد تداخل با برهمکنشهای پروتئینی در داخل سلول طراحی میشوند. این مولکولها حاوی یک لوپ پپتیدی متغیر متشکل از 20-10 آمینواسید هستند که در دو انتها به یک پروتئین اسکافولد[8] (این پروتئین میتواند هر پروتئینی باشد که خواص محلولی دارد)، متصل شدهاند. آپتامرهای پپتیدی میتوانند از یک کتابخانه[9] پپتیدی که توسط یک فاژ ایجاد میشود، انتخاب گردد.
آپتامرهای نوکلئیک اسیدی، برای اتصال به مولکولهای هدف گوناگونی نظیر مولکولهای کوچک، پروتئینها، اسیدهای نوکلئیک و حتی سلولها، بافتها و ارگانیسمها بکار گرفته میشوند. آپتامرها در کاربردهای درمانی و بیوتکنولوژی بهعنوان رقیب آنتیبادیها محسوب میشوند. در جدول زیر برخی از مزایا و معایب آنتیبادی و آپتامر مقایسه شدهاند. در سال 1970 با پیشرفت تکنولوژیهای آنتیسنس، چگونگی اتصال نوکلئیک اسید نیز آشکار گردید. مطالعات بیشتر بر روی آدنوویروسها و HIV درک بیشتر نسبت به اتصال لیگاندهای نوکلئیک اسیدی کوتاه به پروتئینهای هدف را فراهم کرد. تکنیک گزینش نوکلئیک اسیدها در in vitro با اختصاصیت و افینیتی بالا برای مولکولهای هدف معین در سال 1990 معرفی گردید و این تکنیک پیشنهادی، SELEX[10] نام گرفت و نوکلئیک اسیدهای گزینش شده آپتامر نامیده شدند؛ بنابراین آپتامرها بهعنوان کلاس جدیدی از پروبهای مولکولی برای تشخیص، عکسبرداری و هدف قرار دادن مولکولها در سالهای اخیر بهطور چشمگیری موردتوجه هستند.
آپتامرها که از یک کتابخانه نوکلئیک اسیدهای تک رشته گزینش میشوند، حاوی یک ناحیه مرکزی متغیر بوده که توسط نواحی ثابت احاطه میشوند. آپتامرها با ایجاد تاخوردگیهای سهبعدی گوناگون میتوانند به انواع هدفهای مختلف با محدوده وزن مولکولی 100 الی 100000 کیلودالتون شامل یونهای فلزی، رنگهای آلی کوچک، آمینواسیدها و همچنین اهداف با وزن مولکولی بالا نظیر آنتیبادیها، پپتیدها، سلولها، ویروسها و باکتریها متصل شوند.
کاربرد آپتامرها در سیستمهای تحویل[11] داروها، RNAهای تداخلگر، رادیوایزوتوپها، واکسنها، سموم و … به سلولها و بافتها مورد مطالعه قرار گرفته است. تحویل اختصاصی این عوامل توسط آپتامرها دارای مزایایی نظیر کاهش مقدار ماده موردنظر برای تحویل، کاهش عوارض جانبی و هزینه پایین نسبت به سیستمهای تحویل رایج است.
فرآیند SELEX
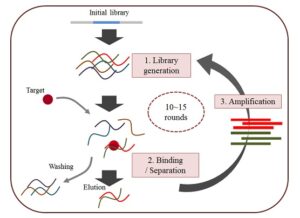
این فرآیند که در سال 1990 توسط گروه گلد و شوستاک معرفی شد، در واقع یک ابزار بسیار مناسب برای پیدا کردن مولکول نوکلئیک اسیدی افینیتی برای یک هدف مشخص از میان یک مجموعه تصادفی تحت شرایط خاص میباشد. این فرآیند شامل سه مرحله اصلی selection، partitioning و amplification است (تصویر 1).
الف) Selection: در مرحله selection فاکتورهای مهم عبارتند از:
1- خواص کتابخانه
کتابخانه آپتامری مجموعهای در حدود 1014 الی 1015 توالی تصادفی الیگونوکلئوتیدی میباشد که در آن هر توالی حاوی یک ناحیه مرکزی متغیر 70-30 جفت بازی میباشد که توسط دو ناحیه ثابت در انتهاهای ´5 و ´3 احاطه شده است. نواحی متغیر مرکزی آپتامرها متشکل از توالیهای منحصربهفردی بوده که اغلب در اتصال به مولکولهای هدف با ایجاد ساختارهای سهبعدی نقش دارند، درحالیکه نواحی ثابت مکمل پرایمرهایی است که برای تکثیر بهواسطه PCR مورد استفاده قرار میگیرد.
اگرچه در ابتدا عقیده بر این بود که نواحی مرکزی متغیر بلند باعث افزایش تنوع میشود، اما ناحیه متغیر بیش از 70 نوکلئوتید میتواند کارآیی آپتامر را کاهش دهد. یک ناحیه متغیر 25 نوکلئوتیدی از نظر تئوری 1015 ساختار متفاوت ایجاد میکند که تنوع کافی برای گزینش آپتامر فراهم میکند (1015=425).
یک میکرومولار کتابخانه حاوی 1015 ساختار آپتامری مختلف است. سنتز کتابخانهای با غلظت بالا معمولاً مشکل و گران است، ازاینرو مطالعات مختلف از غلظتهای نانومولار تا میکرومولار استفاده میکنند. طراحی مناسب پرایمر برای انجام PCR در طی سیکل SELEX ضروری است؛ به این دلیل پرایمرها میبایستی بهگونهای طراحی شوند تا از ایجاد ساختارهای ثانویه و همچنین تشکیل پرایمر-پرایمر جلوگیری شود. حضور توالی WSS (W=A/T، S=C/G، S=C/G) در انتهای ´3 پرایمر و وجود A/T داخلی فراوانتر از C/G میتواند از جفت شدن اشتباهی جلوگیری کند. علاوه بر این ثبات ساختار ثانویه آپتامرها میتواند با بکار بردن دمای annealing بین 70-65 درجه سانتیگراد بدست آید.
با افزایش کتابخانه آپتامر نسبت به مولکول هدف، آپتامرهای بیشتری برای اتصال با هر یک از مولکولهای هدف رقابت خواهند کرد. اگرچه افزایش کتابخانه آپتامر نسبت به مولکول هدف هم از طریق افزایش اندازه مجموعه آپتامر یا کاهش مقدار مولکولهای هدف انجام میشود، اما به علت رقابت میان اتصال توالیهای اختصاصی و غیراختصاصی، افزایش اندازه مجموعه آپتامری ارجح است.
2- ویژگیهای بافر اتصالی
بافر اتصال مناسب یکی از فاکتورهای کلیدی برای موفقیت رویه SELEX میباشد که با توجه به نوع مطالعه طراحی میشود؛ بطور معمول بافر اتصالی حاوی یک عامل بافری، نمک، پروتئین پوشاننده و DNA ماسکهکننده میباشد، بنابراین عوامل بافری از PH=7.2-7.4 نظیر Tris، HEPES یا PBS همراه با 200-50 میلیمولار NaCl یا KCl و 10-1 میلیمولار MgCl2 بطور معمول مورد استفاده است. این املاح میتوانند افینیتی اتصال آپتامر-هدف را با تثبیت کمپلکس نوکلئیک اسید بهبود بخشند. در اغلب موارد DPBS که بافر حاوی MgCl2 و CaCl2 میباشد مورد استفاده است.
پروتئینهای پوشاننده نظیر آلبومین سرم گاوی میتواند اتصال غیراختصاصی آپتامرها را بوسیله رسوب دادن جایگاههای اتصال خالی بر سطوح پلاستیکی کاهش دهد. DNA ماسکهکننده نظیر tRNA مخمر و DNA اسپرم ماهی سالمون بهعنوان رقابتکننده با آپتامر برای کاهش اتصال غیراختصاصی آپتامرهای گزینش شده استفاده میشود، علاوه بر این با استفاده از یک سری FBS با غلظت 20-10 درصد میزان موفقیت رویکرد cell-SELEX بهبود مییابد، زیرا استفاده از سریهای مختلف FBS میتواند بطور چشمگیری رشد سلولی و بیان مولکولهای سطحی را تحتتأثیر قرار دهد و میبایستی از آن اجتناب شود.
3- زمان و دمای انکوباسیون
همانطوری که قبلاً ذکر شد، زمان انکوباسیون کتابخانه با مولکول هدف میبایستی در روند فرآیند SELEX کاهش یابد. زمانهای انکوباسیون برای تسهیل تولید آپتامرها با اختصاصیت و افینیتی بالا میتواند از 60 دقیقه در دور اول به 15 دقیقه در دورهای بعدی کاهش یابد. بطور کلی دماهای انکوباسیون از 4 تا 37 درجه سانتیگراد استفاده میشود. از آنجایی که دمای انکوباسیون 4 درجه متابولیسم سلول را کاهش و مورفولوژی آن را تغییر میدهد به این دلیل ممکن است آپتامرهای غیراختصاصی در طی انکوباسیون گزینش شوند. اگرچه گزینش آپتامر در دماهای پایین نظیر 4 درجه سانتیگراد بسیار موفقیتآمیز است، اما آپتامرهای گزینش شده میبایستی در انتهای فرآیند در دمای 37 درجه نیز مورد بررسی قرار بگیرند.
ب) Partitioning: جداسازی آپتامرهای اتصالیافته به هدف از آپتامرهای اتصال نیافته
بعد از انکوباسیون کتابخانه با هدف موردنظر، آپتامرهای اتصالیافته میبایستی از آپتامرهای متصل نشده جدا شوند. در حال حاضر برای این منظور روشهای مورد استفاده در فرآیند SELEX شامل سانتریفوژ کردن، شستشوی سطح سلولی، الکتروفورز کاپیلاری، FluMag SELEX و MACS میباشد. این مرحله با توجه به نوع هدف متفاوت است. برای مثال در رویکرد cell-SELEX سلولهای معلق سانتریفوژ شده درحالیکه سلولهای چسبیده شستشو میشوند تا آپتامرهای متصل نشده جدا شوند.
توالیهای متصل نشده با شستشو جدا شده و توالیهای متصل شده با حرارت دادن و سپس با روشهای استخراج DNA بازیافت و تخلیص میشوند.
پ) Amplification: تکثیر آپتامرهای بهدستآمده
سیکلهای SELEX حداقل از 5 تا بیش از 20 دور تکرار میشوند تا اینکه توالیهای اختصاصی برای هدف تغلیظ گردند. روند SELEX توسط فلوسایتومتری مورد ارزیابی قرار میگیرد؛ بدین منظور توالیهای منتخب در هر دور که با استفاده از پرایمرهای فلورسنت تکثیر داده شدهاند با مولکولهای هدف انکوبه شده و در دور نهایی SELEX با توجه به متوسط شدت فلورسنت (MFI) تعیین میگردند. آپتامرهای سکانس شده در خانوادههای مختلف با استفاده از sequence alignment گروهبندی شده و برای افینیتی اتصال مورد ارزیابی قرار میگیرند. افینیتی اتصال آپتامر بر اساس ضریب جداسازی تعادل بیان میشود که معمولاً در طیف پیکومولار تا نانومولار قرار میگیرد.
تعیین ویژگی آپتامرها میتواند از طریق شناسایی موتیفهای حفظشده که در اتصال به هدف درگیر میشوند، انجام گردد.
تــــــــوالیهای بازیافت شده توسط PCR و با استفاده از پرایمرهای اختصاصی تکثیر میشوند. DNA دو رشتهای تولید شده سپس تخلیص شده و به DNA تکرشتهای تبدیل میشوند. در سیکلهای SELEX، گزینش منفی میبایستی از دور دوم تا انتها انجام شود تا توالیهایی که ممکن است هم به مولکول هدف و هم به مولکول کنترل متصل شود از دور خارج گردند؛ برای این منظور توالیهای گزینش شده در مراحل گزینش مثبت قبلی با مولکول کنترل انکوبه میشوند سپس مولکولهای متصل شده دور ریخته شده و توالیهای متصل نشده برای انکوبه کردن با هدف در دور بعد بازیافت میشوند.
تصویر 1: پروسه کلی SELEX
اگرچه گزینش آپتامرهای RNA مشابه روش مورد استفاده در آپتامرهای DNA است اما پروموتر RNA پلیمراز T7 در ابتدای کتابخانه RNA قرار میگیرد. در این روش آپتامرهای RNAیی که به هدف متصل میشوند به cDNA رونوشتبرداری معکوس میگردند. cDNA تکثیر یافته و توسط RNA پلیمراز T7 به RNA رونوشتبرداری میشوند. آپتامرهای RNA با مولکولهای هدف انکوبه شده تا آپتامرهای اختصاصی گزینش شوند. مراحل بعدی گزینش همانند گزینش آپتامر DNA میباشد.
انواع SELEX
1- Nitrocellulose filter binding SELEX
بسیاری از مطالعات اولیه SELEX بر روی روش اتصالی فیلترهای نیتروسلولوزی انجام میشده است. اساس این روش بر روی غشاء نیتروسلولوزی انجام میشود که در آن بعد از اضافه کردن آپتامرها به مجموعه پروتئینی بر روی غشا و انکوبه کردن و سپس شستشو، آپتامرهای اتصال نیافته از فیلتر عبور کرده تا از مجموعه کتابخانه حذف گردند. اگرچه این روش بسیار ساده و برای بسیاری از پروتئینها کارآمد است اما دارای محدودیتهای خاصی میباشد؛
1) کارآیی به دام انداختن پروتئینهای مختلف و در شرایط متفاوت توسط غشا متفاوت است.
2) مولکولهای هدف کوچکتر توسط فیلتر جذب نمیشوند.
3) به دورهای بیشتر گزینش نیاز است.
4) برخی از آپتامرها (نظیر آپتامرهای حاوی موتیفهای G) به غشاء متصل میشوند. مزیت اصلی این روش عدم نیاز به ابزار خاص و ساده بودن آن میباشد.
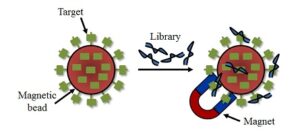
2- Bead-based SELEX
در این روش مولکولهای هدف بر روی یک سطح جامد نظیر بیدهای متصل به مگنت[12] ثابت میشوند (تصویر 2). مولکولهای هدف که ثابت شدهاند با کتابخانه آپتامر انکوبه میشوند و بعد از شستشو آپتامرهای اتصال نیافته جدا میشوند.
تصویر 2: پروسه SELEX با استفاده از بیدهای مگنتیک
مزیت اصلی این روش این است که برای بسیاری از مولکولها نظیر مولکولهای کوچک، پپتیدها و حتی سلول نیز مورد استفاده است. در این روش آپتامرها را میتوان بهسرعت حتی با تعداد دورهای پایین گزینش کرد.
3-Cell-SELEX
Cell-SELEX نوع اصلاحشده فرآیند SELEX است که در آن سلولهای زنده کامل بهعنوان هدف برای گزینش آپتامرها مورد استفاده قرار میگیرد. آپتامرهای گزینش شده در این فرآیند معمولاً در پزشکی مولکولی، کشف بیومارکرها، تشخیص و درمان سرطانها استفاده میشوند. به علت مشکلات موجود در تهیه فرمهای نوترکیب مولکولهای هدف در آزمایشهای SELEX، مطالعات اخیــــــر به سمت cell-SELEX سوق یافتهاند. در این فرآیند آپتامرهای با افینیتی و اختصاصیت بالا علیه پروتئینها و حتی اهداف غیرپروتئین در سطح سلول تولید میشوند.
در این رویکرد، آپتامرها علیه ساختارهای طبیعی در سطح بسیاری از سلولها ایجاد میشوند. در فرآیند cell-SELEX یک تک لایهای از اهداف سلولی در حدود 2 میلیون سلول با خلوص و زنده بودن بالای 95 درصد با مجموعه DNA دورشتهای انکوبه میشوند. بعد از شستشو سلولها جدا شده و برای جداسازی آپتامرهای چسبیده حرارت داده میشوند. در مرحله گزینش منفی، آپتامرهای جدا شده با تک لایه سلولهای کنتــرل انکوبه میشــــــوند. مراحل بعدی cell-SELEX همانند فرآیند SELEX میباشد.
بطور کلی موفقیت گزینش آپتامرها در فرآیند cell-SELEX به زنده بودن سلولها بستگی دارد. مرگ سلولی منجر به تغییر در شکل سلول و بیان پروتئین میشود، علاوه بر این سلولهای مرده میتوانند آپتامرها را بطور غیراختصاصی جذب کنند. زنده بودن سوسپانسیون سلولی مهمتر و ضروریتر از چسبندگی تک لایه سلولی میباشد زیرا بسیاری از سلولهای مرده در کشت سوسپانسیون سلولی چسبنده میتوانند با شستشو جدا شوند درحالیکه در سوسپانسیون سلولی زنده و مرده نمیتوانند جدا شوند. درصد خلوص سلولی بالای 95 درصد شرط دیگر برای موفقیت گزینش آپتامر است. استفاده از ردههای سلولی ایجادشده یکی دیگر از روشهای بسیار مناسب دستیابی به این هدف است. در غیر این صورت میتوان سلولها را با استفاده از تکنیکهای دیگر تخلیص نظیر MACS و FACS جداسازی کرد.
سایر روشهای SELEX عبارتند از:
Electrophoretic
Microfluidic
Microarray-based
Microscopic
In vivo
و …
بدست آوردن DNA تکرشتهای (ssDNA)
یکی از مراحل مهم در فرآیند SELEX بدست آوردن DNA تکرشتهای بعد از مرحله تکثیر با واسطه PCR است. این مرحله بهعنوان ورودی سیکل بعد محسوب میشود، ازاینرو اهمیت آن در این است که DNA تکرشتهای شده و تا حد امکان کوچک باشد. استفاده از پرایمرهای معکوس بیوتینیله به علت سهولت، یکی از پرکاربردترین روشهاست که در آن در مرحله تکثیر رشتههای مکمل با اتصال به رزین رشته دیگر توسط محلول قلیایی جدا میشود. روش دیگر استفاده از asymmetric PCR میباشد که در آن در مرحله تکثیر از پرایمر فوروارد بیشتری نسبت به پرایمر معکوس استفاده میشود که در نهایت منجر به تولید بیشتر رشته دلخواه میشود. روش دیگر استفاده از لامبدا اگزونوکلئاز است که در آن رشته موردنظر برای تجزیه شدن توسط گروههای فسفات نشاندار میشوند تا توسط این آنزیم تجزیه گردند. میزان کارایی و بازده این روشها بین 50 الی 70 درصد میباشد.
کاربردها
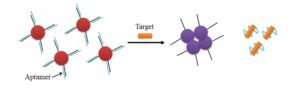
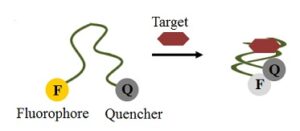
1- استفاده بهعنوان بیوسنسورها: بیوسنسورهایی که از آپتامرها بهعنوان ابزار تشخیصی استفاده میکند آپتاسنسور نامیده میشود. آپتاسنسورها میتوانند بیوسنسورهای الکتروشیمیایی و بیوسنسورهای نوری باشند. در آپتاسنسورهای نوری بیشتر از آپتامرهای متصل به ماده فلورسنت استفاده میشود. در این حالت به دو انتهای آپتامر ماده فلورسنت و خاموشکننده را وصل میکنند که در اغلب موارد این دو انتها به هم نزدیک بوده که ماده خاموشکننده مانع از ایجاد نور فلورسنت میشود.
تصویر 3: بیوسنسور با استفاده از آپتامر و نانوگلد
تصویر 4: بیوسنسور با استفاده از ماده فلورسنت
با اتصال مولکول هدف این دو انتها از هم جدا شده و حالت بازدارندگی نور فلورسنت از بین رفته و نور فلورسنت ایجاد میشود (تصویر 4). در برخی از سنسورها نیز حالت عکس این وجود دارد بطوریکه با اتصال ماده هدف به آپتامر، خاموشکننده به ماده فلورسنت نزدیک شده و نور ساطعشده را خاموش میکند. استفاده از نانوذرات نیز از روشهای رنگسنجی آپتاسنسورهای نوری میباشد که در آن آپتامر قبل از ورود ماده هدف به نانوذرات متصل شده و مانع از ایجاد تجمع ذرات و تولید رنگ میشود. با اضافه شدن ماده هدف، آپتامر به ماده هدف متصل شده و نانوذرات تجمع پیداکرده و تولید نور
میکنند (تصویر 3).
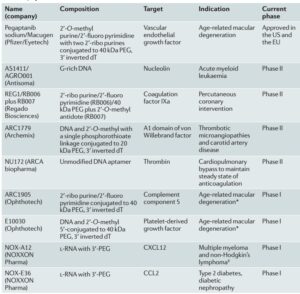
جدول 1: استفاده از آپتامرها در بالین
2- استفاده بهعنوان اهداف درمانی: با توجه با شناسایی مولکولها توسط آپتامرها، از این مولکولها برای فعال یا غیرفعال کردن پروتئینهای عامل انواع بیماریها و نیز تغییر بیان ژن مسئول و انتقال دارو به محل موردنظر استفاده میشود. از داروهای آپتامری میتوان به داروی Macugan (بهعنوان آپتامر ضد VEGF در درمان AMD)، REG1 (آپتامر اختصاصی ضد فاکتور 9 انعقادی) و… اشاره کرد. لیستی از آپتامرهای تولید شده جهت درمان بیماریها در جدول 1 آمده است. علاوه بر این همانند آنتیبادیها میتوان با اتصال دارو به آپتامر اختصاصی علیه پذیرنده سلولی بطور هدفمند دارو را به سلول موردنظر تحویل داد.
3- استفاده در Bio-imaging: در این روش به آپتامر بر ضد مولکول هدف ماده نشاندار متصل کرده و به داخل بدن انسان یا حیوان فرستاده میشود تا توسط دستگاههای تشخیصی ردیابی گردند.
4- استفاده در آزمایشگاه: در انواع روشهای کروماتوگرافی و لکهگذاری وسترن نیز از آپتامرها بهعنوان جایگزین آنتیبادیها استفاده میشود. حتی جایگزین تکنیک ELISA که با واسطه آنتیبادیها انجام میشود تکنیک ELANA است که در آن بجای آنتیبادی از آپتامر استفاده میشود.
منابع:
Ganji, A., Varasteh, A. and Sankian, M., Aptamers: new arrows to target dendritic cells. Journal of drug targeting 2015: 1-12.
Gopinath, S. C. B. Methods developed for SELEX. Analytical and bioanalytical chemistry 2007. 387: 171-182.
Keefe, A. D. Pai, S. and Ellington, A. Aptamers as therapeutics. Nature Reviews Drug Discovery 2010. 9: 537-550.
McKeague, M. and DeRosa, M. C. Challenges and opportunities for small molecule aptamer development. Journal of nucleic acids 2012. 2012.
Ozer, A. Pagano, J. M. and Lis, J. T. New technologies provide quantum changes in the scale, speed, and success of SELEX methods and aptamer characterization. Molecular Therapy—Nucleic Acids 2014. 3: e183.
Song, K.M. Lee, S. and Ban, C. Aptamers and their biological applications. Sensors 2012. 12: 612-631.
Sun, H. Zhu, X. Lu, P. Y. Rosato, R. R. Tan, W. and Zu, Y. Oligonucleotide aptamers: New tools for targeted cancer therapy. Molecular Therapy—Nucleic Acids 2014. 3: e182.
[1] targeting therapies
[2] targeting
[3] aptus
[4] fit
[5] merus
[6] part
[7] riboswitches
[8] scafold
[9] library
[10] systematic evolution of ligands by exponential enrichment
[11] Delivery system
[12] magnet
https://www.nature.com/articles/nrd3141
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام