آزمایش لکه خون با اسپکترومتری جرمی (MS)
و مزایا و معایب آن در پایش سطح درمانی دارو
دکتر شاهرخ مستور تهرانی
خلاصه
پایش سطح درمانی داروها (TDM) متکی بر روشها و تجهیزات آزمایشگاهی ویژهای میباشد که معمولاً در مراکز رفرانس وجود دارند و لذا برای همه بیماران در دسترس نمیباشند. با توجه به این موضوع، علاقه روزافزونی برای استفاده از لکه خون خشکشده Dried Blood Spot (DBS) که معمولاً از نوک انگشت تهیه میشود و تهیه آن ساده و مقرون بهصرفه میباشد، جهت انجام TDMمشاهده میشود. این تمایل بهویژه در کشورهای در حال توسعه بیشتر است. استفاده از DBSبرای برآورد غلظت مواد پلاسما به میزان هماتوکریت فرد بستگی دارد، لذا سنجش از طریق DBS به روشهای اعتباربخشی خاصی محتاج است که بیشتر آنها متأثر از میزان هماتوکریت هستند. در این مقاله استفاده از اسپکترومتری جرمی (MS) برای سنجش داروها در خون و نیز آزمایشهای اعتباربخشی برای روشهای DBS جدید در ده سال اخیر مورد بررسی قرار گرفته است.
1: مقدمه
سنجش سطح درمانی دارو TDM متکی بر سنجشهای آزمایشگاهی پیچیده میباشد. معمولاً این امکانات در آزمایشگاههای مرجع وجود دارند و برای عموم مردم قابل دسترس نیستند، لذا علاقه روزافزون برای استفاده از DBS در بسیاری از جاها بهویژه کشورهای درحال توسعه مشاهده میشود. نمونهگیری برای DBS معمولاً از نوک انگشت انجام میشود و تهیه آن آسان و مقرون بهصرفه میباشد. سایر مزایای DBS برای TDM که توسط Edelbroek و همکارانش (2009) (1) و Wilhem و همکارانش (2014) (2) بررسی شدهاند شامل، کمتر تهاجمی بودن تهیه نمونه، ثبات بالای آنالیت و امکان تهیه نمونه توسط خود بیمار میباشد. معذلک تهیه نمونه DBS خالی از اشکال نیست. تهیه نمونه توسط خود فرد میتواند موجب عفونت و آلودگی و کیفیت غیرقابل قبول نمونه گردد. استفاده بالینی از نتایج TDM برای DBS نیازمند اعتباربخشی گسترده است، چراکه خون مویرگی که با سوراخ کردن نوک انگشت به دست میآید مقادیر متغیری از خون وریدی را دارد و لذا غلظت مواد در آن یکنواخت نیست، علاوه بر این مقادیر هماتوکریت بر میزان مواد موجود در قطره خون خشکشده تأثیرگذار میباشد. از طرف دیگر حجم کم نمونه که به این طریق به دست میآید و معمولاً بین 5 تا 50 میکرولیتر میباشد نیازمند وجود آزمایشگاهی است که بتواند آن را مورد آزمایش قرار دهد. این نمونهها معمولاً با روشهای مبتنی بر اسپکترومتری جرمی مانند گاز کروماتوگرافی- اسپکترومتری جرمی (GC-MS) یا کروماتوگرافی مایع- اسپکترومتری جرمی
(LC-MS/MS) انجام میشود که حساسیت و ویژگی بالایی برای سنجشهای TDM با توجه به نمونه کم DBS دارند (3). حضور دستگاههای GC-MS و LC-MS/MS طی دهه گذشته در آزمایشگاهها انجام آزمایشهای DBS را بسیار بهبود بخشیدهاند.
هدف این مقاله مرور کاربرد روشهای اسپکترومتری جرمی برای پایش سطح درمانی دارو با استفاده از نمونه DBS و بحث در خصوص کاربرد بالینی این نوع نمونهبرداری است و مقالات مرتبط با توسعه روشهای خاص و اعتباربخشی آنها بهمنظور بکارگیری روشهای DBS معرفی خواهند شد. تمرکز ما بهویژه بر روی کاربردهای منتشرشده در ده سال اخیر میباشد.
2: استفاده از (DBS) برای برآورد غلظت مواد در پلاسما
برآورد غلظت داروها در پلاسما با استفاده از DBS متکی بر محدوده مرجعی است که براساس نمونه سرم یا پلاسما به دست آمده است. ازآنجاکه سنجش مواد در DBS درواقع بیانگر مقدار آنها در خون کامل است، لذا باید اطلاعات حاصله بهنوعی تغییر یابند که معرف ماده موردنظر در پلاسما باشند. مقدار هماتوکریت (Hct) نمونه به دو دلیل بر این روند تأثیرگذار است:
- ویسکوزیته خون بر روی مقدار نمونهای که بر روی یک ماتریس با اندازه ثابت پانچ میشود اثر دارد.
- نسبت گلبول قرمز به پلاسما در نمونه بر غلظت نسبی دارو در اجزاء خون تأثیر میگذارد.
بیشتر مقالاتی که کاربرد نمونه DBS را برای TDM بررسی کردهاند در جایی که صحت و دقت سنجش قابلقبول بوده نقش هماتوکریت را بررسی کرده و در مقادیر مختلف هماتوکریت تغییری در نتیجه ندادهاند. اما Vu و همکارانش (2010) (4) با استفاده از ماتریسهای مختلف سلولزی مقدار خون را در لکه بر مبنای هماتوکریت 20، 35 و 50 درصد در سنجش moxifloxacin برآورد نمودند. نهایتاً به این نتیجه رسیدند که مقدار داروی مذکور با هماتوکریت 50% به مقدار 40% بیشتر از مقدار آن در هماتوکریت 20% میباشد، اما اگر بر مبنای محاسبه ریاضی مقدار آن اصلاح شود این اختلاف به 15% میرسد.
علاوه بر نوسانی که بهواسطه مقدار خون موجود در لکه پدید میآید، نسبت دارو در جزء سلولی و پلاسمایی خون هم بر این نوسان تأثیر دارد و باید برای محاسبه غلظت پلاسمایی دارو ا ز روی لکه، این موضوع هم لحاظ گردد. نسبت بین غلظت داروی اندازهگیری شده در خون و پلاسما به جزء غیرمتصل به پروتئین در پلاسما (Fu)، نسبت غلظت آن در گلبول قرمز به پلاسما (2) و هماتوکریت بستگی دارد (5).
به گفته Rowland & Emmens (5)، در مورد داروهایی که نسبت غلظت خونی به پلاسمایی آنها نزدیک به 55% است و این به آن معنی است که تقریباً تمام مقدار دارو در پلاسما وجود دارد، تخمین غلظت پلاسمایی دارو از روی غلظت خون تام عمدتاً به Fu بستگی دارد. از طرفی در مورد داروهایی که غلظت آنها در گلبولها بیشتر است نوسان در P عامل تعیینکننده میباشد، اما در مورد داروهایی که نوسان کمی در Fu و P در شرایط بالینی دارند نگرانی کمی در خصوص استفاده از DBS بجای پلاسما وجود دارد.
برای تخمین غلظت پلاسمایی دارو از فرمول زیر میتوان استفاده کرد (5):
Cplasma = Cblood / [(1 – Hct) + Hct.Fu.P]
وقتی Fu ثابت باشد رویکرد دیگر برمبنای دانستن جزء دارو در پلاسما (Fp) میباشد که آن را میتوان در آزمایشگاه بدست آورد (6) و از فرمول زیر محاسبه کرد:
Fp = (Cblood / Cplasma). (1 – Hct)
وقتی Fp مشخص باشد، غلظت دارو را میتوان از این فرمول به دست آورد (8-6):
Cplasma = [Cblood / (1 – Hct)] . Fp
علاوه بر این ازآنجاییکه DBS معمولاً از خون نوک انگشت تهیه میشود و این خون ترکیبی از خون سیاهرگی و مایع بافتی میباشد، لذا مقدار دارو در آن میتواند از مقدار دارو در پلاسما متفاوت باشد؛ بهعنوان مثال Ashley و همکارانش (9) دریافتند که غلظت piperaquine در خون مویرگی 1/7 برابر غلظت آن در خون وریدی است. از آنجایی که این تفاوت به خصوصیات هر دارو برمیگردد، لذا ارزیابی مورد به مورد برای اعتباربخشی روش ضروری است.
بر مبنای آنچه گفته شد واضح است که داشتن هماتوکریت برای تبدیل مقدار دارو درDBS به مقدار پلاسمایی آن ضرورت دارد. سادهترین روش برای سنجش هماتوکریت توسط Capiau و همکارانش (2013) (10) پیشنهاد شد. در این روش با اندازهگیری پتاسیم لکه خون مقدار هماتوکریت را محاسبه میکنند. این محققین دریافتند که بین غلظت پتاسیم و هماتوکریت در محدوده 19 تا 63 درصد رابطه خطی وجود دارد و صحت و دقت آن قابلقبول میباشد. ضمناً پتاسیم در لکه خون تا 55 روز در دمای اتاق پایداری دارد.
حتی اگر فرض کنیم که رابطه پایداری بین غلظت دارو در DBS و پلاسما را میتوان در محیط آزمایش به دست آورد، ولی باید قبل از بکارگیری روش DBS برای یک داروی بهخصوص با استفاده از نمونه بیمار هم آن روش را اعتبارسنجی نمود.
3: تضمین کیفیت و اعتباربخشی سنجش DBS
برای اطمینان از اینکه در آزمایش TDM دادهها معنیدار میباشند، باید کنترل کیفی کافی به عمل آید. متغیرهای بسیاری در مراحل قبل از آزمایش، آزمایش و پس از آزمایش وجود دارند که میتوانند نتایج آزمایش DBS را تحت تأثیر قرار دهند و این عوامل باید به هنگام ایجاد و اعتباربخشی یک روش جدید DBS، همانگونه که در ذیل خواهد آمد، مدنظر قرار بگیرند.
1.3. انتخاب ماتریکس
انتخاب یک ماتریکس مناسب برای بهینه ساختن آزمایش DBS یک استراتژی مؤثر است. متداولترین ماتریکس مورد استفاده برای DBS، کاغذهای با پایه سلولز میباشند. تفاوت این کاغذها در ترکیب، ضخامت و مقاومت آنها به پخش شدن خون میباشد. این ویژگیها در نتایج استخراج، اثرات ماتریکس، ثبات آنالیت و … تأثیرگذار هستند (11).
بهطور کلی دو نوع کاغذ مناسب برایDBS در بازار وجود دارد؛ کاغذ ساده و کاغذ آغشته به مواد شیمیایی. کاغذ ساده بیشتر استفاده میشود، بهویژه واتمن 903 و Ablstrom 226 که سلولز خالص هستند و تأییدیه FDA دارند. مواد جدید که گفته میشود اندازه لکه و بازیافت آنالیت در آنها کمتر به میزان هماتوکریت وابسته است، تحت بررسی میباشند (2).
کاغذهای گروه دوم به مواد خاص شیمیایی آغشته شدهاند تا موجب لیز سلول، غیرفعال کردن پاتوژنها و دناتوره کردن آنزیمها و سایر پروتئینها گردند. در این گـــــــروه از Whatman FTA،FTA Elute ، FTA DMPK-A و FTA-DMPK-B میتوان بهعنوان پرمصرفترین نمونهها نام برد.
2.3. جمعآوری نمونه
نمونهگیری برای DBS باید تابع روش واحدی باشد تا اثرات خطاهای بالقوه قبل از آزمایش همچون همپوشانی لکهها را کاهش دهد. Peck و همکارانش (2009) حجم و شکل نمونه را در 422 مورد DBS که از 138 بیمار تهیه شده بود، بررسی کردند. یکسان نبودن حجم نمونه (از 2 تا 72 میکرولیتر)، قرار دادن چند قطره روی هم و مناسب نبودن شکل قطره از جمله اشکالاتی بود که در این بررسی مشاهده شدند و لذا ضرورت آموزش کسانی که نمونهگیری میکنند هویدا گردید (12).
آلودگی اشکال دیگری است که میتواند منجر به سنجش ناصحیح در نمونههای DBS گردد. موادی که برای بیحسی موضعی یا ضدعفونی کردن موضع قبل از نمونهگیری استفاده میشوند، میتوانند آلودهکننده نمونه باشند. در این رابطه انجمن بیوآنالیتیکال اروپا پیشنهاد مفهوم Good blood – Spotting Practices (GBSP) را ارائه نمود. (14،13).
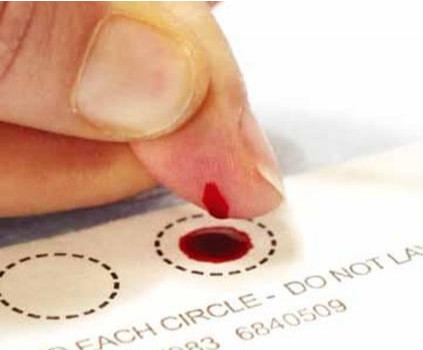
خلاصهای از روش تهیه نمونه برای DBS ذیلاً فهرست شده است (16،15،11):
- قبل از جمعآوری نمونه هیچ تماسی با سطح کاغذ نمونهبرداری به عمل نیاید.
- اگر دست نمونهدهنده سرد است با ماساژ میتوان جریان خون را در آن افزایش داد.
- محل نمونهگیری را با ایزوپروپیل الکل 70% پاک کنید.
- با استفاده از لانست استریل یکبار مصرف درست در مرکز انگشت میانی یا انگشت حلقه شکافی ایجاد کنید.
- قطره اول را با یک کاغذ استریل تمیز کنید چون مایع بافتی در آن زیاد است.
- بهدقت کاغذ را در زیر انگشت قرار داده و اجازه دهید که قطره بر اثر نیروی وزن خون در وسط کاغذ سقوط کند. تا 5 قطره (متوسط حجم هر قطره lµ50) را میتوان در هر کاغذ جمعآوری کرد. برای برقراری جریان بهتر خون از سمت مچ تا پایه انگشت بهآرامی فشار دهید، اما خود انگشت را فشار ندهید. انگشت فرد هرگز نباید با سطح کاغذ تماس داشته باشد. ضمناً قطرات خون را بر روی قطره قبلی نریزید چون باعث تغلیظ نمونه میشود.
- اجازه دهید کاغذ نمونه به مدت 4-3 ساعت در وضعیت افقی در تماس با هوا خشک شود.
- نگهداری و انتقال نمونه باید در ظرف پلاستیکی و به همراه مواد رطوبتگیر باشد. درجه حرارت ظرف بسته به نوع آنالیت متغیر خواهد بود.
قبل از انجام آزمایش باید کیفیت جمعآوری نمونه شامل بستهبندی، ظاهر و اندازه لکه بررسی شود (15).
3.3. تهیه کالیبراتورها و نمونههای کنترل کیفی
هماتوکریت نمونههای استاندارد و کنترل کیفی باید در حدود نمونههای موردسنجش باشند. روشهای مختلفی برای تهیه نمونههای کنترل کیفی با هماتوکریت مشخص از خون حاوی ضدانعقاد تشریح شدهاند. یک روش، جدا کردن پلاسما و گلبولها با سانتریفوژ و سپس انتقال حجم مناسب از هرکدام به همراه آنتیژن موردنظر جهت دست یافتن به هماتوکریت دلخواه میباشد (8-6،17).
راه دیگر این است که پس از سانتریفوژ جهت رسیدن به هماتوکریت دلخواه مقداری از پلاسما برداشته شده و یا اضافه میگردد (10،20-18).
راه دیگر شستن گلبولها با سرم فیزیولوژی و سپس مخلوط کردن آنها با حجم مناسبی از پلاسما میباشد (21،16،4). Koster و همکارانش (2015) اخیراً عملکرد روش اول و دوم را ارزیابی نمودهاند. در روش اول نمونه بهدستآمده دارای سوءگیری قابلتوجه در مقدار هماتوکریت میباشد که احتمالاً ناشی از حضور قسمتی از پلاسما در گلبولهای سانتریفوژ شده است، ولی در روش دوم خطایی در میزان هماتوکریت دیده نمیشود و لذا بر روش اول برتری دارد، اما بهعنوان جزئی از فرآیند تضمین کیفیت توصیه میشود که هماتوکریت نمونه پس از آمادهسازی با دستگاه هماتولوژی اندازهگیری شود (22).
4.3. چالشهای بالقوه ایجاد روش برای DBS
چالشهای متعددی در ایجاد روش برای استفاده بالینی از DBS وجود دارند (23). چالشهای موردنظر در اینجا صرفاً فهرستوار ارائه شده و برای بررسی عمیقتر باید به منابع ذکرشده مراجعه نمود (14).
- به کار گرفتن استاندارد داخلی
- پایداری نمونه
- روش رقیق کردن
- اثرات هماتوکریت بر اندازه لکه و یکنواختی آن و بازیافت آنالیت و کاستن اثرات سوء آن
5.3. روشهای اندازهگیری
مقدار کم نمونه خون (lµ5-50 ~) و پیچیدگی نمونه DBS چالشهای مهمی در اندازهگیری آنالیت ایجاد میکنند. روش اسپکترومتری جرمی (MS) با توجه به حساسیت بالایی که دارد در کنار جداسازی کروماتوگرافیک مهمترین روش اندازهگیری برای DBS محسوب میشود. آنالایزرهای مبتنی بر MS بهویژه GC-MS و LC-MS/MS قادر به سنجش داروها و متابولیتهای بسیاری در مقادیر بسیار پایین در خون میباشند (32،34،33،17،7). در حال حاضر triple qurdrupole mass spectrometer استاندارد طلایی در این حیطه محسوب شده و در بسیاری از مطالعات مربوط بهDBS به کار گرفته میشود (35).
تهیه نمونه DBS در بیشتر موارد کار سادهای میباشد؛ قطر مشخصی از کاغذ را پانچ کرده و محتوای آن با حلالهای آلی استخراج میشود و سپس محلول استخراجشده به داخل دســتگاه آنالایزر تزریق میگردد (8-6،34،38-36).
در سالهای اخیر نیاز به اتوماسیون سبب گردیده که تلاشهایی در این زمینه به عمل آید. بسیاری از آزمایشگاههای تخصصی از این موضوع استقبال میکنند چراکه استفاده از DBS را در سنجش TDM با سرعت بالا ممکن میسازد.
6.3. عوامل اعتباربخشی مورداستفاده در LC-MS/MS و GC-MS برای نمونههای DBS
استفاده وسیع از DBS و ورود آن به عرصه TDM حساسیتهایی را در زمینه الزامات اعتباربخشی روشهای DBS برانگیخته است. علاوه بر ویژگیهایی که برای اعتباربخشی همه آزمایشات باید مدنظر باشد، در خصوص DBS عواملی همچون ثبات حرارتی، اثر هماتوکریت بر روی حجم لکه و بازیافت استخراج، محل پانچ و توزیع دارو در پلاسما و گلبول نیز باید موردتوجه قرار گیرند.
توسعه و ایجاد راهبردهایی که قادر به تخمین غلظت معادل در سایر ماتریسهای سنجش باشد عنصری حیاتی در استفاده از DBS برای پایش سطح درمانی دارو میباشد، لذا قبل از اینکه یک روش DBS وارد حیطه بالینی شود باید بهطور همزمان با روش پلاسمایی مورد اعتبارسنجی قرار بگیرد (6).
خلاصهای از آزمایشهای ضروری برای اعتبارسنجی یک روش جدید DBS برای TDM در جدول یک آمده است.
4: کاربریهای گزارششده از نمونه DBS در TDM
کاربریهای متعددی از نمونه DBS به همراه روشهای اسپکترومتری جرمی در پایش سطح درمانی داروها گزارش شدهاند. در جدول 2 خلاصهای از این روشهای که بین سالهای 2005 تا 2015 گزارش شدهاند آمده است. با استفاده از کلیـــــــــــــــــــــدواژههای DBS، spectroscopy massو therapeutic drug monitoring در pubmed مقالات فوقالذکر فهرست شدهاند.
نمونهگیری با DBS در داروهای مختلفی گزارش شده است از جـمله: ACE inhibitors (51)، analgesic (76،48). آنتیبیوتیکها (4،74،63،60،25،21)، ضدصرعها (80،75،68،67،53،37،6)، ضدافسردگیها (81،39،17)، ضدکرمها (70)، ضدمالاریاها (65)، ضدقارچها (69،61)، ضد رتروویرالها (82،73،64،59،49،34،18)، دیورتیکها (52)، آنتاگونیستهای رسپتور H2 هیستامین (72)، ایمونوساپرسنتها (32،57-54،41،77)، شیمیداروها (62،36،8،7)، استاتینها (51)، بتابلوکرها (71،51،50) و آگونیستهای µ-opioid (33).
ماتریسهای مختلفی برای قرار دادن نمونه استفاده میشود که کاغذ واتمن 903 مهمترین آنها میباشد.
LC-MS/MS بیشترین مورد استفاده را در نمونههای DBS دارد (بیش از 80% موارد گزارششده) که عمدتاً به خاطر امکان تزریق نمونه به همراه مقادیر زیادی آب و نیز حساسیت بالای دستگاه و قابلیت بکارگیری حجم کم نمونه میباشد. در راهکارنماهای روشهای بیوآنالیتیک راجع به اعتبارسنجی کلاسیک دستگاه بهطور کامل توضیح داده شده است (83)، اما وجوه خاص مربوط به آنالیز DBS در بسیاری از این گزارشها مورد بحث واقع نشده است.
ارزیابی اثر هماتوکریت بر صحت و دقت نتایج در 56% گزارشها موردتوجه بوده است، علاوه بر این در خصوص تخمین دارو در پلاسما از روی DBS و استفاده از هماتوکریت بهعنوان ابزار اصلاحی در 21% مقالات مطالبی ذکر شده ولی در خصوص نسبت آنالیت در گلبولها و پلاسما تنها در چند مقاله اشارهای شده است.
در مورد پایداری نمونه درDBS ، بیشتر آنالیتها پایداری طولانی در دمای اتاق و یا بالاتر را نشان میدهند. برخی محققین اما پایداری کمتر و دمای پایینتر را ذکر کردهاند.
5: نتیجهگیری
علاقه به استفاده از DBS برای پایش سطح درمانی داروها بهطور فزایندهای در حال افزایش است. علیرغم مزایای بالقوه متعدد نظیر امکان نمونهگیری توسط خود فرد، موارد خاصی قبل از بکارگیری روش DBS در بالین باید بررسی گردند. مهمترین مسئله این است که به طریقی مقدار آنالیت موجود در DBS را به مقدار پلاسمایی آن تبدیل کنیم. اسپکترومتری جرمی بهویژه به همراه کروماتوگرافی مایع روش اصلی سنجش DBS برای TDM میباشد. این روش حساسیت لازم را با توجه به حجم کم نمونه و نیز ویژگی لازم را برای سنجش داروها دارا میباشد. در حال حاضر تعداد معدودی از روشهای منتشرشده سنجش دارو با استفاده از DBS شامل اعتبارسنجی بالینی وسیع میباشند و این مسئله مهمترین نقطهضعف بکارگیری این روش در TDM میباشد.
قبل از اینکه سنجش DBS برای پایش سطح درمانی دارو بهطور روتین مورد استفاده قرار بگیرد لازم است که اعتباربخشی بالینی برای آن لحاظ گردد.
ترجمه و تلخیص از :
Dried blood spots analysis with mass spectrometry: Potentials and
pitfalls in therapeutic drug monitoring
Marina Venzon Antunes, Mariele Feiffer Charão, Rafael Linden
Toxicological Analysis Laboratory, Instituto de Ciências da Saúde, Universidade Feevale, Novo Hamburgo, RS, Brazil
Clinical Biochemistry 49 (2016) 1035–1046
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام