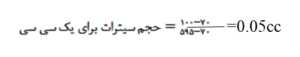کاهش 70 درصدی خطاهای آزمایشگاهی با دانستنیهای قبل از آنالیز قسمت سوم
دکتر حبیباله گل افشان، عضو هیئت علمی دانشگاه علوم پزشکی شیراز
قسمت سوم
کد گذاری رنگی لولههای آزمایش
سرپوش ارغوانی کمرنگ (Lavender stopper)
دربردارنده محلول K3EDTA یا افشان خشک شده (spray) K2EDTA به عنوان ضد انعقاد بوده و مناسب برای آزمایش CBC است. نمک K2EDTA برای CBC ضد انعقاد سفارش شده است. لوله آزمایش بایستی حداقل 8 بار برای یکنواخت شدن خون واژگون (inversion) شود. لوله حاوی EDTA به علت تداخل در عملکرد فاکتور 5 انعقادی و تداخل در عملکرد ترومبین روی فیبرینوژن در آزمایشهای انعقادی کاربردی ندارد.
پارامترهای آزمایش CBC تا 24 ساعت از نگهداری خون EDTA دار در یخچال 4 درجه قابل اطمینان است ولی برای جلوگیری از ایجاد مرفولوژیهای ناهنجار بایستی تا قبل از سه ساعت گستره محیطی را تهیه کرد. برای آزمایش CBC بین 1.5 تا mg 2 از EDTA به ازای هر سیسی خون به کار میرود.
لولههای آزمایش با درپوشهای مختلف رنگی
سرپوش صورتی (Pink)
دربردارنده K2EDTA و با نشان گذاریهای مخصوص (special label) برای نوشتن اطلاعات بیمار بر مبناي استانداردهای بانک خون است. از نمونه EDTA برای گروهبندی از روی گلبول و پلاسما (بجای سرم) و کومبز مستقیم و شناسایی آنتیبادیها استفاده ميشود.
سرپوش سفید
دربردارنده افشان (spray) خشک شده K2EDTA به عنوان ضد انعقاد همراه با ژل جدا کننده پلاسماست که به طور اولیه در مطالعات مولکولی کاربرد دارد. از پلاسمای جدا شده میتوان برای سنجش مارکرهای سکته قلبی و سطح آمونیاک نیز بهره گرفت.
سرپوش آبی روشن (Light blue)
حاوی سیترات سدیم 3.2 درصد برای جدا سازی پلاسما جهت آزمایشهای انعقادی مانند PT و PTT است. نسبت حجم خون به سیترات 9:1 میباشد؛ برای مثال 0.2 سیترات و 1.8 سیسی خون و یا 0.5 سيسی سیترات و 4.5 سیسی خون مخلوط میشود. رعایت این نسبت اساسی است.
چنانچه هماتوکریت بیماری بیشتر از% 55 باشد بایستی سیترات کمتری به خون اضافه کرد و این بدلیل کاهش حجم پلاسما در افراد پرخون است که در غیر اینصورت افزایش کاذب آزمایشهای PT و PTT را بدنبال دارد. برای محاسبه حجم سیترات برای هماتوکریت بالای %55 از رابطه زیر استفاده میشود.
برای مثال: اگر هماتوکریت بیماری %70 باشد جهت تهیه 2 سیسی خون برای آزمایشهای PT و PTT چه حجم از سیترات سديم لازم است؟
سيسي 0/1 = 2× 0/05 = حجم سيترات براي دو سيسي
بدین مفهوم که 0.1 سیسی سیترات بجای 0.2 سیسی در لوله ریخته و با خون به 2 سیسی رسانیده میشود.
سرپوش آبی تيره
حاوی ترومبین و بازدارنده تریپسین(Soybean Trpysin) جهت سنجش برخی از اجزای پپتیدی فیبرین و فیبرینوژن (FDP) ميباشد.
سرپوش سیاه
حاوی سیترات سدیم 3.2تا 3.8 درصد جهت آزمایش سرعت رسوب (ESR) به روش وسترگرن است. در این حالت نسبت حجم خون به سیترات سدیم 4 به یک است؛ برای مثال به 0.4 سیترات سدیم 1.6 سیسی خون اضافه میشود.
سرپوش سبز
حاوی هپارین به صورت لیتیوم یا سدیم هپارین میباشد. خون هپارینه به ویژه لیتیوم هپارین برای آزمایشهای شیمی روی خون کامل یا روی پلاسما بكار ميرود. الکترولیتهای سدیم یا لیتیوم را نمیتوان در چنین نمونههایی ارزیابی کرد. از خون هپارینه برای آزمایش شکنندگی اسمزی نیز استفاده ميشود، ولی برای CBC مورد استفاده قرار نميگيرد. هپارین در رنگ آمیزی رایت ایجاد زمینه آبی میکند.
سبز روشن / سبز / سیاه
لوله با این کد رنگی حاوی هپارین و ژل جدا کننده پلاسماست و مناسبترین لوله جهت اندازهگیری دقیق پتاسیم است و این به علت آن است که از رها شدن پتاسیم توسط پلاکتها جلوگیری كرده و ژل مانع تماس پلاسما و گلبولهای قرمز میگردد.
خاکستری (Gray)
تمام لولههای با سرپوش خاکستری حاوی ضد گلیکولیز مانند فلوراید سدیم هستند که تا 3 روز قند خون را حفظ میکند. فلوراید سدیم ضد انعقاد نیست و از این رو برای تهیه پلاسما به لوله آزمايش اگزالات پتاسیم یا Na2EDTA اضافه شده است. از لولههای فلورایددار نبایستی برای آزمایش غیر از گلوکز استفاده شود چون فلوراید سدیم در اندازهگیری ALP ,AST ,ALT ,CK دخالت دارد. برای اندازهگیری سطح الکل نیز از لوله خاکستری استفاده میشود چون از رشد میکروبهایی که ممکن است الکل تولید کنند جلوگیری میکند.
آبی رویال (Royal blue)
این لوله برای آزمایشهای سم شناسی و فلزات نادر، مناسب بوده و در تهیه آن موادی که باعث افزایش کاذب آنالیت شود به كار نرفته است. این لولهها حاوی ضد انعقادهایی مانند K2EDTA و یا سدیم هپارین و ژل جدا کننده با توجه به نیازهای آزمایشگاه است.
خرمایی (Tan Hemogard)
مناسب برای اندازهگیری سرب بوده و گواهی شده که دارای سرب کمتر از(ppm) 0.01 mcg/cc است. لوله حاوی K2EDTA است.
زرد (yellow)
لوله با سرپوش زرد برای دو هدف در دسترس است؛ یک نوع دارای اسید سیترات دکستروز (ACD) و قابل استفاده در بانک خون برای مطالعات سلولی، فنوتایپ HLA و تست DNA و آزمایش تعیین پدر در پزشکی قانونی (Paternity) است.
لوله استریل با سرپوش زرد حاوی ضد انعقاد (Sodium polyanethol sulfonate) بوده و جهت تهیه نمونه برای کشت میکروبی است. ماده SPS نه تنها کلسیم را از حالت یونیزه خارج میكند بلکه دارای خواص ضد فاگوسیتوز، ضد کمپلمان و خنثیگر برخی آنتیبیوتیکها نیز میباشد.
زرد / خاکستری و نارنجی (yellow/ gray stopper/ orange closure)
حاوی ترومبین جهت فعال سازی انعقاد و تولید لخته در 5 دقیقه است. از این لوله برای آزمایشهای اورژانس شیمی و بیمارانی که داروهای ضد لختگی مصرف میکنند یا خون آنها به علت کمبود فاکتور دیر لخته میشود قابل استفاده است.
قرمز / خاکستری و طلاییRed/ gray stopper and gold closure
حاوی فعال کننده سيستم انعقاد خون و ژل پلیمری برای تهیه سرم جهت آزمایشهای شیمی است. سیلیکا موجب لخته شدن سریعتر خون میگردد. این لولهها به اختصار SST ناميده میشوند. قبل از سانتریفوژ بايستي 30 دقيقه صبركرد تا خون لخته شود. لولههاي پلاستيكي با سرپوش قرمز و سيليكا به عنوان فعال كننده تشكيل لخته براي آزمايشهاي شيمي و سرولوژي به كار ميروند. نوع شیشهای با درپوش قرمز بدون افزودنی بوده و 60 دقیقه جهت ایجاد لخته و تهیه سرم لازم دارد.
اثرات ضد انعقادها و افزودنیها روی آزمایشها
| ضد انعقاد / افزودنی | نام آزمایش | اثر | |
| EDTA | فسفاتاز قلیایی | بازدارنده | |
| کراتین کینا ز | بازدارنده | ||
| لوسین آمینوپپتیداز | بازدارنده | ||
| آهن و کلسیم | کاهش | ||
| PT و PTT | افرایش زمان | ||
| سدیم و پتاسیم | افزایش | ||
| آزمایش تجمع پلاکتی | بازدارنده | ||
| اگزالات | فسفاتاز اسیدی و قلیایی | بازدارنده | |
| آمیلاز | بازدارنده | ||
| آنزیم LDH | بازدارنده | ||
| کلسیم | کاهش | ||
| سدیم و پتاسیم | افزایش | ||
| مرفولوژی سلولی | ناهنجاری | ||
| سیترات | ALT و AST | بازدارنده | |
| فسفاتاز قلیایی | بازدارنده | ||
| فسفاتاز اسیدی | محرک | ||
| آمیلاز | کاهش | ||
| کلسیم | کاهش | ||
| سدیم و پتاسیم | افزایش | ||
| فاکتورهای ناپایدار انعقاد | پایداری | ||
| هپارین | T3 و T4 | افزایش | |
| PT و PTT | طولانی | ||
| رنگ رایت | ایجاد زمینه آبی | ||
| لیتیم | افزایش با لیتیم هپارین (Li Hep) | ||
| سدیم | افزایش با سدیم هپارین(Na Hep) | ||
| فلوراید | فسفاتاز اسیدی و قلیایی | کاهش | |
| آمیلاز | کاهش | ||
| کراتین کیناز | کاهش | ||
| ALT و AST | کاهش | ||
| مرفولوژی سلولی | ناهنجاری | ||
توجه داشته باشید که آلوده شدن سوزن در هنگام اضافه کردن نمونههای خون ممکن است موجب انتقال ضد انعقاد یا افزودنی از لولهای به لوله دیگر شود. این پدیده به ویژه با سیستم نمونهگیری با لولههای خلأدار با شیوع بیشتری رخ میدهد و از اینرو ترتیب نمونهگیری اهمیت زیاد دارد.
ترتیب نمونهگیری به سفارش(Clinical Laboratory standard institute)
ترتیب نمونهگیری برای سیستمهای خلأدار و نیز وقتی که نمونهگیری با یک سرنگ در لولههای مختلف انجام میگیرد به شرح زیر است:
- نمونه استریل (لوله با سرپوش زرد یا اضافه کردن خون به بطری کشت)
- نمونه برای آزمایشهای انعقادی در لوله با سرپوش آبی کمرنگ حاوی سیترات سدیم
- لولههای سرم با سرپوش قرمز و یا طلایی، شیشهای یا پلاستیکی ژلدار (SST)
- لولههای هپاریندار با سرپوش سبز رنگ
- لولههای حاوی EDTA برای CBC
- لولههای با سرپوش خاکستری حاوی فلوراید
- لوله با سرپوش زرد/ خاکستری یا نارنجی با فعال کننده انعقادی ترومبین.
لولههای ژلدار
از لولههای ژلدار برای جدا سازی سرم استفاده میشود. ژل از مواد تیکسوتروب (Thixotropic) است که در ته لوله قرار میگیرد و در هنگام سانتریفوژ، ضربه خون به ژل وارد میشود و از اینرو شدت همولیز کمتر است. تغییراتی در چگالی ژل در هنگام سانتریفوژ ایجاد گردیده و موجب ميشود كه ژل بین سرم و گلبول قرار گیرد. ژلها دارای فعال کنندههای لخته مانند سیلیکا و یا ترومبین هم بوده و از اینرو انعقاد را سرعت میبخشند. زمان لخته شدن خون در لوله ژلدار حدود 30 دقیقه و چنانچه فعال کننده لخته آن ترومبین باشد 5 دقیقه است. در حالی که خون در لولههای ساده حدود یک ساعت برای لخته شدن زمان لازم دارد.
راحتی استفاده، کوتاه شدن زمان لخته، تولید سرم بیشتر، نیاز به یک بار سانتریفوژ، حمل نمونه بدون به هم ریزی سطح جدایی سرم از گلبول محاسن این گونه لولهها است.
لولههای مخصوص با سرپوش قرمز/ خاکستری و طلایی دارای فعال کننده و ژل جدا کننده است که به آنها لولههای SSTS گویند که به مفهوم Serum separator tubes است.
از سرم جدا شده از لولههای ژلدار برای آزمایشهای شیمی استفاده میشود ولی در بانک خون برای تستهای ایمونولوژی سفارش نمیشود. به علت اینكه ژلها ممکن است داروها را بخود جدب کنند از اینرو از لولههای ژلدار برای پیگیری سطح داروها استفاده نمیشود. ژلهاي سیلیکون و پلی استر از ژلهای جذب کننده هستند در حالی که ژلهای بر پایه آکریل (acrylic) ممکن است مشکل جذب را نداشته باشند.
نمونه هموليز
مشكل در پيدا كردن رگ، استفاده از سر سوزن بسيار باريك، كشيدن محكم خون بداخل سرنگ، وارد كردن سوزن قبل از خشك شدن الكل و تكان شديد به خون همگي با هموليز همراه هستند. آنزيم LDH و پتاسيم به طور چشمگير تحت اثر هموليز قرار ميگيرند. هموليز شديد با افزايش meq/L2-3 پتاسيم آنرا در طيف بحراني قرار ميدهد. گفتني است كه غلظت يا فعاليت برخي از مواد در گلبول قرمز چندين برابر سرم است و با هموليز شدن خون اين مواد به خون راه مييابند و يا برخي آناليتها رقيق ميشوند.
براي مثال:
- فعاليت LDH در گلبول قرمز 16 برابر سرم است.
- فعاليت AST در گلبول قرمز 4 برابر سرم است.
- غلظت پتاسيم گلبول قرمز 23 برابر سرم است.
- فعاليت ALT گلبول قرمز 6.7 برابر سرم است.
- غلظت گلوكز و فسفات در گلبول قرمز بترتيب 0.82 و 0.78 سرم است.
- غلظت سديم گلبول 0.11 غلظت سرم است.
- غلظت كلسيم گلبول0.1 غلظت سرم است.
با توجه به موارد فوق، هموليز موجب افزايش آن دسته از موادي ميشود كه فعاليت آنها در گلبول قرمز بيشتر است در بقيه موارد كه غلظت آناليت در گلبول قرمز كمتراست با توجه به رقتي كه هموليز ايجاد ميكند نتايج متغيري در پي دارد.
نكته مهم: با رها شدن پتاسيم از پلاكت در ضمن لخته شدن خون، پتاسيم سرم بالا ميرود و اين اختلاف زماني بسيار چشمگير است كه بيمار داراي افزايش فوقالعاده پلاكت باشد. از اين رو تهيه نمونه خون در ليتيوم هپارين مقدار صحيحي از پتاسيم را بدست ميدهد.
در بيماران مبتلا به لوسمي چنانچه سلولهاي لوسمي ترد و شكننده باشند باعث افزايش كاذب پتاسيم ميشود ولي چنانچه سلولهاي لوسمي از نظر متابوليكي فعال باشند با ورود پتاسيم و گلوكز به داخل سلول ممكن است موجب كاهش كاذب پتاسيم (هيپوكالمي) گردد.
نكته مهم: در بسياري از سنجشهاي مبتني بر اليزا، سنجش آناليت با آنتيباديهاي كانژوگه يا نشاندار شده با آنزيم پروكسيداز صورت ميگيرد، گرچه افزايش بيليروبين و چربي در نمونه ميتواند تداخل در رنگ سنجي ايجاد كند ولي مراحل شستشو، تداخل آنها را كم ميكند. در نمونه هموليز به علت اينكه خون هموليز شده گروه هيم (Heme) را رها كرده و گروه هيم خود داراي خاصيت پروكسيداز است از اينرو باعث افزايش كاذب آناليتها در روشهاي اليزا كه مبتني بر توليد رنگ توسط آنزيم پروكسيداز است ميشود.
در ساير روشهاي اليزا كه از آنزيم فسفاتاز قليايي يا بتاگلوكورنيداز استفاده ميشود يا روش كميلومينسانس (Chemiluminscance)، هموليز تداخل چنداني ندارد.
گفتني است كه برخي از بيماران داراي آنتيبادي ضد آنتيبادي موش هستند و تحريك ايمني از طريق دارويي يا كار با پروتئينهاي موش و در پارهاي موارد ناشناخته است. با توجه به اينكه در آزمايشهاي ايمونولوژي از آنتيبادي مونوكلونال موش استفاده ميشود وجود اين آنتيبادي در سرم بيمار نتايج تست را كاذب ميكند.
براي حمل نمونه به صورت منجمد بايستي لوله نمونه را در يخ خشك (solid carbon dioxide) و در ظرف پلي استيرين قرارداد و چنانچه حمل هر گونه نمونه احتمال خطر عفونت دارد بايستي در ظرف مقاوم به سوراخ شدن قرار داده شود و داراي برچسب خطر بيولوژيكي (biohazard) با رنگ فلورسانس نارنجي باشد.
نكته: سانتريفوژ دوباره لوله حاوي ژل جدا كننده سرم ممكن است باعث افزايش پتاسيم يا گزارش پتاسيم نرمال در شخصي كه كمبود واقعي پتاسيم دارد شود. گفتني است كه يك لايه سرم زير ژل در بالاي گلبولهاي قرمز فشرده و غني از پتاسيم شكل گرفته كه با سانتريفوژ دوباره اين لايه بداخل سرم نشت ميكند.
نكته: آناليز سرمهاي زرد و شيري و هموليزه روي آزمايشهاي شيمي نتايج درست بدست نميدهد و اين به دليل تغييرات در جذب نوري و پراكنده كردن نور توسط ذرات ليپيد در آناليزورها ميباشد.
مطالعات مولكولي
نمونه خون براي آزمايشهاي اسيد نوكلوئيك در ضد انعقاد EDTA گرفته ميشود. گفتني است كه ضد انعقاد هپارين همراه با DNA استخراج شده و بازدارنده آنزيم DNA پليمراز در آزمايش PCR است. تركيبات هيم مانند همين (Hemin) كه از خون هموليز در سرم يا پلاسما رها ميشود نيز توانايي بازدارندگي پليمراز DNA دارد. با توجه به اينكه RNA سلولهاي خون و بافت آسيب پذير است، از اين رو انجماد سريع نمونه قبل از پروسه استخراج آن لازم است. املاح نمكي، پروتئازها و فنل و كلروفرم براي استخراج بكار ميروند. جلوگيري از آلودگي در روش كار بسيار حائز اهميت است و سفارش ميشود كه قسمتهاي تكثير اسيد نوكلوئيك و آماده سازي پس از تكثير در محل جداگانه باشد.
اثرات ماتريكس
آناليتهايي مانند الكتروليتها، مولكولهاي ريز و آنزيمها و ….. در فاز مايع پلاسما يا سرم قرار دارند. افزايش پروتئينها، براي مثال در مايلوم مالتيپل و يا هيپرليپيدمي با اشغال كردن فاز مايع منجر به كاهش آناليتهاي فوق ميگردند.
(Solvent exclusion effect). خارج كردن ليپيدها با سانتريفوژ اولترا مؤثر است. اثرات ماتريكس با توجه به غلظت بالا يا كاهش پروتئينها در مايعات بدن چشمگير است.
وضعيت
وقتي يك شخص بالغ از وضعيت درازكش به حالت ايستاده در ميآيد حجم خون در حدود %10 در 10 دقيقه كاهش مييابد و اين ناشي از افزايش فشار هيدروستاتيك و فرار مايعات و مولكولهاي ريز خون به فضاي ميان بافتي است. عكس پديده فوق نياز به 30 دقيقه دارد تا آب ميان بافتي وارد خون گردد. فرار مايعات موجب افزايش مولكولهاي سنگين مانند توتال پروتئين (8 تا %10 افزايش)، تيروكسين، كلسترول، تري گليسريد و داروهاي متصل به پروتئين و آلبومين و برخي از آنزيمها ميگردد.
اين تغييرات در افراد مبتلا به پرفشاري خون بيشتر است. گفتني است كه بستن طولاني تورنيكت موجب خروج مايعات و غليظ شدن سلولهاي خون و پروتئينها ميشود. براي اندازه گيري سطح لاكتات نبايستي از تورنيكت استفاده كرد.
پياده روي به مدت 4 ساعت در هفته با كاهش 5 درصدي كلسترول و افزايش 3.4 درصدي HDL كلسترول نسبت به افراد غير فعال همراه است. سطح آنزيمهاي ماهيچهاي، اوره، كراتينين و تيروكسين در ورزشكاران بيشتر است.
مسافرت دور دست ريتم ترشح فيزيولوژيك را تغيير داده و براي پيدا كردن ريتم پايدار به 5 روز زمان نياز است.
بيشترين تغييراتي كه خوردن غذا و ناشتا نبودن روي افزايش تستهاي آزمايشگاهي دارد عبارت است از قند، آهن، ليپيد توتال و فسفاتاز قليايي كه به ويژه با خوردن غذاي چرب افزايش بيشتري نشان ميدهد و بيشترين افزايش در گروه خوني O و B ديده ميشود. گرسنگي طولاني مدت با ليپوليز و كتوژنز كبدي همراه است و موجب افزايش اسيدهاي چرب آزاد، اجسام كتوني، افزايش كلسترول و تري گليسريد و رها شدن اسيد آمينه از ماهيچهها و كاهش قند خون ميگردد. مصرف مزمن الكل فعاليت آنزيمها را تحت اثر ميگذارد. از اندازه گيري GGT (Gamma Glutamyl Transferase) و افزايش آن به عنوان نشانه الكليسم مزمن استفاده ميشود.
تزريق عضلاني با افزايش آنزيمهاي ماهيچهاي مانند CK و LDH همراه بوده و افزايش تا چند روز ادامه دارد.
تركيبات مرفين با افزايش فعاليت TSH، پرولاكتين، آميلاز، ليپاز و آنزيمهاي كبدي و افزايش بيليروبين همراه است. هروئين، كلسترول، T4 و پتاسيم را افزايش ميدهد.
تب
افزايش قند خون در اوايل تب رخ داده و موجب ترشح بيشتر انسولين ميشود، ولي افزايش هورمون رشد و گلوكاگون نيز رخ ميدهد و از اينرو ممكن است انسولين ترشحي قادر به پايين آوردن قند خون نباشد.
تب و بيماريهاي حاد با كاهش T4 همراه ميباشند. سطح كرتيزول پلاسما افزايش يافته و ممكن است تغييرات ريتمي در ترشح آن موقتاً ناپديد شود.
افراد نابينا
در افراد نابينا به علت كاهش تحريك محور هيپوتالاموس- هيپوفيز ممكن است نشانههايي از كمكاري غدد فوق كليه و غده هيپوفيز مشاهده شود. در برخي ممكن است ريتم ترشحي كرتيزول ادامه يا ناپديد شود. تغييرات روزانه آهن سرم ناپديد گرديده و كاهش ترشح آلدوسترون ممكن است با كاهش سديم و كلر همراه شود.
چرخه قاعدگي
در خانمي كه سيكل قاعدگي دارد مقدار كلسترول توتال دارای نوسان% 19 در طول ماه میباشد. به موازات افرايش سطح استروژن HDL- كلسترول هم افزايش مييابد. اوج افزايش HDL كلسترول در نيمه سيكل (تخمك گذاري) در همراهي با اوج افزايش استروژن مشاهده ميشود. كلسترول توتال، HDL كلسترول و تريگليسريد از نيمه سيكل شروع به كاهش كرده و داراي كمترين مقدار، درست قبل از شروع خونريزي است. با وجودي كه سطح تغييرات در غالب موارد 5 تا 8% است ولي ممكن است يك جواب نرمال را غيرطبيعي كند.
تأثير سيگار روي پارامترهاي خون (Smoking)
اثرات نيكوتين در ارتباط با تعداد سيگار و مقدار دود وارد شده به ريه ميباشد. با تحريك مدولاي غده فوق كليه غلظت اپينفرين پلاسما بالا رفته و دفع ادراري كاتكول آمينها و متابوليتهاي آن افزايش مييابد. غلظت گلوكز ممكن است 10mg% در ده دقيقه بعد از كشيدن يك سيگار بالا رفته و تا يكساعت دوام داشته باشد. غلظت انسولين پلاسما پاسخ تأخيري به افزايش قند خون نشان ميدهد و بعد از يك ساعت از كشيدن سيگار بالا ميرود و از اين رو غلظت گلوكز در سيگاريها بيشتر بوده و تحمل گلوكز ممكن است اندكي اختلال داشته باشد.
هورمون رشد حساسيت ويژهاي به دود تنباكو داشته و ممكن است تا 10 برابر در 30 دقيقه بعد از كشيدن يك سيگار بالا رود. كلسترول، تري گليسريد و LDL كلسترول در افراد سيگاري بيشتر بوده و مقدار HDL كلسترول كمتر است. هر چند ريتم ترشح كرتيزول تحت اثر سيگار قرار نميگيرد ولي افزايش ترشح 40 درصدي آن در 5 دقيقه از شروع كشيدن سيگار ديده ميشود.
ترشح 5- هيدروكسي ايندول استيك اسيد در افراد سيگاري افزايش مييابد. افزايش گلبولهاي سفيد تا% 30، و افزايش كاربوكسي هموگلوبين تا سطح %10 و كاهش ويتامين B12 در افراد سيگاري مشاهده ميشود. فشار اكسيژن شرياني 5 ميليمتر جيوه در افراد سيگاري كمتر از افراد غير سيگاري است. كاهش سطح IgA و IgM و IgG و افزايش سطح IgE در افراد سيگاري مشاهد شده است.
آزمايشهاي مثبت ضعيف فاكتور ضد هستهاي و كارسينوامبريونيك آنتيژن (CEA) مشاهده شده است. كاهش تعداد اسپرم و افزايش اشكال غيرطبيعي در مقايسه با افراد غير سيگاري مشاهده شده است.
سن
افراد به چهار دسته سني نوزاد، بچه، جوان و پير طبقهبندي ميگردند. مقـدار هموگلوبين F در بدو تولد بين 85-60 درصد و هموگلوبين A بين 15 تا 40 درصد است. سنتز هموگلوبين A2 بعد از تولد آغاز ميشود. نارس بودن كبد موجب پيدايش زردي فيزيولوژيك حدود 3 تا 5 روز پس از تولد ميگردد؛ در حالي كه حضور زردي در روز اول بيانگر كمخوني هموليتيك نوزاد ميباشد. كاهش ميزان قند خون در نوزاد به علت كاهش ذخاير گليكوژن مشاهده ميشود. غلظت پتاسيم حتي تا 7meq/L در بدو تولد ديده شده كه به سرعت به مقدار نرمال برميگردد. چنين روندي در افزايش كلسيم هم مشاهده شده است.
غلظت سرمي T4 نوازد سالم شبيه خانم حامله بالاتر از حالت معمول است. بعد از تولد TSH نوزاد بالا رفته كه منجر به افزايش بيشتر سطح سرمي T4 ميگردد. اين حالت پركاري فيزيولوژيك تيروئيد نوزادي در سالهاي اول زندگي ناپديد ميگردد.
فعاليت فسفاتاز قليايي در كودكان به موازات رشد استخوان به طور چشمگير بالاست ولي بعد از بلوغ كاهش مييابد. افزايش كراتينين سرم به موازات افزايش توده ماهيچهاي مشاهده ميشود.
كلسترول توتال سرم و تري گليسريد در زن و مرد با سرعت 2mg/dL در سال رو به افزايش رفته و به سطح ماكزيمم خود در سن 50 تا 60 سالگي ميرسد. افزايش كلسترول در خانمهاي منوپاز به علت احتمالي كاهش استروژن است. در سن پيري سرعت فيلتراسيون گلومرول كاهش مييابد. سطح سرمي T3 ممكن است به 40% كاهش يابد، ولي مقدار T4 تقريباً ثابت است.
كار با نمونه خون در آزمايشگاه
پلاسما يا سرم بايستي هر چه سريعتر و ايدهآل در ظرف يكساعت، پلاسما و تا دو ساعت سرم از خون جدا گردد. جدا كردن زود هنگام سرم موجب ادامه روند پروسه انعقاد در سرم و تشكيل فيبرين گرديده كه امكان مسدود كردن پروپ (probe) آناليزور را بدنبال دارد. براي تهيه پلاسما نمونه را با شتاب g 850- 1000 براي 10 دقيقه سانتريفوژ كنيد. چنانچه تأخير در انجام آزمايش بيشتر از 4 ساعت است سرم يا پلاسما را در يخچال نگه داريد. در شرايط اورژانس ميتوان از پلاسماي هپارينه جهت آزمايشهاي شيمي استفاده كرد. سفارش ميشود لوله آزمايش با سرپوش سانتريفوژ گردد تا از تبخير و قطره سازي در هوا (aerosolization) جلوگيري كرده و شرايط غيرهوازي را براي اندازه گيري پارامترهايي مانند دي اكسيدكربن و كلسيم يونيزه را بهتر فراهم كند.
نگهداري خون در يخچال موجب از كار افتادن پمپ سديم و پتاسيم گلبولهاي قرمز شده كه منجر به افزايش پتاسيم و كاهش سديم ميشود.
نگهداري خون لخته شده در آزمايشگاه موجب تغييراتي در آناليتهاي خوني ميشود؛ توجه داشته باشيد كه براي مثال فعاليت فسفاتاز موجب افزايش فسفر شده و برخي مواد مانند كاتهكول آمينها جذب گلبول قرمز و پلاكت ميگردند.
براي آزمايشهاي انعقادي جداسازي پلاسما با دور 2000g براي 15 دقيقه جهت توليد پلاسماي بدون پلاكت سفارش ميشود. نگهداري پلاسما در 4 درجه با فعال كردن فاكتور 7 زمان PT را كوتاه ميكند در حالي كه انجماد پلاسما در 20– درجه تأثيري در آزمايش PT و يا PTT ندارد.
آزمايش PT تا 24 ساعت در حرارت اتاق و PTT تا 4 ساعت در حرارت اتاق بلامانع است. اگر منظور از آزمايش PTT به منظور پيگيري درمان با هپارين است پلاسما را ظرف يكساعت جدا كرده و تا 4 ساعت ميتوان آزمايش PTT را انجام داد.
تأخير در جدا سازي سرم يا پلاسما
تماس طولاني سرم يا پلاسما با گلبولهاي قرمز ممكن است تغييرات چشمگيري در برخي پارامترها ايجاد كند. جذب مواد روي شيشه و پلاستيك، تبخير، ورود آب بدرون گلبولهاي قرمز و ادامه متابوليسم گلبولها علت پارهاي از اين تغييرات هستند.
گلوكز در 24 ساعت اول نمونهاي كه سرم آن جدا نشده بشدت كاهش مييابد و شدت كاهش در پلاسما بيشتر است. جدا سازي سريع سرم يا پلاسما و يا نمونه گيري در لوله سرخاكستري با داشتن فلورايد سديم از اين پديده جلوگيري ميكند. فلورايد با ايجاد كمپلكس يوني با Mg++، آنزيمهاي گليكوليز وابسته به آن مانند انولاز (Enolase) را غير كارآمد ميكند و تا 3 روز ميزان قند سرم را پايدار نگه ميدارد.
ورود آب بداخل گلبول موجب افزايش بيليروبين توتال، سديم، اوره، آلبومين، كلسيم و پروتئين توتال ميشود. مطالعات نشان داده است كه پتاسيم، فسفر و گلوكز از پارامترهاي بسيار ناپايدار در سرمي هستند كه در مدت 30 دقيقه از لخته جدا نشده است. آلبومين، بيكربنات، كلرايد، پپتيد C، HDL، LDL كلسترول، آهن و پروتئين توتال بعد از 6 ساعت از جدا نشدن سرم از گلبول ناپايدار هستند. چربيها و برخي از آنزيمها با گذشت زمان در سرم يا پلاسماي جدا نشده افزايش يافته و اين تغييرات در پلاسما بيشتر از سرم است. فعاليت آنزيم LDH تا 56 ساعت به طور مداوم رو به افزايش ميرود در حالي كه آنزيمهاي CK ,ALT ,AST تا اين مدت پايدارند.
فعاليت آنزيم GGT در پلاسما با يا بدون تماس با گلبولهاي قرمز %27 كمتر از نمونه سرمي است كه در0.5 ساعت جدا شده باشد، بهرحال فعاليت آنزيمي GGT با تماس بيشتر پلاسما با گلبول افزايش مييابد.
افزايش 110 درصدي كراتينين در پلاسما و 60 درصدي در سرم بعد از 48 تا 56 ساعت از جدا نشدن سرم يا پلاسما مشاهده ميشود. ممكن است كه اندازه گيري مقدار يك آناليت در سرم يا پلاسما داراي تفاوت چشمگيري باشد. براي مثال ميتوان به هورمون پاراتيروئيد با افزايش 19 درصدي در پلاسما اشاره كرد.
نكته مهم: سيكلهاي يخ زدن و آب كردن (Freeze- Thaw) داراي اثرات مهمي روي پايداري آناليتهاي ميباشد. كريستالهاي يخ داراي اثرات تخريبي به ويژه روي مولكولهاي بزرگ پروتئيني ميباشند. انجماد يواش و كند با شكلگيري كريستالهاي بزرگ يخ و اثرات تخريبي بيشتر همراه است، در حالي كه انجماد سريع براي پايداري بهتر سفارش ميشود.
کاهش 70 درصدی خطاهای آزمایشگاهی با دانستنیهای قبل از آنالیز
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام