بیومارکرهایی برای تشخیص زودهنگام کارسینوم هپاتوسلولار
دکتر شاهرخ مستور تهرانی
چکیده
کارسینوم هپاتوسلولار (HCC) یکی از دلایل مرگ ناشی از سرطان در سراسر جهان است و این سرطان با بیش از ۳۹۰۰۰ مورد ابتلا و ۲۹۰۰۰ مرگ در سال ۲۰۱۸، سریعترین افزایش مورتالیتی در ایالات متحده امریکا را داشه است. همانند بسیاری از سرطانهای دیگر، بقای بیماران با تشخیص زودهنگام بهطور چشمگیری افزایش مییابد. میانگین بقای بیماران با HCC در مراحل اولیه بیشتر از 60 ماه است، اما اگر بیماری در مراحل پیشرفته تشخیص داده شود، این مقدار به کمتر از ۱۵ ماه میرسد. پایش بیماران در معرض خطر، پیامد بیمار را بهبود میبخشد اما کمتر از 20% کسانی که در معرض خطر HCC هستند، این نظارتها را دریافت میکنند و استراتژیهای نظارتی و مراقبتی فعلی، حساسیت و اختصاصیت محدودی دارند. در حالت ایدهآل، بیومارکرهای خونی با حساسیت یا اختصاصیت کافی برای تشخیص زودهنگام HCC در دسترس هستند، اگرچه رایجترین بیومارکری که برای HCC استفاده میشود، یعنی آلفا فتوپروتئین، شاخصههای کارایی کافی را ندارد. گزینههای متعددی از مارکرهای سرمی پروتئومیک، گلیکومیک و ژنتیکی در اعتبارسنجی بیومارکرهای مراحل اولیه بررسی شدهاند و برای شناسایی زودهنگام HCC نویدبخش بودهاند، اما این مارکرها نیازمند اعتبارسنجی در کوهورتهای بسیار دقیق هستند. مطالعات کوهورت آیندهنگر در حال انجام، اعتبارسنجی طولی گذشتهنگر (فاز III مطالعات بیومارکر) بیومارکرها را ممکن میسازد. در این مقاله، بیومارکرهای منتخب نویدبخش و پنلهای بیومارکری که ارزیابی فاز II را کامل کردهاند، اما نیازمند اعتبارسنجی بیشتر برای استفاده بالینی هستند را بررسی میکنیم.
مقدمه
کارسینومای هپاتوسلولار (HCC) هفتمین تشخیص شایع سرطان در سراسر جهان با میزان مورتالیتی بالا است. HCC یک بدخیمی منحصر به فرد است، زیرا بهطور معمول در زمینه بیماری مزمن کبدی به ویژه سیروز ایجاد میشود و با افزایش ریسک نارسایی کبد میزان بقای ۵ ساله کاهش مییابد (۲۰-۱۸%). بیش از نیمی از مرگهای ناشی از HCC در سراسر جهان به دلیل عفونت اندمیک هپاتیت B (HBV) در آسیا رخ میدهد. به دلیل افزایش شیوع بیماری کبد چرب غیرالکلی (NAFLD)، بیماری کبدی مرتبط با الکل و عوارض مربوط به هپاتیت C (HCV)، بروز HCC در بسیاری از کشورهای غربی در حال افزایش است.
مرحله تشخیص HCC، پیشبینیکننده قوی مورتالیتی کلی است. بیماران در مراحل اولیه، واجد شرایط درمانهای بهبوددهنده از جمله جراحی، درمانهای ablative و پیوند کبد هستند، در حالی که بیماران در مراحل آخر معمولاً فقط امکان دریافت درمانهای تسکینی سیستمیک را دارند که البته میزان پاسخ به درمان اندک خواهد بود. در نتیجه، بقای 5 ساله در بیماران مبتلا به HCC در مرحله اولیه بیش از 70% است، در حالی که در مراحل پیشرفته به کمتر از 5% کاهش مییابد. متأسفانه به دلیل استفاده اندک از اصول نظارتی، روشهای نظارتی نامناسب و فقدان استراتژیهای مبتنی بر ریسک، اکثر بیماران در مراحل انتهایی تشخیص داده میشوند.
نظارت برای HCC در بیماران در معرض خطر، از جمله مبتلایان به سیروز با همه اتیولوژیها و جمعیتهای خاص با عفونت مزمن HBV (جدول 1) توصیه میشود. گایدلاینها، نظارت بر HCC را با استفاده از اولتراسوند شکمی (US) با یا بدون اندازهگیری آلفا فتوپروتئين سرمی (AFP) در هر 6 ماه توصیه میکنند.
یک متاآنالیز اخیر نشان داد که حساسیت نظارت مبتنی بر اولتراسوند شکمی برای تشخیص زودهنگام HCC، ۴۵% است. شایان ذکر است که ناهمگونی قابلتوجهی در حساسیت نظارت مبتنی بر اولتراسوند شکمی، بین مطالعات موجود در متاآنالیز دیده میشود (۸۹- 21%) که محدودیت نظارت مبتنی بر تصویربرداری را برجسته میسازد. مطالعات دیگری نیز آسیبهای نظارت اولتراسوند را برجسته ساختهاند که از اختصاصیت غیربهینه ناشی میشود و میتواند به انجام تستهای غیرضروری بیشتر که ممکن است عوارضی را به همراه داشته باشند، منجر شود. علاوه بر این، نشان داده شده است که وجود سیروز و چاقی که هر دو در بیماران غربی در مقایسه با بیماران آسیایی شیوع بیشتری دارند، حساسیت اولتراسوند شکمی را کاهش میدهند.
محدودیتهای نظارت مبتنی بر اولتراسوند به خوبی مستند شدهاند و نیاز به روشهای عینیتر و حساستر برای نظارت بر HCC را برجسته میسازند. علاوه بر این، نظارت اولتراسوند، افراطی است و نیاز به مراجعه جداگانه بیمار دارد (یعنی هر 6 ماه یک بار مراجعه به رادیولوژی) و این امر میتواند به موانع تدارکاتی قابلتوجهی هم برای بیماران و هم برای ارائهدهندگان منجر شود.
در حالت ایدهآل، بیومارکرهای خونی اعتبارسنجیشده با حساسیت و اختصاصیت کافی برای تشخیص زودهنگام HCC در دسترس خواهد بود. چندین بیومارکر زیستی منتخب وجود دارد که برای تشخیص زودهنگام HCC موردمطالعه قرار گرفتهاند و در این مقاله ما چشمانداز فعلی این نشانگرهای زیستی را بررسی خواهیم کرد.
اعتبارسنجی بیومارکرها
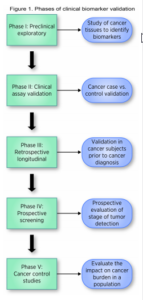
تعریف بیومارکر گسترده است و شامل هر ماده، ساختار یا فرآیند قابل اندازهگیری است که میتواند بیماری را تشخیص داده یا پیامدهای آن را پیشبینی کند. در اصل Pepe و همکاران به همراه شبکه تحقیقات تشخیص زودهنگام (EDRN) از انستیتوی ملی سرطان (NCI) پیشنهاد کردهاند که کشف و اعتبارسنجی بیومارکرها، قبل از اینکه بهطور روتین در بالین استفاده شوند، به چندین مرحله نیاز دارد (شکل 1). کشف اولیه در یک مرحله اکتشافی پیشبالینی (preclinical exploratory) و به دنبال آن اعتبارسنجی بالینی رخ میدهد که شامل توسعه روش اندازهگیری آن است (فاز I). اعتبارسنجی بالینی با انجام مطالعات کنترل موردی گذشتهنگر و مقایسه ترجیحاً کیسهایی در مراحل اولیه و گروه کنترل بدون سرطان از یک جمعیت غربالگری مرتبط (فاز II) آغاز میشود. اعتبار سنجی فاز III شامل ارزیابی طولی بیومارکر برای تعیین عملکرد آن در تشخیص بیماری پیشبالینی است. مطالعات اعتبارسنجی مرحله آخر، عملکرد بیومارکر را در عمل بالینی ارزیابی و تأثیر آن را در کاهش بار سرطان در یک جمعیت تعیین میکند. به دلیل فقدان کوهورتهای آیندهنگر بزرگ با مدت زمان پیگیری کافی و پیامدهای بیماران (مرحله اولیه HCC)، بیومارکرهای بسیار اندکی اعتبارسنجیهای کافی را گذراندهاند و به همین دلیل استفاده بالینی آنها محدود است. مطالعه استراتژی تشخیص زودهنگام سرطان هپاتوسلولار NCI EDRN و مطالعات کوهورت آیندهنگر این مانع را برطرف میسازد.
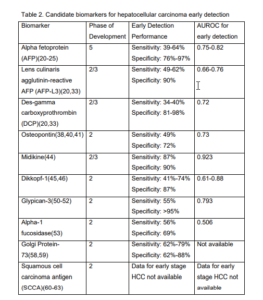
از بین بیومارکرهایی که در ادامه تشریح خواهند شد، AFP بهطور گستردهای موردمطالعه قرار گرفته است و علیرغم محدودیتهای آن، از چندین دهه قبل بهصورت بالینی مورد استفاده قرار میگیرد. در مقابل، بسیاری از بیومارکرهای دیگر به غیر از AFP-L3 و پروترومبین دس-گاما کربوکسی (DCP)، فقط در چند مطالعه ارزیابی شدهاند و عملکرد آنها برای تشخیص زودهنگام HCC در عمل بالینی، به ویژه در میان بیماران مبتلا به بیماری کبدی غیر ویروسی، ناشناخته است (جدول ۲).
بیومارکرهایی که ۵ فاز اعتبارسنجی را کامل کردهاند
آلفا فتوپروتئین
AFP رایجترین بیومارکر مورد استفاده در تشخیص زودهنگام HCC و تنها بیومارکری است که برای استفاده بالینی اعتبارسنجی شده است. به دلیل نگرانی در مورد اختصاصیت و حساسیت محدود در تشخیص مرحله اولیه HCC، در حال حاضر AFP بهتنهایی در گایدلاینهای رایج گنجانده نشده است. با این حال، یک متاآنالیز اخیر نشان داده است که در صورت استفاده ترکیبی از AFP و اولتراسوند شکمی میتوان حساسیت تشخیص زودهنگام HCC را افزایش داد (۶۳% در مقابل 45% هنگام استفاده از اولتراسوند بهتنهایی). افزایش مثبت کاذب AFP میتواند همراه با افزایش سطح آلانین آمینوترانسفراز سرم (ALT) رخ دهد که در هپاتیت مزمن C و B دیده میشود. تا ۵۰-۴۰% موارد HCC، سطح بالای AFP را نشان نمیدهند که باعث میشود حساسیت AFP بهتنهایی برای تشخیص HCC محدود باشد. مطالعات کوهورت منتشرشده، از جمله یک مطالعه بزرگ چند مرکزی با حمایت NCI EDRN، نشان میدهد حساسیت AFP برای تشخیص زودهنگام HCC در محدوده
۶۴-۳۹% و اختصاصیت آن در بازه ۹۷- ۷۶% قرار دارد. مقادیر cut-off برای AFP سرم در مطالعات مختلف بسیار متفاوت است، اما مقدار ng/mL ۲۰ به عنوان یک آستانه معتبر در تشخیص HCC اولیه پذیرفته شده است. برای بیمارانی که تحت نظارت قرار میگیرند، تغییر مقدار AFP در طول زمان نسبت به مقادیر واحد AFP در تشخیص HCC اولیه برتری دارد (منحنی عملیاتی گیرنده0/81در مقابل 0/76). تغییر در AFP در الگوریتم غربالگری تشخیص زودرس کارسینومای هپاتوسلولار (HES) که اخیراً معتبر شناخته شده است، گنجانده شده؛ بنابراین در حالی که AFP، ۵ فاز توسعه بیومارکر را پشت سر گذاشته است، استفاده روتین آن به عنوان بخشی از استراتژی نظارتی برای تشخیص زودهنگام HCC بحثبرانگیز است.
بیومارکرهایی با دادههای محدود از فاز III اعتبارسنجی
AFP L3
AFP L3 یا AFP واکنشدهنده با آگلوتینین lens culinaris، یک گلیکوفرم فوکوزیله شده از AFP است که برای تشخیص مراحل اولیه HCC مطالعه شده است. در حالی که سنجش مرسوم AFP، برای شناسایی آن نیاز به وجود مقادیر بالای ng/mL ۱۰ دارد، استفاده از سنجشی با حساسیت بالا برای AFP-L3 (hs-AFP-L3)، اندازهگیری AFP در بیمارانی با سطوح کمتر تا ng/mL ۲ را ممکن میسازد. متأسفانه، در حالی که AFP-L3 نسبت به AFP اختصاصیت بهتری برای تشخیص زودهنگام HCC دارد (9۰% ~)، حساسیت آن پایینتر است (۶۰-۴۹%). یک مطالعه اعتبارسنجی بیومارکر در کره، شامل 42 بیمار مبتلا به HCC نشان داد که در زمان تشخیص HCC، مساحت ناحیه زیر منحنی، مشخصه عملیاتی گیرنده (AUROC) برای AFP-L3، 0/73 است، در حالی که این مقدار برای AFP 0/77 است. AUROC برای 38 بیمار مرحله o/A (یعنی مرحله اولیه HCC) در کلینیک سرطان کبد بارسلون (BCLC) در این کوهورت حدود 0/76 بود که در صورت ترکیب با AFPL3 به 0/81 ارتقا مییابد. علاوه بر این، AFP-L3 در بیماران مبتلا به HCC، ۶ ماه قبل از تشخیص بالینی در مقایسه با گروه شاهد بهطور قابلتوجهی بالاتر بود. در اعتبارسنجی فاز II EDRN HEDS شامل 131 بیمار با HCC در مرحله اولیه، AUROC برای AFP-L3، 0/66 در مقابل 0/80 برای AFP بهتنهایی بود. یک محدودیت عمده در AFP-L3 این است که AFP خود حساسیت کمی دارد و بررسی هر ایزوفرم باعث بهبود حساسیت نمیشود. برای تأیید اینکه آیا ارزش افزودهای در مقایسه با AFP بهتنهایی دارد یا خیر، به تأیید مرحله سوم اعتبارسنجی AFP-L3 نیاز است.
دس-گاما کربوکسی پروترومبین
دس گاما كربوكسی پروترومبین (DCP) یک پروترومبین غیرطبیعی است كه با ترانسفورماسیون بدخیم هپاتوسیتها به دلیل ناکافی بودن ویتامین K، ناشی از مکانیسمهای انتقال درونسلولی ناكارآمد، نقص در آنزیم گاما-کربوکسیلاز و تغییرات اسکلت سلولی که باعث کاهش جذب ویتامین K میشود، تولید میشود. حساسیت و اختصاصیت DCP در تشخیص مرحله اولیه HCC به ترتیب در محدوده ۶۲-۳۴% و 98-81% قرار دارد. در مطالعه EDRN، مرحله II از 131 بیمار مبتلا به مرحله اولیه HCC، DCP دارای AUROC 0/72 بود. ارزیابی محدود مرحله III، حساسیت ضعیف DCP را در تشخیص HCC پیشبالینی (12/۱%) نشان داده است. استفاده ترکیبی از مقادیر DCP و AFP میتواند حساسیت DCP را به 80% برای تومورهای بزرگ (> cm ۳) و 70% برای تومورهای کوچک (3-2 سانتیمتر) افزایش دهد. دادههای اخیر نشان میدهد DCP هنگامی که با AFP و AFP-L3 برای تشخیص HCC اولیه، ترکیب شود، قدرت افتراقی را افزایش نمیدهد. علیرغم انجام نشدن اعتبارسنجی رسمی فاز III یاIV ، DCP در بسیاری از کشورهای جهان برای تشخیص زودهنگام HCC استفاده میشود. بر اساس مطالعات اعتبارسنجی انجام شده تاکنون، به نظر نمیرسد DCP بهتنهایی ویژگیهای عملکردی مناسب برای تشخیص مراحل اولیه HCC را داشته باشد، اما همچنان میتواند به عنوان بخشی از پنل بیومارکری در نظر گرفته شود.
بیومارکرهای دارای دادههای اعتبارسنجی فاز II
همه بیومارکرهای زیر نتایج نویدبخشی را در ارزیابی فاز II نشان دادهاند اما با توجه به اینکه عملکرد بیومارکر ممکن است در مطالعات فاز II بیش از حد واقعی تخمین زده شود، کماکان نیازمند اعتبارسنجی فاز III هستند.
استئوپونتین
استئوپونتین یک فسفوپروتئین متصلشونده به اینتگرین است که در سیگنالینگ سلولی دخیل در تنظیم پیشرفت تومور نقش دارد. استئوپونتین برای تشخیص HCC اولیه که توسط BCLC مرحله o/A تعریف میشود، در متاآنالیزی متشکل از ۴ مطالعه ارزیابی شد و حساسیت ۴۹% (95% CI: 42- 56) و اختصاصیت ۷۲% (95% CI: 68 – 76) را نشان داد که هر دو با عملکرد AFP بهتنهایی، قابلمقایسه است. هنگامی که استئوپونتین و AFP بهطور ترکیبی استفاده شوند، حساسیت به ۷۳% (95% CI: 67-79) و اختصاصیت با تغییر جزئی به ۶۸% (95% CI: 64-72) میرسد. یکی از مطالعات موجود در این متاآنالیز، مطالعه اعتبارسنجی فاز II بر روی ۷۸ بیمار با HCC اولیه و ۷۶ بیمار مبتلا به سیروز بود. استئوپونتین از AFP بهتنـــــــــــهایی،
در تشخیص HCC اولیه بهتر عمل کرد (AUROC: 0.73 [95% CI: 0.62 -0.85] در برابر AUROC: 0.68 [95% CI: 0.54-0.82]) و عملکرد استئوپونتین در ترکیب با AFP باز هم بهتر شد و AUROC آن برای مرحله اولیـــــــــــه HCC 0/81 (95% CI: 0.70-0.91) بود.
Midikine (میدیکین)
مدیکین (MDK) یک فاکتور رشد متصلشونده به هپارین است که در رشد سلولی، تهاجم و آنژیوژنز طی پیشرفت سرطان، دخالت دارد. افزایش سطوح MDK در بیماران دچار مرحله بسیار اولیه HCC نشان داده شده است و به دنبال جراحی درمانی، کاهش مییابد. سطوح MDK در بیمارانی که بهطور کامل درمان نمیشوند یا بیماران مبتلا به HCC عودکننده، افزایش مییابد یا در سطوح بالا باقی میماند. یک مطالعه اعتبارسنجی فاز II شامل ۱۱۹ بیمار BCLC 0/A، حساسیت MDK را ۸۷% و اختصاصیت آن را 90% نشان داد، در حالی که حساسیت AFP برابر ۵۲% و اختصاصیت آن 35% بود. AUROC مربوط به MDK در این مطالعه برای بیماران مبتلا به HCC BCLC 0/A در مقایسه با بیماران مبتلا به سیروز، 0/92 بود. ترکیب MDK و AFP میزان تشخیص زودهنگام HCC را به 96% افزایش داد. در یک مطالعه فاز ۳ محدود بر روی بیماران مبتلا به سیروز مرتبط با استئاتوهپاتیت غیرالکلی، MDK برای تشخیص زودهنگام AFP نسبت به AFP برتری نداشت، اما تقریباً در نیمی از بیمارانی که افزایش AFP را نشان نمیدادند، افزایش یافته بود.
Dikkopf-1
Dikkopf-1 (DKK1) گلیکوپروتئینی است که به عنوان یک آنتاگونیست ترشحی مسیر سیگنالینگ Wnt/B-catenin عمل میکند. در یک مطالعه بر روی ۱۲۸۴ بیمار (۸۳۱ بیمار در کوهورت تست و ۴۵۳ نفر در کوهورت اعتبارسنجی)، غلظتهای DKK1 در بیماران مبتلا به HCC نسبت به گروه کنترل در کوهورت تست بهطور چشمگیری بالاتر بود و مقادیر آن بین گروههای کنترل (بیماران سیروز و کنترلهای سالم) تفاوت معناداری نشان نداد (p < 0.001). در کوهورت اعتبارسنجی، حساسیت تشخیص HCC مرحله اولیه ۷۲-۷۰% و اختصاصیت آن ۹۰-۸۷% بود (0/88 = AUROC). استفاده ترکیبی از مقادیر DKK1 با AFP میزان تشخیص HCC مرحله اولیه را افزایش میدهد (0/89 = AUROC). در یک مطالعه فاز II جداگانه، با شرکت بیماران آلوده به هپاتیت B در کره جنوبی (۲۰۸=n)، استفاده از ترکیب AFP و DKK1 مشابه استفاده از AFP بهتنهایی، برای تشخیص HCC مرحله اولیه بود (AUROC: ۶۳/۰ در برابر 0/69). این دادههای اولیه پیشنهاد میکند که اتیولوژی بیماری کبدی میتواند یک فاکتور مهم در کارایی DKK1، به عنوان یک بیومارکر تشخیصی زودهنگام، باشد؛ بنابراین سودمندی آن باید به اثبات برسد.
Glypican-3 (GPC-3)
Glypican-3 (GPC-3) یک پروتئوگلیکان هپاران سولفات سطح سلولی است که تکثیر سلولی و سرکوب تومور را تنظیم میکند. متاآنالیزی متشکل از ۱۹ مطالعه فاز II بر روی بیومارکرها نشان داد که حساسیت GPC-3 برای تشخیص زودهنگام HCC، اگر بهتنهایی استفاده شود، کمتر از حد مطلوب است (تقریباً ۵۵%) و اگر بهصورت ترکیبی با AFP استفاده شود به ۷۶% افزایش پیدا میکند، با این وجود دادههای موجود در مورد تشخیص مرحله اولیه HCC محدود است. اختصاصیت GPC-3 بیش از ۹۵% است که سودمندی بالقوه آن را به عنوان یک بیومارکر مکمل برای افزایش حساسیت AFP یا دیگر بیومارکرهای سرمی، مطرح میسازد.
آلفا-۱ فوکوزیداز
آلفا-۱ فوکوزیداز (AFU) یک آنزیم لیزوزومی است که افزایش آن در بیماران HCC نشان داده شده است. در یک مطالعه بیومارکر فاز II بر روی ۵۷ بیمار مبتلا به HCC مرحله اولیه، حساسیت و اختصاصیت AFU در تشخیص زودهنگام HCC به ترتیب ۵۶ و ۶۹ درصد بود. ترکیب AFU و AFP حساسیت یا AUROC را به میزان قابلقبولی افزایش نداد، بهگونهای که استفاده از AFP بهتنهایی بر استفاده ترکیبی برتری دارد. اختصاصیت AFU اندک است؛ به دلیل اینکه بیان آن در دیابت، پانکراتیت و هایپوتیروئیدیسم نیز افزایش مییابد و بر اساس نژاد و قومیت متفاوت است. اگرچه یک مطالعه فاز III کوچک با ۲۷ بیمار نشان داد که در 85 درصد بیماران فعالیت AFU حداقل ۶ ماه پیش از تشخیص HCC افزایش مییابد که نشان میدهد ممکن است مطالعات بیشتر لازم باشد.
پروتئین گلژی- ۷۳
پروتئین گلژی ۷۳ (GP-73) یک پروتئین ترانسممبران است که در سلولهای اپیتلیال بیان میشود و میتواند در بیماران مبتلا به HCC و فیبروز پیشرفته به دنبال عفونت هپاتیت B یا هپاتیت C افزایش یابد. این پروتئین برای اولین بار به عنوان بیومارکر HCC از طریق گلیکوپروتئومیکس شناسایی شد. در یک مطالعه فاز II، حساسیت و اختصاصیت GP-73 برای افتراق بین HCC مرحله اولیه (BCLC 0/A) و سیروز، به ترتیب ۶۹% و ۸۶% نشان داده شد. حساسیت و اختصاصیت تشخیص HCC مرحله اولیه (BCLC A/0) در این کوهورت، همان حدود بود و به ترتیب ۶۲% و 88% نشان داده شد. ترکیب GP-73 و AFP حساسیت و اختصاصیت را برای افتراق همه مراحل HCC از سیروز به ترتیب تا ۹۸% و 85% افزایش داد، گرچه کارایی استفاده ترکیبی در تشخیص HCC مرحله اولیه گزارش نشده است. در یک متاآنالیز، حساسیت GP-73 برابر ۷۹% بود، در حالی که اختصاصیت آن 62% نشان داده شد که مشابه عملکرد AFP است. یک مشکل عمده در ارتباط GP-73، وابستگی آن به آنالیز وسترن بلات برای اندازهگیری دقیق ایزوفرم مرتبط با HCC است. اثبات شده است که بهکارگیری سنجشهای مبتنی بر الایزا که ذاتاً برای استفاده بالینی مناسبتر هستند، برای اندازهگیری ایزوفرمهای GP-73 مرتبط با HCC، دشوار است.
آنتیژن کارسینومای سلول سنگفرشی
آنتیژن کارسینومای سلول سنگفرشی (SCCA) یک مهارکننده سرین پروتئاز است که در اپیتلیوم سنگفرشی وجود دارد. SCCA توسط سلولهای اپیتلیال نئوپلاستیک و هپاتوسیتها بیان میشود و با مهار آپوپتوز، رشد تومور را هموار میسازد. علاوه بر SCCA، کمپلکس ایمنی SCCA (SCCA-IgM) نیز برای تشخیص HCC مورد بررسی قرار گرفته است. SCCA حساسیت بالایی برای HCC دارد (۸۹%)؛ با این وجود در تشخیص HCC از سیروز اختصاصیت ضعیفی دارد (۵۰%). در یک متاآنالیز متشکل از ۱۱ مطالعه، SCCA AUROC معادل 0/80 را نشان داد در حالی که SCCA-IgM دارای AUROC معادل 0/77 بود. متأسفانه کارایی آن در تشخیص HCC مرحله اولیه بهطور جداگانه گزارش نشده است.
واریانتهای گلیکوزیلاسیون
گلیکوپروتئینهای فوکوزیلهشده
بر اساس این یافته که تغییرات در بیومارکرها میتواند در سطح سلولی و نه در سطح پروتئین رخ دهد، تلاشهایی برای شناسایی پروتئینهایی با تغییرات گلیکانی صورت گرفت که میتوانند به عنوان بیومارکرهای HCC استفاده شوند. سطوح افزایشیافته پروتئینهای فوکوزیلهشده مانند هموپکسین، فتوئین A (fetuin A)، آلفا-۱ آنتیتریپسین، سروپلاسمین، هاپتوگلوبین، پاراکسوناز ۱ سرمی و گلیکوپروتئین غنی از هیستیدن، از طریق توالییابی گلیکان بهصورت مستقیم یا متدهای مبتنی بر لکتین در سرم بیماران مبتلا به HCC مشاهده شده است. فوکوزیلاسیون بهطور مستقیم در تومور نیز مشاهده شده است و این نتایج در کنار هم قویاً مطرحکننده این است که فوکوزیلاسیون افزایشیافته هم در مرکز و هم در بازوی بیرونی، در تعداد بسیاری از پروتئینها رخ میدهد.
تنها تعداد محدودی مطالعات فاز I و II در مورد گلیکوپروتئینهای فوکوزیله انجام شده است. مهمترین آنها کینینوژن فوکوزیلهشده است که در چندین کوهورت فاز II مستقل (اعتبارسنجی داخلی و خارجی) مورد بررسی قرار گرفته است. کینینوژن فوکوزیلهشده به خودی خود بیومارکر مناسبی نیست اما هنگامی که با AFP و دیگر فاکتورهای بالینی بهصورت ترکیبی استفاده شود، به نظر میرسد کارایی بیومارکری آن با AUROC برابر 0/97 که در یک مطالعه فاز II شامل ۶۹ بیمار با HCC اولیه به دست آمده است، در حد عالی خواهد بود.
هاپتوگلوبین گلیکوزیلهشده
یک گلیکوپروتئین دیگر که مشخص شده است در HCC، گلیکوزیلاسیون آن تغییر میکند، هاپتوگلوبین است. مطالعات اولیه، تغییر در فوکوزیلاسیون و سیاله شدن این مولکول را در کنار تغییرات دیگر، شناسایی کردند. مطالعات بیشتر، افزایش مقدار انشعابات را در این مولکول مشخص ساخت. همانند سایر مارکرهای گلیکوپروتئینی، عملکرد آن بهتنهایی محدود است، اما این مارکرها در ترکیب با AFP و دیگر فاکتورهای بالینی، حساسیتی نزدیک به ۸۰% و اختصاصیت ۹۵% را برای تشخیص زودهنگام در یک مطالعه فاز II نشان میدهند.
قابلتوجه است که آنالیز گلیکوفرمهای پروتئینی در سنجشهای مبتنی بر پلیت با استفاده از لکتینها، بهطور چشمگیری تحت تأثیر حضور آنتیبادیهای هتروفیلیک در بیماران مبتلا به فیبروز کبدی قرار میگیرد. به دلیل اینکه اکثر بیماران مبتلا به HCC دچار فیبروز کبدی میشوند، این آنتیبادیها باید پیش از آنالیز در نظر گرفته شوند. روشهای مبتنی بر طیفسنجی جرمی امیدوارکننده بودهاند اما قبل از استفاده بالینی روتین، نیازمند بررسی و سادهسازی هستند.
مارکرهای ژنومیک
MicroRNA
بیان نابجای میکروRNAها (miRNA) که RNAهای غیرکدکننده در گردش هستند، میتواند در اونکوژنز و پیشرفت سرطان دخیل باشد. به دلیل پایداری ذاتی و نقش آنها در تکثیر تومور، چندین مطالعه miRNAهای در گردش را به عنوان بیومارکری برای تشخیص HCC ارزیابی کردهاند. دو miRNA اختصاصی miRNA-21 و miRNA-199a، به عنوان بیومارکرهای احتمالی برای تشخیص زودهنگام HCC پیشنهاد شدهاند. مشخص شده است که سطوح miRNA-21 در بیماران مبتلا به HCC افزایش یافته است و در مطالعههای کوچک فاز II برای افتراق بین سیروز و HCC نویدبخش بوده است؛ اگرچه تفسیر نتایج این مطالعات ممکن است به دلیل ناکافی بودن بیماران کنترل و شمار اندک بیماران مبتلا به مرحله اولیه HCC، دشوار باشد. چند miRNA دیگر نیز از گزینههای مورد بررسی برای تشخیص زودهنگام HCC و تعیین پروگنوز آن هستند و miRNAهای بسیاری نیز بهتنهایی یا در قالب پنلهای miRNA در ترکیب با دیگر بیومارکرها، در مطالعات فاز I و II بررسی شدهاند. در رابطه با آنالیز miRNAها به دلیل تفسیرهای متغیر، چالشهایی وجود دارد؛ اگرچه تلاشها برای تضمین هماهنگی در تعیین مشخصات مولکولهای miRNA ادامه دارد.
جهشهای DNA
سلولهای مشتقشده از بافت HCC حامل جهشهای ژنتیکی و تغییرات اپیژنتیکی هستند که برخی از آنها میتوانند در اونکوژنز HCC دخیل باشند، در حالی که برخی از دیگر جهشها، گذرا بود و پیامد بیولوژیکی ندارند. در آنالیز بزرگ مقیاس از جهشهای اختصاصی HCC، حذفها یا تغییرات اپیژنتیکی در حداقل یک ژن از ۳۱ ژن مختلف رخ داده بودند. فراوانترین جهش مرتبط با HCC، در پروموتر TERT است که تقریباً ۶۰% همه بافتهای HCC حامل این جهشها هستند. دومین ژنهای جهشیافته رایج، p53 و CTNNB1 هستند که در ۳۵-۲۵ درصد بافتهای HCC، دچار جهش شدهاند. DNA عاری از سلول مشتق از بافت HCC حامل همه این ناهنجاریها است و در پلاسما و یا ادرار شناسایی شده است و برای طبقهبندی ریسک و تشخیص سرطان پیشنهاد شدهاند. در یک مطالعه، شناسایی پروموتر TERT جهشیافته در پلاسما، بهطور کلی دارای اختصاصیت ۴۷ درصدی برای HCC (تمام مراحل) بود اما هنگامی که به گروه مردان مبتلا به HCV مزمن محدود شد، به اختصاصیت ۸۷ درصد رسید. حساسیتها و اختصاصیتها برای ژنهای مختلف تستشده و جمعیتهای مطالعهشده، بسیار متغیر بودند که اجرای این سنجشها را دشوار میساخت و استفاده عملی مستلزم بررسیهای بیشتر است.
تغییرات اپیژنتیکی/ متیلاسیون DNA
متیلاسیون DNA اغلب در کارسینوژنز HCC دخیل است و از این رو مطالعاتی انجام شدهاند که DNA عاری از سلول متیلهشده را برای تشخیص زودهنگام HCC، بررسی کردهاند. چندین پنل متیلاسیون DNA وجود دارد؛ اگرچه تاکنون اعتبارسنجی و مقایسه مناسب با کنترل برای استفاده بالینی محدود بوده است. یک پنل از ۴ مارکر متیله، در ترکیب با AFP و AFP-L3، برای تشخیص HCC مرحله اولیه (BCLC 0/A) حساسیت ۷۱% و اختصاصیت ۹۰% و AUROC برابر 0/91نشان داد. این پنل به خوبی با AFP بهتنهایی مقایسه شد (حساسیت ۲۱%، اختصاصیت 98% و AUROC برابر 0/81). در حالی که این نتایج اولیه نویدبخش هستند، اما باید در انتظار اعتبارسنجی بیشتر باشند.
الگوریتمها
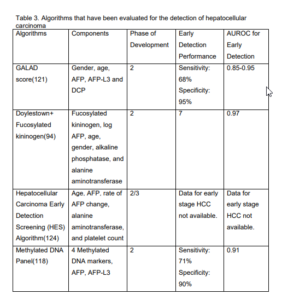
بیولوژی تومور HCC، با در نظر گرفتن کارسینوژنز آن که شامل چندین تغییر ژنتیکی در یک بیمار واحد است، هتروژن میباشد. این مسئله تا حدی میتواند کارایی محدود هر بیومارکر واحد را توضیح دهد. الگوریتمها/ پنلهایی که شامل چندین بیومارکر هستند، مسیرهای هتروژن در کارسینوژنز و بیولوژی تومور و فاکتورهای بالینی مرتبط با ریسک HCC مانند جنس، سن و اتیولوژی بیماری کبدی را در بر میگیرند. این پنلها برای ارتقاء حساسیت و اختصاصیت برای تشخیص HCC اولیه، توسعه یافته و مورد اعتبارسنجی قرار گرفتهاند (جدول ۳).
امتیاز گالاد: جنس، سن، AFP-L3، AFP و دس کربوکسی پروترومبین (GALAD)
امتیاز GALAD شامل جنس، سن،AFP ، AFP-L3 و DCP است. توانایی امتیاز GALAD برای تمایز بین HCC، سیروز و سایر بدخیمیهای کبدی- صفراوی (به عنوان مثال کلانژیوکارسینوم) مورد بررسی قرار گرفته است. استخراج این مدل بر اساس دادههای 833 بیمار (394 بیمار مبتلا به HCC و 439 بیمار مبتلا به بیماری مزمن کبدی) در دو مرکز در انگلستان صورت گرفت و در کوهورتهای مستقل با شرکت 6834 بیمار (2430 بیمار مبتلا به HCC و 4404 بیمار مبتلا به بیماری مزمن کبدی) در ژاپن، آلمان و هنگکنگ اعتبارسنجی شد. کل 1038 بیمار در تمام مراکز، مبتلا به مرحله اولیه HCC بودند که اندازه تومور کمتر از cm ۳ بود. در این مطالعات کوهورت ( AUROC of 0.85-0.95 (حساسیت کلی از ۹۱-۸۰% و اختصاصیت از 90- 81% متغیر بود. یک مطالعه اعتبارسنجی فاز ۲ با شرکت بیماران مبتلا به استئاتوهپاتیت غیرالکلی با یا بدون HCC از ۸ مرکز در آلمان، AUROC معادل 0/91، حساسیت 68% و اختصاصیت 95% برای تشخیص زودهنگام HCC داشت. برای ارائه اعتبارسنجی فاز III این پنل در کوهورتهای آیندهنگر، تحقیقات در حال انجام است.
الگوریتم Doylestown
الگوریتم Doylestown از log AFP، سن، جنس، آلکالین فسفاتاز و آلانین آمینوترانسفراز تشکیل شده است. در یک مطالعه فاز ۲ با شرکت ۶۹ بیمار مبتلا به مرحله اولیه HCC (مرحله T1 یا T2 بیماری) و ۹۳ بیمار مبتلا به سیروز به عنوان کنترل، اضافه کردن کینینوژن فوکوزیله به الگوریتم، نسبت به الگوریتم Doylestown و AFP بهتنهایی، AUROC بالاتری دارد (0/97 در برابر 0/93 و 0/80 به ترتیب). جالب توجه است که در ۲۹ بیمار مبتلا به مرحله اولیه HCC و AFP < 20، الگوریتم Doylestown به همراه کینینوژن فوکوزیله، تشخیص ۸۹ درصدی داشت و AUROC را در مقدار 0/97 حفظ کرد. این سطح از کارایی باید در مطالعههای فاز II بزرگتر و نیز مطالعات اعتبارسنجی فاز ۳ تأیید شود که در حال انجام هستند.
الگوریتم غربالگری تشخیص زودهنگام کارسینومای هپاتوسلولار (HES)
الگوریتم HES شامل سن، AFP، میزان تغییرات AFP، آلانین آمینوترانسفراز و شمارش پلاکت، در یک مطالعه فاز ۲ با استفاده از دادههای Veterans Administration، اعتبارسنجی شده است. در یک کوهورت متشکل از ۴۸۰۴ بیمار که غالباً بیماران مبتلا به HCC مرتبط به HCV بودند، الگوریتم HES در شناسایی HCC، ۶ ماه پیش از تشخیص بالینی، از AFP بهتنهایی، عملکرد بهتری داشت و حساسیت آن ۵۳% در برابر 48% با میزان مثبت کاذب 10% بود. این اعتبارسنجی محدود بود، زیرا شامل عملکرد الگوریتم در بیماران مبتلا به HCC اولیه نبود و عملکرد آن در اتیولوژیهای غیرویروسی بیماری کبدی نیازمند اعتبارسنجی بیشتر است.
اقدامات آتی
در حالی که چندین گزینه به عنوان بیومارکرهایی برای تشخیص زودهنگام HCC وجود دارد، تعداد کمی از آنها به عرصه بالینی راه یافتهاند که عمدتاً به دلیل فقدان کوهورتهای بهخوبی تفسیرشده برای مطالعات اعتبارسنجی است. با این وجود، چندین مطالعه آیندهنگر از جمله مطالعه EDRN HEDS و کنسرسیوم کارسینومای هپاتوسلولار تگزاس وجود دارد که ممکن است فرصتی برای انجام مطالعات اعتبارسنجی فاز III بزرگ مقیاس را فراهم کند. این کوهورتها علاوه بر اعتبارسنجی بیومارکرهای منفرد، اعتبارسنجی الگوریتمهای مرکب از چند بیومارکر و دادههای بالینی، در تشخیص HCC اولیه با اتیولوژی بیماری کبدی ویروسی و غیرویروسی را ممکن میسازد که با توجه به تغییر اپیدمیولوژی HCC در ایالات متحده آمریکا و سراسر جهان حائز اهمیت است. تلاشها برای بهبود طبقهبندی ریسک بیماران با توجه به خطر ابتلا به HCC ادامه دارد. فاکتورهای مرتبط با بیمار، مانند سن و جنس، در حال حاضر در بسیاری از الگوریتمهای بیومارکری موجود وجود دارد. درک بیشتر از ریسک فردی بر اساس پروفایل ژنتیکی یا سایر بیومارکرها میتواند استراتژیهای نظارت شخصی بر بیماران در معرض خطر HCC را ممکن سازد، بهطوری که گروههای پرخطر برای نظارت شدیدتر شناسایی شوند، در حالی که گروههای کمخطر میتوانند تحت نظارت نباشند. در نهایت اینکه، مطالعات برای توسعه و تأیید تکنیکهای تصویربرداری (به عنوان مثال MRI) و تکنولوژیهایی مانند استخراج دیجیتال دادههای کمی با ابعاد بالا از تصویربرداری (به عنوان مثال رادیومیک)، به منظور بهبود حساسیت تشخیص زودهنگام HCC و برای طبقهبندی ریسک بیمار در حال انجام است که میتواند مکمل بیومارکرهای سرمی باشد.
نتیجهگیری
چندین بیومارکر منتخب وجود دارد که قابلیت بهبود چشمگیر تشخیص زودهنگام HCC را دارا هستند. رویکردهایی که طبقهبندی ریسک بیمار و چند بیومارکرهای منتخب را ترکیب میکنند، احتمالاً بهترین مشخصات عملکردی را نشان میدهند. حمایت از ایجاد و پیگیری بلندمدت کوهورتهای بهخوبی تفسیرشده از نژاد/ قومیتهای متفاوت با اتیولوژیهای متفاوت بیماری کبدی و جمعآوری و ذخیره مناسب نمونههای زیستی برای اعتبارسنجی بیومارکرها و الگوریتمهای جدید در مطالعات فاز 3 بسیار مهم است، با این هدف که برخی از این مطالعات برای دستیابی به مطالعات فاز 5/4 واجد شرایط بشوند و در نهایت به بهبود پیامدها در بیماران مبتلا به HCC کمک کنند.
برگردان از:
Biomarkers for the Early Detection of Hepatocellular Carcinoma
Downloaded from cebp.aacrjournals.org on April 14, 2020. © 2020 American Association for Cancer Research
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام