دربارهی اهدای خون بیشتر بدانیم
(قسمت چهل و یکم)
عوارض انتقال خون – 18
علیاصغر صفری فرد
كارشناس ارشد خونشناسی و بانك خون
کارشناس عالی سازمان انتقال خون ایران
safarifardas@ gmail.com
www.shokofanews.blogsky.com
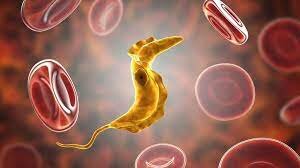
بیماری شاگاس
تريپانوزوميازيس آمریکایی یا بیماری شاگاس که عامل آن تکیاختهای به نام “تريپانوزوما كروزي” است فقط در آمریکا دیده میشود. این بیماری برای اولین بار در سال 1909 در برزیل توسط Carlos Chagas گزارش شد. او طی چندین مقاله ماهیت تکیاخته، مرفولوژی آن در جریان خون، سیکل زندگی انگل در دستگاه گوارش بیمهرگان، کشت در آگار خون و انتقال آن را به مهرهداران نشان داد.
احتمال انتقال آن از طریق خون اولین بار توسط Mazza در کشور آرژانتین در سال 1936 مطرح شد. سایر دانشمندان و محققین بعدها در برزیل، اروگوئه و آرژانتین برداشت کلی او را دراینباره تأیید کردند. گزارش اولیه بیماری شاگاس منتقله از طریق تزریق خون در سال 1952 در برزیل انتشار یافت و در طی همین دوره ارزش پروفیلاکسی دارویی مورد مطالعه قرار گرفت. با وجود آن که این بیماری صرفاً بهعنوان مشکل آمریکای لاتین تلقی میگردید، بیماری شاگاس منتقله از طریق فرآوردههای خون در اواخر دهه 1980 در آمریکای شمالی شناسایی شد.
تعدادی بسیاری از بیش از 90 میلیون انسان ساکن در مناطق آندمیک در معرض خطر بوده، احتمالاً 18 تا 24 میلیون نفر در 18 کشور آمریکای لاتین آلوده هستند. تخمین زده میشود که 2 تا 3 میلیون انسان مبتلا به علائم مزمن بیماری (قلبی یا معدی- رودهای) و حدود 45000 مورد مرگ سالانه وجود داشته باشد. در نتیجه بیماری شاگاس یک علت عمده بازنشستگی زودرس و سالهای ازدسترفته به علت ناتوانی است.
در مناطق آندمیک، انگل توسط ساس منتقل میشود. انگل از طریق مدفوع ساس وارد محل گزش و یا غشاهای موکوسی اطراف میشود. این انگل میتواند در گلبولهای قرمز کیسههای خون تا هفتهها باقی بماند. تمامی فرآوردهای خون بهجز پلاسمای لیوفیلیزه و مشتقات پلاسمایی میتوانند باعث انتقال انگل شوند. انتقال بیماری شاگاس همچنین از طریق مادرزادی و یا تغذیه با شیر مادر، آلوده شدن اتفاقی آزمایشگاهی، پیوند عضو یا انتقال خون صورت میگیرد.
این انگل میتواند معضل اساسی برای انتقال خون در مناطق آندمیک باشد. اخیراً یک تحقیق سرواپیدمیولوژیک در لسآنجلس آمریکا برای اهداکنندهها نشان داد که 1311 نفر از 3320 اهداکننده خون (حدود 39/5%) که پرسشنامه را تکمیل کرده بودند برای انتقال انگل پرخطر شناخته شدند. این تحقیق نشان میدهد شیوع این بیماری در آمریکا در حال افزایش است و میتواند ناشی از افزایش مهاجرت از مناطق آندمیک به داخل کشور باشد.
انگل معمولاً در اطراف چشم تجمع کرده، موجب التهاب میشود و درنهایت بهصورت عفونت بروز میکند. این علائم را “رومانا” مینامند. باید توجه داشت که در شاگاس ناشی از انتقال خون این علائم ایجاد نمیشود، لذا علائمی شبیه سرماخوردگی معمولی ممکن است بروز یابد. بعد از گذشت یک دوره 10 ساله در اثر پاسخ دفاعی بدن بیمار نسبت به انگل، آسیب بافتهای عصبی قلب یا مجرای گوارش میزبان ایجاد میشود و میتواند بهصورت کاردیومیوپاتی، بزرگ شدن کولون و بزرگ شدن مری تظاهر نماید.
علائم شاگاس حاد پس از دوره کمون 20 تا 40 روزه ظاهر میگردد. تب یکی از شایعترین و گاهی تنها علامت بیماری حاد است که گاهی با لنفادنوپاتی و بزرگی طحال و کبد بروز میکند. آریتمی قلبی، کاهش برونده قلبی و تجمع مایع در پریکارد نیز ندرتاً دیده میشود. ابتلای سیستم اعصاب مرکزی میتواند با علائمی مثل تشنج، میوکلونوس و خستگی همراه باشد. مننژیت و مننگوآنسفالیت نیز ندرتاً در افراد دچار ضعف سیستم ایمنی دیده میشود. در عین حال حدود 20% افرادی که به علت تزریق خون مبتلا شدهاند ممکن است بدون علامت باشند و این دوره بدون علامت تا زمانی که بیماری به فرم مزمن تبدیل شود ادامه مییابد. فاز مزمن بیماری شاگاس معمولاً سالها و حتی دههها بعد ممکن است بروز نماید که با کاردیومیوپاتی، بزرگ شدن معده و مری همراه است.
در مناطق آندمیک بیمارییابی سرولوژیکی، کاربردیترین روش در پیشگیری از سرایت شاگاس است. در آمریکا بیمارییابی با گرفتن شرححال از اهداکنندگان انجام میشود. اگر اهداکنندهای سابقه بیماری شاگاس داشته باشد برای همیشه از اهدای خون معاف میشود. در کل روش مؤثری برای درمان مرحله مزمن بیماری شاگاس وجود ندارد ولی در مرحله حاد، داروی Nifortimex میتواند انگل را از بین ببرد.
شاگاس و انتقال خون
نظر به اینکه قاره آمریکا شامل بیش از 20 کشور مختلف است، طیف وسیعی از اهداکنندگان آلوده در مناطق مختلف مشاهده میشوند که شامل تعداد کمی مانند 0/01% در ایالات متحده تا 60% در بعضی شهرهای بولیوی است. در کالیفرنیا، جایی که 40% اهداکنندگان لاتینتبار هستند تخمین فراوانی در محدوده 0/1 تا 1/1% است. تداوم بررسی، یک کاهش پیشرونده در فراوانی تریپانوزوم کروزی در میان اهداکنندگان خون آمریکای لاتین را نشان داد. سه دلیل اصلی برای این موضوع عبارتند از: بکارگیری برنامههای بهداشتی مؤثر، شهرنشینسازی جمعیت و جایگزین کردن اهداکنندگان دریافتکننده پول با اهداکنندگان داوطلب و نوعدوست.
اگرچه امروزه مراکز انتقال خون بهتری در آمریکای لاتین وجود دارند، هنوز تعدادی از آنها فاقد این برنامههای مؤثر هستند، در نتیجه انتقال خون بهعنوان دومین راه عمده انتقال بیماری شاگاس محسوب میشود.
بهاستثناء پلاسمای لیوفیلیزه و مشتقات خون که تحت روشهای استریلیزاسیون (مانند آلبومین، گاما گلوبولین و کنسانترههای فاکتورهای انعقادی) قرار میگیرند، همه محصولات خون عفونتزا هستند.
تریپانوزوم کروزی در درجه حرارت 4 درجه سانتیگراد به مدت حداقل 18 روز و در حرارت اتاق تا 250 روز زنده میماند. توان زنده ماندن انگل در فراوردههای منجمد تااندازهای کمتر است (تا 24 ساعت).
اگرچه چندین بیمار مبتلا به هموفیلی که فقط با کرایوپرسیپیتیت درمان شدهاند آلودگی داشتهاند، در بسیاری از جاها تزریق خون بهعنوان دومین راه عمده انتقال بیماری شاگاس شناخته شده است. از سوی دیگر آن را میتوان بهعنوان یک راه مهم انتقال در کشورهای صنعتی تلقی کرد (مانند کانادا، ایالات متحده و اسپانیا).
تعداد واقعی موارد گزارششده بهطور آشکار کم برآورد شده است زیرا بیشتر از چند صد مورد تابهحال در منابع ذکر نشده است که بهطور واضح نشاندهنده قله کوه یخ است که یکی از دلایل این موضوع کمبود دانش و آگاهی بهخصوص در مناطق صنعتی و غیرآندمیک میباشد. اگرچه موارد گزارششده در کشورهای نیمکرهی شمالی کاملاً پایین است، مهاجرت شدید اخیر از این کشورها باعث مقداری نگرانی است. در حال حاضر تخمین زده میشود که صدها هزار مهاجر قانونی آمریکای لاتین در ایالات متحده، اروپا، ژاپن و استرالیا ساکن باشند. از سوی دیگر انتظار میرود که تعداد زیادی از این مهاجران آلوده به تریپانوزوم کروزی بوده، برخی از آنها ممکن است دارای درجاتی از تظاهرات قلبی باشند. بیماری شاگاس بهکندی ولی تدریجی تغییراتی را در محدوده جغرافیای خود انجام میدهد و سایر کشورهایی را که تا یک دهه قبل انتظار آن نمیرفت در معرض خطر قرار داده است.
امکان ایجاد عفونت از طریق فرآوردههای خون بستگی به عوامل متعددی مانند میزان خون تزریقشده، نوع انگل، وجود پارازیتمی در زمان اهدا و وضعیت ایمنی گیرنده دارد، بهعلاوه امکان عفونت کاملاً بستگی به انجام آزمایشهای غربالگری در بانکهای خون دارد.
یافتههای بالینی مشاهدهشده در گیرندگان واحدهای آلوده اغلب همانند همان علائم ناشی از عفونت برای انتقال از طریق حشره است. بهجز تورم مشخص پوست، صورت یا پلکها (نشاندهنده محل ورود پارازیت) که در اینجا دیده نمیشود. دوره نهفتگی 20 تا 40 روز متغیراست (محدوده 120-8 روز). تب شایعترین و در مواردی تنها تظاهر بیماری است. لنفادنوپاتی و اسپلنومگالی نیز ممکن است وجود داشته باشد و با همراهی این علائم همیشه باید به بیماری شاگاس در گیرندگان تحت تزریق با خون آزمایشنشده از اهداکنندگان آمریکای لاتین مظنون شد.
یکی از موضوعات کلیدی در ارتباط با یافتههای بالینی در بین اهداکنندگان خون این است که آنها اکثراً بدون علامت هستند. با این وجود آنها را میتوان به گروههای اصلی زیر تقسیم کرد:
- بیماری شاگاس سرولوژیکی: فقط آنتیبادیها یافت میشوند، بدون وجود هرگونه علائم، 60 تا 80 درصد تمام اهداکنندگان آلوده را تشکیل میدهند.
- دوره مزمن نهفته: اهداکننده مقادیری اختلالات احشایی را نشان میدهد که بهوسیله آزمایشهای مختلف تشخیصی (مانند نوار قلب، سیتیاسکن و رادیوگرافی) قابل اثبات است ولی هنوز بدون علامت هستند. نیاز به مراقبت از نزدیک و پیگیری دارند چون در آینده علائم بالینی ایجاد میشود.
اهداکنندگان خون دریافتکننده پول دیگر در برزیل پذیرفته نمیشوند ولی آنها هنوز حدود 40% اهداکنندگان را در بعضی از مناطق آمریکای لاتین (بهخصوص در بولیوی) تشکیل میدهند.
افزایش میزان اهداکنندگان آلوده در ارتباط با سن بالاتر، اهداکننده بار اول و مدت طولانیتر زندگی در مناطق آندمیک است. در مناطق آندمیک و غیرآندمیک، اهداکنندگانی که در مناطق مسکونی آلوده زندگی میکنند یا گزش توسط ساس اظهار گردد باید از اهدا خون منع شوند. بهمنظور شناسایی اهداکنندگان پرخطر در کالیفرنیا پرسشنامههای خاصی استفاده میشود. در 70 نفر از 3492 داوطلب اهدای واجد شرایط که به علت پاسخشان فاقد صلاحیت تشخیص داده شده بودند، 45 نمونه برای آنتیبادیهای تریپانوزوم کروزی آزمایش شدند و 2 نفر پاسخ مثبت داشتند. همین یافتهها در مطالعههای بعدی انجامشده در آمریکای شمالی گزارش گردید.
به علت اینکه برخی از کشورها هنوز دارای فراوانی بالایی از اهداکنندگان آلوده به تریپانوزوم کروزی هستند، اغلب یافتن تعداد کافی اهداکننده غیرآلوده برای تأمین ذخایر موردنیاز خون غیرممکن است، علاوه بر این برخی از این مناطق فقیر و فاقد مراکز خون پیشرفته هستند. همچنین برخی از کشورها دارای فراوانی بسیار کم اهداکنندگان آلوده، هنوز بیماری شاگاس را بهعنوان یک مشکل تزریق خون موردتوجه قرار ندادهاند. همانند مالاریا مشکلات متعددی در رابطه با انتشار جغرافیایی الگوی مهاجرت، تعداد بالای اهداکنندگان بدون علامت، فقدان اطلاعات طبی برای تشخیص صحیح بیشتر موارد بهخصوص درکشورهای پیشرفته و نیاز به اصلاحات فنی برای غربالگری آزمایشگاهی منجر به این شده است که بیماری شاگاس بهعنوان یک مشکل عمده بهداشت عمومی در تمام کشورهای آمریکا باقی بماند. علاوه بر این حتی با حذف کامل عوامل منتقلکننده (ناقلین) بیماری شاگاس بهعنوان یک بیماری زئونوز باقی خواهد ماند. میلیونها نفر قبلاً آلوده شدهاند و نیازمند توجهات طبی در سراسر طول عمر خود هستند. نهایتاً بعضی از بیماران بدون علامت، بانوانی هستند که در سنین باروری قرار دارند؛ یعنی کسانی که به گسترش بیماری از طریق مادرزادی ادامه خواهند داد. با این وجود تلاشهای مستمر در چندین کشور نتایجی مثبت فراهم آورده است.
باکتریها و انتقال خون
اولین مورد مرگ ناشی از آلودگی باکتریایی در انتقال خون در ایالات متحده در سال 1941 و در ارتباط با شرایط ذخیرهسازی برای پلاسما، گزارش گردید. در آن زمان تعداد و نوع واکنشهای انتقال خون در مقادیری به میزان 25% یا بیشتر گزارش شده بود. در سال 1942 احتمال بروز واکنش به علل مختلف تا میزان بالای 50 درصد تخمین زده شد. با گسترش جنگ جهانی دوم به سراسر جهان، میزان کل عوارض انتقال خون بهواسطه باکتریها بالغ بر 8/5 درصد گزارش گردید.
در انتقال خون برای انجام صحیح امور، استانداردهایی تدوین شده است. رعایت دقیق استانداردها از انتخاب اهداکننده تا خونگیری و از خونگیری تا حملونقل، همینطور رعایت اصول صحیح تهیه فرآوردهها، نگهداری و مصرف آنها در کاهش خطرهای مرتبط با انتقال خون، از جمله عفونتهای باکتریایی نقش اساسی را بهعهده دارند.
جمعآوری خون باید بر اساس روشهای استریل و سترون باشد که در این روشها از سیستم بسته سترون و خونگیری از یک محل استفاده میشود. درستی و ایمنی سیستم باید مورد رسیدگی قرار گیرد تا از ورود هرگونه آلودگی به سیستم جلوگیری گردد. خون باید در کیسههای سترون جمعآوری شود. این کیسههای خون دارای مقدار کافی ماده ضدانعقادی میباشند. روی برچسب کیسهها باید نوع و مقدار ماده ضدانعقاد، میزان خونی که میتوان جمعآوری کرد و دمای لازم برای ذخیرهسازی مشخص شده باشد. رهنمودهای شرکت تولیدکننده کیسههای خون در ارتباط با نگهداری، تاریخ استفاده و انقضاء کیسهها باید مورد لحاظ قرار گیرند. پیش از ترخیص، کیسههای خون باید برای اطمینان از درستی دوباره بازنگری شوند. کیسهها باید از نظر سوراخ نبودن مجدداً بررسی شوند. در صورتی که شواهدی مبنی بر نشت، آسیبدیدگی کیسه، هوای اضافی، شک به آلودگی میکروبی یا عوامل منع مصرف دیگر نظیر تجمع پلاکتی، کدورت غیرمعمول، همولیز یا تغییر رنگ غیرطبیعی مشاهده شود، باید از مصرف فرآورده صرفنظر گردد.
بخشهای تولید فرآوردههای خون باید بر اساس مقررات، اصول بهینه تولید (GMP)، عمل نمایند. همچنین دمای محیط آزمایشگاه فرآوری فرآوردههای خون میباید در محدودهای باشد که اثرات زیانبار روی نیمهعمر قابلیت زیستی فرآورده نداشته باشد.
میزان بروز عفونتهای باکتریایی سرایتیافته از راه انتقال فرآوردههای خون بهخصوص در فرآوردههای پلاکت بسیار بیشتر از سایر عفونتهای منتقله از راه تزریق خون است. تخمین زده میشود که از هر 2000 واحد پلاکت، حداقل یک واحد حاوی آلودگی باکتریایی باشد، درحالیکه احتمال انتقال ویروسهای HIV و HCV یک در 2،000،000 واحد تزریقشده، تخمین زده میشود.
اختلاف بین میزان آلودگی باکتریایی فرآوردههای خون با میزان بروز عفونتهای ناشی از تزریق آنها، نشاندهنده آن است که در بسیاری از موارد یا میزان باکتریهای واردشده کافی نبوده تا علائم بالینی ایجاد کند و یا باکتریها در شرایط نگهداری فرآوردهها در یخچال از بین رفتهاند.
غربالگری جهت استریل بودن فرآوردههای خون در صلیب سرخ ژاپن نشان داد که 0/2% فرآوردهها آلودهاند. در یک پایش در هلند نشان داده شد که 5% فرآوردههای خون آلوده بودهاند ولیکن این میزان در فرآوردههای تولیدشده با فیلترهای کاهشدهنده لکوسیت کمتر بوده است. در این مطالعه، شایعترین ارگانیسم جداشده استافیلوکوک اپیدرمیدیس بود. بر اساس اطلاعات محدود بدستآمده در ایالات متحده آمریکا، میزان بروز آلودگیهای باکتریایی فرآوردههای خون، یک در 5000 کیسه پلاکت و یک در 30،000 واحد گلبول قرمز برآورد میشود.
یکی از مهمترین عوامل مؤثر بر میزان آلودگی، طول مدت نگهداری و ذخیرهسازی فرآورده است. در یک مطالعه که بر روی پلاکتهای پولد (کیسه پلاکتی که از مخلوط کردن 6 واحد پلاکت معمولی تهیه میشود) بیش از 30000 اهداکننده بهصورت تصادفی انجام شد، میزان بروز آلودگی در واحدهایی که کمتر از چهار روز ذخیره شده بودند در مقایسه با واحدهای پنج روزه بسیار کمتر بود (1/8 در مقابل 11/9در ده هزار واحد). در میان فرآوردههای آلوده نیز شدت آلودگی در فرآوردههایی که کمتر از چهار روز نگهداری شده بودند نیز کمتر بود.
به علت تفاوتهایی که در تعاریف استفاده شده، همچنین معنای موارد گزارش گردیده و احتمالی که وجود دارد، میزان بروز بالینی عفونتهای باکتریایی منتقله از راه خون (TTBI) بسیار متفاوت است. همچنین خطر بروز بالینی TTBI هم به نوع فرآورده خون مصرفشده و هم به بیماری زمینهای بیمار گیرنده خون بستگی دارد. تزریق پلاکت خطر آلودگی بیشتری دارد زیرا این فرآورده در دمای اتاق نگهداری میشود. در مقایسه با تزریق گلبول قرمز، میزان موارد TTBI در تزریق پلاکت سه برابر، پلاکت پولد دوازده برابر و پلاکت فرزیس 5 تا 5/5 برابر بیشتر است. در یک مطالعه در ایالات متحده دیده شد که میزان موارد عفونتهای باکتریایی منتقله از راه خون به ازای هر میلیون واحد تزریق شده به ترتیب 0/2، 10 و 10/6 برای واحدهای گلبول قرمز، پلاکت اهداکننده منفرد و پلاکت پولد است. همچنین میزان بروز حملات سپتیک شدید به دنبال تزریق فرآوردههای خون، یک به ازای هر 50/000 واحد پلاکتی تزریقشده و یک به ازای هر 500/000 واحد گلبول قرمز تزریقشده برآورد شده است.
در برخی گروههای جمعیتی پرخطر، مانند گیرندگان پیوند سلولهای بنیادی، احتمال بروز TTBI افزایش مییابد. این موضوع در یک مطالعه آیندهنگر بر روی 161 فرد گیرنده پیوند سلولهای بنیادی که برای آنها 3584 بار پلاکت تزریق شده بود، دیده شد. یک مطالعه نشان داد که خطر بروز TTBI در بیمارانی که برای درمان پانسیتوپنی یا ترومبوسیتوپنی تحت تزریق گلبول قرمز قرار میگیرند در مقایسه با خطر ناشی از تزریق گلبول قرمز برای درمان آنمی بیشتر است.
واکنشهای عفونی بهوجود آمده در ارتباط با تزریق واحدهای گلبول قرمز شدید بوده، با یک میزان مرگومیر بالا همراه میباشد. دمای بالای 38 درجه سانتیگراد، لرز و کاهش فشارخون معمولاً در طی تزریق بوجود آمده و علائمی چون تهوع و استفراغ، تنگی نفس، اسهال، شوک سپتیک، الیگوری (کاهش میزان ادرار) و انعقاد منتشره داخل عروق (DIC) از دیگر عوارض میباشند. واکنشهای حادی که در اثر تزریق خون آلوده با ارگانیسمهای Gram منفی و بهویژه یرسینیا آنتروکولیتیکا ایجاد میشوند ناشی از آندوتوکسین بوجود آمده در چنین فرآوردههایی میباشد. تولید آندوتوکسین در واحدهای گلبول قرمز و تزریق آن به دریافتکنندگان منجر به آزاد شدن مقادیر زیادی سیتوکین مانند فاکتور نکروزدهنده تومور (TNF) میگردد که مدیاتور مهمی در بیماریزایی شوک محسوب میشود. در بررسی واکنشهای گزارششده به دنبال تزریق چنین واحدهای آلودهای دیده شده که واحدهای گلبول قرمز بیشتر از 21 روز نگهداری شده بودند. در چنین حالتی امکان حضور تراکم بالایی از باکتری و آندوتوکسین در واحدهای گلبول قرمز ممکن میشود.
بیشتر موارد گزارش شده از عوارض عفونی ناشی از تزریق واحدهای پلاکت آلوده به عوامل باکتریایی است که به واکنشهای شدید منجر میشود. در موارد گزارششده از سپسیس مرتبط با تزریق واحدهای پلاکت، بیماران علائم تب و افت فشارخون را از خود نشان میدهند. لرز در طی تزریق یا به فاصله زمانی کوتاهی پس از تزریق شروع میشود. بهطور نادر ظهور علائم به دو هفته پس از تزریق به تأخیر میافتد. میزان مرگومیر ناشی از تزریق پلاکتهای آلوده با عوامل باکتریایی، تقریباً 25% است. بیشترین واکنشها زمانی به وقوع میپیوندد که بیش از 3 روز از زمان نگهداری پلاکتها گذشته باشد.
مطالعات گذشتهنگر نشان میدهد که اکثر دریافتکنندگان پلاکتهای آلوده، علائمی مانند تب و لرز را نشان نمیدهند. این واکنشها ممکن است از نظر بالینی با واکنشهای تزریق غیرهمولیتیک از نوع تبدار قابل افتراق نباشند، از این رو ممکن است میزان واقعی شیوع آلودگیهای باکتریایی پلاکتها درست تخمین زده نشود.
گزارشهایی نیز وجود دارد که نشان میدهد بیمارانی که کرایو یا پلاسمای ذوبشده در یک بنماری آلوده را دریافت کرده بودند، چند روز بعد دچار زخمهای عفونی، اندوکاردیت و سپتیسمی با چندین ارگانیسم غیرمعمول شدهاند.
در مورد سلولهای بنیادی خون محیطی قابل ذکر است که گرچه مطالعات انجامشده نشان داد که در حدود 4/5% این سلولهای جمعآوریشده، از نظر کشت باکتریایی مثبت بودند، بااین حال هیچ عارضه مضری از ترزیق آنها گزارش نشد، زیرا دریافتکنندگان آنها اغلب درمان آنتیبیوتیکی مناسب و پیشگیریکنندهای را در حین تزریق دریافت کرده بودند.
پیآمد بالینی آلودگی باکتریایی اجزای خون در یک محدوده از حداقل واکنش یا بدون واکنش تا یک شوک سپتیک میباشد. عوامل مؤثر در شدت تظاهرات بالینی عبارتند از:
- آندوتوکسینهای حاصله از باکتریهای Gram منفی
- عوامل تسریعکننده رشد باکتریها
- مقدار باکتری واردشده
- زمان ذخیرهسازی، بیشتر از 21 روز برای گلبولهای قرمز و بیشتر از 3 روز برای پلاکتها
- حجم فرآورده
- ویژگیهای میزبان (مصرف آنتیبیوتیک، شدت ضعف سیستم ایمنی، سن و وضعیت سلامت)
میکروارگانیسمهای واردشده به درون بدن از طریق انتقال خون، معمولاً بهسرعت پس از برهمکنش با اجزای پلاسما مانند کمپلمان پلاسما و آنتیبادیها بهخصوص توسط سلولهای سیستم رتیکولواندوتلیال بهویژه ماکروفاژهای درون بافت کبد و طحال، همچنین توسط سلولهای نوتروفیل در حال گردش از میان برداشته میشوند. بااینحال هنگامی که باکتری درون فرآوردههای خون (که فاقد مکانیسم دفاعی اصلی این ماکروفاژهای بافتی است) در حال تکثیر و چند برابر شدن میباشند، نهتنها تعداد افزونتری ارگانیسم تزریق میگردد، بلکه احتمال تولید محصولات جنبی متابولیکی نظیر آندوتوکسین هم وجود دارد که این عوامل خود منجر به تشدید بیماری و حتی مرگ ناشی از دریافت اجزای خون آلوده میشود.
منابع آلودگیهای باکتریایی در طب انتقال خون
علل احتمالي مسبب آلودگي خون و اجزاء آن مختلف هستند. اين عوامل دربرگیرنده اهداكننده خون، مراحل جمعآوری و بستهبندی و آمادهسازی فرآوردههای خون میباشند.
با وجود عوامل مختلف مرتبط با آلودگي خون، امروزه اين باور وجود دارد كه علت اصلي آلودگي باكتريايي خون و اجزاي خون به اهداكننده برمیگردد؛ چه از راه پوست به هنگام خونگیری، چه در اثر يك باكتريمي نهفته گذرا و چه از طريق يك عفونت مزمن تحت حاد فاقد علامت در لحظه اهداي خون. هر از چندگاه سيفليس منتقلشده از راه تزريق خون تازه (كه از اهداكنندگاني كه بهتازگی رابطه جنسي داشتهاند، تهيه گرديده) نيز گزارش شده است.
اخيراً يك گزارش مستند از كانادا، بر دخالت دستکاریهای دندانپزشكي بر آلودگي باكتريايي خون صحه نهاد، بهخصوص كه دربرگيرندة میکروارگانیسمهایی همچون استرپتوكوكوس ميتيس و استافيلوكوكوس اپيدرميديس) بود كه در حفره دهاني بهطور شايع حضور دارند. محققان دیگر تعداد دیگری از منابع را براي باكتريميهاي گذرا شرح دادهاند، از جمله انجام سيگموئيدوسكوپي، دستكاريهاي دستگاه ادراري و تناسلي، عفونتهای دستگاه ادراري، قاعدگي و آميزش جنسي (بهخصوص در خانمهای دچار باكتريوري يا بیماریهای التهابي لگن). آنها نتيجه گرفتند كه جراحت و صدمه جزئي به غشاهاي مخاطي احتمال دارد كه منجر به باكتريمی شود.
يك منبع ديگر آلودگي، حوادث يا آلودگیهای غیرعمدی هستند كه در حين خونگیری يا فرآوري خون رخ میدهد. گزارش شده است که لبه معيوب دستگاه درزگيرندة حرارتي یا سیلر ممكن است مسبب آلودگي سودومونایی (سودوموناس فلورسنس) در کیسههای خون و فرآوردههای آن بوده باشد.
مطالب مندرج در تحقیقات پیشین منابع آلودگي باكتريايي بيشتري را معرفي کردهاند؛ اين موارد عبارتند از: فضاي اتاق خونگیری، مكيده شدن هواي اتاق به درون بطریهای خونگیری از طريق سوزن، ورود آلودگي به علت محكم نبودن درب بطریهای خونگیری، استفاده تصادفي از سرنگهای آلوده، استفاده از مايع غيراستريل جهت نگهداری درپوشهای پلاستيكي بطریهای شیشهای، آلوده بودن محلولهای مختلف و گازپدهايي که آغشته به الكل يا ساير محلولهای شيميايي شده باشند، سوزنهای مورد استفاده جهت ايجاد بیحسی موضعي در محل سوزن زدن، برگشت جريان از لولهها يا سرنگهای آزمايش غيراستريل، درهمريختن بطریها و خالي كردن آنها در يك سيستم باز، استريليزه كردن غلط بطریها، آلودگي در حين جداسازي فرآوردهها و بالا بودن دماي يخچال.
باكتريمي در اهداکننده (سابقه)
انحصاري بودن منبع تهيه خون بهصورت اهداي داوطلبانه يك انسان به ديگري، نگرانیهای خاصي را ايجاد میکند كه براي هيچ نوع داروي تجويزي ديگري وجود ندارد. يك اهداكننده خون نهتنها بايد در لحظه اهداي خون سالم باشد، بلكه بايد در ضمن مصاحبه با پزشك بهدقت سابقه پزشكي خود را بياد آورده و بازگو نمايد. مدتها قبل در سال 1935 نگرانیهایي در مورد قابل اعتماد بودن اطلاعات اهداكننده خون ابراز شد. براي مؤثر و کارآمد بودن تشخيص يرسينيا، يك اهداكننده خون ممكن است نياز به اين داشته باشد كه دفعات اسهال خود را در روزهاي اخير بياد آورده و گزارش كند، معضلي كه خيلي از ما ممكن است از آن غافل شويم.
ساير باکتریهای قابل انتشار از طريق انتقال خون نظير ترپونما پاليدوم، گونههای بروسلا، بورليا بورگدورفري و ريكتزيا ريكتزي خطرات درازمدتتری را نسبت به باکتریهایي كه اثراتشان عموماً بلافاصله در حين تزريق آشكار و مشخص میشود، بدنبال دارند. دور ماندن از عوارض احتمالي اين میکروبها، تقريباً فقط بستگي به ميزان صحت اطلاعات ارائهشده از سوي اهداكنندگان خون دارد، با اين همه در صورت عدم اطلاع يك اهداكننده خون از عواملي كه ممكن است منجر به آلودگي باكتريايي خون وی شود، هيچ روش استاندارد مصاحبهای وجود ندارد كه اين خطر را مرتفع سازد.
اهداكننده خون امروزه با سؤالاتي در رابطه با رفتار شخصیاش مواجه است كه يك دهه قبل فكر آن نيز به ذهنش خطور نمیکرد. تفحص روي مشكلات اخير مربوط به سلامت و بهداشت كه منجر به معافيت موقت براي اهداي خون شود، ممكن است موجب يك واقعيتگريزي قابل توجه در يك اهداکنندهی عادي گردد. با توجه به اینکه تبعات و عواقب معافيت يك فرد در زماني كه او با هم سن و سالان خود براي اهداي خون مراجعه كرده، ممكن است وي را جزو مظنونين به ارتكاب رفتارهاي مرتبط با بيماري ايدز قرار دهد، لذا اين احتمال وجود دارد كه تنها تعداد اندكي از اهداكنندگان خون انصراف خود را بهواسطه ناراحتیهای خفيف گوارشي اعلام نمايند. اين وضعيت مسلماً موقعي كه دوستان شخص دنبال اين را میگیرند كه كدام يك اهداي موفقي داشتهاند، تشديد میشود.
بهطور معمول بيشتر افرادي كه دچار باكتريمي هستند، فاقد علائم باليني میباشند. چنين افرادي نمیبایست بهعنوان اهداكننده خون پذيرفته شوند. در بسياري از كشورها از جمله كانادا و ايالات متحده آمريكا درجه حرارت بدن فرد اهداكننده در هنگام مراجعه بايد كمتر از 37/5 درجه سانتي گراد باشد تا بتواند خون اهدا كند.
اهداكنندگاني كه در مرحله بدون علامت و يا در مرحله نقاهت يك عفونت دستگاه تنفس فوقاني و يا گاستروانتريت قرار گرفتهاند، میتوانند در بروز آلودگي باكتريايي مؤثر باشند. همچنين علائم گوارشي در اهداكنندگان اتولوگ از نظر يرسينيا انتروكوليتيكا نيز بايد در نظر گرفته شود. گزارش يك مورد سپتيسمي ناشي از استافيلوكوكوس اورئوس در يك فرد كانادايي كه پلاكت دريافت كرده بود و احتمال میرفت منشأ آن سپتيسمي اهداكننده پلاكت بوده باشد، قابل توجه است. يك مرد 76 ساله مبتلا به ميلوديسپلازي بهخاطر بروز تب سه روز بعد از تزريق 5 واحد پلاكت در بيمارستان بستري شده بود. واحدهای پلاكتي مذكور از اهداكنندگان تصادفي تهيه و از قبل ذخيره شده بودند، همچنين تمامي واحدهاي پلاكتي جهت كاهش لوكوسيت فيلتر شده بودند. فرد مذكور از قبل تحت درمان خاصي قرار نگرفته بود و هیچگونه علائمي را در طي تزريق پلاكت و بعد از آن نداشت؛ اما سه روز بعد از تزريق واحدهاي پلاكتي پولد، دچار شوك سپتيك شد و فوت كرد. کشتهای خون بهعملآمده از نظر استافيلوكوكوس اورئوس مثبت شدند.
در بررسي واحدهاي پلاكتي كه بهصورت پولد تهيه شده بود مشخص گرديد كه يكي از واحدها كه 4روز قبل از تزريق خون تهيه گرديده، متعلق به اهداکننده 36 سالهای بوده كه سه روز بعد از اهدای خون با احساس ناخوشي علائم سرگيجه و منگي، حالت تهوع و اسهال در اورژانس تحت مراقبت قرار گرفته، درنهایت يك روز بعد دچار شوك سپتيك شده بود. كشت خون بهعملآمده از او از نظر استافيلوكوكوس اورئوس مثبت شده بود. بررسیهای باليني نشان داد كه فرد مذكور دچار ناراحتي قلبي شده و اكوكارديوگرافي، اختلال دريچه ميترال را نشان داد پس از يك دوره درمان و مراقبت ويژه، يكي از بستگان او به پزشك معالج وي اطلاع داد که بيمار اخيراً خون اهدا نموده است.
اين مطلب به واحدهاي پخش خون مراكز انتقال خون كانادا اطلاع داده شد و در نهایت اين مراكز كوشش خود را براي كنار گذاشتن فرآورده پلاكتي تهيهشده از بيمار مذكور اعمال نمودند. استافیلوکوکوس اورئوسهاي جداشده از فرد اهداكننده و دریافتکننده مورد آزمايش حساسيت آنتیبیوتیک و تعيين نقشه ژنتيكي قرار گرفتند. نتايج بدستآمده نشان داد كه میکروبهاي موردنظر از يك منبع بودهاند.
اهداكنندگان مبتلا به ترپونما پاليدوم (عامل سيفليس) میتوانند بدون علامت بوده و آزمايش سرولوژي غیراختصاصی براي اثبات وجود سفليس در طي زمان حضور اسپيروكت در خونشان منفي باشد. اسپيروكتهاي عامل سيفليس بعد از چند روز ذخیرهسازی در 4 درجه سانتیگراد غيرفعال میشوند، اما در موارد نادری انتقال اين عامل از طريق خون ذخيرهشده براي كمتر از 24 ساعت، گزارش شده است. گاهي مواردي از آلودگیهای باكتريايي به علت باكتريمي خفيف در اهداكنندگان گزارش گرديده است. وجود چنين باكتريميهايي بيشتر در ارتباط با عفونت مزمن يا بروز يك باكتريمي بدنبال ترميم دندان بوده است.
نقص يا آسیبدیدگی کیسهها و ظروف نگهداری
صدمات و عيوب بوجود آمده در هنگام تولید کیسهها، ممكن است سبب ايجاد سوراخهای كوچك در آنها شود. در ژوئن 1991 در كشورهاي دانمارك و سوئد شش مورد سپتيسمي بدنبال تزريق خون گزارش شد كه عامل آن سراشيا مرسسنس بود. 5 مورد از اين سپتيسمیها ناشي از تزريق کیسههای خون و يك مورد ناشي از تزريق كيسه پلاكتي بود. به غير از اين 5 مورد، موارد ديگري از سپتيسمي نيز شناسايي شدند. تمامي اين حوادث مربوط به کیسههای توليدي در کارخانهای واقع در بلژيك بود. يكسان بودن گونه سراشيا مرسسنس جداشده از هر گيرنده، با باکتریهای کشتشده از 0/3% تا 1/5% واحدهاي خوني جمعآوریشده در طي اين دوره زماني و باکتریهای بدست آمده از غبار كارخانه قابل توجه بود.
فرض بر اين است كه سراشيا مرسسنس سطح خارجي کیسههای خون را آلوده كرده بود. کیسههای خون همچنين داخل يك پاكت پلاستيكي تميز اما غيراستريل قرار داشتند. سراشيا مرسسنس بهخوبی در 4 درجه سانتیگراد و 22 درجه سانتیگراد حتي تحت شرايطي كه مواد غذايي كمي در دسترس باشد، رشد میکند. اين ميكروب قادر است قسمتي از كيسه خون را بهعنوان منبع كربن مورد استفاده قرار داده، به داخل آن نفوذ كند. علاوه بر آلودگي خارجي کیسههای خون، باکتریها احتمالاً در زمان اهدای خون از طريق مكش به داخل سرنگ، يا از طريق آلودگي دستهای فرد خونگیر و متعاقب آن پوست، میتوانند باعث آلودگي کیسههای خون گردند.
برخي خطرات خاص كه در حين تهيه اجزاي خوني سبب آلودگي ميكروبي آنها میگردد شامل آسیبدیدگیها و سوراخهای ريز بوجودآمده بر روي كيسه میباشند كه به طرق مختلف از جمله در هنگام درزگيري كردن لولهها و يا از طريق تماس كيسه با لبههای تيز موجود بر روي تجهيزاتي مانند روتاتورها یا اکستراکتورها و يا حتي سبدهاي سانتريفيوژ، بوجود میآیند. وجود سوراخ و درز در جدار کیسهها میتواند معبري براي ورود باکتریها به داخل کیسهها باشد. دو مورد از آلودگي باكتريايي در سوئد مربوط به سوراخ شدن محل درزگيري شده در لولههاي کیسههای خون بود كه باعث ورود باكتري به داخل کیسهها گرديده بود.
در سال 1995 انجمن ملي خون در انگليس به خاطر درزگیریهای معيوب در برخي از کیسههای خون 7000 كيسه خون خود را معدوم كرد. در 1996 در ايالات متحده چندين مورد سپتيسمي ناشي از انتروباكتر كلواكه گزارش گرديد كه با ويالهاي آلبومين صدمهدیده در طي حملونقل در ارتباط بود. اين امر باعث شد كه 10 قسمت از آلبومين و يك قسمت از فاكتور VIII انعقادی بهوسیله كارخانه توليدكننده دور ريخته شود.
بررسی میزان نسبت خون کراسمچ شده به تزریق در زنان باردار
اصول بهینه تولید ویژه مراکز انتقال خون (6)
آلودگی باکتریال فرآوردههای خون (13)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام