تشخيص باليني و آزمايشگاهي هپاتيتهاي ويروسي
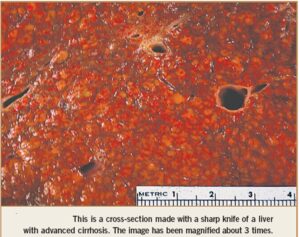
سيروز پيشرفته كبدي
دکتر علیرضا پوررضا (DCLS)
مقدمه: هپاتيت به التهاب كبد گفته ميشود كه علت آن ميتواند عوامل توكسيك (همانند سموم و مواد آسيبرسان به كبد) و يا عوامل عفوني ويروسي باشد. گذشته از علت اوليه هپاتيت، مواد توكسيك ميتوانند اثر عوامل عفوني را تشديد كنند: از جمله ميتوان الكل را نام برد كه مصرف مقادير كم آن در طي عفونتهاي ويرال سبب آسيبهاي جدي كبد خواهد شد. درنوشته پيش رو به اختصار به هپاتيتهاي ويروسي ميپردازيم به اميد آنكه از نظرات ارزشــــــمند شما بهره مند گرديم.
نمایی از ویروس هپاتیت B
سیروز کبدی پیشرفته
هپاتیت (HBV) B
ويروس هپاتيت (B (HBV وابسته به گروه هپادناويريده (Hepadnaviridea) ميباشد.كه در آن Heapa به معني كبد، DNA نشانه ماهيت ژنومي ويروس وviridea به معني ويروس ميباشد. اعضاي اين گروه سبب عفونتهاي كبدي در ميزبان ويژه خود ميشوند كه ميزبان اصلي HBV انسان است.
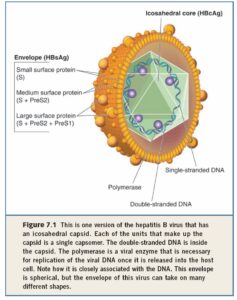
هپادناويريدهها داراي ژنوم و DNA و غير معمول به شكل دورشتهاي گرد ميباشند ( شكل روبرو). ژنوم كوچك بوده و حدود 3200 باز ميباشد، بنابراين ويروس تعداد كمي از پروتئينها و آنتيژنها را ميسازد. چهار جايگاه ژنومي به نام”چهارچوب خواندن باز” ياORF شناخته شده است.
- ORF-C: آنتيژن هستهاي ياHBcAg را كد ميكند كه نقش آن نوكلئوتيد محافظ اطراف ژنوم ويروس است.
- ORF-S: آنتيژن سطحي ياHBsAg را ميسازد. اين آنتيژن از سه پروتئين كوچك (S)، متوسط (M) و بزرگ (L) تشكيل شده است. پروتئين بزرگ خودش از سه قسمت ديگر بنام S – Pre S2 – PreS1 تشكيل شده است. قطعه متوسط نيز از دو قطعه Pre-s2 و S تشكيل شده و قطعه كوچك فقط دارايS است. حاصل اين قطعات پروتئينهاي سطحي ويروس هستند كه در اطراف لايه نوكلئوكسپيد قرار دارند و به صورت جوانههايي از غشائ ليپيدي دو لايه بيرون ميزنند.
- ORF-P: آنزيم پليمراز را كد ميكند. اين آنزيم فعاليت DNA و RNA پليمرازي دارد.
- ORF- X: آنتي ژن X را كد ميكند كه فعال كننده ترانسكريپشن ميباشد و به نظر ميرسد در فعاليتهاي كارسينوژن در گير هست.
سيكل تكثيري HBV در ميان ويروسهاي پاتوژن انساني بيهمتا است. ويروس پس از چسبيدن به رسپتور خودش در سطح سلول و رفتن به درون سلول، پوشش ژنوم خودش را برداشته و در اولين قدم ساخت رشته DNA مثبت را آغاز ميكند. تعدادي RNA نيز از روي DNA ساخته ميشود كه براي ساخت پروتئينهاي ويروسي كه در بالا ذكر شد بكار ميرود. همچنين يك RNA كامل از روي كل ژنوم با طول 3/5 كيلوباز ساخته ميشود. اين RNA به همراه پليمراز ويروسي در داخل پروتئينهاي جديد ساخته شده، قرار ميگيرد و تشكيل ذره ويروسي جديد و نابالغ را ميدهد. اين ذره پس از ساخت DNA دورشتهاي از روي RNA به كمك آنزيم ترانسكريپتاز معكوس به بلوغ ميرسد.
ورود و گسترش ویروس در بدن
HBV از راه تناسلي و يا تزريق خون وارد بدن ميزبان ميشود. پس از آن ويروس از راه خون به سلولهاي كبدي ميرسد. ويروس پس از تكثير در داخل سلول كبدي از آن خارج شده و به سلولهاي مجاور كبدي حمله ميكند. به هنگامي كه ويروس از سلول خارج ميشود قسمتي از آن به جريان خون راه يافته و ميتواند به هر عضوي از جمله ترشحات دستگاه تناسلي برود.
انتقال ويروس از فردي به فرد ديگر
HBV از سه را منتقل ميشود:
- انتقال از مادر به فرزند يا انتقال عمودي: نوزاد به هنگام زايمان در تماس با ترشحات دستگاه تناسلي يا از طريق خون مادر آلوده ميگردد. در مقياس جهاني اين روش عمده ترين روش انتقال است. بيش از 90 درصد نوزادان مادران الوده به اين ويروس مبتلا ميشوند.
- انتقال جنسي: در هر دو جنس ترشحات سمينال و ژنيتال حاوي ويروس ميباشد. بنابراين تماس جنسي حفاظت نشده سبب انتقال ويروس خواهد شد، به ويژه در افراد هموسكسوال كه احتمال تماس با خون نيز زياد است.
- انتقال مستقيم ويروس از خون به خون: كه بين خويشاوندان نزديك يا (parenteral transmission) و يا از راه تزريق خون و فراوردههاي آن انجام ميشود. ازآنجا كه در روند زندگي طبيعي به جز هنگام زايمان تماس بين خون دو انسان بندرت انجام ميشود، انتقال از اين دست زائيده رفتار انسان است كه مهمترين آن انتقال خون است. اگر خون دهنده به ويروس آلوده باشد تزريق آن سبب آلودگي گيرنده ميشود. از راههاي رايج ديگر، استفاده از سرنگ مشترك، تماس با سوزن آلوده در خالكوبي و سوراخ كردن گوش و بدن و همچنين طب سوزني، رفتن سرسوزن به بدن كاركنان بهداشتي (needle stick) و يا استفاده مشترك از ماشين اصلاح و مسواك را ميتوان نام برد.
اپيدميولوژي: برآورد سازمان بهداشت جهاني وجود بيش از 300 ميليون حامل ويروسHBV در جهان است كه البته ميزان كاريرها در نقاط مختلف يكسان نيست. بر اين اساسWHO كشورها را به سه گروه تقسيم ميكند. كشورهاي با شيوع بالا كه بيش از 8 درصد كارير دارند، شيوع متوسط بين 2 تا 8 درصد و شيوع پايين كمتر از 2 درصد. از كشورهاي با شيوع بالا ميتوان چين، ژاپن، كشورهاي جنوب شرقي آسيا، صحراي آفريقا و آمريكاي جنوبي را نام برد كه شيوع ممكن است از 20 درصد هم فراتر رود. كشورهاي آمريكاي شمالي و USA از شيوع پاييني برخوردار هستند و حاملين در انگلستان حدود 0/1 درصد است.
براساس يافتههاي بالا براي روشهاي انتقالHBV ميتوان ليستي از افراد با ريسك بالا را تنظيم كرد (جدول 1). شناخت ريسك فاكتورها در تعيين سياستهاي غربالگري HBV و واكسيناسيون كمك كننده است.
جدول 1
پاتوژنز بيماري
- ايمني ذاتي: در شروع عفونت كبدي پاسخ ذاتي القاء ترشح انترفرن (INF) و فعاليت هاي سلولهاي كشنده طبيعي NK- cells ميباشد. آزادسازيINF در محل سبب چسبيدن آن به سلولهاي منطقه شده و پاسخ سلولها به آن مقاومت در برابر ابتلاي به ويروس است.
- ايمني اكتسابي: ويروس آنتيژنهاي متعددي را ميسازد. علاوه بر HBsAg و HBcAg، گروه سومي از آنتيژنهاي مهم بنام آنتيژنهاي e يا HBeAg وجود دارند. HBeAg محلول است و از سلولهاي آلوده رها ميشود. HBeAg از روي ژنومي كه آنتيژنهاي هستهاي را ميسازند كد ميشود. در افراد ايمن شده، ايمني اكتسابي سبب توليد انواع آنتيباديها عليه آنتيژنهاي ويروسي ميشود. اين آنتي باديها به طور روتين در آزمايشگاهها مورد بررسي قرار ميگيرند و شامل آنتيباديهاي عليه سطح هسته و آنتي ژن c ميباشند كه به ترتيب Anti-HBs و Anti-HBc ناميده ميشوند. آنتي HBs بويژه خيلي اهميت دارد زيرا به ميزبان كمك ميكند به عفونت ويروسي غلبه كرده و سبب پاكسازي ويروس ميشود. اين آنتيبادي سبب خنثي كردن ويروسهاي جديد آزاد شده از هپاتوسيتها ميشود. از طرفي پاسخ ايمني سلولي سبب توليد لمفوسيت هاي CD8+ بنام CTLها ميشود كه در كبد به كمك سيستم HLA كلاس يك موجب كشته شدن سلولهاي كبدي آلوده به ويروس ميگردد. بنابراين بيشتر آسيب به هپاتوسيتهاي آلوده به HBV ناشي از پاسخ CTLها در برابر سلولهاي آلوده است. تكثير HBV داخل سلولي به تنهايي خاصيت سيتوليتيك نداشته و نميتواند سبب مرگ سلولهاي آلوده باشد.
نشانههاي باليني
نماي باليني HBV متفاوت است. حدود 55% آلودگي به HBV بدون علائم ميباشد و پديدهاي بنام بيماران سرم مثبت بدون علامت (seroconversion) يا هپاتيت سابكلينيكال را ايجاد ميكند. نوزاداني كه از مادر مبتلا ميشوند عليرغم وجود HBV-DNA بالا در خونشان بدون علامت بوده و آنزيم كبدي نرمال دارند. كودكان با سنين بالاتر اگر مبتلا شوند در 15 تا 30درصد موارد علامت دار بوده وALT سرم آنها افزايش مييابد. سيروز كبدي در آنها نادر است ولي مواردي از HCC گزارش شده است. علايم در بيماران با نقص ايمني شديدتر است، حدود ده درصد مبتلايان به HIV به HBV آلوده هستند كه مقادير بالاي HBV-DNA در خونشان وجود دارد. در افراد الكلي آلوده به ويروس، آسيبهاي كبدي زودتر پيدا ميشوند و ريسك سيروز و HCC بالا ميرود.
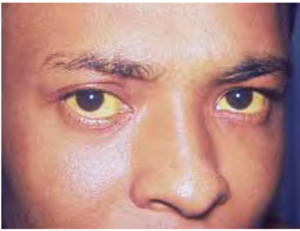
عفونت حاد: اگر آسيب سلولهاي كبدي بالا باشد بيمار علائم هپاتيت حاد را بروز ميدهد. علائم كلينيكي را ميتوان به قبل از زردي يا فاز پريايكتريك و مرحله زردي يا فاز ايكتريك تقسيمبندي كرد. فاز قبل از زردي تا حدودي غير اختصاصي است. بيمار ضعف و خستگي، كاهش اشتها، تهوع، عدم تحمل به سيگار و الكل و همچنين تب را بروز ميدهد. كليد شايد مهمتر درد در ناحيه كبد و يا در قسمت يك چهارم فوقاني راست شكم است. يكي از مهمترين كارهاي کبد خارج كردن پيگمانهاي حاصل از هموگلوبين خون به صورت صفرا و از طريق مدفوع است. بدنبال آسيب كبد اين پروسه كند ميشود و سبب بالا رفتن مقدار پيگمانهاي خون ميشود و بيمار دچار زردي ناشي از افزايش بيلروبين ميگردد، مدفوع سفيد ميشود. زردي در قرنيه بيمار بهتر نمايان ميشود. پيگمانهاي زردي از طريق غشاي كليوي دفع شده و ادرار زرد پررنگ و متمايل به سياه ميشود.
اگرچه هپاتیت بيماري سادهاي نيست و بيماري چندين هفته طول ميكشد ولي بيشتر بيماران بهبود مييابند. گاهي در حدود يك درصد موارد آسيب سلولهاي كبدي زياد است و بيماري به سوي نارسايي حاد كبدي پيش ميرود كه به آن هپاتيت برقآسا ياfulminant ميگويند. در اين حالت ميزان مرگ و مير بيش از 70% است و تنها راه درمان نسبتا موثر پيوند كبد ميباشد.
عفونت مزمن : برخي از بيماران توانايي حذف ويروس را از كبد ندارند، بنابراين به سوي عفونت مزمن ميروند. در اين حالت ويروس در داخل هپاتوسيتها به تكثير و رها شدن در خون محيطي ادامه ميدهد. اين درحالي است كه سبب تخريب سلولهاي كبدي نميشود. اين بيماران سرچشمه آلودگي ساير افراد از راههاي انتقالي كه قبلا به آن اشاره شد ميباشند. فاكتورهاي متعددي در رفتن بيمار به سوي عفونت مزمن دخيل هستند كه از مهمترين آنها ميتوان سن و وضعيت سيستم ايمني را نام برد. بيشتر نوزاداني كه از مادر آلوده ميشوند بدليل سيستم ايمني ضعيف به سوي عفونت مزمن ميروند. حدود 10درصد در سنين كودكي و 5 درصد در سنين بزرگسالي به سوي عفونت مزمن ميروند. ناتواني در رها سازي انتــــــرفرنها ( INF ) در پاسخ به بيماري عامل اصلي عدم پاكسازي ويروس از بدن است. بيماران با نقص ايمني همچون مبتلايان HIV بدليل ضعف پاسخ ايمني سلولي و عملكرد CTLها در پاكسازي ويروس تمايل بالايي را به سوي عفونت مزمن نشان ميدهند.
هميشه حاملين مزمن بدون علامت نيستند. ظرفيت ذخيره عملكرد كبد بالاست بنابراين با وجود هپاتوسيتهاي آلوده به ويروس، كبد وظيفه خودش را انجام ميدهد. ولي در برخي افراد كه مبتلا به هپاتيت طولاني و التهاب مزمن هستند در پاسخهاي ایمنی سلولي، CTLها سبب كشتن هپاتوسيتهاي آلوده ميگردند. نتيجه مرگ سلولي و فيبروز كبدي است. به مرور زمان هپاتوسيتها ميميرند و جايشان بافت فيبروزي مينشيند، در نتيجه به تدريج ساختار و عملكرد طبيعي كبد به هم ميريزد و شرايطي ايجاد ميشود كه به آن سيروز كبدي ميگويند. سيروز كبدي يكي از بيماريهايي است كه منجر به مرگ بيمار ميشود. متوسط زمان شروع عفونت HBV تا رسيدن به سيروز كبدي حدود بيست سال است.
يكي ديگر از درگيريهاي سخت به دنبال عفونت مزمن HBV پيدايش كارسينوماي هپاتوسلولار (HCC) است كه در آن پروليفراسيون بدخيم هپاتوسيتها رخ ميدهد. مكانيزمهاي مولكولي متعددي در آن درگير هستند ولي نقش پروتئين X ويروس HBV كه سبب به هم زدن مكانيزمهاي طبيعي تقسيم سلولي هپاتوسيتها ميشود، امروزه مورد بحث و گفتگو است. در كاريرهاي HBV، كارسينوماي هپاتوسيتها 300 برابر بيشتر از افرادي كه آلوده به HBV نيستند، ديده ميشود. بنابراين در هر جا از دنيا كه شيوع HBV بالاست شيوع HCC نيز به همان اندازه بالا است. HCC چهارمين تومور شايع جهاني است. از نظر زماني HCC حدود 5 سال ديرتر از سيروز كبدي خودش را نشان ميدهد.
از آنجا كه عفونتهاي HBV در نوزادان بيشتر به سوي عفونت مزمن ميرود آلودگي بيمار تا بروز علائم كبدي 20 سال پنهان ميماند كه ميتواند دليل اپيدميولوژي براي شيوع بالاي HBV را در يك قوم و يا يك منطقه خاص توجيه كند. نوزادان دختر به HBV مبتلا ميشوند و تا سن 20 سالگي كه زمان بارداري آنها است هيچ علامتي از آلودگي را نشان نميدهند و آماده انتقال ويروس به فرزندانشان ميشوند. بدين صورت است كه ويروس از نسلي به نسلي ديگر منتقل ميشود و سبب افزايش شيوع HBV در جامعه ميشود.
تشخيص بيماري
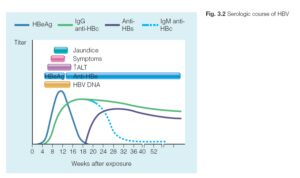
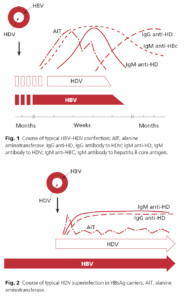
تشخيص آزمايشگاهي وابسته به تعيين ماركرهاي عفونت است(جدول 4 ). سه تست آزمايشگاهی كه آنتيژنها را تشخيص ميدهند HBsAg, HBcAg, HBeAg هستند و آنتيباديهاي عليه آنها Anti-HBS , Anti-HBC- Anti-HBE ميباشند. تست HBV-DNA نيز روش حساس در دسترس است كه امروزه براي تشخيص ژنوم ويروس استفاده ميشود. اولين تست كه انجام ميشود HBsAg خون است. اين پروتئين به مقدار زياد توسط ويروس داخل سلول ساخته ميشود و به سرم راه پيدا ميكند، بنابراين تشخيص آن آسان است. يك تا ده هفته پس از آلودگي HBs Ag مثبت ميشود. بايد توجه داشت وجود HBsAg در خون فقط يك معني دارد و آنهم اين كه در روز نمونهگيري بيمار آلوده به HBV بوده است. اين ماركر نميتواند حالت مزمن يا فعال بيماري را مشخص كند.
تمامي بيماران آلوده شده به HBV در پاسخ به آنتيژنهاي هستهاي، anit-HBC توليد ميكنند. از اين ماركر براي تعيين حالت حاد يا مزمن بيماري استفاده ميشود. نوع IgM در حالت حاد و نوع IgG آن در مزمن ديده ميشود. HBcAg يك آنتيژن داخل سلولي است و در سرم قابل شناسايي نيست، بنا براين تستي به اين نام وجود ندارد. در حدود يك درصد اهدا كنندگان خون در مناطق با آلودگي پايين از نظر HBcAb مثبت هستند، در حالي كه از نظر HBsAg و HBsAb منفي هستند. اين ميزان درمناطق آندميك به 20 درصد نيز ميرسد. اين وضعيت نشانگر ابتلا به ويروس و پاكسازي بعد از يك دوره مزمن بيماري است. اين افراد در برابر HBV حفاظت كامل ندارند.
بيماراني كه عفونت حاد را نشان ميدهند يعني HBsAg و anti-HBC نوع IgM مثبت هستند پس از 6 ماه بايد براي پاكسازي ويروس دوباره آزمايش شوند. در اين حالت HBsAg پس از مدت كوتاهي از مثبت شدن anti-HBS منفي خواهد شد. اگر بيش از 6 ماه از مثبت شدن HBsAg بگذرد، بيمار به عنوان عفونت مزمن شناخته ميشود و اين بدان معني نيست كه تمام اين افراد به بيماريهاي مزمن كبدي مبتلا ميشوند. در اينجا از HBeAg و anti-HBE براي تعيين دو نوع حاملين مزمن كمك ميگيريم. بيماران HBeAg مثبت به شدت عفونتزا هستند و همچنين آمادگي بيشتري براي بيماريهاي مزمن كبدي دارند. HBeAg از ژنوم هستهاي ويروس ساخته ميشود و به عنوان ماركر تكثير ويروس شناخته ميشود. برخي از حاملين HBeAg به مرور زمان از نظر HBeAg منفي ميشوند، بدين معنا كه تكثير ويروس در بدن آنها كاهش مييابد و پس از مدتي HBeAb شروع به افزايش مينمايد. بنابراين حاملين مزمن با HBeAb مثبت توانايي انتقال ويروس را كمتر داشته و همچنين بيماريهاي مزمن كبدي نيز در آنها كمتر ديده ميشود. بايد توجه داشت كه موتاسيونهايي از HBV هستند كه از قوانين كلي بيان شده بالا پيروي نميكنند، بويژه درHBV هايي كه نتيجه موتاسيون، توقف در ساخت HBeAg باشد. در اين بيماران قطعه كامل ويروس ساخته نميشود در حالي كه مقادير بالاي DNA ويروس در بدن آنها قابل تشخيص است، ولي از نظر HBeAg منفي ميباشند. شايعترين موتاسيونها جابجايي A و G در موقعيت 1896 است كه در آن كد كردن پروتئين precore متوقف ميشود. اين موتاسيون در كشورهاي با شيوع بالاي هپاتيتهاي ويروسي همانند كشور خودمان شايع است. ساير موتاسيونها با شيوع كمتر نيز گزارش شده است.
در يك فاصله زماني كه ممكن است هفتهها تا ماهها طول بكشد HBsAg و آنتي HBS هر دو منفي هستند كه به آن پنجره ميگويند. در اين دوره بيمار در حال بهبودي است و براي يافتن رد پاي ويروس از ساير ماركرها استفاده ميكنيم.
امكان مثبت شدن همزمان HBS آنتيژن و آنتيبادي در برخي افراد وجود دارد. علت آن ميتواند ابتلاي فرد به دو زير گروه متفاوت از ويروس باشد. بايد توجه داشت تا زمانيكه HBsAg در آنها مثبت است اين افراد توانايي آلوده كردن ديگران را دارند.
HBsAb در افرادي كه ويروس را پاكسازي كردهاند و همچنين در افردي كه واكسن زدهاند وجود دارد. اندازهگيري تيتر HBsAb در افراد واكسن زده، معيار خوبي براي ميزان حفاظت آنها در برابر عفونت است. HBV-DNA نيز ماركر خوبي براي ارزيابي تكثير و عفونتزايي ويروس است.
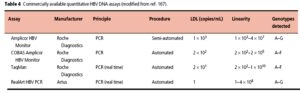
امروزه تعيين ميزان HBV-DNA قسمت ضروري پروتكل درماني بيماران تحت درمان با داروهاي آنتيويرال ميباشد. با روش PCR معمولي يا كلاسيك ميزان حدود 2000 كپي ويروس در ميليليتر را ميتوان سنجيد. در مبتلايان حاد HBV حتي قبل از HBsAg ميتوان HBV-DNA را پيدا كرد. در بيماران با هپاتيت مزمن HBeAg مثبت، لود يا بار ويروس بيش از 100000 كپي در ميليليتر است. در نتيجه PCR آنها مثبت است، در حالي كه در بيماران هپاتيت مزمن با HBeAg منفي بار HBV-DNA كم بوده (متوسط 1000 كپي در ميليليتر) و در نتیجه PCR آن منفي است. در بيماران مزمن با افزايش ALT سرم و HBV-DNA منفي باPCR كيفي (بار ويروسي كمتر از 10000 كپي در ميليليتر)، اندازهگيري كمي HBV-DNA با روش Real-time PCR و فقط با متد Taq Man که از حساسیت تشخیصی 200 کپی در میلیلیتر برخوردار میباشد – لازم است. درمان در مواردي كه بار ويروسي بيش از 10000 كپي در ميليليتر باشد و يا در هپاتيتهاي مزمن با HBeAg مثبت انديكاسيون دارد.
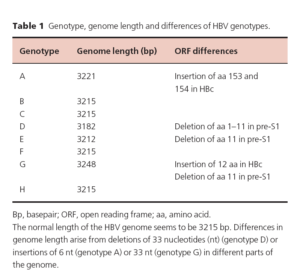
هشت ژنوتايپ شايع براي HBV وجود داردكه با حروف A-G نمايش ميدهند. در آسيا و ايران ژنوتايپ D,B و C شايعتر است. ژنو تايپ C بيشتر سبب آسيبهاي كبدي ميشود، بنابراين افزايش آنزيمهاي كبدي و بار ويروسي در آن بيشتر است.
تشخيص افتراقي:
عوامل زيادي براي هپاتيت حاد وجود دارد، بنابراين تشخيص افتراقي مبتلايان به زردي مطرح است. هپاتيت الكلي نماي مشابه دارد. عوامل عفوني ديگري نيز سبب آسيب سلول كبدي ميشوند. اين سري از ويروسها كه تمايل به عفونتهاي سلولهاي كبدي دارند را با حروف الفباي انگلسيي مشخص ميكنند كه بايد توجه داشت هركدام يك ويروس كاملاًٌَُْ جدا بوده و هيچگونه ارتباطي با يكديگر ندارند. وجه اشتراك آنها عفونت سلولهاي كبدي است.
ساير ويروسهاي هپاتيت
- – ويروس هپاتيت A (HAV)
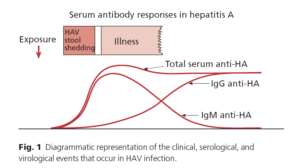
از دسته پيكوآرناويروسها (picornavirus) بوده، بنابراين ژنوم RNA تك رشتهاي دارد. ويروس از طريق مدفوع خارج ميشود بنابراين راه انتقال مدفوع – دهاني است. سه نماي باليني دارد. 1- بيشتر موارد بدون علامت بيماري است كه فقط سرم از نظر آنتي HAV مثبت ميشود. 2- هپاتيت حاد كه از نظر باليني نميتوان آنرا از نوع HBV تشخيص داد و 3- كه خيلي كم ديده ميشود نوع برقآسا يا Fulminant است. شيوع اين حالت از نوعHBV كمتر است. بايد توجه داشت كه عوارض مزمن در HAV وجود ندارد و بيمار پس از بهبودي داراي آنتي HAV بوده و در برابر بيماري مقاوم خواهد شد. تشخيص با سنجش آنتي HAV نوع IgM است.
- ويروس هپايت E (HEV)
هپاتت E نيز از نوع RNA ويروسها بوده و داراي ژنوم غير معمول است بنابراين هنوز در تقسيمبنديهاي شناخته شده ويروسها گنجانده نشده است. از نظر اپیدميولوژي و باليني خيلي شبيهHAV است. راه انتقال مدفوعي – دهاني است. انتقال با شيوع بالا از طريق آب در مناطق آلوده گزارش شده است. مرگ و مير ناشي از HEV از HAV بيشتر است، بويژه در خانمهاي حامله (10درصد) بيشتر است. حامل مزمن در اين نوع نيز ديده نميشود. تشخيص بر اساس يافتن آنتيبادي IgM عليه HEV است. اين تست در آزمايشگاههاي كمتري انجام ميشود.
- ويروس هپاتيت C (HCV )
از دسته فلاو ويروسها است با ژنومي از RNA تك رشتهاي مثبت. از نظر باليني و اپيدميولوژي خيلي شبيه HBV است. انتقال از طريق خون است، بنابراين مصرف كنندگان داروهاي تزريقي و دريافت كنندگان خون و فرآوردههاي آن در معرض خطر هستند. بر خلافHBV انتقال مادر به نوزاد در HCV خيلي كم است (حدود 3 درصد) و شواهد كمي از انتقال جنسي ويروس ديده شده است. آلودگي به HCV نيز به سمت مزمن شدن پيش ميرود و در واقع احتمال آن ازHBV در بالغين خيلي بيشتر است. به عبارتي در حدود 25 درصد عفونتهاي مزمن امكان بهبودي و پاكسازي ويروس وجود دارد و 75 درصد به سمت آلودگي مزمن پيش ميروند. آلودگي مزمن بيمار را آماده براي پيشرفت به سمت سيروز و كارسينوم هپاتوسلولار ميكند. تشخيص در قدم اول تعيين آنتيبادي HCV است كه در واقع مشخص ميكند فرد به HCV آلوده شده است. اگرHCV مثبت بود تست HCV-DNA (تعيين وجود ژنوم ويروس با روش RT-PCR) كمك كننده است. در بيماراني كه ويروس را پاكسازي كردهاند HCV-RNA منفي است. بيمارانيكه همچنان بصورت مزمن آلوده به ويروس هستند HCV-RNA مثبت ميباشند. در بيماراني كه آلودگي همزمان HBV و HCV رخ ميدهد، ميزان HBV-DNA پايين و HCV –RNA بالا است كه نشانگر سركوب تكثير HBV توسط HCV است. علايم باليني و عوارض كبدي در اين موارد بيشتر است .
- ويروس هپاتيت D (HDV)
HDV يك قطعه ناكامل ويروس است و داراي RNA كوچكي بوده كه پروتئين كپسيدي را توليد ميكند و به نام آنتيژن دلتا (Delta Ag) ناميده ميشود. اين ويروس براي اينكه توانايي داخل شدن به سلول كبدي را داشته باشد نياز به يك پروتئين پوششي دارد كه خودش توانايي ساخت آن را ندارد. HBsAg ميتواند نقش اين پروتئين را بازي كرده و به ويروسHDV براي رفتن به داخل سلول كمك كند. بنابراين بيماريزايي HDV فقط در افرادي كه به HBV آلوده هستند (سوپرانفكسيون) و يا (co-infection ) – انتقال همزمان HDV وHBV امكانپذير است. بديهي است كه روشهاي انتقالي با HBV يكسان است.
درمان
درماني اختصاصي براي هپاتيت B وجود ندارد. استراحت و پرهيز از الكل (به عنوان يك سم قوي كبدي) توصيه ميشود. در هپاتيتهاي برقآسا پيوند كبد كمك كننده است. به بيماران حامل HBV بايد آموزش داده شود كه توانايي آلوده كردن ديگران را از راه جنسي و تماس نزديك و استفاده از وسايل مشترك دارند. آنها نبايد خون اهداء كنند و با ترشحات خوني آنها بايد به عنوان ترشحات خطرزا برخورد كرد.
روشهاي درماني بيماران مزمن هپاتيت B در 5 سال اخير تغييرات چشمگيري كرده است. سيكل تكثيري پيچيده ويروس امروزه به خوبي شناخته شده است. در اينجا سيكلي بنام ترانسكرپشين معكوس (RT) وجود دارد كه داروهاي جلوگيري كننده از فعاليتRT امروزه براي مهار تكثير ويروس استفاده ميشوند.
روشهاي درماني به شرح زير است:
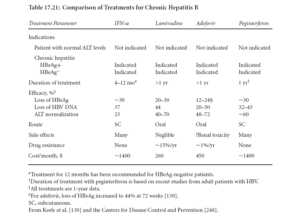
1- انترفرن آلفا: انترفرن آلفا داروي تنظيم كننده سيستم ايمني است نه يك آنتي ويرال. انترفرن آلفا در واقع باعث بروز بيشتر HLA كلاس يك در سطح سلولهاي كبدي شده و به CTLها توان بيشتري براي شناسايي و كشتن هپاتوسيتهاي آلوده به ويروس را ميدهد. لذا اين دارو در بيماران با سيستم ايمني كامـــــــل كه داراي CTLهاي كار آمد هستند، مفيد است. بنابراين در بيماران با نقص ايمني مثل مبتلايان به HIV و نوزادان مبتلا به HBV (اكثر آلوده شدگان) تاثيري ندارد زيرا در اين افراد تحمل ايمني ايجاد شده و سيستم ايمني آنها توانايي شناخت عوامل خارجي ويروس را ندارد. انترفرن آلفا در يك دوره شش ماهه و سه بار تزريق در هفته داده ميشود. شكل داروي جديدتر به بازار آمده كه تركيــــــــــــــــــــــب انترفرن آلفا با پلياتيلنگليكول (Pegylated or PEG-INF) است و سبب افزايش نيمه عمر INF ميشود، بنابراين تزريق هفتهاي يكبار انجام ميشود. طولاني بودن نيمه عمر در PEG-INF سبب افزايش كارآمدي دارو نيز ميشود. از عوارض جانبيINF ها ميتوان برافروخته شدن پوست، دردهاي عضلاني، خستگي و سردرد را نام برد كه البته در بيشتر بيماران ديده نميشود. سركوب مغز استخوان (كاهش شمارش WBC) و تظاهرات رواني همانند افسردگي و حتي تمايل به خودكشي نيز گاهي ديده ميشود.
2- مهار كننده DNA پليمراز ويروسي:
Lamivudine, Adefovir dipivoxil, Entecavir داروهايي هستند كه سبب مهار DNA پليمراز ويروسي و جلوگيري از ازدياد ويروس ميشوند. اين داروها ويروس را نميكشند، بنابراين پس از توقف دارو ممكن است ازدياد ويروس از سر گرفته شود. از طرفي موتاسيونهاي ويروسي در پليمراز نيز سبب مقاومت ميشود. در 75 درصد بيماران كه طي سه سال با لاميوودين تحت درمان بودهاند، مقاومت ديده شده و در مورد آدفووير دي پي ووكسيل و انتهكاوير مقاومت ذكر نشده است. تركيب دارويي ممكن است از مقاومت جلوگيري كند.
انتقال همزمان اين ويروسها ابتلا به هپاتيت برقآسا را افزايش ميدهد. اگر بيمار براي هر دو ويروسHDV و HBV مزمن شود خطر بيماريهاي خطرناك كبدي افزايش مييابد. تشخيص بر اساس يافتن آنتيژن و آنتيباديهاي HDV است.
پيشگيري (Prevention)
مهمترين راه پيشگيري واكسيناسيون با آنتيژن HBS ميباشد. ابتدا به عنوان منبع آنتيژن، HBsAg را از سرم افراد حامل ميگرفتند كه در برخي كشورها هنوز رايج است. امروزه در اروپا و آمريكاي شمالي واكسنها از نوع DNA نوتركيبي است. ژني كه HBsAg را كد ميكند از ويروس جدا كرده و آنرا داخل ژنوم مخمر جاسازي ميكنند. بدنبال تكثير مخمر در محيط كشت مقادير بالاي HBsAg توليد ميشود كه پس از ليز مخمر و خالص سازي، از آن به عنوان واكسن داخل عضلاني استفاده ميشود. واكسن در سه نوبت صفر، يكماه و شش ماه تزريق ميشود. براي تعيين پاسخ واكسن عيار HBsAb ،6 تا 8 هفته پس از آخرين واكسيناسيون سنجيده ميشود. ميزان اثر حفاظتي واكسن وابسته به عيار HBsAb است. در حدود 10 درصد افراد پاسخ به واكسن ديده نميشود يعني تيتر آنتي بادي صفر است. و در حدود 10 درصد نيز پاسخ ضعيف است و اثر حفاظتي آن پايين است. بدون شك توليد واكسن موثر عليه HBV يكي از بزرگترين اهداف پزشكي است ولي در مورد راه رسيدن به آن اختلافاتي وجود دارد. WHO واكسيناسيون HBV را به عنوان ايمونيزاسيون روتين در كودكان توصيه كرده است و بسياري از كشورها از آن پيروي ميكنند. برخي از كشورها نيز گروههاي در خطر را براي واكسيناسيون انتخاب كردهاند.
واكسيناسيون ساير ويروس هاي هپاتيت
واكسن موثري براي HAV وجود ندارد ولي از ويروس كشته شده در برخي موارد استفاده ميشود كه براي كساني كه در معرض ابتلا هستند مثل مسافرين به مناطق آندميك توصيه ميشود.
درمان و واكسن موثري براي HEV شناخته نشده است، تلاشها براي شناخت دارو و واكسن ادامه دارد. در مورد HCV در حالي كه واكسن موثري ندارد ولي درمان بيماران آلوده با موفقيتهايي همراه بوده است.
درمان انتخابي تركيبي از PEG-INF-α و ريباويرين (Ribavirin) خوراكي است. درمان شش ماهه در حدود 50 درصد از مبتلايان به عفونت مزمن سبب پاكسازي ويروس شده است. اگر در حالت حاد بيماري درمان انجام شود، موفقيت بيش از 95 درصد خواهد بود. ولي بايد توجه داشت كه اكثر بيماراني كه به HCV آلوده ميشوند بدون علامت هستند. بنابراين از آلودگي خودشان اطلاعي ندارند.
در حال حاضر براي HDV درماني وجود ندارد ولي واكسيناسيون موثر HBV سبب افزایش حفاظت عليه HDV نيز ميشود.
موارد Seroconstelation تشخيص بيماري هپاتيت B
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام