ایمونوتراپی در بدخیمیهای خونی
اکرم سادات جعفریان۱– اصغر الهی۲
۱- کارشناسی علوم آزمایشگاهی – علوم پزشکی قم
۲- عضو هیئت علمی علوم پزشکی قم
مقدمه:
ایمونوتراپی شکلی از درمان است که از قسمتهای مشخص دستگاه ایمنی فرد برای مبارزه با سلولهای بدخیم، از جمله بدخیمیهای هماتولوژیک استفاده میکند. این عمل به چند صورت انجام میشود:
1- تحریک سیستم ایمنی برای عملکرد بهتر در حمله به سلولهای سرطانی
2- تجویز ترکیباتی مثل پروتئینهای دستساز دستگاه ایمنی به بیمار
یکی از قدیمیترین روشهای ایمونوتراپی در درمان بدخیمیهای هماتولوژیک، SCT[1] آلوژنیک بوده و استفاده از آن رو به افزایش است. در این نوع پیوند، سلولهای بنیادی از فرد دیگری برداشت شده و به بیمار تزریق میشود. این روش به علت ناسازگاری ایمونولوژیک، علیرغم سازگاری HLA دارای مرگومیر قابلتوجهی است. در مقابل، یک اثر دیگر بنام پیوند علیه لوکمی (GVL[2]) نیز وجود دارد که زمینهساز بخش اعظمی از موفقیت پیوند سلولهای بنیادی است. به نظر میرسد دلیل این موفقیت را میتوان با مشاهدات ذیل مرتبط دانست [۲، ۱]
۱) اثربخش بودن پیوند آلوژنیک در بیماریهایی که به شیمیدرمانی مقاوماند [۴، ۳]
۲) در مواقعی که عود بعد از پیوند رخ میدهد، تزریق لنفوسیتهای اهداکننده میتواند مفید باشد [۶، ۵]
۳) بهکارگیری ریزپیوند آلوژنیک (پیوند سلولهای بنیادی و بهکارگیری شیمیدرمانی با دوز پایین و استفاده از مواد سمی کمتر) میتواند در ریشهکنی بدخیمیها مؤثر باشد [۷].
بقای بعد از پیوند آلوژنیک بهطور قابلتوجهی افزایش پیدا میکند [ ۸] که به علت کاهش مرگومیر ناشی از عود و پیشرفت مراقبتهای حمایتی است[ ۹]، با این حال عود بدخیمی شایعترین علت مرگ است که نیاز به مهار سیستم ایمنی بدن دارد.
سلولهای سیستم ایمنی بدن و سلولهای بدخیم در تماس با یکدیگر در سیستم خونی هستند که محیطی برای نظارت ثابت ایمنی ایجاد میکنند. به علت مشابهت سلولهای بدخیم به سلولهای سیستم ایمنی، سلولهای بدخیم نیز میتوانند توسط پاسخ التهابی و شبکه سیتوکینی تحت تأثیر قرار گرفته، فعال شده و برای بدن اثرات زیانباری به دنبال داشته باشند.
آنتیبادی مونوکلونال:
نسخه دستسازی از پروتئینهای دستگاه ایمنیاند که در درمان سرطان بسیار مفید بوده و میتوانند به قسمتهای مشخصی از سلول سرطانی حمله کنند.
Rituximabیک آنتیبادی مونوکلونال ضدCD20 بر سطح B cellها و از نوع آنتیبادی نوع ۱ است و باعث القاء مستقیم آپوپتوز و اپسونیزاسیون شده و در درمان بدخیمیهای سلول B بهکار برده میشود. Oftatumumab نسل دوم از آنتیبادیهای مونوکلونال و ضد CD20 و از نوع ۱ است و به جایگاه متفاوتی نسبت به Rituximab متصل شده و در درمان CLL[3] بهکار میرود.
Obinutuzumabیک آنتیبادی ضد CD20 و از نوع آنتیبادیهای نوع ۲ است و باعث مرگ مستقیم و افزایش سمیت سلولی وابسته به آنتیبادی میشود و هم در درمان لنفوم فولیکولار و هم CLL بهکار میرود [۱۱، ۱۰].
Daratumumab یک آنتیبادی مونوکلونال ضد CD38 و از بازدارندههای پروتئوزومی است که در درمان MM[4] بهکار میرود.
CD38 یک گلیکوپروتئین غشایی است که بهطور گسترده در سطح سلولهای MM بیان میشود. این دارو باعث بهبود ORR[5] (میزان پاسخ کلی)[ ۱۴-۱۲] و کاهش خطر مرگ یا پیشرفت بیماری میگردد [ ۱۶، ۱۵].
Elutuzumab یک آنتیبادی ضد SLAMF7[6](CS1) در درمان MM است.
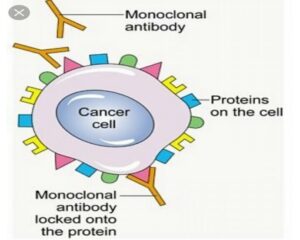
SLAMF7 یک گلیکوپروتئین بر سطح سلولهای MM و NK است و باعث اثرات ضدتوموری از طریق سیتوتوکسیسیتی وابسته به آنتیبادی و افزایش سمیت سلولی سلولهای NK از طریق پیوند SLAMF7 میشود (شکل ۱).
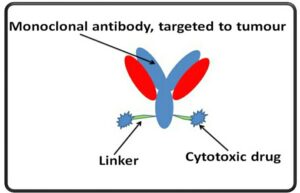
آنتیبادیهای متصل به دارو:
این اتفاق با پیوند دادن آنتیبادیهای هدفمند با یک عامل سیتوتوکسیک انجام میشود.
یکی از مثالهای آنGO[7] است که در افراد مبتلا به AML[8] باعث بهبود بقاء و کاهش خطر عود میشود [۱۷]. Brentuximab یک آنتیبادی ضد CD30 است که به یک مهارکننده میکروتوبولی به نام MMAE متصل شده و در درمان لنفوم هوچکین، پس از پیوند اتولوگ سلولهای بنیادی و لنفوم سلول بزرگ آناپلاستیک سیستمیک که در همه آنها CD30 بروز بالایی دارد بهکار میرود [۱۹، ۱۸]
IO[9] ترکیب دیگری است که مورد هدف CD22 بوده و به یک آنتیبیوتیک آنتیتوموری قوی متصل شده و در بیماران مبتلا به ALL[10] اثر میگذارد ]۲۰]
ترکیب دیگر SGN-CD33a است که به یک آنتیبادی ضد CD33 بر سطح سلولهای AML با یک دایمر پیرولوبنزودیازپین متصل شده و باعث بهبود بیماران مبتلا به AML میشود [۲۲، ۲۱] (شکل۲).
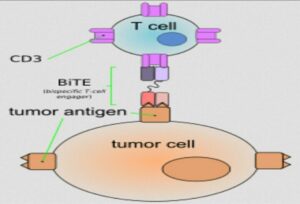
گیرنده سلول T با خاصیت دوگانه:
یکی از روشهای جدیدی ایمونوتراپی بوده و شامل دو بخش متغیر آنتیبادی است که یکی از آنها ضد CD3 سطحی سلولهای T است و دیگری علیه یک آنتیژن سطحی تومور است [۲۴، ۲۳]. این عوامل سلولهای T و سلولهای تومور را با یکدیگر تلفیق کرده و منجر به تکثیر پلیکلونال سلولهای T و سمیت سلولهای تومور میشوند. این فرایند مستقل از بیان MHC است و از مکانیسمهای ایمنی فرار تومور جلوگیری میکند. علاوه بر این CD19 که بر سطح اغلب سلولهای بدخیم B قرار داشته و از شاخصهای اختصاصی سلولهای B است، یکی از اهداف ایدهآل در ایمونوتراپی در درمان این سرطانهاست (شکل۳).
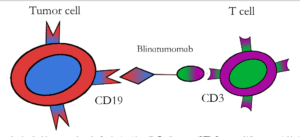
Bilinatumumab یک جزء از این سیستم و دارای خاصیت دوگانه برای CD19 و CD3 بوده و در درمان بیماران مبتلا به B-ALL فیلادلفیا مثبت/منفی[۲۶، ۲۵] و همچنین در لنفومهای غیرهوچکین از جمله لنفوم سلول B بزرگ منتشر [۲۸، ۲۷] مؤثر است (شکل۴).
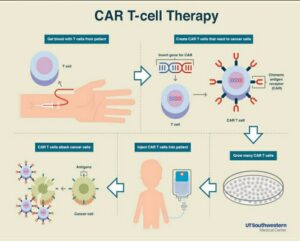
گیرندههای آنتیژنی نوترکیب سلولهای T (CAR4T Cell):
یکی از راههای درمانی در درمان بدخیمیهای هماتولوژیک CAR T cell therapy است که آنتیژنهای توموری را بهطور مستقیم مورد هدف قرار میدهد. CAR T cellها سلولهای اتولوگ (خودی) اند و برای بیان گیرندههای آنتیژنی نوترکیب (کایمریک) علیه یک آنتیژن اختصاصی روی سطح تومور طراحی شدهاند. از آنجایی که این آنتیژنها اختصاصی بوده و HLA مستقلی دارند، مسیر پردازش آنتیژنی آنها بینیاز از بیان MHC صورت میگیرد.
گیرندههای CAR دارای سه بخش خارج سلولی، درون غشایی و داخل سلولی بوده و به آنتیژنهای سطح سلولی در تومور متصل میشوند. موفقیت در این روش در درمان بدخیمیهای هماتولوژیک نسبت به تومورهای توپر بیشتر است. از آنجایی که بدخیمیها در بافتهایی نظیر خون، مغز استخوان و غدد لنفاوی اتفاق میافتند که بهطور طبیعی سلولهای T در آن مکانها جایگزین میشوند، لذا مسیر عملکرد این گیرندههای نوترکیب جهت واکنشدهی تسهیل میگردد؛ فرایندی که طی آن بیماران تحت درمان با CAR T cell therapy قرار میگیرند با جمعآوری سلولهای T با لوکوفرزیس آغاز و گیرندههای نوترکیب را از طریق مکانیسمهای مختلف (اغلب وکتورهای ویروسی) به سلولهای T متصل و سپس اجازه میدهند سلولها در محیط کشت رشد و تکثیر کنند. معمولاً بیماران قبل از تزریقCAR T cell ها جهت نابودی لنفوسیتها تحت شیمیدرمانی قرار میگیرند که منجر به گسترش سلولهای T در بیان سیتوکینهای هموستاز مثل IL-5 و IL-7 میشود که این گسترش با پاسخ به درمان در ارتباط است [۳۱-۲۹]. در نهایت درگیری آنتیژنهای تومور با CAR T cell ها باعث سمیت سلولی و گسترش تکثیر سلول T میشود (شکل ۵).
معمولترین نوع تومور که توسط CAR T cellها مورد هدف قرار میگیرد، بدخیمیهای سلول B است. در همه مراحل درمانی از CAR T cellهای نسل دوم استفاده میشود که دارای یک دومین منفرد کمک تحریکی مشتق از CD28 یا 4-1BB هستند.
این روش در درمان ALL مقاوم یا عودکننده [۳۴-۳۲] و بهطور نادر در موارد عودکننده پس از پیوند آلوژنیک سلولهای بنیادی بهکار میرود. CAR T cell therapy باعث پسرفت بیماری درNHL[11] و CLL وALL مقاوم/ عودکننده میگردد؛ بهعنوان نمونه، 4 سال پس از تزریق این سلولها به بیمار مبتلا به CLL ثبات CAR T cell در حال گردش مشاهده گردیده است. CAR T cell therapyدر تنظیم بیماری قبل و بعد از پیوند و بیماری مقاوم به شیمیدرمانی مؤثر است. جالب است بدانید که CAR T cell therapy حتی میتواند سبب پاکسازی دستگاه عصبی مرکزی گردد؛ جایی که درمانهای رایج بهطور معمول قدرت نفوذ به آن را ندارند، علاوه بر این، در این روش هیچگونه علائمی مبنی بر وجود GVHD[12] مشاهده نشده است، با این حال کارهای زیادی در کشف آنتیژن برای سایر بدخیمیها مثل BCMA[13] در مولتیپل میلوما و CD123 در AML در حال انجام است [ ۳۵].
CAR T cell therapy ممکن است با سندرم آزادسازی سیتوکین (CRS[14]) در ارتباط باشد که یک فرایند التهابی مرتبط با تکثیر سلولهای T است که با افزایش سطح سیتوکینها همراه است. حضور CRS ممکن است با پاسخ در ارتباط باشد اما شدت پاسخ ارتباط مستقیم با درمان ندارد. در صورتی که CRS بهطور مناسب درمان نشود، کشنده خواهد بود. CRS با تب بالا و علائم شبه آنفلوانزا مشخص میشود و درصورتیکه شدید باشد باعث نشت عروقی، افت فشارخون، بیثباتی دستگاه گردش خون و نارسایی چند اندامی میگردد. این واکنش یک همبستگی با سطوح CRP[15] و IL-6 قبل از توسعه CRS دارد [ ۲۹].
Tocilizumab یک ضد IL-6 در درمان روماتوئید آرتریت است و با توجه به افزایش IL-6 در CRS حتی در موارد خطرناک نیز کاربرد داشته و عامل مهمی در مدیریت CRS است، اما تأثیری در واکنشهای ضدتوموری ندارد. اگرچه استروئیدها در مدیریت CRS استفاده میشوند، اما ممکن است باعث کاهش واکنشهای سلول T و تأثیر آنها شوند.
سایر سمیتهای مرتبط با CAR T cell therapy شامل سمیت عصبی است که منجر به سردرد، سردرگمی، توهم، عدم قدرت تکلم، ناهماهنگی و اختلال در حرکت عضلات، فلج عصب صورت، لرزش، انسفالوپاتی و حتی تشنج میشود [۳۶]. این پدیده یک مسمویت حاد است و با tocilizumab درمان نمیشود.
علیرغم پیشرفتهای زیاد در CAR T cell therapy، با این حال ساختار بهینه CAR T cellها و مهندسی پیوند همچنان ناشناخته باقی مانده است. درCAR T cell therapy علاوه بر کشف آنتیژن، مدت زمان ایدهآل برای جذب CAR T cellها نامعلوم و در بدخیمیهای مختلف متفاوت است، علاوه بر این تأثیر ریزمحیطها مثل عوامل مهارکننده از جمله PD-L1[16] یکی از عوامل مهم در CAR T cell therapy است. درنهایت CAR Tcell therapy در درمان BCMA ,AML در مولتیپل میلوما [5] و ALL با حضور سلولهای ضد CD22 بهکار میرود [۳۷] .
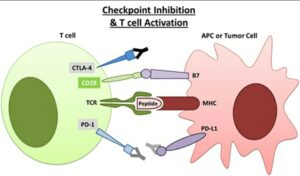
Immune Checkpoint Blockade:
بدخیمیها از مسیرهای ایمنی (مثل CTLA-4[17] و PD-1[18] که باعث غیرفعال شدن سلولهای T میشوند) بهعنوان مکانیسمهای فرار استفاده میکند. مهارکنندههای نقاط بازرسی ایمنی، ترمز دستگاه ایمنی را میگیرند و با مهار این مسیرهای ایمنی به رفع خستگی سلول T و در نتیجه شناسایی و حمله به سلولهای سرطانی کمک میکنند. این مهارکنندهها در درمان بسیاری از تومورهای توپر مثل ملانوما، سرطان ریه غیرکوچک، سرطان سلولهای کلیوی و سرطان مجاری ادراری مؤثرند [۳۹، ۳۸]. شواهد متعددی وجود دارد که نشان میدهد که چرا در لنفوم هوچکین [19]HL مسیرهای مهاری PD-1 و PD-L1 مستعد آسیب بیشتری هستند [۴۰]؛ زیرا اولاً بیوپسی HL نشاندهنده سلولهای رید- اشتنبرگ است که بهطور وسیعی احاطه شدهاند، دوم اینکه HL با تغییرات کروموزومی در 9p24.1 مشخص شده که منجر به افزایش بیان PD-L1 و PD-L2 میشود [۴۲، ۴۱] و سوم اینکه عفونتEBV(Epstein-Barr Virus) که در HL رایج است، منجر به افزایش بیش از حد PD-L1 و ماندگاری ویروس در بدن میزبان میشود [۴۳]. در نهایت افزایش سطح PD-L1 در بیوپسیهای تومور HL دیده میشود (شکل ۶).
Nivolumab (آنتیبادی ضد PD-1) و Brentuximab برای درمان HL مقاوم به SCT اتولوگ مورد استفاده قرار میگیرد.
Pembrolizumab یک مهارکننده ضد PD-1 است که در درمان ملانوما، سرطان ریه غیرکوچک، سرطان سر و گردن و HL بهکار میرود.
عامل دیگری که باعث میشود مهارکنندههای نقاط بازرسی ایمنی نقش مهمی در بدخیمیهای هماتولوژیک داشته باشند، محیط ایمنی منحصربهفردی است که پس از پیوند سلولهای ایمنی ایجاد میشود، علاوه بر این، بازسازی ایمنی منجر به افزایش لنفوسیتهایی میشود که هدف مهارکنندههای PD-1 واقع شده و در نهایت ممکن است باعث افزایش اثر پیوند علیه تومور در تنظیم پیوند آلوژنیک شود.
Pidilizumab یک مهارکننده ضد PD-1 است که باعث بهبود بیماران مبتلا به لنفوم سلول B بزرگ منتشر پس از SCT اتولوگ میشود [۴۴].
بهعلاوهIpilimumab ، یک مهارکننده ضد CTLA-4 در درمان ملانوما است و در بیماران مبتلا به بیماریهای عودکننده پس از SCT آلوژنیک بهکار رفته [۴۵] که در بعضی از موارد توأم با بهبودی و در مواردی با مرگ یا GVHD همراه بوده است.
نتیجهگیری:
ایمونوتراپی یا استفاده از سیستم ایمنی برای درمان، بعد از جراحی، شیمیدرمانی رادیوتراپی بهعنوان مهمترین روش در درمان سرطان مطرح شده و کارآزماییهای بالینی در انواع مختلف آن در حال انجام است. ایمونوتراپی توانایی انسان در مهار سیستم ایمنی بدن برای مبارزه با بدخیمیهای هماتولوژیک را افزایش میدهد. علیرغم اینکه در حال حاضر SCT بهعنوان یک گزینه درمانی ضروری بهکار گرفته میشود، درمانهای جدید ایمونوتراپی در آینده بهعنوان یک روش درمانی در برخی بدخیمیهای هماتولوژیک مفید خواهد بود.
شکل 1– آنتیبادیهای مونوکلونال
شکل 2 –آنتیبادیهای متصل به دارو
شکل 3- گیرندههای سلول T با خاصیت دوگانه
شکل 4– گیرندههای سلول T با خاصیت دوگانه
شکل 5-گیرندههای آنتی ژنی نوترکیب سلولهای T
شکل 6- Immune checkpoint blockade
References:
- 1. Horowitz MM, Gale RP, Sondel PM, Goldman JM, Kersey J, Kolb HJ, Rimm AA, Ringden O, Rozman C, Speck B, et al. Graft-versus-leukemia reactions after bone marrow transplantation. Blood. 1990;75:555–62.
- 2. Weiden PL, Flournoy N, Thomas ED, Prentice R, Fefer A, Buckner CD, Storb R. Antileukemic effect of graft-versus-host disease in human recipients of allogeneic-marrow grafts. N Engl J Med. 1979;300:1068–73.
۳. Duval M, Klein JP, He W, Cahn JY, Cairo M, Camitta BM, Kamble R, Copelan E, de Lima M, Gupta V, et al. Hematopoietic stem-cell transplantation for acute leukemia in relapse or primary induction failure. J ClinOncol. 2010;28:3730–8.
۴. Lieskovsky YE, Donaldson SS, Torres MA, Wong RM, Amylon MD, Link MP, Agarwal R. High-dose therapy and autologous hematopoietic stem-cell transplantation for recurrent or refractory pediatric Hodgkin’s disease: results and prognostic indices. J ClinOncol. 2004;22:4532–40.
۵. Ali SA, Shi V, Maric I, Wang M, Stroncek DF, Rose JJ, Brudno JN, StetlerStevenson M, Feldman SA, Hansen BG, et al. T cells expressing an anti-B-cellmaturation-antigen chimeric antigen receptor cause remissions of multiple myeloma. Blood. 2016. doi: https://doi.org/10.1182/blood-2016-04-711903.
۶. Collins Jr RH, Shpilberg O, Drobyski WR, Porter DL, Giralt S, Champlin R, Goodman SA, Wolff SN, Hu W, Verfaillie C, et al. Donor leukocyte infusions in 140 patients with relapsed malignancy after allogeneic bone marrow transplantation. J ClinOncol. 1997;15:433–44.
۷. Carella AM, Giralt S, Slavin S. Low intensity regimens with allogeneic hematopoietic stem cell transplantation as treatment of hematologic neoplasia. Haematologica. 2000;85:304–13.
۸. Gooley TA, Chien JW, Pergam SA, Hingorani S, Sorror ML, Boeckh M, Martin PJ, Sandmaier BM, Marr KA, Appelbaum FR, et al. Reduced mortality after allogeneic hematopoietic-cell transplantation. N Engl J Med. 2010;363:2091–101.
۹. Chang YJ, Xu LP, Wang Y, Zhang XH, Chen H, Chen YH, Wang FR, Han W, Sun YQ, Yan CH, et al. Controlled, randomized, open-label trial of riskstratified corticosteroid prevention of acute graft-versus-host disease after haploidentical transplantation. J ClinOncol. 2016;34:1855–63.
۱۰. Goede V, Fischer K, Busch R, Engelke A, Eichhorst B, Wendtner CM, Chagorova T, de la Serna J, Dilhuydy MS, Illmer T, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med. 2014;370:1101–10.
۱۱. Sehn LH, Chua N, Mayer J, Dueck G, Trneny M, Bouabdallah K, Fowler N, Delwail V, Press O, Salles G, et al. Obinutuzumab plus bendamustine versus bendamustinemonotherapy in patients with rituximab-refractory indolent non-Hodgkin lymphoma (GADOLIN): a randomised, controlled, open-label, multicentre, phase 3 trial. Lancet Oncol. 2016;17:1081–93.
۱۲. Usmani SZ, Weiss BM, Plesner T, Bahlis NJ, Belch A, Lonial S, Lokhorst HM, Voorhees PM, Richardson PG, Chari A, et al. Clinical efficacy of daratumumabmonotherapy in patients with heavily pretreated relapsed or refractory multiple myeloma. Blood. 2016;128:37–44.
۱۳. Lonial S, Weiss BM, Usmani SZ, Singhal S, Chari A, Bahlis NJ, Belch A, Krishnan A, Vescio RA, Mateos MV, et al. Daratumumabmonotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial. Lancet. 2016;387:1551–60.
۱۴. Lokhorst HM, Plesner T, Laubach JP, Nahi H, Gimsing P, Hansson M, Minnema MC, Lassen U, Krejcik J, Palumbo A, et al. Targeting CD38 with daratumumabmonotherapy in multiple myeloma. NEngl J Med. 2015;373:1207–19. ۱۵. Palumbo A, Chanan-Khan A, Weisel K, Nooka AK, Masszi T, Beksac M, Spicka I, Hungria V, Munder M, Mateos MV, et al. Daratumumab, bortezomib, and dexamethasone for multiple myeloma. N Engl J Med. 2016;375:754–66. ۱۶. Dimopoulos MA, Oriol A, Nahi H, San-Miguel J, Bahlis NJ, Usmani SZ, Rabin N, Orlowski RZ, Komarnicki M, Suzuki K, et al. Daratumumab, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med. 2016;375:1319–31.
۱۷. Hills RK, Castaigne S, Appelbaum FR, Delaunay J, Petersdorf S, Othus M, Estey EH, Dombret H, Chevret S, Ifrah N, et al. Addition of gemtuzumabozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia: a meta-analysis of individual patient data from randomised controlled trials. Lancet Oncol. 2014;15:986–96.
۱۸. Younes A, Gopal AK, Smith SE, Ansell SM, Rosenblatt JD, Savage KJ, Ramchandren R, Bartlett NL, Cheson BD, de Vos S, et al. Results of a pivotal phase II study of brentuximabvedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J ClinOncol. 2012;30:2183–9.
۱۹. Pro B, Advani R, Brice P, Bartlett NL, Rosenblatt JD, Illidge T, Matous J, Ramchandren R, Fanale M, Connors JM, et al. Brentuximabvedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase II study. J ClinOncol. 2012;30:2190–6.
۲۰. Kantarjian HM, DeAngelo DJ, Stelljes M, Martinelli G, Liedtke M, Stock W, Gokbuget N, O’Brien S, Wang K, Wang T, et al. Inotuzumabozogamicin versus standard therapy for acute lymphoblastic leukemia. N Engl J Med. 2016;375:740–53.
۲۱. Stein AS, Walter RB, Erba HP, Fathi AT, Advani AS, Lancet JE, Ravandi F, Kovacsovics TJ, DeAngelo DJ, Bixby D, et al. A phase 1 trial of SGN-CD33A as monotherapy in patients with CD33-positive acute myeloid leukemia (AML) [abstract]. Blood. 2015;126:324.
۲۲. Fathi AT, Erba HP, Lancet JE, Stein EM, Walter RB, DeAngelo DJ, Faderl S, Jillella AP, Ravandi F, Advani AS, et al. SGN-CD33A plus hypomethylating agents: a novel, well-tolerated regimen with high remission rate in frontline unfit AML [abstract]. Blood. 2015;126:454.
۲۳. Rogala B, Freyer CW, Ontiveros EP, Griffiths EA, Wang ES, Wetzler M. Blinatumomab: enlisting serial killer T-cells in the war against hematologic malignancies. Expert OpinBiolTher. 2015;15:895–908.
۲۴. Fan G, Wang Z, Hao M, Li J. Bispecific antibodies and their applications. J HematolOncol. 2015;8:130.
۲۵. Wu J, Fu J, Zhang M, Liu D. Blinatumomab: a bispecific T cell engager (BiTE) antibody against CD19/CD3 for refractory acute lymphoid leukemia. J HematolOncol. 2015;8:104.
۲۶. Fan D, Li W, Yang Y, Zhang X, Zhang Q, Yan Y, Yang M, Wang J, Xiong D. Redirection of CD4+ and CD8+ T lymphocytes via an anti-CD3 x anti-CD19 bi-specific antibody combined with cytosine arabinoside and the efficient lysis of patient-derived B-ALL cells. J HematolOncol. 2015;8:108.
۲۷. Goebeler ME, Knop S, Viardot A, Kufer P, Topp MS, Einsele H, Noppeney R, Hess G, Kallert S, Mackensen A, et al. Bispecific T-cell engager (BiTE) antibody construct blinatumomab for the treatment of patients with relapsed/refractory non-Hodgkin lymphoma: final results from a phase I study. J ClinOncol. 2016;34:1104–11
۲۸. Viardot A, Goebeler ME, Hess G, Neumann S, Pfreundschuh M, Adrian N, Zettl F, Libicher M, Sayehli C, Stieglmaier J, et al. Phase 2 study of the bispecific T-cell engager (BiTE) antibody blinatumomab in relapsed/ refractory diffuse large B-cell lymphoma. Blood. 2016;127:1410–6.
۲۹. Lee DW, Kochenderfer JN, Stetler-Stevenson M, Cui YK, Delbrook C, Feldman SA, Fry TJ, Orentas R, Sabatino M, Shah NN, et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial. Lancet. 2015;385:517–28.
۳۰. Brudno JN, Somerville RP, Shi V, Rose JJ, Halverson DC, Fowler DH, GeaBanacloche JC, Pavletic SZ, Hickstein DD, Lu TL, et al. Allogeneic T cells that express an anti-CD19 chimeric antigen receptor induce remissions of B-cell malignancies that progress after allogeneic hematopoietic stem-cell transplantation without causing graft-versus-host disease. JClinOncol. 2016;34:1112–21.
۳۱. Park JH, Geyer MB, Brentjens RJ. CD19-targeted CAR T-cell therapeutics for hematologic malignancies: interpreting clinical outcomes to date. Blood. 2016;127:3312–20.
۳۲. Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, Chew A, Gonzalez VE, Zheng Z, Lacey SF, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. NEngl J Med. 2014;371:1507–17
۳۳. Porter DL, Hwang WT, Frey NV, Lacey SF, Shaw PA, Loren AW, Bagg A, Marcucci KT, Shen A, Gonzalez V, et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. SciTransl Med. 2015;7:303ra139.
۳۴. Davila ML, Riviere I, Wang X, Bartido S, Park J, Curran K, Chung SS, Stefanski J, Borquez-Ojeda O, Olszewska M, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. SciTransl Med. 2014;6:224ra225.
۳۵. Gill S, Tasian SK, Ruella M, Shestova O, Li Y, Porter DL, Carroll M, DanetDesnoyers G, Scholler J, Grupp SA, et al. Preclinical targeting of human acute myeloid leukemia and myeloablation using chimeric antigen receptor-modified T cells. Blood. 2014;123:2343–54.
۳۶. Brudno JN, Kochenderfer JN. Toxicities of chimeric antigen receptor T cells: recognition and management. Blood. 2016;127:3321–30.
۳۷. Haso W, Lee DW, Shah NN, Stetler-Stevenson M, Yuan CM, Pastan IH, Dimitrov DS, Morgan RA, FitzGerald DJ, Barrett DM, et al. Anti-CD22chimeric antigen receptors targeting B-cell precursor acute lymphoblastic leukemia. Blood. 2013;121:1165–74.
۳۸. Postow MA, Callahan MK, Wolchok JD. Immune checkpoint blockade in cancer therapy. J ClinOncol. 2015;33:1974–82.
۳۹. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12:252–64. ۴۰. Armand P. Immune checkpoint blockade in hematologic malignancies. Blood. 2015;125:3393–400.
۴۱. Green MR, Monti S, Rodig SJ, Juszczynski P, Currie T, O’Donnell E, Chapuy B, Takeyama K, Neuberg D, Golub TR, et al. Integrative analysis reveals selective 9p24.1 amplification, increased PD-1 ligand expression, and further induction via JAK2 in nodular sclerosing Hodgkin lymphoma and primary mediastinal large B-cell lymphoma. Blood. 2010;116:3268–77.
۴۲. Roemer MG, Advani RH, Ligon AH, Natkunam Y, Redd RA, Homer H, Connelly CF, Sun HH, Daadi SE, Freeman GJ, et al. PD-L1 and PD-L2 genetic alterations define classical Hodgkin lymphoma and predict outcome. J ClinOncol. 2016;34:2690–7.
۴۳. Green MR, Rodig S, Juszczynski P, Ouyang J, Sinha P, O’Donnell E, Neuberg D, Shipp MA. Constitutive AP-1 activity and EBV infection induce PD-L1 in Hodgkin lymphomas and posttransplantlymphoproliferative disorders: implications for targeted therapy. Clin Cancer Res. 2012;18:1611–8
۴۴. Armand P, Nagler A, Weller EA, Devine SM, Avigan DE, Chen YB, Kaminski MS, Holland HK, Winter JN, Mason JR, et al. Disabling immune tolerance by programmed death-1 blockade with pidilizumab after autologous hematopoietic stem-cell transplantation for diffuse large B-cell lymphoma: results of an international phase II trial. J ClinOncol. 2013;31:4199–206.
۴۵. Davids MS, Kim HT, Bachireddy P, Costello C, Liguori R, Savell A, Lukez AP, Avigan D, Chen YB, McSweeney P, et al. Ipilimumab for patients with relapse after allogeneic transplantation. N Engl J Med. 2016;375: 143–53.
[1]– Hematopoietic Stem Cell Transplantation
[2]– Graft Versus Leukemia
[3]– Choronic Lymphocytic Luekemia
[4]– Multiple Myeloma
[5]-Overall Response Rate
[6]– Signaling Lymphocytic Activation Molecule Family7
[7]– Gemtuzumab Osogamicin
[8]– Acute Myeloid Luekemia
[9]– Inotuzumab Osogamicin
[10]– Acute Lymphoblastic Lyekemia
[11]– None-Hodgkin Lymphoma
[12]– Graft Versus Host Disease
[13]– B Cell Maturation Antigen
[14]– Cytokine Release Syndrome
[15]– C-reactive protein
[16]-Programmed-death Ligand1
[17]– Cytotoxic T-lymphocyte-associated protrin 4
[18]– Programmed-death1
[19]– Hodgkin Lymphoma
درمان بدخیمیهای خونی با استفاده از سلولهای T بروزدهنده پذیرندههای کایمریک (CAR)
درمان بدخیمیهای سلول B (قسمت 2)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام