سیر تکاملی (life cycle) و شکلشناسی (morphology)انگلهای مالاریای انسانی
گردآوری و تألیف:
دکتر احمد مردانی
استادیار مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
مقدمه
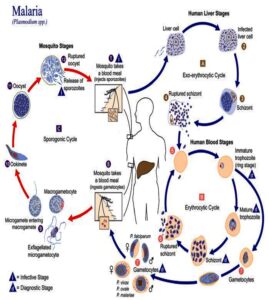
چرخه زندگی (life cycle) یا سیر تکاملی انگلهای مالاریا در دو میزبان مهرهدار و بیمهره انجام میگیرد. میزبان نهایی و اصلی پلاسمودیومها (Plasmodia) یا انگلهای مالاریای انسانی، گونههایی از پشه آنوفل (Anopheles) ماده هستند که تکثیر جنسی یا اسپوروگونی (sporogony) انگل در بدن آنها طی میشود و میزبان واسطه که مرحله شیزوگونی (schizogony) یا تکثیر غیرجنسی انگل در بدن آن انجام میگیرد، انسان میباشد (شکل 1). البته بایستی توجه داشت که در بدن انسان علاوه بر اشکال غیرجنسی، سلولهای جنسی یا گامتوسیتها (gametocytes) نیز بوجود میآیند. ایجاد گامتوسیتها از مروزوئیتهای خونی (erythrocytic merozoites) و تبدیل آنها به گامتهای نر و ماده را اصطلاحاً گامتوگونی (gametogony) میگویند. تبدیل گامتوسیتها به گامتهای نر و ماده در بدن پشه آنوفل ماده انجام میشود. در ادامه، به تشریح مراحل مختلف چرخه زندگی و شکلشناسی انگلهای مالاریای انسانی میپردازیم.
الف. اسپوروگونی (sporogony)
این مرحله از سیر تکاملی انگلهای مالاریا ی انسانی در بدن پشه آنوفل ماده انجام میگیرد. پشههای آنوفل ماده خونخوار هستند و معمولاً سه تا پنج روز یک بار جهت رشد تخمکهای خود نیاز به خونخواری دارند. اگر ناقل مالاریا از بیمار مالاریایی که در خون او به تعداد کافی گامتوسیتهای نر و ماده انگل مالاریا وجود دارد، خونخواری نماید؛ تعدادی از سلولهای جنسی به همراه سایر اشکال انگلی و خون از راه خرطوم وارد معده (midgut) پشه آنوفل ماده میشود.
در معده پشه، گامتوسیت نر (male gametocyte) یا میکروگامتوسیت (microgametocyte) پس از exflagellation تقسیم میگردد و ایجاد چهار تا هشت سلول دراز تاژک مانند به نام گامت نر یا میکروگامت (microgamete) میکند. بهطور همزمان، گامتوسیت ماده (female gametocyte) یا ماکروگامتوسیت (macrogametocyte) بعد از تغییراتی به شکل یک سلول به نام گامت ماده یا ماکروگامت (macrogamete) درمیآید. از لقاح یک گامت نر و یک گامت ماده، سلول تخم یا زیگوت (zygote) حاصل میشود که پس از دوکی شدن و کسب قدرت تحرک به آن اواوکینت (ookinete) میگویند.
شکل 1: چرخه زندگی و مراحل مختلف سیر تکاملی انگلهای مالاریای انسانی [1]
اواوکینتها از بین سلولهای معده پشه آنوفل ناقل عبور کرده و در زیر غشایی که سطح خارجی سلولهای معده را میپوشاند، قرار میگیرند و ایجاد برآمدگی میکنند که به آن اواوسیست (oocyst) گفته میشود. در ادامه، اواوسیستها رشد کرده و پس از تقسیم شدن ایجاد تعداد زیادی اسپوروزوئیت (sporozoite) مینمایند. با پاره شدن اواوسیستها، اسپوروزوئیتها آزاد شده و وارد حفره عمومی بدن پشه میشوند. هنگامی که پشه آلوده به اسپوروزوئیتها از شخص سالمی خونخواری نماید؛ قبل از مکیدن خون، همراه بزاق خود اسپوروزوئیتهایی که در مجاری غدد بزاقی (یک جفت غده بزاقی سه لوبه) جایگزین شدهاند را وارد بدن فرد میکند. دوره اسپوروگونی در شرایط مطلوب از نظر دمایی و رطوبت برحسب گونه انگل پلاسمودیوم (Plasmodium) هشت تا 16 روز به طول مـیانجامد (جدول 1).
جدول 1: مقايسه برخي مشخصههای مراحل اسپوروگوني و شيزوگوني نسجی پلاسموديومهای انساني [2]
| گونه انگل پلاسمودیوم | دوره اسپوروگونی (روز) | شکل انتشار پیگمان در اواوسیست | دوره شیزوگونی نسجی (روز) | تعداد مروزوئیتهای شیزونت نسجی |
| پ. ویواکس | 8-10 | feathery | 6-8 | 10000 |
| پ. مالاریه | 14-16 | clusters at periphery | 14-16 | 15000 |
| پ. اوال | 12-14 | crossed line | 9 | 15000 |
| پ. فالسیپاروم | 9-10 | row sand chains | 5/5-7 | 30000 |
ب. شیزوگونی (schizogony)
شیزوگونی یا تکثیر غیرجنسی انگل مالاریا در بدن میزبان واسطه یعنی انسان انجام میگیرد که شامل دو مرحله شیزوگونی نسجی pre-erythrocytic schizogony) یا primary exo-erythrocytic) و شیزوگونی خونی (erythrocytic schizogony) است.
1: شیزوگونی نسجی
این مرحله از تکثیر غیرجنسی در سلولهای پارانشیم کبدی (hepatocytes) انسان انجام میشود. پس از ورود اسپوروزوئیتها به جریان خون انسان متعاقب گزش پشه آنوفل ماده، تعدادی از آنها در مدت زمان کوتاهی (حدود نیم ساعت) خود را به سلولهای پارانشیـم کبدی رسانـده و وارد آنها مـیشوند. بایستی توجه داشت که تعداد زیادی از اسپوروزوئیتها پس از ورود به جریان خون توسط سلولهای بیگانهخوار فاگوسیته شده و از بین میروند. انگل مالاریا در داخل سیتوپلاسم سلول پارانشیم کبدی حالت کروی به خود میگیرد و پس از رشد، ابتدا هسته و در ادامه سیتوپلاسم آن تقسیم میگردد و ایجاد تعداد زیادی مروزوئیت (merozoite) نسجی مینماید.
به مجموعه مروزوئیتها در داخل سلول کبدی، شیزونت نسجی (tissue schizont) گفته میشود. تعداد مروزوئیتهای شیزونت نسجی برحسب گونه پلاسمودیوم بین 10 تا 30 هزار عدد متغیر میباشد (جدول 1). در ادامه، پس از رسیده شدن شیزونت نسجی، جدار سلول کبدی پاره شده و مروزوئیتها نهایتاً وارد جریان خون میشوند. مرحله شیزوگونی نسجی برحسب گونه پلاسمودیوم حدود شش تا 16 روز طول میکشد (جدول 1). لازم به ذکر است که در تمامی پلاسمودیومهای انسانی، شیزوگونی نسجی قبل از ورود انگل به داخل گلبولهای قرمز انجام میگیرد.
در سیر تکاملی پلاسمودیومهای ویواکس (P. vivax) و اوال (P. ovale) تعدادی از اسپوروزوئیتها در داخل سلولهای پارانشیم کبدی برای مدت نسبتاً طولانی به حالت خفته و غیرفعال به نام هیپنوزوئیت (hypnozoite) باقی میمانند و هر چند وقت یک بار تعدادی از آنها فعال شده، رشد و تکثیر کرده و پس از گذراندن شیزوگونی نسجی ثانویه (secondary exo-erythrocytic schizogony) وارد جریان خون شده و سبب عود (relapse) میشوند. در مالاریای ویواکس و احتمالاً مالاریای اوال طول زمانی که ممکن است عودهای مالاریا رخ دهد، یکونیم تا پنج سال است. فاصله عودهای مکرر در سویههای مناطق معتدل پلاسمودیوم ویواکس طولانی (چند ماه) و در سویههای مناطق گرمسیری کوتاه (حدود یک ماه) و تعداد موارد عود معمولاً بیشتر میباشد.
در چرخه زندگی پلاسمودیوم فالسیپاروم (P. falciparum) و پلاسمودیوم مالاریه (P. malariae) تمامی اسپوروزوئیتهایی که وارد سلولهای کبدی میشوند، تکثیر یافته و مروزوئیتهای آنها وارد جریان خون میگردند و انگلی در پارانشیم کبد باقی نمیماند، بنابراین عود بیماری به شکلی که در پلاسمودیومهای ویواکس و اوال مطرح میباشد، در چرخه زندگی این پلاسمودیومها دیده نمیشود. آنچه در پلاسمودیومهای فالسـیپاروم و مالاریه مطرح است، ظهور مجدد (recrudescence) انگل در خون میباشد.
در اثر درمان ناقص، مقاومت ضعیف انگل به دارو و همچنین مصونیت نسبی، تکثیر انگل کاملاً مهار نمیشود و تعدادی از اشکال شیزوگونی خونی به تعداد خیلی محدودی به تکثیر خود ادامه میدهند. در این مرحله، بیمار برای مدتی هیچگونه علائمی از بیماری ندارد ولی با از بین رفتن عوامل مهارکننده تکثیر، انگل فعالتر شده و به تعداد بیشتری تکثیر مییابد و منجر به ظهور علائم بالینی بیماری میگردد. ظهور مجدد در مالاریای فالسیپاروم ممکن است طی یک ماه تا دو سال اتفاق بیافتد، درحالیکه در مالاریای مالاریه ممکن است تکثیر انگل در خون محیطی معمولاً در حد خیلی محدود (تحت فشار مصونیت نسبی) به مدت طولانی حتی تا آخر عمر فرد حامل انگل ادامه یابد. در مالاریای ویواکس و مالاریای اوال علاوه بر عود، امکان رخداد ظهور مجدد وجود دارد.
2: شیزوگونی خونی
این مرحله از تکثیر غیرجنسی در گلبولهای قرمز خون (erythrocytes) انسان انجام میگیرد. اکثر مروزوئیتهای نسجی پس از ورود به جریان خون، از طریق گیرندههای اختصاصی (receptors) موجود در سطح گلبولهای قرمز انسان از جمله آنتیژنهای دافی (duffy antigens) به غشای آنها میچسبند. پس از اتصال و ایجاد واکوئل پارازیتوفروس (parasitophorous vacuole) انگل عملاً وارد گلبول قرمز میگردد. در این مرحله، در صورت رنگآمیزی با یکی از روشهای Romanowsky مانند گیمسا (Giemsa) انگل به شکل یک انگشتر دیده میشود که به آن رینگ (ring) یا تروفوزوئیت جوان (young trophozoite) میگویند. گاهی کروماتین (chromatin) هسته در تروفوزوئیتهای جوان بهصورت دو قطعه جدا از هم و کامـلاً مشخص (double chromatin) دیـده میشود. وجود بیش از یک تروفوزوئیت جوان در یک گلبول قرمز یا عفونت مضاعف (multiple infection) و double chromatin عمدتاً در مالاریای فالسیپاروم گزارش شده است.
تروفوزوئیت جوان با رشد و نمو به تروفوزوئیت در حال رشد (growing trophozoite) و با کامل شدن رشدش به تروفوزوئیت پیر (old trophozoite) تبدیل میشود. در ادامه، با تقسیم شدن هسته تروفوزوئیت پیر، شیزونت نارس (immature schizont) بوجود میآید که با تقسیم شدن سیتوپلاسم آن برحسب گونه انگل پلاسمودیوم شش تا 24 مروزوئیت خونی در داخل گلبول قرمز ایجاد میشود. به مجموعه مروزوئیتهای خونی داخل یک گلبول قرمز، اصطلاحاً شیزونت رسیده (mature schizont) میگویند. با رسیده شدن شیزونت، گلبول قرمز پاره شده و تعدادی از مروزوئیتها وارد گلبولهای قرمز سالم میگردند و تعدادی توسط سلولهای بیگانهخوار موجود در خون فاگوسیته شده و از بین میروند.
یک دوره شیزوگونی خونی که با ورود انگل به داخل گلبول قرمز شروع میشود و با تقسیم کامل آن و پاره شدن گلبول قرمز خاتمه مییابد، در پلاسمودیومهای ویواکس، فالسیپاروم و اوال حدود 48 ساعت و در پلاسمودیوم مالاریه 72 ساعت به طول میانجامد، به همین دلیل مالاریای ویواکس، فالسیپاروم و اوال را مالاریای سه یک (tertian malaria) و به مالاریای مالاریه، مالاریای چهار یک (quartan malaria) میگویند؛ به عبارت دیگر در مالاریای سه یک، بیمار یک روز در میان و در مالاریای چهار یک، دو روز در میان لرز و تب مینماید.
با رسیده شدن شیزونت و پاره شدن گلبول قرمز، تعدادی از مروزوئیتهای وارد شده به گلبولهای قرمز سالم ایجاد انگلهایی با سیتوپلاسم متراکم و هسته نسبتاً درشت میکنند که پس از رشد کامل برحسب گونه پلاسمودیوم شکل آنها گرد یا بیضی (پلاسمودیومهای ویواکس، اوال و مالاریه) و یا هلالی یا لوبیای شکل (پلاسمودیوم فالسیپاروم) میشود. این مرحله از انگل مالاریا، سلول جنسی یا گامتوسیت نامیده میشود که گامتوسیت نر و ماده از هم متمایز هستند. به گامتوسیت نر که کوچکتر است، میکروگامتوسیت و به گامتوسیت ماده که بزرگتر میباشد، ماکروگامتوسیت میگویند. شکل گامتوسیتهای گونههایی که در دو زیرجنس (sub-genus) پلاسمودیوم و لاورانیا (Laverania) قرار دارند، اساس تقسیمبندی جنس پلاسمودیوم به دو زیرجنس مذکور میباشد [3].
مراحل تروفوزوئیت جوان، تروفوزوئیت در حال رشد، تروفوزوئیت پیر، شیزونت نارس، شیزونت رسیده و گامتوسیتهای نر و ماده برحسب گونه پلاسمودیوم در گسترش خونی نازک رنگآمیزیشده به روش گیمسا ویژگیهایی دارند که در تشخیص و افتراق گونهها از یکدیگر مورد استفاده قرار میگیرد (شکل 2).
شکل 2: اشکال مختلف مرحله شیزوگونی خونی پلاسمودیومهای انسانی (human Plasmodia) در گسترش خونی نازک رنگآمیزی شده به روش گیمسا (Giemsa) [4]
علاوه بر این، انگلهای مالاریا ی انسانی در انـدازه، رنـگ و شکل گلبـولهای قرمز تغییراتی ایجاد مـیکنند که تا حدودی در تشخیص و افتراق گونه پلاسمودیوم در گسترشهای خونی نازک رنگشده کمک مینماید (جدول 2). در بین پلاسمودیومهای انسانی، گونه فالسیپاروم قادر به آلوده کردن گلبولهای قرمز در تمام ردههای سنی است. این در حالی است که گونههای ویواکس و اوال، رتیکولوسیتها (reticulocytes) و گونه مالاریه، گلبولهای قرمز پیر را ترجیح میدهند [5].
جدول 2: ویژگیهای مرفولوژیک گلبولهای قرمز (RBCs) آلوده به پلاسمودیومهای انسانی [6]
| ویژگی مرفولوژیک | پ. ویواکس | پ. مالاریه | پ. فالسیپاروم | پ. اوال |
| اندازه | بزرگ | کوچک | طبیعی | بزرگ |
| رنگ | کمرنگ | طبیعی | طبیعی | کمرنگ |
| شکل | گرد | گرد | گرد و احتمالاً دندانهدار | تخممرغی و احتمالاً زائدهدار |
پیگمان (pigment) یا هموزوئین (haemozoin)، ماده آهندار زائدی است که بعد از تغذیه انگل از هموگلوبین گلبول قرمز بوجود میآید و در داخل سیتوپلاسم انگل باقی میماند. این رنگدانهها که به رنگ زرد، قهوهای و یا سیاه دیده میشوند تا مرحله اواوسیست در انگل وجود داشته و انتشار آنها در اواوسیستهای هر یک از گونههای پلاسمودیوم شکل خاصی دارد (جدول 1). با تقسیم شدن اواوسیستها و ایجاد تعداد زیادی اسپوروزوئیت، رنگدانهها از انگل جدا میشوند و به عبارت دیگر اسپوروزوئیتها فاقد رنگدانه میباشند.
علاوه بر پیگمان، انگلهای مالاریا ی انسانی در گلبولهای قرمز ایجاد دانههایی به رنگ صورتی، نارنجی و یا خرمایی مینمایند که به نام اسامی کاشفین آنها نامگذاری شدهاند. این دانهها در پلاسمودیوم ویواکس Schuffner’s dots، پلاسمودیوم فالسیپاروم Maurrer’s clefts، پلاسمودیوم مالاریه Ziemann’s dots و پلاسمودیــوم اوال Schuffner’s dots و یا James dots نام دارند. به داندان شدن گلبول قرمز انگلدار به سبب وجود این دانهها، استیپلینگ (stippling) میگویند [3]. دانههای زیمن (Ziemann’s dots) بندرت در رنگآمیزی معمولی گسترشهای خونی به روش گیمسا دیده میشوند.
منابع:
- http://en.wikipedia.org/wiki/File:Plasmodium_lifecycle_PHIL_3405_lores.jpg
- Warrel DA, Gilles HM. 2002. Essential Malariology, 4th ed. Oxford University Press Inc, Oxford, UK.
- ادریسیان غـلامحسین، رضائیان مصطفی، قربانی مهـدی، کشاورز حسین، محبعلی مهـدی. تک یاختهشناسی پزشکی. انتشارات دانشگاه علوم پزشکی تهران، چاپ اول، 1386.
- http://www.shoklo-unit.com/lab.shoklo-unit.com/labman/images/msex2.jpg
- Markell EK, Voge M, John DT. 1992. Medical Parasitology, 7th ed. W.B. Saunders Company, Philadelphia, USA.
- چیودینی پیتر. اطلس کرمشناسی و تکیاختهشناسی پزشکی. ترجمه پارسا فرزاد. انتشارات نامدار، چاپ اول، بهار 1383.
پلاسمودیوم فالسیپاروم و پروتئین Knob
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام