تأثیر داروها بر آزمونهای عملکرد تیروئید
دکتر شهروز همتی، دکترای علوم آزمایشگاهی، مسئول فنی آزمایشگاه دکتر همتی سنقر
دکتر مهناز آل یاسین، دکترای علوم آزمایشگاهی، مسئول فنی آزمایشگاه پارسیان کرمانشاه
مقدمه:
آزمونهای عملکرد تیروئید (TFT) بهطور معمول توسط پزشکان درخواست میگردد. بسیاری از بیماران کسانی هستند که به دلیل بیماری تحت درمان هستند و برخی از بیماران نیز داروهایی را مصرف میکنند که میتواند عملکرد غده تیروئید را تحت تأثیر قرار دهد، بنابراین این آزمونها از دو جنبه موردتوجه قرار میگیرند؛ یکی از نظر تشخیص و پیگیری درمان بیماریهای تیروئید و دیگری از نظر تأثیر مصرف برخی داروها بر عملکرد غده تیروئید. درک صحیح و شناخت ما از نحوه تأثیر داروها بر روی آزمونهای عملکرد تیروئید میتواند بسیاری از اقدامات تشخیصی و درمانی غیرضروری را مرتفع سازد.
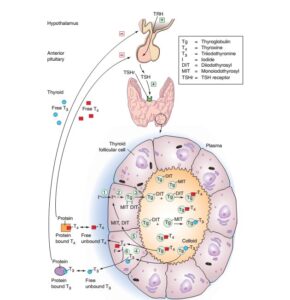
شکل 1- مسیرهای سنتز و متابولیسم هورمونهای تیروئیدی
مسیرهای سنتز هورمونهای تیروئید مانند ترشح، انتقال هورمون در جریان خون و متابولیسم هورمونهای تیروئید اهدافی هستند که میتوانند بوسیلهی داروها تحت تأثیر قرار گیرند. (شکل 1)
ترشح هورمونهای تیروئید وابسته به تیروتروپین (TSH) است. ترشح TSH بوسیلهی هورمونهای تیروئید سرکوب شده و بوسیلهی TRH تحریک میگردد (فیدبک منفی). ید سرم بوسیلهی سلولهای تیروئید انبار میگردد؛ بعد از آن اکسیده شده و با ترکیبات تیروگلوبولین که حاوی تیروزین هستند ادغام، سپس باهم جفت شده و تیروکسین (T4) و ترییدوتیرونین (T3) را میسازند. بطور طبیعی غدهی تیروئید حاوی مقادیر زیادی ذخیره تیروگلوبولین بوده که بیشتر در فضای فولیکولهای تیروئید است.
وقتی که تیروگلوبولین به داخل سلولهای فولیکولار بازجذب میشود، در آنجا هیدرولیز شده و T3 و T4 بداخل جریان خون ترشح میشوند. در جریان خون این هورمونها به پروتئینهای حملکننده اختصاصی سرمی متصل شده و بنابراین مقدار کمی از هورمون در جریان خون بهصورت آزاد وجود خواهد داشت. در بافتهای خارج تیروئید، T4 توسط چند نوع آنزیم دیدیناز (deiodinase) به T3 تبدیل میگردد. این رویکرد در حدود 80 درصد T3 سرمی را تولید میکند.
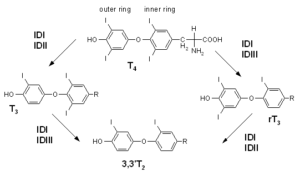
سه نوع دیدیناز وجود دارد (شکل 2):
- دیدیناز نوع 1 (DIOI) که عمدتاً در بافتهای کبد، کلیه و تیروئید قرار دارد و تمایل نسبتاً کمتری برای اتصال با T4 داشته و تبدیل محیطی T4 به T3را کنترل میکند.
- دیدیناز نوع 2(DIOII) تمایل بیشتری برای T4 داشته و بیشتر در غده هیپوفیز (فید بک منفی)، مغز و چربی قهوهای (ترموژنز) وجود دارد. وجود دیدیناز نوع 2 این امکان را فراهم میکند که غلظت T3 بهطور موضعی تنظیم شود.
شکل 2- واکنشهای انجامشده توسط انواع دیدیناز
این ویژگی در درمان جایگزینی لووتیروکسین اهمیت دارد. مقدار دیدیناز نوع 2 نیز بوسیله هورمونهای تیروئید تنظیم میشود؛ بهاینترتیب که هایپوتیروئیدی سبب القای تولید این آنزیم شده و درنتیجه تبدیل T4 به T3در بافتهایی مانند مغز و هیپوفیز افزایش مییابد. تبدیل T4 به T3 هم توسط دیدیناز نوع 1 و 2 کاتالیز میشود. این آنزیمها بهطور همزمان در یک بافت وجود دارند اما توزیع بافتی آنها متفاوت است. در شرایط هایپوتیروئیدیسم، T3 اساساً از نوع 2 مشتق میشود درحالیکه وقتی سوبسترای T4زیاد است (هایپرتیروئیدیسم)، T3 اساساً از دیدیناز نوع 1 مشتق میشود.
- دیدیناز نوع 3 (DIOIII)، سبب غیرفعال شدن هورمونهای T4 و T3شده و T4 را به T3 معکوس (rT3) و T3 را به T2 تبدیل میکند. دیدیناز نوع 3 برای کنترل مقدار هورمون تیروئید مادری که به جنین در حال تکامل حمل میگردد، اهمیت دارد.
حدود 80 درصد T4 و T3 بوسیله روش دیدیناسیون (deiodinatin) و 20 درصد باقیمانده توسط مسیرهای دیگر شامل کونژوگاسیون (ترکیب با گلوکورونیدها) و سولفاتها، دکربوکسیلاسیون و دآمیناسیون متابولیزه میگردد.
در بافتها T3 و با اندازهی کمتر T4 به پروتئینهای اختصاصی هسته متصل شده و با نواحی تنظیمکنندهی ژنها فعل و انفعال نشان داده و بیان ژنی را تحت تأثیر قرار میدهند.
در این بررسی، اثرات گروهی از داروها که بر روی تولید، ترشح، انتقال و متابولیسم T4 و T3 و همچنین جذب T4 خارجی تجویزشده اثر میگذارند را شرح خواهیم داد.
جدول 1) گروهی از داروها که آزمونهای عملکرد تیروئید را تحت تأثیر قرار میدهند
| با تغییر در ترشح هورمونهای تیروئید
(↓T3,T4;↓FT4;↑TSH) با کاهش ترشح هورمونهای تیروئید تیونامیدها لیتیوم ید آمیودارون آمینوگلوتتمید (↑T3,T4;↑FT4;↓TSH) با افزایش ترشح هورمونهای تیروئید ید آمیودارون |
| داروهایی که میزان پروتئینهای ناقلT3 و T4 را تحت تأثیر قرار میدهند
با افزایش غلظت TBG (↑T3,T4;N,↑FT4;normal TSH) استروژنها مدولاتورهای انتخابی گیرنده استروژن (SERMs) نارکوتیکها (هروئین و متادون) میتوتان 5-فلورواوراسیل کلوفیبرات تاموکسیفن با کاهش غلظت TBG (↓T3,T4;NFT4,FT3,TSH) آندروژنها استروئیدهای آنابولیک (دانازول) نیکوتینیک اسید نیکوتینیک اسید آهسته رهش در ترکیب با نیاسین یا کولستیپول ال-آسپارژیناز |
|
رقابت بر سر جایگاه اتصال T3و T4 بر روی پروتئینهای ناقل هورمونهای تیروئید (↓T3,T4;↑,↓FT4,FT3;N,↓TSH) آسپیرین (ان استیل سالیسیلیک اسید) سالسالاتها (سالیسیلیک اسید) فورزماید با دوز بالا هپارین فنیل بوتازون سولفونیل اوره کلرال هیدرات فنکلوفناک |
| با افزایش متابولیسم هورمونهای تیروئید
فنیتوئین کاربامازپین فنوباربیتال اکسی کاربامازپین ریفامپین |
| مهار 5́́́-دیدیناسیون; (rT3;N,↑TSH ↓T3;N,↑T4,FT4↑)
آمیودارون داروهای حاجب رادیوگرافی (ایوپانوئیک اسید) پروپیل تیواوراسیل داروهای آنتاگونیست بتا آدنرژیک با دوز بالا گلوکوکورتیکوئیدها (دگزامتازون) |
| با کاهش ترشح TSH(مهار مرکزی) (T4,FT4;↑TSH↓)
دوپامین دوبوتامین آکتروتاید گلوکوکورتیکوئیدها (دگزامتازون) بگزاترون متفورمین |
| داروهایی با اثرات چندگانه
گلوکوکورتیکوئیدها (سرکوب TSH و کاهش تبدیل T4 به T3) آمیودارون بگزاترون (سرکوب TSH و افزایش تجزیه هورمونهای تیروئید) سایتوکاینها (ایجاد تیروئیدیت) ممانعت کنندههای تیروزین کیناز (سانیتینیب، سورافنیب، ایماتینیب) با اختلال در سنتز هورمونهای تیروئید، ایجاد تیروئیدیت، افزایش متابولیسم هورمونهای تیروئید) |
| داروهائیکه موجب کاهش جذب T4 خوراکی میگردند (T4,FT4;↑TSH↓)
کلستیپول کلستیرامین هیدروکسید آلومینیوم سوکرالفات سیپروفلوکساسین |
1- تغییر در ترشح هورمونهای تیروئید
طیف وسیعی از داروها میتوانند باعث مهار ترشح هورمونهای تیروئید گردند. بسیاری از این داروها در درمان بیماران هایپرتیروئید مورداستفاده قرار میگیرند، درصورتیکه کاهش سطح هورمونهای تیروئید ممکن است از اثرات جانبی سایر داروها باشد.
1-1) تیونامیدها: تیونامیدها ترکیباتی هستند که بهطور فعال به داخل غده تیروئید منتقل میشوند. این داروها از ارگانیفیکاسیون ید و جفت شدن زنجیرههای یدوتیرونین ممانعت به عمل آورده و موجب کاهش سطح تیروکسین سرم و ترییدوتیرونین میگردند. پروپیل تیواوراسیل (PTU) و متیمازول (MMI) تیونامیدهای رایج هستند. کاربیمازول که یک زنجیره جانبی کربوکسیل به آن اضافه شده، وقتی شکسته شود به متیمازول تبدیل میشود. سطح هورمونهای تیروئید در اثر مصرف این داروها در طی چند هفته در 90٪ بیماران کاهش مییابد. استفاده از تیونامیدها درمان مؤثر جهت بیماران مبتلا به گریوز و سایر اشکال هایپرتیروئیدیسم میباشد. علاوه بر کاهش سطح هورمونهای تیروئید بهواسطه تأثیر مستقیم دارو بر روی غده تیروئید، پروپیل تیواوراسیل فعالیت آنزیم 5-دیدیناز را مهار نموده، درنتیجه تبدیل T4 به T3 در بافتهای محیطی مختل میگردد.
2-1) لیتیوم: لیتیوم بهطور معمول جهت درمان اختلالات دوقطبی و اختلالات رفتاری مورداستفاده قرار میگیرد. بیمارانی که به مدت طولانی تحت درمان با لیتیوم هستند به هایپوتیروئیدیسم و گواتر مبتلا خواهند شد. لیتیوم اثرات مختلفی روی عملکرد تیروئید دارد.
لیتیوم سبب مهار ترشح هورمون تیروئید میگردد. معتقدند که این دارو موجب کاهش تشکیل قطرات کولوئید در سلولهای فولیکولار تیروئید، کاهش سطح T4 و T3 و درنتیجه افزایش غلظت تیروتروپین (TSH) میشود. در دو سال اول مصرف لیتیوم در حدود 35 درصد بیماران دچار هایپوتیروئیدیسم میگردند؛ اما در برخی از مقالات آمده است که سالها پس از مصرف لیتیوم نیز میتواند این حالت ایجاد شود. هایپوتیروئیدیسم تحتبالینی ناشی از لیتیوم (که با افزایش سطح TSH و طبیعی بودن سطح FT4 و FT3 مشخص میگردد) نسبت به هایپرتیروئیدیسم شایعتر بوده و بیشتر در زنان مسن ایجاد میگردد.
مصرف لیتیوم با بیماریهای خودایمنی تیروئید نیز همراه میباشد. شیوع اتوآنتیبادیهای ضدتیروئید در بیماران مبتلا به هایپوتیروئیدیسم که لیتیوم نیز مصرف مینمایند در مقایسه با افراد یوتیروئید بیشتر است. گزارش شده که استفاده از لیتیوم باعث ایجاد آنتیبادیهای ضدتیروئید و تیروئیدیت خودایمن در این افراد میگردد.
استفاده از لیتیوم ندرتاً ممکن است سبب تیروتوکسیکوز شود (کاهش سطح TSH و افزایش سطح T4 و T3). شیوع بیماری گریوز، گواتر سمی ندولار و تیروئیدیت در افرادی که لیتیوم مصرف میکنند نسبت به سایر افراد جامعه بیشتر است.
اثرات مصرف لیتیوم بر روی کاهش ترشح هورمونهای تیروئید منجر به استفاده درمانی از آن در بیماران هایپرتیروئیدیسم شده و برای احتباس ید رادیواکتیو در درمان مبتلایان به گریوز و سرطان تیروئید مورداستفاده قرار میگیرد.
3-1) یدید: اثر داروهای حاوی ید بر روی غده تیروئید به عملکرد پایه تیروئید بستگی دارد. بهطورکلی سلولهای فولیکولار تیروئید با مکانیسم خودتنظیمی که دارند از تیروئید در برابر اثرات ناشی از مصرف زیاد ید محافظت کرده و این عمل را بهواسطه اثر ولف- چایکوف انجام میدهند.
در هنگام مصرف مقادیر زیاد ید، تیروئید از اثر ولف- چایکوف فرار کرده و میتواند بهطور طبیعی سنتز شده و ترشح هورمونهای تیروئید را از سر گیرد. هایپوتیروئیدیسم ناشی از ید در افرادی مشاهده میگردد که مقدار زیادی ید آلی را از راه گوارشی مصرف نمودهاند (بهطور معمول بیشتر از 2-1 میلیگرم در روز) و غده تیروئید آنها نمیتواند از اثر ولف- چایکوف فرار نماید، این بیماران معمولاً یک بیماری زمینهای تیروئید و یا تاریخچهای از یک بیماری خودایمن (نظیر تیروئیدیت تحتحاد یا پس از زایمان و یا بیماری گریوزی که تحت درمان با ید رادیواکتیو یا تیروئیدکتومی نسبی قرار گرفتهاند) را داشتهاند. همچنین سایر افراد در خطر شامل افراد مسن، نوزادان و بیماران مبتلا به سایر بیماریهای مزمن نظیر فیبروز سیستیک و تالاسمی ماژور میباشند. در هنگام مصرف مقدار زیاد ید، این بیماران کاهشی را در سطح FT4 و FT3 داشته که نتیجه آن افزایش سطح TSH میباشد.
هایپوتیروئیدیسم ناشی از ید، معمولاً در طی 2 تا 3 هفته پس از قطع منبع اضافی ید بهبود مییابد. اگر عامل حاوی ید را نتوان حذف نمود ممکن است درمان جایگزین با لووتیروکسین لازم باشد. این اثر کاهش سطح هورمونهای تیروئید بهواسطه مصرف ید را در درمان بیماران هایپرتیروئیدیسم به کار میبرند که تجویز یدید منجر به سرکوب گذرای ترشح T4 و T3در این بیماران میگردد.
افزایش سطح هورمونهای تیروئید به دلیل مصرف ید، هایپرتیروئیدیسم ناشی از ید یا پدیده جود- بازدو نام دارد و هنگامی به وجود میآید که داروهای حاوی ید به بیمارانی تجویز میشود که تیروئید خودکار داشته و اثر ولف-چایکوف در آنها اتفاق نمیافتد. این حالت بیشتر در مناطقی که کمبود ید وجود دارد و خصوصاً در بیماران مبتلا به گواتر مولتیندولر خودکار ایجاد میشود.
در مناطقی که کمبود ید وجود دارد هایپرتیروئیدیسم ناشی از ید شیوع کمتری داشته و ممکن است در بیماران مبتلا به گریوز خفته یا بیماران دارای ندول خودکار ایجاد شود. خطر تیروتوکسیکوز ناشی از ید در بیمارانی که حالت پایه تیروئید آنها هایپرتیروئیدیسم تحت بالینی است بیشتر است. افراد مسن در معرض خطر ویژهای قرار دارند زیرا شیوع ندولهای خودکار تیروئید و بیماری گریوز خاموش در آنها بیشتر است.
اگر مقدار زیادی ید از راه غذایی، دارودرمانی و یا مواد حاجب رادیوگرافی وارد بدن شود، منجر به هایپرتیروئیدیسم میگردد. در این حالت T4 افزایش، T3 طبیعی و TSH سرکوب میگردد. هایپرتیروئیدیسم معمولاً 4 تا 8 هفته پس از وارد شدن ید به بدن ایجاد میشود. تغییر در سطح هورمونهای تیروئید میتواند به مدت چندین ماه پس از قطع منبع ید تداوم داشته باشد.
بسیاری از داروها منبع ید هستند. علاوه بر افزایش مصرف ید روزانه در رژیم غدایی، داروهای حاوی ید نیز میتوانند موجب تغییر در سطح هورمونهای تیروئید شوند.
این داروها شامل محلول یدید پتاسیم، بتادین واژینال، داروهای آنتیسپتیک جلدی، یدوکینول (داروی ضدآمیب) و آمیودارون (که جداگانه در زیر در مورد آن بحث خواهد شد) میباشند.
مواد حاجب رادیوگرافی، مثل داروهایی که برای آنژیوگرافی عروق کرونر یا سیتیاسکن مورداستفاده قرار میگیرند نیز حاوی مقادیر قابلتوجهی ید هستند و میتوانند منجر به تغییر در میزان هورمونهای تیروئید شوند، بعلاوه برخی از عوامل حاجب محلول در چربی میتوانند سبب دیدیناسیون هورمونهای تیروئید گردند. مواد حاجب رادیوگرافی به دلیل اینکه در طب بالینی استفاده گستردهای دارند بایستی مورد توجه بیشتری قرار گیرند.
4-1) سایر داروهایی که موجب کاهش ترشح هورمونهای تیروئید میگردند
استفاده طولانی مدت از آمینوگلوتتیمید (داروی آنتینئوپلاستیک مهارکننده آروماتاز و عامل ضد آدرنال) ممکن است موجب کاهش غلظت T4 و T3 شود. علاوه بر این گزارش شده که داروهایی مانند تولبوتامید و سولفونامیدها نیز ممکن است موجب هایپوتیروئیدیسم گردند.
اتیونامیدها (بهعنوان داروی خط دوم در درمان توبرکلوز مقاوم به چند دارو مورداستفاده قرار میگیرد) از نظر ساختمانی شبیه متیمازول بوده و سبب کاهش در TT4 بهواسطه کاهش سنتز هورمونهای تیروئید و افزایش در غلظت TSH میگردند. هایپوتیروئیدیسم ایجادشده پس از قطع مصرف دارو قابلبرگشت است.
2- تغییر در غلظت پروتئینهای سرمی ناقل T4 و T3
گلبولین متصلشونده به تیروکسین (TBG)، ترانستیرتین (پرهآلبومین) و آلبومین سه پروتئین اصلی ناقل هورمونهای تیروئید هستند. لیپوپروتئین با دانسیته بالا (HDL) نیز عامل انتقال مقدار بسیار کمی از T4 و T3محیطی است. کینیتیک هورمونهای تیروئید سرم بهواسطه تغییر در غلظت پروتئینهای ناقل هورمونهای تیروئید و یا تغییر در تمایل اتصال هورمونهای تیروئید به پروتئینهای ناقل میتواند تغییر یابد.
1-2) داروهایی که موجب افزایش TBG میگردند
در حدود 70 درصد T4 و T3 سرم به TBG متصل میشوند و تغییر در غلظت TBG میتواند مقادیر سرمی T4 و T3 را تحت تأثیر قرار دهد.
1-1-2) استروژنها ومدولاتورهای انتخابی گیرنده استروژن
درمان با استروژن خوراکی، چه بهعنوان درمان جایگزین استروژن و یا بهعنوان داروی ضدبارداری خوراکی، موجب افزایش تولید کبدی TBG میگردد. افزایش استروژن موجب افزایش سیالیشن TBG (افزودن یک گروه سیالیک اسید به TBG) شده که این امر موجب کاهش کلیرانس کلیوی و افزایش نیمهعمر TBG میگردد. این اثر وابسته به دوز دارو میباشد. این اثر معمولاً دو هفته پس از مصرف استروژن رخ داده و سطح جدید هورمونهای تیروئید معمولاً پس از 4 تا 8 هفته ایجاد میشود. باقی ماندن بیمار در حالت یوتیروئید و طبیعی بودن غلظت TSH سرم در طی این دوره بستگی به توانایی تیروئید در افزایش گذرای ترشح T4دارد.
زنان هایپوتیروئیدی که لووتیروکسین دریافت میکنند ممکن است نیاز به افزایش دوز لووتیروکسین داشته باشند تا در حالت یوتیروئید باقی بمانند. دوز استروژنی که معمولاً مورداستفاده قرار میگیرد، مانند اتینیل استرادیول (30-20 میلیگرم در روز) که در قرصهای ضدبارداری خوراکی وجود دارد، یا استروژن کونژوگه (625 میلیگرم) سبب افزایش 50 درصدی در غلظت TBG شده که این خود سبب افزایش 35 درصدی غلظت TT4 و اندکی افزایش در سطح TT3 میگردد. استروژنهای پوستی به دلیل جذب از راه پوست از کبد عبور نکرده، بنابراین سطح TBG و TT4 را افزایش نمیدهند. درمان با پروژسترون بهطور مجزا یا همراه با استروژن درمانی، تأثیری بر روی غلظت TBG ندارد.
SERMs (مدولاتورهای انتخابی گیرنده استروژن) که شامل تاموکسیفن، درولوکسیفن و رالوکسیفن میباشند، خطر سرطان سینه و ناشی از یائسگی و خطر بیماریهای قلبی و عروقی را کاهش میدهند. این دسته دارویی اثر آگونیستی ضعیفی در کبد داشته و بنابر این غلظت TBG و T4 را افزایش میدهند. رالوکسیفن تغییرات قابلتوجهی در غلظت TBGو T4 ایجاد نمیکند.
درولوکسیفن که از نظر ساختمانی مشابه تاموکسیفن است غلظت TBG و T4 را افزایش میدهد اما در زنان یائسه مقدار T4 نمایه را تغییر نمیدهد.
2-1-2) مخدرها
مصرف طولانی مدت هروئین و متادون با افزایش غلظتTBG همراه میباشد؛ اما مشکل است که بتوان تعیین نمود که تغییر غلظت TBG ناشی از اثر مستقیم مخدرهاست یا ناشی از نارسایی کبدی همزمانی که در این بیماران وجود دارد. کوکایین چنین تأثیراتی را ندارد.
3-1-2) سایر داروهایی که موجب افزایش TBG میگردند
میتوتان (که جهت درمان بیماران مبتلا به آدرنوکورتیکال کارسینوما به کار میرود) موجب افزایش گلبولینهای متصلشونده به هورمون از جمله TBG میگردد. این اثر یک سال پس از قطع مصرف میجوتان برگشتپذیر است.
2-2) داروهایی که موجب کاهش TBG میگردند
1-2-2) آندروژنها: برخلاف اثر استروژنها، آندروژنها سطح سرمی TBG را کاهش میدهند. مقدار TT4 و TT3 کاهش و مقدار TSH بدون تغییر است و بیماران از نظر بالینی یوتیروئید هستند. علت کاهش غلظت TBG به دلیل تجویز آندروژنها واضح نیست و معتقدند که ممکن است ناشی از تأثیر بر روی نسخهبرداری باشد، اگرچه تجزیه پروتئینها ممکن است نقشی در افزایش کلیرانس داشته باشد.
همانند آندروژنها، درمان طولانیمدت با گلوکوکورتیکوئیدها نیز موجب کاهش سطح سرمی TBG میگردد (که در زیر شرح داده میشود).
دانازول (یک استروئید صناعی با خواص آنتیگونادوتروپیک) در زنان جوان که مشکل نازایی دارند و در درمان آندومتریوز مورد استفاده قرار میگیرد. این دارو موجب تغییر در آزمایشهای عملکرد تیروئید میشود. در 8 بیمار که روزانه 800 میلیگرم دانازول به مدت 1 تا 5 ماه مصرف مینمودند، TT4 کاهش یافته، درصورتیکه T3uptake افزایش پیدا نموده است. TSH و FTI در این بیماران طبیعی بوده است و نشانگر این مطلب است که بیماران در طول درمان با دانازول یوتیروئید بودهاند.
2-2-2) سایر داروهایی که موجب کاهش TBG میگردند
نیکوتینیک اسید: (که برای درمان هایپرکلسترولمی مورداستفاده قرار میگیرد) موجب کاهش 25 درصدی در غلظت TBG میگردد. بیمارانی که تحت درمان با نیکوتینیک اسید به مقدار 6-3 گرم به همراه کولستیپول بودند، در آنها کاهش TT4 کمتر بوده و غلظت سرمی TSH و FT4 آنها تغییری نمیکند. مصرف ال-آسپارژیناز (یک داروی آنتینئوپلاستیک) با کاهــش حاد TBG همراه بوده است.
3-2-2) رقابت با T4 و T3 در جایگاه اتصال پروتئینهای ناقل
جایگاه اتصال پروتئینهای ناقل بهوسیله تعداد زیادی از داروها مهار میشود، بنابراین موجب تغییر در غلظت T4و T3 تام سرم میگردد. ابتدا در اثر جداسازی هورمونها از پروتئینهای ناقل FT4 افزایش مییابد، اما با ادامه درمان FT4 و TSH طبیعی شده و TT4 کاهش مییابد. بهطور مشخص این حالت وقتی پیش میآید که داروهای موردنظر در دوز بالا مورداستفاده قرار گیرند.
سالیسیلاتها مانند آسپیرین (داروهای ضدالتهابی غیراستروئیدی) وقتیکه در دورهای بالاتر از 2 گرم در روز مورداستفاده قرار گیرند از اتصال T4 و T3 به TBG و ترانستیرتین ممانعت به عمل میآورند. به همین صورت سالسالاتها (سالیسیلیک اسید) فقط موجب ممانعت از اتصال T4 به TBG و در نتیجه موجب 30 درصد کاهش در مقدار TT4 و با درجات کمتری TT3 میشوند.
تکدوز آسپیرین و سالسالاتها غلظت هورمونهای تام و آزاد را کاهش میدهند، اما مصرف یکهفتهای این دو دارو موجب کاهش TT4، FT4 (فقط در اثر مصرف سالسالاتها) FT3 ,TT3 و TSH میگردد.
ایبوپروفن، ناپروکسن و ایندومتاسین چه بهصورت تکدوز و چه بهصورت مصرف یکهفتهای تأثیری بر روی هورمونهای تیروئید ندارند. فنکلوفناک نیز باعث جدا شدن T4 از پروتئینهای ناقل میشود.
فورزماید (داروی مدر) وقتی در دوزهای بالاتر از 80 تا 100 میلیگرم در روز مورداستفاده قرار گیرد از اتصال T4 به TBG ممانعت میکند. این اثر در تزریق داخل وریدی دارو شایعتر از مصرف خوراکی آن میباشد. کاهش TT4 و افزایش FT4 گذرا بوده و بستگی به فاکتورهای متغیر دیگری نظیر تکرار دوز فورزماید، میزان کلیرانس کلیوی دارو و غلظت پروتئینهای اتصالی در سرم (که این دیورتیک به آن متصل میشود) دارد.
توجه به این نکته مهم است که فوروزماید و آسپیرین موجب میشوند که T4 با تمایل کمتری به پروتئینهای ناقل متصل شود.
هپارین: تجویز هپارین منجر به افزایش غلظت FT4 سرم میشود. این دارو موجب فعال شدن آنزیم لیپوپروتئین لیپاز موجود در اندوتلیوم عروقی شده که تریگلیسرید را به اسیدهای چرب آزاد هیدرولیز میکند. اسیدهای چرب آزاد از اتصال FT3 و FT4 به پروتئینهای ناقل ممانعت به عمل میآورند. دوزهای بالای این دارو چه بهصورت زیرجلدی یا داخل وریدی موجب افزایش T4 پلاسما و کاهش T4 بافتی میگردد، اما با تیروتوکسیکوز بالینی همراه نیست. چنین تأثیری در میزان FT4 پلاسما پس از تجویز 200 واحد آنوکساپرین هم مشاهده شده است.
3) متابولیسم هورمونهای تیروئید
متابولیسم کبدی و دیدیناسیون T3 و T4 توسط تعداد زیادی از داروها دستخوش تغییر میشود.
1-3) متابولیسم کبدی
وجود اشکال در مسیرهای آنزیم کبدی P450 اکسیداز موجب کاهش T4 سرم به دلیل کاهش نیمهعمر پلاسمایی هورمونهای تیروئید میگردد. این تأثیر در بیمارانی که دارای مشکل در محور پایه هیپوتالاموس- هیپوفیز- تیروئید بوده و قادر به جبران تغییرات ایجادشده در سطح هورمونهای تیروئید نیستند، واضحتر است، بنابراین وقتی بیمارانی که با داروهایی که مسیر P450 را دچار اشکال میکنند، درمان شوند ممکن است لازم باشد تا دوز لووتیروکسین را در آنها افزایش دهیم.
1-1-3) داروهای ضد صرع
فنیتوئین و کاربامازپین سبب هایپوتیروکسینمی یوتیروئید بهواسطه افزایش متابولیسم هورمونهای تیروئید میگردند. همچنین این داروها موجب جدا شدن هورمونهای تیروئید از پروتئینهای ناقل خصوصاً TBG میشوند. کاربامازپین در مقایسه با فنیتوئین تأثیر کمتری بر روی میزان هورمونهای تیروئید دارد، اما ممکن است در ترکیب با سایر داروهای ضد صرع این اثر تقویت شود. فنیتوئین و کاربامازپین غلظت FT4 و FT3 را کاهش میدهند. T4 در حدود 40 درصد کاهش یافته ولی کاهش T3 کمتر قابلتوجه است.
فنوباربیتال مانند فنیتوئین و کاربامازپین موجب فعال شدن آنزیمهای کبدی شده و منجر به افزایش متابولیسم T3 و T4 میگردند. محور هیپوتالاموس– هیپوفیز- تیروئید طبیعی است، غلظت TT3 و TT4 و TSH در محدوده طبیعی قرار دارد ولی در بیماران هایپوتیروئیدی که لووتیروکسین دریافت میکنند ممکن است نیاز باشد تا دوز دارو را افزایش دهیم.
اکسیکاربامازپین (داروی ضد صرع که نسبت به بقیه عوارض جانبی کمتری دارد) تأثیر کمتری بر روی سیستم P450 اکسیداز کبدی دارد، اما بااینوجود غلظت سرمی T4 را کاهش میدهد درصورتیکه TSH در محدوده طبیعی قرار دارد.
2-1-3) ریفامپین
ریفامپین که یک دارو است، تأثیر بالقوهای روی سیستم P450 اکسیداز کبدی دارد. بیمارانی که با این دارو درمان میشوند به دلیل افزایش کلیرانس T4، کاهش قابلتوجهی در TT4 و FT4 دارند. تغییرات T4 نسبت به T3 چشمگیرتر است، زیرا گلوکورونیداسیون T4 تقویت میشود، درصورتیکه T3 در مسیر سولفاتاسیون متابولیزه میگردد که بهوسیله سیستم اکسیژناز کبدی دستخوش تغییر نمیشود. بیماران این حالت را بهوسیله افزایش ترشح T4 جبران میکنند که نتیجه آن افزایش اندازه غده تیروئید میباشد.
2-3) دیدیناسیون
دیدیناسیون (مرحله برداشت ید از T4) مسیر اولیه متابولیسم یدوتیرونین است. بسیاری از داروها در فعالیت آنزیمهای دیدیناز تداخل ایجاد مینمایند. دیدیناز نوع یک (D1) تولیدکننده اولیه T3 در بافتهای خارج از تیروئید بوده و هدف اصلی دارو است. ممانعت از فعالیت این آنزیم موجب کاهش غلظت T3 سرم میگردد. غلظت rT3 (T3 معکوس) ممکن است افزایش یابد. داروهای حاوی ید در مقایسه با داروهایی که ید ندارند ممانعتکننده بالقوه آنزیم دیدیناز میباشند.
1-2-3) داروهای ممانعتکننده دیدیناز حاوی ید
یکی از اثرات چندگانه آمیودارون بر روی آزمونهای عملکرد تیروئید ممانعت از فعالیت آنزیم دیدیناز نوع یک است که در بخش بعدی بهطور مفصل شرح داده میشود.
برخی ازاز داروهای رادیوگرافی حاوی ید، علاوه بر ایجاد هایپو یا هایپرتیروئیدیسم ناشی از ید، مهارکننده دیدیناسیون T4 بوده و بنابراین در درمان هایپرتیروئیدیسم نیز ممکن است مورداستفاده قرار گیرند. داروهای رادیوکنتراست محلول در چربی مانند آیوپانوئیک اسید، سدیم آیپودات و تیروپانوآت، موجب کاهش کلیرانس پلاسمایی T4، افزایش TT4 و FT4 و کاهش TT3 و FT3 میگردند. مانند آمیودارون، این عوامل رادیوگرافیک علاوه بر دیدیناز نوع 1، دیدیناز نوع 2 را نیز مهار میکنند. نتیجه عمل این دارو افزایش گذرای TSHاست که بعداً طبیعی میگردد. این داروها به آهستگی دفع شده، بنابراین سبب هایپوتیروئیدیسم طولکشنده میگردند. عوامل دارویی رادیوکنتراست محلول در آب نمیتوانند دیدیناسیون را مهار نمایند.
2-2-3) داروهای مهارکننده دیدیناز فاقد ید
پروپیل تیواوراسیل(PTU) علاوه بر اثر کاهنده بر روی ترشح هورمونهای تیروئید موجب مهار تبدیل T4 به T3نیز میگردد، درصورتیکه متیمازول فاقد این عملکرد است. پروپیل تیواوراسیل، آنزیم 5-دیدیناز که موجب تبدیل T4 به T3 میگردد را مهار میکند. این عمل در صورت تجویز دوزهای بالای PTU (400 تا 600 میلیگرم در روز) صورت گرفته و تقریباً موجب کاهش 25 تا 35 درصدی میزان T3 پس از 48 ساعت میگردد. غلظت TSH سرم ممکن است افزایش یابد و پاسخ TSH به تحریک توسط TRH تشدید شود. این تغییرات در آزمونهای عملکرد تیروئید پس از قطع دارو برگشتپذیر میباشد.
آنتاگونیستهای گیرنده بتا معمولاً جهت درمان علائم تیروتوکسیکوز (مانند تاکیکاردی، لرزش و اضطراب) که به دلیل سرکوب فعالیت سیستم سمپاتیک ایجاد میشوند، مورداستفاده قرار میگیرند، اما پروپرانولول (آنتاگونیست غیرانتخابی گیرنده بتا) بر روی متابولیسم خارج تیروئیدی هورمونهای تیروئید از طریق مهار آنزیم دیدیناز نوع 1 اثر میگذارد. این دارو هنگامیکه در مقادیر بیش از 160 میلیگرم در روز مورداستفاده قرار گیرد موجب کاهش متوسط میزان T3 سرم به دلیل کاهش تبدیل T4به T3میگردد. به دلیل مهار ایجاد شده غلظت rT3 (T3 معکوس) افزایش مییابد، بیماران یوتیروئید بوده و سطح سرمی TSH آنها طبیعی است. این تأثیرات مختص به پروپرانولول و با درجات کمتری سایر عوامل دارویی خانواده آنتاگونیستهای گیرنده بتا میباشد. آتنولول، متوپرولول وآلپرهنولول نیز موجب کاهش سطح سرمی T3 (اما نه بشدت و مداومت پروپرانولول) در بیماران هایپرتیروئید میگردند.
دگزامتازون نیز موجب مهار 5-دیدیناز شده که در ادامه در مورد آن بحث میشود.
4) سرکوبکنندههای مرکزی TSH
چندین دارو موجب مهار ترشح TSH هیپوفیزی و درنتیجه کاهش غلظت سرمی TSH میگردند. بهطور مشخص این کاهش ملایمتر از سرکوب ایجادشده در هایپرتیروئیدیسم است. افتراق تأثیرات ناشی از این داروها با تغییرات ایجادشده توسط بیماریهای غیرتیروئیدی (NTI) در مراحل شدید بیماری مشکل است، زیرا در این بیماران بسیاری از این داروها مورداستفاده قرار میگیرند.
دوپامین وقتیکه حداقل به میزان یک میکروگرم بر کیلوگرم وزن بدن در دقیقه مورداستفاده قرار گیرد موجب سرکوب TSH سرم، TSH آزادشده توسط تحریک TRH و کاهش زیرواحد آلفا و بتای TSH میگردد. تزریق طولانیمدت دوپامین منجر به کاهش پایدار TSH و همچنین کاهش ترشح T4 وT3 از غده تیروئید میگردد. بایستی توجه نمود که این تغییرات در آزمونهای عملکرد تیروئید بهطور قطع در اثر تجویز دوپامین نبوده و ممکن است ناشی از بیماریهای زمینهای نیز باشد.
تجویز دوزهای بالای دوبوتامین منجر به کاهش قابلتوجه در غلظت TSH در بیماران مبتلا به بیماریهای حاد به دلیل سرکوب مرکزی TSH میگردد.
(آنالوگ سوماتواستاتین و هورمون رشد) در دوزهای بالاتر از 100 میکروگرم در روز موجب کاهش ترشح TSH شده و به همین دلیل موجب کاهش ترشح T4 نیز میگردد. این دارو برخی مواقع در درمان آدنومهای هیپوفیزی ترشحکننده TSH بهمنظور کاهش غلظت TSH سرم و کوچک کردن غده هیپوفیز مورداستفاده قرار میگیرد، اما استفاده طولانیمدت از اکتروتاید منجر به کاهش طولانیمدت TSH نمیگردد، زیرا سرکوب TSH منجر به کاهش ترشح هورمونهای تیروئید گشته و این خود بهصورت فیدبک موجب ترشح دوباره TSH میگردد، نیز موجب سرکوب ترشح TSH در افراد طبیعی و هم در بیماران هایپوتیروئیدی که با یا بدون تجویز لووتیروکسین درمان میشوند، میگردد. گلوکوکورتیکوئیدها و بگزاترون نیز سبب سرکوب ترشح TSH شده که در زیر در مورد آنها بحث خواهد شد.
5) داروهایی با اثرات چندگانه
1-5) گلوکوکورتیکوئیدها
گلوکوکورتیکوئیدها اثرات متفاوتی بر روی عملکرد تیروئید دارند. وقتی این داروها در دوزهای بالا (دگزامتازون به مقدار 0/5 میلیگرم در روز و یا بیشتر و یا هیدروکورتیزون به مقدار 100 میلیگرم در روز) مورداستفاده قرار گیرند، موجب کاهش سطح سرمی TSH به دلیل مهار مرکزی ترشح TSH میگردند. کاهش سطح TSH سرم بهاندازهای که در هایپرتیروئیدیسم دیده میشود نیست.
در طی 48 ساعت اول تجویز کوتاهمدت گلوکوکورتیکوئیدها، سطح TSH سرم بهطور گذرا ممکن است به بالاتر از مقدار اندازهگیری شده آن قبل از شروع درمان برسد. تجویز طولانیمدت گلوکوکورتیکوئیدها منجر به سرکوب دائمی ترشح TSH نمیگردد، زیرا کاهش ترشح هورمونهای تیروئید (درنتیجه کاهش ترشح TSH) موجب تحریک دوباره ترشح TSH میگردد.
دوزهای بالای گلوکوکورتیکوئیدها، مانند دگزامتازون 4 میلیگرم در روز، ممکن است در طی 3 روز موجب کاهش غلظت T3 سرم گردد. تولید خارج تیروئیدی T3به دلیل مهار آنزیم
5-دیدیناز تقریباً 30 درصد کاهش و تولید rT3نیز افزایش مییابد. درمان طولانیمدت با گلوکوکورتیکوئیدها منجر به کاهش غلظت TBG احتمالاً به دلیل کاهش نسخهبرداری میگردد، اگرچه تخریب این پروتئین نیز ممکن است نقشی در افزایش کلیرانس آن داشته باشد. این تأثیرات برروی TBG و T3 با کاهش اندک T4 در افراد سالم همراه است، اما وقتی این دارو در دوزهای بالا در بیماران مبتلا به گریوز تجویز شود ترشح T4کاهش مییابد. علت اینکه این کاهش ناشی از اثر مستقیم دارو در مهار تیروئیدی است و یا به دلیل کاهش تولید ایمونوگلبولین محرک تیروئید (TSI)است، ناشناخته است.
2-5) آمیودارون
آمیودارون داروی غنی از ید بوده که بهطور معمول در درمان تاکیآریتمی قلبی مورداستفاده قرار میگیرد. اثر آمیودارون بر روی آزمونهای عملکرد تیروئید را میتوان به دو صورت طبقهبندی نمود:
الف) اثرات ناشی از سمیت مستقیم دارو
ب) اثرات وابسته به ید
37 درصد وزن آمیودارون ید است. دوز معادل 400 میلیگرم در روز آمیودارون در حدود 100 برابر مقدار مجاز مصرف ید در روز میباشد، بنابراین تغییر در آزمونهای عملکرد تیروئید در بیمارانی که آمیودارون مصرف میکنند اجتنابناپذیر است. به دلیل اینکه نیمهعمر آمیودارون 100 روز است این اثرات میتواند طولانیمدت باشد. خطر ایجاد مشکلات عملکردی تیروئید بهواسطه مصرف آمیودارون در حدود 2 تا 30 درصد بوده و به دو فاکتور عمده بستگی دارد:
الف) وضعیت پایه تیروئید بیمار
ب) میزان ید دریافتی رژیم غذایی در آن منطقه جغرافیایی
بیماران یوتیروئید با غده تیروئید طبیعی که تحت درمان با آمیودارون هستند بهطور متناوب دچار تغییر در غلظت T3 و T4 سرم میشوند ولی 90 درصد آنها یوتیروئید باقی میمانند. در حالات حاد مصرف آمیودارون (کمتر از 3 ماه)، غلظت TSH ,TT4 ,FT4 افزایش یافته درصورتیکه غلظت FT3 و TT3کاهش مییابد. این اثر ناشی از مهار مستقیم دیدیناز کبدی (D1) و مهار ورود هورمونهای تیروئید به بافتهای محیطی است. سطح TSH سرم پس از اولین روز درمان افزایش یافته درصورتیکه تغییر در غلظت T3 و T4 سرم 2 تا 4 روز بعد ایجاد میشود. (جدول2)
در افراد یوتیروئید 3 تا 6 ماه پس از مصرف آمیودارون TSH سرم طبیعی، غلظت TT4 و FT4 سرم در بالاترین حد محدوده طبیعی و سطح سرمی TT3در پایینترین حد محدوده طبیعی قرار دارد.
هایپوتیروئیدیسم ناشی از آمیودارون (AIH)
این حالت میتواند در بیمارانی که دارای فاکتورهای خطری مانند تیروئیدیت هاشیموتو، مثبت بودن آنتیبادیهای ضدتیروئید، سابقه درمان قبلی با ید رادیواکتیو یا تیروئیدکتومی نسبی هستند، ایجاد شود. به دلیل اینکه این اختلالات در خانمها شایعتر است، AIH در زنان شایعتر از مردان است. بهطورکلی هایپوتیروئیدیسم ناشی از ید در نواحی جغرافیایی با ید کافی از هایپرتیروئیدیسم شایعتر بوده و ممکن است در 30 درصد بیمارانی که آمیودارون مصرف میکنند ایجاد شود.
این هایپوتیروئیدیسم همچنان که قبلاً گفته شد در نتیجه عدم توانایی تیروئید برای فرار از اثر ولف- چایکوف به علت محتوای ید داروی آمیودارون میباشد. به نظر نمیرسد که این پدیده وابسته به دوز باشد. این حالت ممکن است 6 تا 12 ماه پس از آغاز درمان با این دارو ایجاد شود. بهبودی در طی 2 تا 4 ماه پس از قطع مصرف آمیودارون ایجاد میشود و همراه با طبیعی شدن سطح TSH سرم میباشد، مگر اینکه تیروئیدیت هاشیموتو از قبل وجود داشته باشد.
هایپرتیروئیدیسم ناشی از آمیودارون که معمولاً به آن تیروتوکسیکوز ناشی از آمیودارون (AIT) اطلاق میشود به دو شکل طبقهبندی میگردد:
- القاشده توسط ید (Type 1 AIT)
- تیروئیدیت التهابی (Type 2 AIT)
شیوع این دو نوع بر اساس مقدار دریافتی ید موجود در نواحی مختلف جغرافیایی متفاوت است.
در مناطق کمبود ید، نوع یک غالبتر است، درصورتیکه در مناطق جغرافیایی با ید کافی AIT کمتر شایع بوده و درصورتیکه وجود داشته باشد نوع دو غالبتر است. AIT نوع یک بهطور شایع در افرادی که دارای غده تیروئید خودکار (در نتیجه بیماری گریوز یا گواتر مولتی نودولار) هستند، بیشتر دیده میشود که نتیجه آن افزایش تولید T3 و T4در غده تیروئید و سرکوب TSH است. این امر نتیجه افزایش محتوای ید داروی آمیودارون و اختلال در پدیده ولف- چایکوف میباشد.
AIT نوع دو، یک تیروئیدیت تخریبی است که ناشی از سمیت مستقیم داروی آمیودارون بر روی سلولهای فولیکولار تیروئید است که منجر به افزایش غلظت T3و T4میگردد و هفتهها تا ماهها به طول میانجامد. به دنبال این حالت ممکن است یک فاز هایپوتیروئیدی و یا حتی بهبودی در بیمار ایجاد شود. نوع یک و نوع دو AIT ممکن است بهطور همزمان و بهصورت مخلوط وجود داشته باشد.
جدول 2) اثرات آمیودارون بر روی آزمونهای عملکرد تیروئید در افراد یوتیروئید
|
طول مدت درمان |
آزمایش |
|
|
مزمن (بیشتر از سه ماه) |
تحت حاد (کمتر از سه ماه) |
|
|
افزایشیافته باقی میماند و حدوداً 40٪بالاتر از حالت پایه بوده و ممکن است در قسمت بالای محدوده طبیعی و یا مختصری افزایش یافته باشد |
افزایش متوسط |
T4 |
|
معمولاً در قسمتهای پائینی محدوده طبیعی است یا مختصری کاهش دارد. |
کاهش، معمولاً در قسمتهای پائینی محدوده طبیعی |
T3 |
|
طبیعی اما برخی مواقع ممکن است بالا یا پایین باشد. |
بهطور گذرا افزایش مییابد (تا mu/l20) |
TSH |
|
افزایش |
افزایش |
rT3 |
3-5) بگزاترون
جهت درمان لنفوم سلول T به کار میرود. مشخص شده که این دارو موجب هایپوتیروئیدیسم با اثرات مختلف بر روی آزمونهای عملکرد تیروئید میگردد. بگزاترون فعالیت پروموتور TSH، سنتز TSH mRNA و متعاقب آن ترشح TSH را مهار نموده و موجب هایپوتیروئیدیسم مرکزی با کاهش سطح TT4و TT3میگردد. همچنین این دارو موجب تغییر در متابولیسم محیطی هورمونهای تیروئید بدون توجه به اثر ترشح TSH نیز میگردد.
4-5) سایتوکاینها
درمان با سایتوکاینها با تغییر در آزمونهای عملکرد تیروئید همراه است. اینترفرون آلفا و اینترلوکین-2 موجب پیدایش آنتیبادی تیروپراکسیداز (Anti-TPO) میگردند. در حدود 35 درصد بیماران درمان شده با اینترفرون آلفا تغییراتی را در سطح هورمونهای تیروئید خواهند داشت. بسیار مهم است که در بیماران مبتلا به هپاتیت C و مالتیپل اسکلروزیس این تغییرات را شناسایی نماییم، زیرا این افراد نسبت به افراد عادی در معرض خطر بیشتری برای بیماریهای خودایمنی تیروئید هستند.
اینترفرون آلفا موجب هایپو و هایپرتیروئیدیسم میگردد، گرچه مکانیسم ایجاد آن بهخوبی روشن نشده اما ممکن است این تغییرات با واسطه ایمنی باشد. تیروئیدیت التهابی با تیروتوکسیکوز و متعاقب آن هایپرتیروئیدیسم نیز گزارش شده است. عملکرد بد تیروئید از هر نوعی که باشد تقریباً 3 ماه پس از شروع درمان دیده شده و ماهها پس از قطع دارو ادامه خواهد داشت. زنان و بیمارانی که از قبل آنتیبادی تیروئید دارند در خطر افزایش بدی عملکرد تیروئید در طی درمان با اینترفرون قرار دارند. اگرچه گزارشهایی در مورد تغییر در آزمونهای عملکرد تیروئید به واسطه مصرف اینترفرون بتا گزارش شده است، اما روشن نیست که این همبستگی واقعی باشد.
مصرف سایتوکاینهای دیگری نظیر اینترلوکین- 2(IL-2) در 15 تا 40 درصد بیماران با هایپوتیروئیدیسم گذرا و تیروئیدیت خودایمن همراه میباشد. در این موارد تغییر در آزمونهای عملکرد تیروئید پس از قطع درمان به حالت طبیعی برمیگردد. چنین تأثیری بر روی آزمونهای عملکرد تیروئید بهواسطه مصرف دنیلوکین دیفیتوکس (که یک ترکیب سمی شامل جایگاه ترجمهشونده و آنزیمی سم دیفتری و ناحیه اتصال لیگاند نوترکیب اینترلوکین-2 انسانی است) نیز توصیف شده است.
اینترفرون گاما ممکن است بیان آنتیژنهای سازگاری نسجی کلاس 2 را تحت تأثیر قرار داده و ممکن است بیماری خودایمن تیروئید را افزایش دهد.
5-5) سایر داروهایی که روی آزمونهای عملکرد تیروئید مؤثرند
سانیتینیب که مهارکننده تیروزین کیناز است و در تومورهای استرومال دستگاه معدی رودهای (GIST) و کارسینومای متاستاتیک سلول کلیوی مورداستفاده قرار میگیرد، میتواند سبب سوء عملکرد تیروئید و به دنبال آن تغییر در آزمونهای عملکرد تیروئید گردد. درحدود 36 درصد بیمارانی که سانیتینیب مصرف مینمایند در خطر ابتلا به هایپوتیروئیدیسم قرار دارند.
براساس اندازهگیری 5 هفتهای TSH پس از شروع مصرف سانیتینیب در بیماران مبتلا به GIST، خطر ابتلا به هایپوتیروئیدیسم با طولانی شدن درمان افزایش یافته اما این امر ممکن است برگشتپذیر باشد، اگرچه تعیین زمان بهبودی مشخص نیست. هایپوتیروئیدیسم ممکن است ناشی از اختلال در ساخت هورمونهای تیروئید پس از درمان بوده و به دنبال آن تیروئیدیت ایجاد شود. متعاقب تیروئیدیت که ممکن است شامل دورهای از تیروتوکسیکوز نیز باشد، ممکن است هایپوتیروئیدیسم گذرا و یا دائمی ایجاد شود.
معتقدند که سانیتینیب ممکن است روند آلیسازی هورمونهای تیروئید را مهار کرده و یا بهعنوان یک مهارکننده رقابتی آنزیم تیروپراکسیداز عمل کند (مکانیسمی مشابه متیمازول یا پروپیل تیواوراسیل). سانیتینیب در بیمارانی که تیروئید آنها برداشته شده و لووتیروکسین دریافت میکنند میتواند بهواسطه افزایش کلیرانس هورمونهای تیروئید موجب تغییراتی در آزمونهای عملکرد تیروئید گردد. سایر مهارکنندههای تیروزین کیناز نیز میتوانند موجب تغییراتی در سطح هورمونهای تیروئید گردند. ایماتینیب که در درمان GIST مورداستفاده قرار میگیرد، در بیمارانی که تیروئید آنها برداشته شده موجب افزایش نیاز به دوز لووتیروکسین میگردد که عمل آن بهواسطه افزایش متابولیسم هورمونهای تیروئید میباشد.
سورافنیب (رسپتور فاکتور رشد اندوتلیال عروقی (VEGF) مهارکننده تیروزین کیناز) نیز موجب هایپو یا هایپرتیروئیدیسم میگردد. اما این بیماران کمتر به درمان نیاز پیدا میکنند.
متسانیب که در درمان کانسر تمایزیافته تیروئید مقاوم به ید رادیواکتیو مورداستفاده قرا میگیرد موجب افزایش TSH میگردد.
تالیدومید که قبلاً بهعنوان مسکن مورداستفاده قرار میگرفت و به دلیل سرطانزا بودن از رده خارج شد، اکنون بهعنوان تعدیلکننده سیستم ایمنی در برخی بیماریها نظیر مالتیپل میلوما مورداستفاده قرار میگیرد. هایپوتیروئیدیسم ناشی از تالیدومید در حدود 14 درصد از بیمارانی که این دارو را دریافت میکنند دیده شده و این بیماران طی 3 ماه دچار هایپوتیروئیدیسم تحت بالینی میگردند. این دارو به دلیل تولید چند سیتوکاین مختلف موجب تغییر در جمعیت سلولهای T شده و ممکن است موجب شروع پاسخ ایمنی و تخریب خودایمنی غده تیروئید گردد. یک فرضیه دیگر نشان میدهد که این دارو از ترشح هورمونهای تیروئید بهواسطه تأثیر مستقیم بر روی سلولهای تیروئید ممانعت به عمل میآورد.
کوتیاپین نیز موجب تغییر در آزمونهای عملکرد تیروئید میگردد. این دارو که بهعنوان یک داروی آنتیسایکوتیک مورداستفاده قرار میگیرد، تقریباً در حدود 6 هفته پس از شروع درمان موجب کاهش TT4 و FT4 میشود. تغییراتی در غلظت TSH مشاهده نشده است. مکانیسم عمل آن بهخوبی شناخته نشده ولی مهار تولید یا ترشح هورمونهای تیروئیدی، تغییر در متابولیسم کبدی دارو و تغییر در دیدیناسیون هورمونهای تیروئید از فرضیات احتمالی میباشند.
6) داروهایی که جذب لووتیروکسین را کاهش میدهند
دستگاه گوارش نقش اندکی در متابولیسم هورمونهای تیروئید دارد، درصورتیکه برای جذب کافی لووتیروکسین باید دئودنوم و ژئوژونوم سالم باشد. 80درصد لووتیروکسین خوراکی در طی 3 ساعت اول پس از مصرف دارو جذب میشود. ازآنجاییکه برای درمان بیماران جذب ثابت و مطلوب دارو موردنیاز است، لازم است تا داروها و شرایطی را که ممکن است در جذب لووتیروکسین اختلال ایجاد میکنند را شناسایی نماییم، زیرا کاهش جذب T4 موجب افزایش TSH میگردد.
هیدروکسید آلومینیوم حاوی آنتیاسید و سوکرالفات که در درمان زخمهای گوارشی مورداستفاده قرار میگیرد موجب کاهش جذب لووتیروکسین میگردد. داروهای جدید جهت اختلالات اسید معده، مانند مسدودکنندههای کانال H2 و مهارکنندههای پمپ پروتون چنین تأثیری روی جذب لووتیروکسین ندارند.
سولفات آهن و کربنات کلسیم نیز موجب کاهش جذب لووتیروکسین و افزایش TSH میگردند.
داروهای متصلشونده به فسفات مانند سولامر و کربنات لانتانوم و کرومیوم پیکولینات که در درمان هایپرفسفاتمی مورداستفاده قرار میگیرند نیز موجب کاهش جذب لووتیروکسین میگردند.
کلستیرامین (تجزیهکننده اسیدهای صفراوی) نیز موجب کاهش جذب T4 خوراکی و افزایش TSH میگردد.
منتظر نقطه نظرات، پیشنهادها و راهنماییهای شما دوستان گرامی هستیم.
Drhemmatilab@yahoo.com
References:
1- Martin I. Surks, M.D., and Rubens Sievert, M.D. Drugs and Thyroid Function. N Engl J Med 1995; 333:1688-1694December 21, 1995DOI: 10.1056/NEJM199512213332507
2-Betty J Dong.How medications affect thyroid function..West J Med. 2000 Feb; 172(2): 102–106.
3-Martin I Surks, MD. Drug interactions with thyroid hormones.
4- Olympia Koulouri, Carla Moran, David Halsall, Krishna Chatterjee, Mark Gurnell. Pitfalls in the measurement and interpretation of thyroid function tests. Best Practice & Research Clinical Endocrinology & Metabolism. Dec 2013, Vol. 27: 745-762
5- Drugs affecting thyroid function. Thyroid. 2010 Jul;20(7):763-70. doi: 10.1089/thy.2010.1635.
6- Surks MI, Sievert R. Drugs and Thyroid Function. N.Engl.J.Med. 1995 Dec 21;333(25):1688–94.
7- de Groot JW, Zonnenberg BA, Plukker JT, Der Graaf WT, Links TP. Imatinib Induces Hypothyroidism in Patients Receiving Levothyroxine. Clin.Pharmacol.Ther. 2005;78(4):433–8.
8-. Wilber JF, Utiger RD. The Effect of Glucocorticoids on Thyrotropin Secretion. J.Clin.Invest. 1969;48(11):2096–103.
- Brabant A, Brabant G, Schuermeyer T, Ranft U, Schmidt FW, Hesch RD, von zur, Muhlen A. The Role of Glucocorticoids in the Regulation of Thyrotropin. Acta Endocrinol. (Copenh) 1989;121(1):95–100.
- Samuels MH. Effects of Variations in Physiological Cortisol Levels on Thyrotropin Secretion in Subjects With Adrenal Insufficiency: a Clinical Research Center Study. J.Clin.Endocrinol.Metab. 2000;85(4):1388–93.
نکاتی در مورد کنترل مصرف داروی لووتیروکسین در کمکاری تیروئید
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام